- Sarkoidose
Häufigkeit und Ursache
In der Schweiz tritt die Sarkoidose mit einer Häufigkeit von ca. sieben Neuerkrankungen pro 100 000 Personen pro Jahr auf, wobei ein erhöhtes Risiko in Gebieten mit Metallindustrie und intensiver Landwirtschaft gefunden wurde. Dies sowie die Tatsache, dass die Lunge das am häufigsten betroffene Organ ist, könnte auf einen kausalen Zusammenhang zwischen inhalativen Noxen und Sarkoidose hinweisen, welche die Erkrankung bei entsprechend genetisch prädisponierten Personen auslösen oder begünstigen könnte. Mehrere Studien konnten zudem auch einen Zusammenhang zwischen Sarkoidose und beruflicher Exposition herstellen. Es ist somit naheliegend, dass es nach der Inhalation von gewissen Antigenen (anorganische Partikel, nicht-tuberkulöse Mykobakterien) zu einer Immunreaktion mit Granulombildung kommen könnte. Nicht-nekrotisierende, epithelioidzellige Granulome sind gemeinhin der histologische Indikator für eine Sarkoidose, obschon auch andere Erkrankungen zu ähnlich aussehenden Granulomen führen können. Die Aufrechterhaltung und das Fortschreiten der Granulombildung können schliesslich zu chronischen Entzündungen und Fibrosierung führen.
Klinische Präsentation
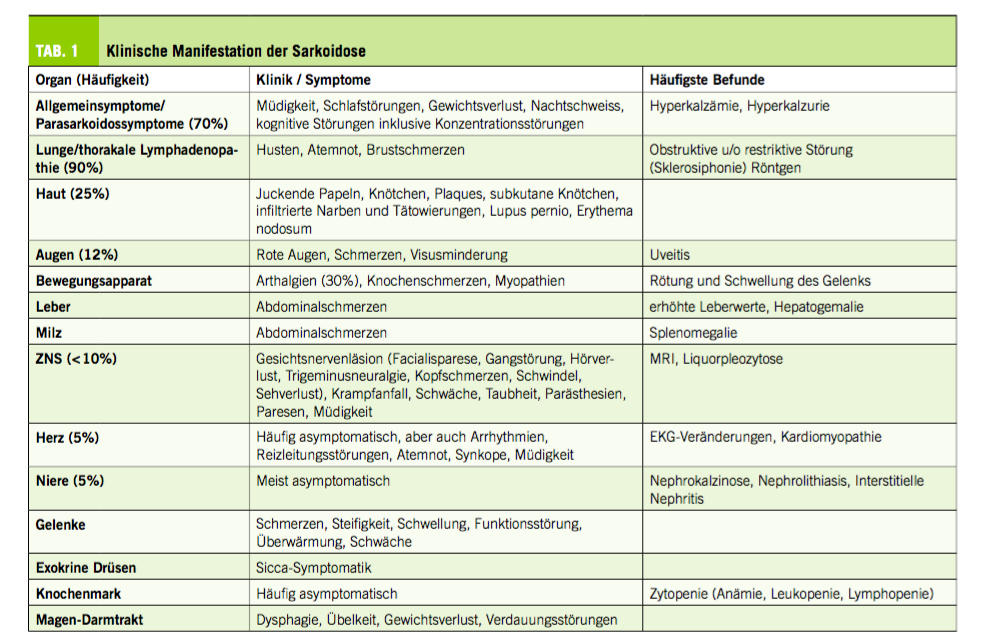
Die Sarkoidose ist eine potentielle Multisystemerkrankung, die abhängig von den Organmanifestationen und dem zeitlichen Verlauf der Erkrankung mit einem breiten Spektrum von Symptomen auftreten kann (Tab. 1). Bei ca. 50% der Patienten verläuft die Sarkoidose innerhalb von zwei Jahren selbstlimitierend. Umgekehrt ist eine vollständige Remission nach einem Krankheitsverlauf von fünf Jahren wenig wahrscheinlich (1).
Die pulmonale Sarkoidose umfasst die Beteiligung der Lunge und / oder der mediastinalen / hilären Lymphknoten und ist die häufigste Manifestation (80-90% der Fälle). Das klinische Erscheinungsbild umfasst Husten, Atemnot und Brustschmerzen, die mit Müdigkeit, Gewichtsverlust, Fieber und Unwohlsein einhergehen können (2). Die Ergebnisse von Lungenfunktionstests sind unspezifisch, da die Lungensarkoidose obstruktive, restriktive, gemischte oder normale Muster aufweisen kann. Die Lungenfunktionsmessung ist jedoch ein wichtiges Instrument zur Beurteilung des Schweregrads der Lungenbeteiligung sowie für Therapie-Indikation und -Ansprechen. Interstitielle Lungenerkrankungen («Interstitial Lung Disease», ILD) im Rahmen der Sarkoidose reichen von subklinischer Manifestation bis zur Lungenfibrose im Endstadium (Stadium 4). Letzteres ist ein irreversibler Organschaden, während eine leichte bis mittelschwere ILD aufgrund von Sarkoidose ein potenziell behandelbarer und reversibler Zustand ist. Die auf der konventionellen Röntgenuntersuchung basierende Stadieneinteilung nach Scadding reflektiert diese pulmonalen Phänotypen und findet bis heute noch Anwendung (Scadding Typ 1: Hilusvergrösserung, unauffälliges Lungenparenchym; Scadding Typ 2: Hilusvergrösserung und retikulonoduläre Verschattung der Lunge; Scadding Typ 3: Keine Hilusvergrösserung, aber retikulonoduläre Verschattung der Lunge; Scadding Typ 4: Retikuläres Muster im Sinne einer Lungenfibrose).
Extrapulmonale Manifestationen treten bei bis zu 30% der Patienten auf. Grundsätzlich kann jedes Organ betroffen sein, einschliesslich Haut (ca. 25%), Auge (25-50%), Leber (ca. 20%), extrathorakale Lymphknoten (40%), Milz (ca. 6%), Herz (2-7%), Nervensystem (5-10%), Niere (interstitielle Nephritis 20%, Nephrokalzinose 5%), Gelenke (bis zu 15%), Muskeln (bis zu 10%), exokrine Drüsen (ca. 5%), Knochenmark, Magen-Darm-Trakt (ca. 1%)
und obere Atemwege (ca. 1%) (3, 4-6). Die einzelnen Manifestationen variieren je nach Geschlecht, Alter und ethnischer Zugehörigkeit, was wiederum den Vergleich mit eingangs erwähntem Chamäleon rechtfertigt.
Die kardiale Sarkoidose ist eine seltene, aber potentiell lebensbedrohliche Manifestation, die bei 2-7% der Sarkoidose-Patienten und je nach Studie bis zu 83% der Fälle in Autopsie-Reihen beschrieben wurde (7, 8). Gemäss eigenen, bislang nicht publizierten Erfahrungen kann mit modernen bildgebenden Verfahren, wie kardiale Magnetresonanztomographie (c-MRT) oder 18FDG-PET/CT sogar eine Prävalenz der Herzbeteiligung von ca. 50% beobachtet werden. Daher wird angenommen, dass ein signifikanter Anteil der asymptomatischen Herzbeteiligung in diesem Stadium unerkannt bleibt. Eine Herzbeteiligung kann zu ventrikulären Arrhythmien, Reizleitungsstörungen oder Herzinsuffizienz aufgrund einer granulomatösen Myokardinfiltration und / oder Fibrose führen. Da bei bis zu 25% der Patienten mit Herzsarkoidose ein plötzlicher Herztod auftreten kann, ist eine frühzeitige Diagnose und angemessene Behandlung von grosser Bedeutung (9).
Para-Sarkoidose-Syndrome umfassen heterogene Symptomkomplexe, welche keinem spezifischen Organ zuzuordnen sind. Das Post-Sarkoidose-Müdigkeitssyndrom ist eine der problematischsten Manifestationen, da keine spezifischen Behandlungsmöglichkeiten bestehen und die Lebensqualität stark beeinträchtigt wird. Zudem können die Symptome, wie Müdigkeit, Erschöpfung und Konzentrationsschwierigkeiten sogar über die eigentliche Krankheitsremission hinaus bestehen bleiben (10).
Das Löfgren-Syndrom ist eine akute Form der Sarkoidose mit Fieber, bilateraler Knöchelarthritis und/oder Erythema nodosum und bilateraler Hilus-Lymphadenopathie (11). Es hat eine gute Prognose mit einer Remission bei 70-80% dieser Patienten (12). Das Heerfordt-Syndrom ist eine äusserst seltene Variante, die durch Uveitis, Vergrösserung/Entzündung der Speicheldrüsen und Parese der Hirnnerven, insbesondere des N. facialis, definiert ist.
Differenzialdiagnose
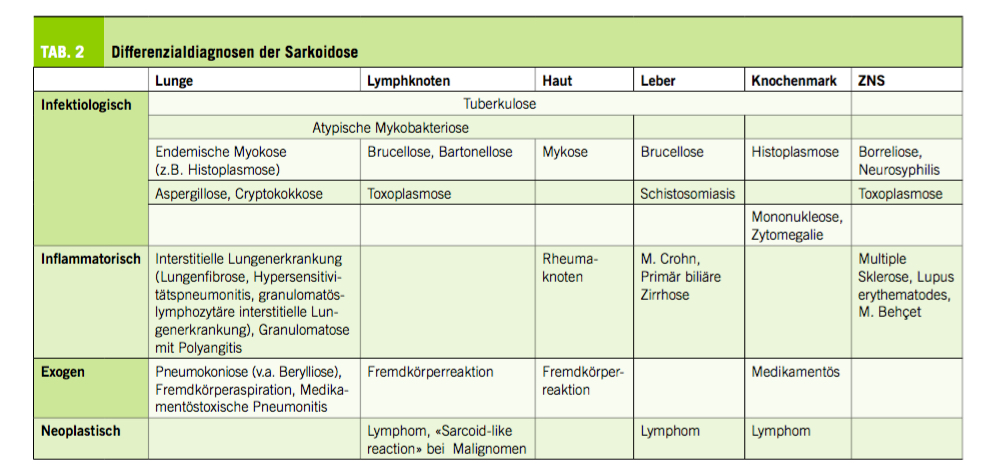
Die Liste der Differenzialdiagnosen ist vielfältig, was auch den heterogenen Phänotypen der Sarkoidose geschuldet ist (Tab. 2). Prinzipiell unterscheiden sich klinische, radiologische und histologische Differenzialdiagnosen.
Diagnose
Die histologische Bestätigung ist insbesondere bei symptomatischen Patienten empfohlen, um die oben erwähnten Differenzialdiagnosen auszuschliessen und eine korrekte, in der Regel entzündungshemmende und/oder immunsupprimierende Therapie einzuleiten. Schlussendlich ist die Sarkoidose aber meist eine Ausschlussdiagnose. Bei Löfgren-Syndrom, Heerfordt-Syndrom oder einer zufällig entdeckten, asymptomatischen, symmetrischen, bi-hilären Lymphadenopthie ist eine klinische Diagnose ausreichend (13).
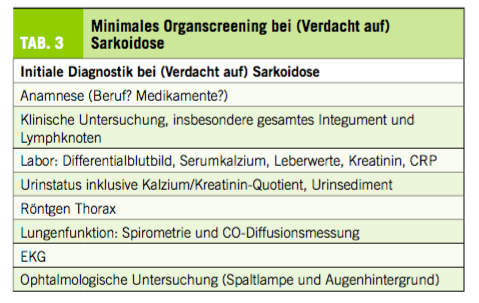
Da Sarkoidose eine Multisystemerkrankung mit unterschiedlichen Verläufen ist, wird nach Diagnosestellung initial ein minimales Organscreening empfohlen (Tab. 3). Die Häufigkeit und die Dauer der Verlaufsuntersuchungen hängen von der Erkrankungsschwere und -aktivität sowie von der jeweiligen Organbeteiligung ab. Als Faustregel gilt, dass Patienten unter aktiver Behandlung mindestens alle drei Monate, Patienten mit asymptomatischem oder selbstlimitierendem Verlauf während der Remission zwei Jahre lang zweimal jährlich, dann drei Jahre lang in jährlichen Intervallen kontrolliert werden sollten.
Bisher gibt es keine spezifischen Laboruntersuchungen für Sarkoidose. Einige sarkoidose-assoziierte Serum-Biomarker wie Angiotensin-Converting-Enzym (ACE), löslicher Interleukin-2-Rezeptor Alpha (sIL-2Rα) und Neopterin sowie die Kalziumbestimmung im Spot-Urin können, sofern positiv, zur Aktivitäts- und Verlaufsparameter herangezogen werden.
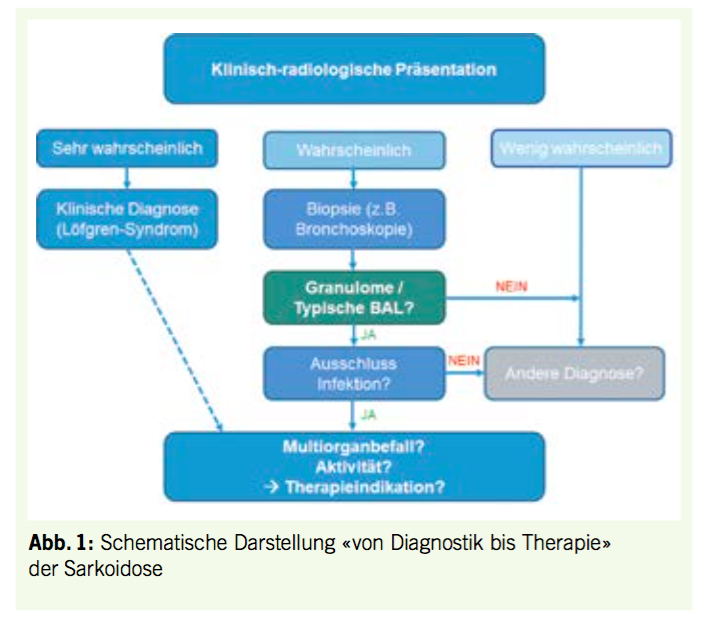
Bei Anzeichen auf andere Organbeteiligungen sollten spezifische weitere Untersuchungen durchgeführt werden, da jede extrapulmonale Manifestation potentiell die Indikation für eine Systemtherapie sein könnte und prognostische Relevanz hat. Bei Verdacht auf Herzsarkoidose stehen heute entweder eine c-MRT, ein 18FDG-PET / CT oder eine Kombination von beiden (18FDG-PET / MRT) zur Verfügung (14). Die Abfolge von Diagnostik bis hin zur Therapie ist in (Abb. 1) veranschaulicht.
Behandlung
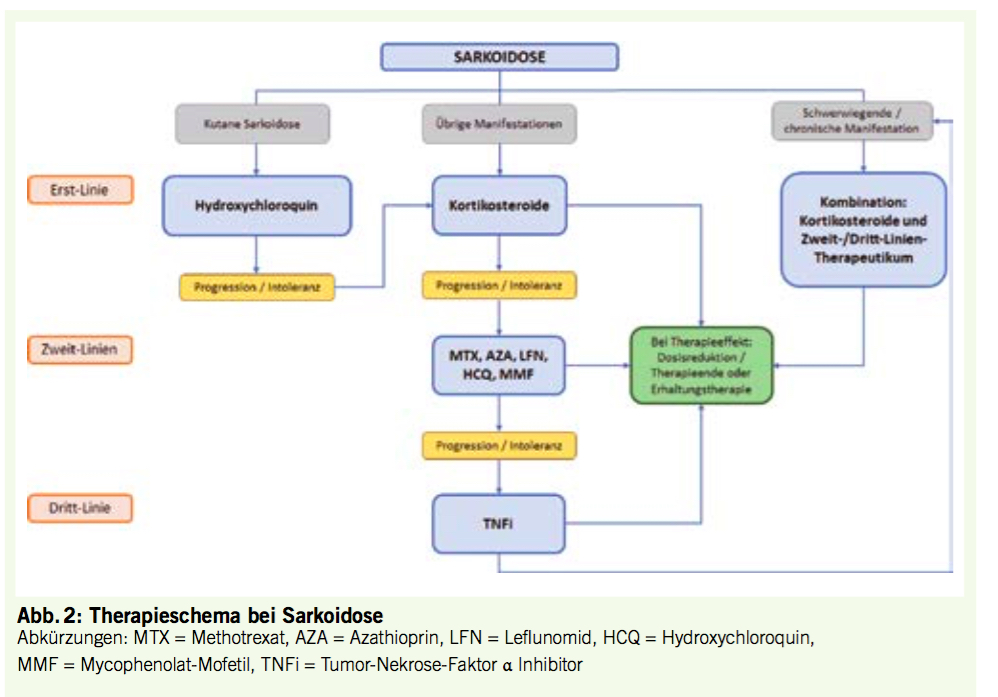
Die Krankheitsverläufe der Sarkoidose sind individuell sehr verschieden und im Einzelfall schwierig vorherzusagen. Darüber hinaus gibt es derzeit keine verlässlichen, einheitlich akzeptierten Prädiktoren für Progress oder ein Rezidiv. Generell gilt aber, dass in milden pulmonalen oder kutanen Formen eine topische Behandlung und / oder eine konservative Verlaufsbeobachtung gerechtfertigt sind. Absolute Behandlungsindikationen für eine systemische Behandlung bei anhaltender Krankheitsaktivität sind eine symptomatische Beeinträchtigung der Lungenfunktion, signifikante radiologische Manifestationen oder fortschreitende Lungenfibrose, pulmonale Hypertonie, Herzbeteiligung, Neurosarkoidose, ausgeprägte Leberfunktionsstörung, Hyperkalzämie und Nierenbeteiligung sowie therapierefraktäre kutane Beteiligung. Da in der Schweiz formal kein Immunsuppressivum für die Behandlung der Sarkoidose zugelassen ist, muss bei der Auswahl einer geeigneten Behandlung auf Konsensempfehlungen zurückgegriffen werden (15, 16). Orale Glukokortiko-Steroide gelten gemeinhin als Erstlinientherapie der Wahl (17, 18). Ein typisches Dosierungsschema besteht aus einer anfänglichen Tagesdosis von 0,5–0,75 mg Prednison pro kg Körpergewicht für vier Wochen. Danach kann die Steroid-Dosis über 6 bis 12 Monate langsam verringert werden. In refraktären oder chronisch-aktiven Fällen sollte das Steroid, sofern möglich, in niedriger Dosis in Kombination mit einem (oder mehreren) steroidsparenden Medikament(en) fortgesetzt werden. Für die Zweitlinienbehandlung (bei schwerer Organbeteiligung, bei steroid-refraktären, chronisch-aktiven oder rezidivierenden Fällen) oder als steroidsparendes Regime (bei nicht-tolerierbaren Nebenwirkungen, Kontraindikationen gegen Steroide oder Notwendigkeit
einer längerdauernden Steroidbehandlung) sind alternative Immunsuppressiva in Betracht zu ziehen. So konnte in kleinen randomisierten Studien und Fallserien über positive Effekte von Azathioprin, Methotrexat, Mycophenolat-Mofetil, Leflunomid und den Tumor-Nekrose-Faktor-α-Inhibitoren (TNFα-Blocker) Infliximab oder Adalimumab berichtet werden (19-25). Chloroquin und Hydroxychloroquin sind immunmodulatorisch wirksame Arzneimittel, die ursprünglich als Malariamedikamente bekannt waren. Hydroxychloroquin wird zur Erstbehandlung bei Hautbeteiligung eingesetzt und zeigt bei einigen Patienten mit Polymyalgie / Arthralgie und Müdigkeit vorteilhafte Wirkungen (21). Ein Behandlungsalgorithmus für systemische Behandlungsoptionen ist in (Abb. 2) zusammengefasst. Da TNFα eine Schlüsselrolle bei der Pathogenese der Sarkoidose zu spielen scheint, haben mehrere entzündungshemmende Arzneimittel, die mit dem TNF-Metabolismus interagieren wie Thalidomid, Lenalidomid und Pentoxifyllin in kleinen Fallserien oder Berichten ebenfalls eine therapeutische Wirkung gezeigt (26, 27). Andererseits können TNFα-Inhibitoren auch Sarkoidose-ähnliche Erkrankungen begünstigen (28). Mittlerweile ist jedoch bekannt, dass die Pathogenese der Sarkoidose über den TNF-Metabolismus weit hinausgeht und Störungen auf verschiedenen Ebenen der erworbenen und angeborenen Immunität vorliegen. Daher wurden alternative Ansätze in Fallserien und Berichten mit dem IL-17-Inhibitor Secukinumab, dem IL-6-Rezeptorantagonisten Tocilizumab, dem JAK-1/3-Inhibitor Tofacitinib und dem monoklonalen chimären Anti-CD20-Antikörper Rituximab publiziert. Derzeit laufen zudem Studien zum Phosphodiesterase-Inhibitor Roflumilast und zum Fusionsprotein Abatacept. In schweren, therapierefraktären Fällen oder bei Neurosarkoidose kann auch Cyclophosphamid in Betracht gezogen werden, obwohl das Evidenzniveau dafür tief ist.
Zusätzlich zu entzündungshemmenden Behandlungen sollte die ICD / Schrittmacher-Implantation bei Herzsarkoidose mit schweren ventrikulären Arrhythmien, hochgradigem AV-Block oder beeinträchtigter linksventrikulärer Funktion sowie ausgedehnter Myokardfibrose in Betracht gezogen werden. Nintedanib, ein Tyrosinkinase-Inhibitor, der für die idiopathische Lungenfibrose zugelassen ist, erhielt kürzlich eine erweiterte Zulassung für chronisch fibrosierende interstitielle Lungenerkrankungen mit progressivem Phänotyp, zu denen unter anderem auch Sarkoidose gehört (29, 30).
Bei Sarkoidose im irreversiblen Endstadium könnte eine Allotransplantation (Lunge, Herz, Niere oder Leber) die letzte Möglichkeit sein. Bei einer langfristigen Immunsuppression von Steroiden > 20 mg/d über 1 Monat empfiehlt sich zudem 3x/Wo. eine Prophylaxe gegen P. jiroveci mit Trimethoprim-Sulfamethoxazol 160/800 mg (31).
Bei längerfristiger Steroid-Therapie ist an eine Osteoporoseprophylaxe und regelmässiges Monitoring des Serumskalziums zu denken.
Die umfassende Betreuung von Sarkoidose-Patienten schliesst auch nicht-pharmakologische Massnahmen ein wie Sauerstofftherapie, Physiotherapie und Ergotherapie, körperliches Training, Lungenrehabilitation, kognitive Verhaltenstherapie, psychosoziale Beratung, multimodale Sprachpathologietherapie, achtsamkeitsbasierte Therapie und vieles mehr (32). Je nach Organbefall ist ein interdisziplinärer Ansatz erforderlich. An grösseren Zentren in der Schweiz sind bereits interdisziplinäre Sarkoidose-Sprechstunden etabliert, wo personalisierte Therapieansätze basierend auf entzündungs-Profiling im Gewebe oder Blut durchgeführt werden können. Ein Sarkoidose-Netzwerk (www.SARNET.ch) ist im Aufbau als Austausch- und Vermittlungs-Plattform.
Copyright bei Aerzteverlag medinfo AG
Universitätsspital Zürich, Klinik für Pneumologie Rämistrasse 100, 8006 Zürich
Daniel.Franzen@usz.ch
Die Autoren haben deklariert, in Zusammehang mit diesem Artikel keine Interessenskonflikte zu haben.
- Die Sarkoidose ist eine multisystemische granulomatöse Erkrankung mit verschiedenen klinischen Symptomen.
- Je nach Organbefall ist eine interdisziplinäre Betreuung erforderlich.
- Besonderes Augenmerk sollte auf schwerwiegenden Manifestation mit Beteiligung von Lunge, Herz, Nervensystem, Augen und Nieren liegen.
- Die umfassende Patienten-Betreuung beinhaltet pharmakologische und nicht-pharmakologische Massnahmen, auch unter Einbezug der psychosozialen Belastung und Behandlung der Para-Sarkoidose-Symptome wie Müdigkeit.
der informierte @rzt
- Vol. 11
- Ausgabe 4
- April 2021