- Schmerzmedizin in der Geriatrie
Aufgrund der steigenden Lebenserwartung ist künftig mit mehr chronischen Schmerzpatienten im Allgemeinen und im Speziellen im geriatrischen Patientenkollektiv zu rechnen. Chronische Schmerzen sind oftmals sehr komplex und verlangen immer nach einem individuell abgestimmten Beurteilungs- und Therapieverfahren. Oftmals gehen psychologisch-psychosomatische und physikalische Therapieoptionen neben den medikamentösen Therapiemöglichkeiten vergessen. Bei den medikamentösen Therapieoptionen sollte immer eine Nutzen-Risiko Abwägung insbesondere beim geriatrischen Patienten durchgeführt werden. Das oftmals angewendete WHO Stufenschema soll nur bei Tumorschmerzen konsequent angewendet werden. Nicht vergessen werden sollten minimal-invasive Schmerztherapiemethoden. Falls richtig indiziert, können sie insbesondere bei älteren Menschen oftmals hilfreich und mit wenig Risiken assoziiert sein.
Due to increasing life expectancy, more chronic pain patients in general and in particular in the geriatric patient population can be expected in the future. Chronic pain is often very complex and always requires an individually tailored assessment and therapy process. Often, psychological-psychosomatic and physical therapy options are forgotten alongside drug therapy options. In the case of drug therapy options, a risk-benefit analysis should always be carried out, especially in geriatric patients. The WHO step-by-step regimen, which is often used, should only be applied consistently in cases of tumor pain. Minimally invasive pain therapy methods should not be forgotten. If properly indicated, they can often be helpful and associated with few risks, especially in older people.
Key Words: Geriatrics, pain medicine, multimodal pain therapy, opioids
Einführung
Aufgrund der Fortschritte in der modernen Medizin und anderen
Faktoren (z.B. Ernährung, Wohlstand, Bildungsniveau) ist künftig mit einer weiteren Zunahme der Lebenserwartung zu rechnen (1). Zusammen mit der erhöhten Schmerz-Vulnerabilität im Alter sowie der erhöhten Inzidenz von chronischen Schmerzen nach Tumorbehandlungen und Operationen (2) führt dies zu einer weiteren Zunahme von chronischen Schmerzen im Alter. So wird die Prävalenz von chronischen Schmerzen in der geriatrischen Patientenpopulation bereits jetzt auf 50 bis 85 % geschätzt (3). Ebenso leiden Bewohner von Pflegeeinrichtungen häufig unter chronischen Schmerzen (4, 5).
Dabei stellt die «Schmerzfreiheit» kein sinnvolles therapeutisches Ziel dar. Im Fokus des ärztlichen Bemühens sollte die Verbesserung der Funktionalität sowie vor allem eine gute Lebensqualität mit und trotz Schmerzen stehen (6).
Ätiologien
Die wichtigsten Ätiologien für Schmerzen im Alter sind degenerative, osteoporotische und entzündliche Krankheiten des Bewegungsapparats, neuropathische Schmerzen, Ischämie und Schmerzen bedingt durch Tumorerkrankungen als Folge der diversen Tumortherapien oder duch den Tumor selber (3). Kombinationen diverser Schmerzlokalisationen und -ursachen sind in der geriatrischen Patientengruppe häufig.
Geriatrische Schmerztherapie
Eine multimodale Schmerztherapie, mit Einbezug von pharmakologischen und nicht-pharmakologischen Therapieoptionen, stellt auch beim geriatrischen Patienten mit chronischen Schmerzen das erfolgversprechendste Konzept dar (7). Eine entsprechende S3-Guideline wird voraussichtlich im Dezember 2024 publiziert (www.awmf.org).
Schmerzassessment
Eine strukturierte Schmerzanamnese mit Erhebung der sechs Dimensionen des Schmerzes (Lokalisation, Dauer, Qualität, Verbesserung, Verschlechterung, Begleitbeschwerden) bildet auch in der Geriatrie die Basisdiagnostik (8) und sollte neben der Erhebung einer vertieften psychosozialen Anamnese sowie der patientenseitigen Erwartungshaltung routinemässig erfolgen (9). Dazu existieren spezifisch für das geriatrische Patientenkollektiv entwickelte Instrumente, wie beispielsweise den «Geriatric Pain Measure» (GPM) und das «Geriatric Painful Events Inventory» (10). Aufgrund der häufig bestehenden kognitiven und/oder kommunikativen Einschränkungen stellt die Schmerzerfassung jedoch oft eine zusätzliche Herausforderung dar. Hier können mehrdimensionale Fremdbeurteilungsskalen mit Beurteilung von Mimik, Gestik, Sprache, Körperhaltung, Verhalten sowie physischen Indikatoren (z.B. Schwitzen, Hypertonie, Tachykardie) hilfreich sein (z.B. BISAD-, BESD-, PAINAD-, MOBID-2-, Doloshort- oder Doloplus-2-Skala) (11). Ein besonderes Augenmerk sollte bei der Schmerzerfassung auf das Vorhandensein von «Red Flags» gelegt werden (7), um kausal behandelbare Ursachen oder Ursachen mit hoher und unmittelbarer Patientengefährdung nicht zu verpassen.
WHO Stufenschema und neueste Empfehlungen
Im Jahre 1985 publizierte die Weltgesundheitsorganisation (WHO) das WHO-Stufenschema zur Therapie von nozizeptiven Tumorschmerzen (12). In den letzten Jahren wurde die Validität des WHO-Stufenschemas vor allem in der Schmerztherapie von nicht-tumorbedingten Schmerzzuständen zusehends hinterfragt, nicht zuletzt vor dem Hintergrund der «Opioid-Krise» in den USA (13). Aktuelle schmerzmedizinische Publikationen zu Tumor bedingten Schmerzen empfehlen, auch minimal-invasive schmerztherapeutische Verfahren in Erwägung zu ziehen (insbesondere bei
loko-regionalen Schmerzen) und sehen insbesondere die Dauertherapie mit Opioiden äusserst kritisch (14) (15-17) (Abb. 1). Allgemein wird heute empfohlen, das WHO Stufenschema nur bei Karzinompatienten zu verwenden, nicht aber bei chronischen oder akuten Schmerzzuständen bei Nicht-Tumor-Patienten; bei akuten Schmerzen ist es oft sogar sinnvoll, mit der Stufe 4 (minimal invasive Schmerztherapie) zu beginnen.
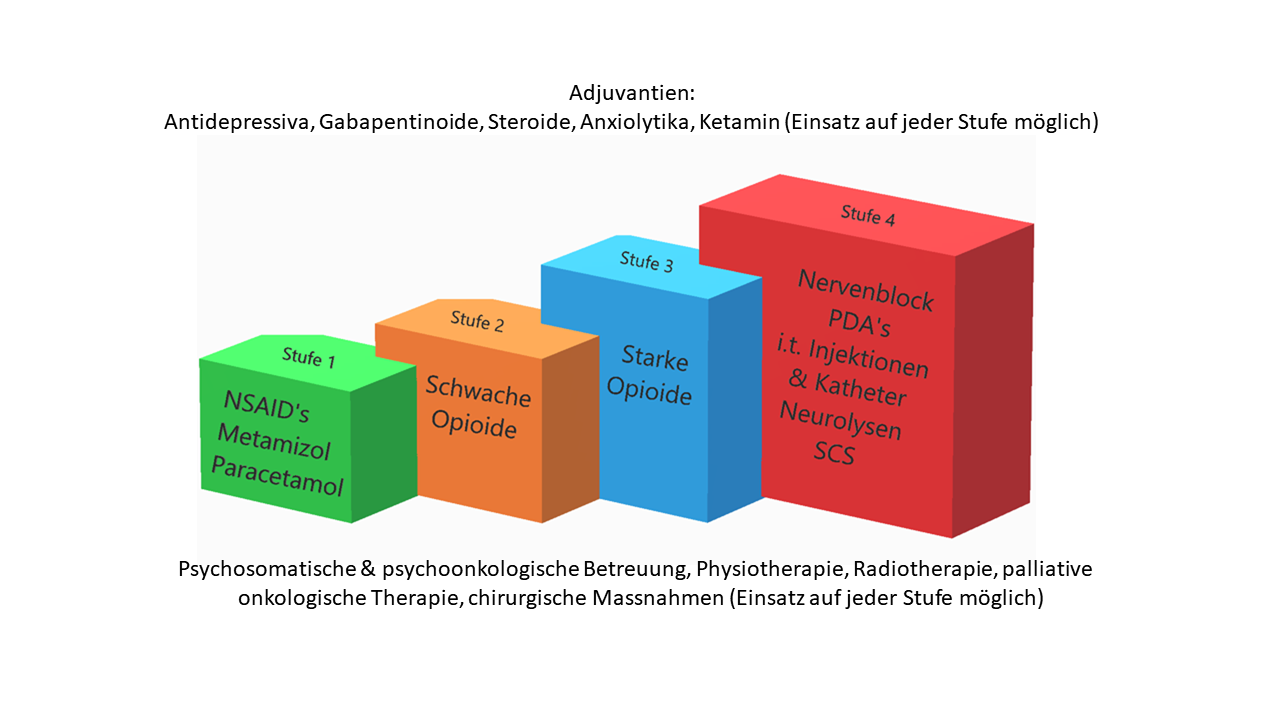
Nicht-Opioidanalgetika
Nicht-Opioidanalgetika gehören zu den am meisten verordneten sowie eingenommen Medikamenten weltweit und hemmen (wie auch Paracetamol) die Cyclooxygenasen-Isoenzyme COX-1 und COX-2 in unterschiedlichem Ausmass. Diese wirken analgetisch, antipyretisch, antiphlogistisch sowie im Fall von Metamizol spasmolytisch. Kombinationen von zwei Präparaten der gleichen Substanzklasse müssen unbedingt vermieden werden. Wechselwirkungen von Nicht-Opioidanalgetika mit anderen, Patienten eigenen Dauermedikationen sind häufig. So konnte eine erhöhte Blutungsgefahr bei der Kombination von NSAR-Analgetika mit SSRI-Antidepressiva, mit Steroiden sowie mit verschiedenen Antikoagulantien nachgewiesen werden. Eine wichtige Besonderheit der selektiven COX-2-Hemmer ist die höhere Rate an kardiovaskulären Ereignissen (18) (19), weshalb diese Substanzen besonders beim geriatrischen Patientenkollektiv mit Bedacht verordnet werden müssen. Des Weiteren hebt die gleichzeitige antiemetische Therapie mit Setronen (z.B. Tropisetron) die analgetische Potenz von Paracetamol auf (20). Bei Paracetamol können auch bereits nach kurzer Behandlungsdauer Leberzellschädigungen auftreten, insbesondere bei akzidentiell zusätzlicher Einnahme von «over the counter» Kombinationspräparaten. Der Patient muss auf diese Gefahr unbedingt hingewiesen werden. Neuere Untersuchungen lassen auch darauf schliessen, dass Paracetamol u.U. den Blutdruck erhöhen und für kardiovaskuläre Komplikationen verantwortlich sein kann. Die Gefahr einer Agranulozytose unter Metamizol wird in der Regel überschätzt bei ansonsten gutem Wirkung-Nebenwirkungsprofil dieser Substanz (21). Dennoch müssen sich Arzt und Patient über diese, wenn auch sehr seltene, Nebenwirkung im Klaren sein, auch wenn mitunter schwere Nebenwirkungen bei NSAID’s deutlich häufiger auftreten (Faktor 10 bis 100).
Opioidanalgetika
Opioide können bei akuten nozizeptiven Schmerzen, welche ein ungenügendes Ansprechen auf Nicht-Opioidanalgetika zeigen, zusammen mit diesen kurzzeitig indiziert sein. Die analgetische Potenz bei neuropathischen Schmerzen ist hingegen deutlich reduziert. Eine Opioid-Langzeittherapie (mehr als 90 Tage) bei
chronischen nicht Tumor-bedingten Schmerzen wird heutzutage sehr kritisch betrachtet und sollte in der Regel vermieden werden (16, 22). Grundsätzlich stellen z.B. Kopfschmerzerkrankungen und Fibromyalgie keine Indikationen für Opioidanalgetika dar.
Zu beachten ist, dass eine Therapie mit Opioidanalgetika bei ca. 80% der Patienten mit leichten bis moderaten und bei 8% mit starken unerwünschten Arzneimittelwirkungen einhergeht (23).
Zur Therapie von akuten Schmerzexazerbationen haben sich nicht-retardierte Opioidpräparate bewährt (z.B. Morphin Tropfen). Der Einsatz von Opioiden und deren Dosierung muss immer individuell und situativ erfolgen. Des Weiteren scheinen Opioide das Schmerzerlebnis im limbischen System (Stichwort: Stimmungsaufhellung) zu beeinflussen, was bei Risikopatienten rasch zu Abhängigkeit, Missbrauch oder gar Suchtverhalten führen kann, ganz besonders bei rasch wirksamen, rasch anflutenden Opioid-Formen. Wegen häufig auftretender Nausea und Obstipation sollte parallel eine Verordnung mit Antiemetika sowie Laxanzien zumindest in der initialen Phase erfolgen.
Vor allem bei älteren Schmerzpatientinnen und -patienten kann es unter einer neu initiierten Opioidschmerztherapie zu Dysphorie, Sedierung, Delirium sowie zum Auftreten von Halluzinationen kommen. Einige Opioide, wie beispielsweise das in der Schweiz sehr verbreitete Tramadol, besitzen neben der analgetischen Wirkung auch einen therapeutisch bedeutsamen antidepressiven Effekt, welcher durch eine Noradrenalin-Serotonin Wiederaufnahme vermittelt wird.
Die Opioid-haltigen transdermalen Systeme (Fentanyl oder Buprenorphin) sind hochpotente pharmakologische Systeme und zeichnen sich vor allem durch eine sehr langsame Kinetik (Steady state erst innerhalb von Tagen) aus, so dass eine «Steuerung» der Schmerztherapie mit dieser Applikationsform sehr anspruchsvoll ausfällt. Der korrekte Einsatz erfordert klinische Erfahrung, da es ansonsten rasch zu Über- oder unter Unterdosierungen kommen kann. So sind diese Systeme etwa bei Kachexie und akuten Schmerzsituationen kontraindiziert.
Co-Analgetika und topische Analgetika
Co-Analgetika wie beispielsweise trizyklische Antidepressiva, SSRI, NSRI, Gabapentinoide und Ketamin sowie Lokalanästhetika i.v. sind wichtige therapeutische Pfeiler in der komplexen Schmerzmedizin. Diese hier ausführlich darzustellen, sprengt den Rahmen dieses Artikels, weshalb diese nur kursorisch genannt werden (Abb. 2).
Cannabinoide
Bezüglich den vor allem auch in den Medien zum Teil schon fast überschwänglich gepriesenen Therapieoptionen mit Cannabinoiden sollte mit sachlich nüchterner, evidenzbasierter Haltung begegnet werden. Eine wissenschaftliche Begründung für den breitflächigen Einsatz von THC bei chronischen Schmerzen gibt es zurzeit nicht. Metaanalysen schätzen die NNT bei chronischen Schmerzen bei etwa 25, die NNH bei etwa 6 (24). Eigene Daten aus unserer CBD Forschung in einem akuten Schmerzmodell sind sehr enttäuschend (25, 26).
Physikalische und psychologische Therapiemodalitäten
Die nicht-pharmakologischen Schmerztherapien haben insbesondere bei der Behandlung von chronischen Schmerzen einen sehr hohen Stellenwert.
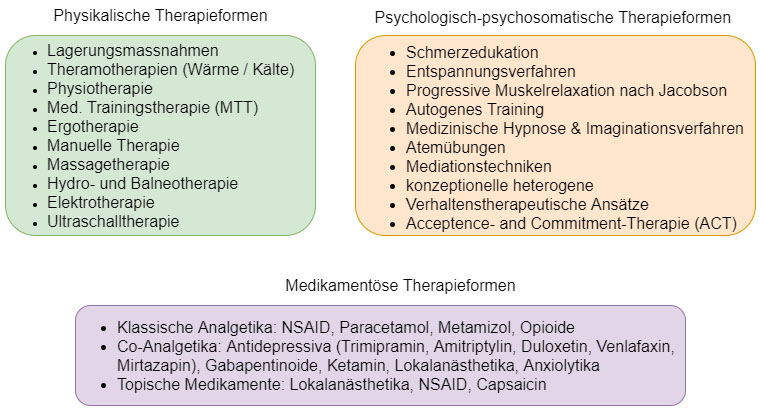
Abbildung 2 zeigt die wichtigsten physikalischen Therapiemodalitäten. Die körperlichen Übungen müssen vom Patienten auch im häuslichen Umfeld selbstständig angewendet werden können. Für multimodalen Therapieansätze besteht insgesamt eine gute Evidenzlage bezüglich ihrer Wirksamkeit (27).
Die wichtigsten Formen psychologisch-psychosomatischer Therapieformen sind ebenfalls in Abbildung 2 aufgeführt. Die Wirksamkeit von psychologischen Verfahren bei akuten Rückenschmerzen sowie bei chronischen Schmerzen ist wissenschaftlich belegt. Es scheinen jedoch keine wesentlichen Wirkunterschiede zwischen den einzelnen (verhaltenstherapeutischen) Ansätzen zu bestehen (28). Eine grosse Herausforderung stellt in der täglichen Praxis die Gewinnung des Patienten für das «bio-psycho-soziale» Krankheitsmodell dar. Dabei hat sich vor allem die schmerzedukative Arbeit mit gut verständlichen Metaphern sowie graphischen Erklärungsmodellen durch den Schmerzmediziner bewährt.
Interventionelle Schmerztherapie
Bei allen Patienten mit einem streng regionalen Schmerzgeschehen ist zu überlegen, ob die Möglichkeit einer interventionellen Schmerztherapie oder lokalen Therapie (statt einer systemischen Therapie) besteht. Die interventionellen Therapiemodalitäten spielen auch in der geriatrischen Schmerztherapie eine wichtige Rolle. Grundsätzlich lassen sich Infiltrationen in der Nähe der Wirbelsäule, in die grossen Gelenken sowie Interventionen an den peripheren Nerven unterscheiden. Diese interventionellen Schmerztherapien finden meistens unter Zuhilfenahme von bildgebenden Verfahren statt (Ultraschall, C-Bogen, CT). Es handelt sich somit um eine möglichst spezifische Therapie eines anatomischen Schmerzgenerators.
Als Beispiele für diagnostisch-therapeutische Interventionen an der Neuraxis in der geriatrischen Patientenpopulation gelten die interlaminäre epidurale Steroidinfiltration bei Spinalkanalstenose, die periradikuläre Wurzelinfiltration mit Steroiden bei Neuroforaminalstenosen, die intra- bzw. periartikulären Steroidinfiltrationen in die Facettengelenke sowie die intra- oder periartikulären Steroidinfiltrationen wie z.B. ins ISG Gelenk. Bei therapieresistenten Kniegelenkarthrosen können Blockaden der Nn. geniculares der Kniegelenke oftmals eine deutliche Verbesserung der Schmerz Situation insbesondere bei geriatrischen Patienten herbeiführen, bei denen eine prothetische Massnahme nicht mehr möglich oder erwünscht ist. Die Darstellung der Möglichkeit von ablativen Schmerztherapieverfahren sprengt den Rahmen dieses Artikels ebenso wie die Durchführung von regelmässig wiederkehrenden Schmerzinfusionstherapien mit Lokalanästhetika und Ketamin. Ebenso kann an dieser Stelle auf weitere Therapiestrategien wie Neuraltherapie, Hypnose oder traditionelle chinesische Medizin nicht eingegangen werden.
Leitender Arzt Abteilung für Schmerzmedizin
Klinik für Anästhesie, Notfall- und Schmerzmedizin
Universitätsspital Basel
Spitalstrasse 1
4031 Basel
schmerzmedizin@usb.ch
Dr. med. Pascal Gerster
Universitätsspital Basel
Spitalstrasse 1
4031 Basel
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Die Schmerztherapie soll bei jedem Patienten individuell beurteilt und indiziert werden.
◆ Bei älteren Menschen kann aufgrund verschiedener funktioneller Defizite eine systematische, standardisierte Schmerzerfassung zielführend sein.
◆ Je komplexer die Schmerzsituation ist, umso mehr müssen neben medikamentösen Behandlungsansätzen auch psychologisch-psychosomatische und physikalische Therapieoptionen in Erwägung gezogen werden.
◆ Minimalinvasive Schmerz Therapiemethoden sollten insbesondere beim geriatrischen Patienten in Erwägung gezogen werden, da, richtig indiziert, wenig bis kaum systemische Nebenwirkungen zu erwarten sind.
◆ Das WHO Stufenschema soll prinzipiell konsequent nur bei Tumor- Schmerzpatienten zur Anwendung gelangen.
◆ Die Schmerzmedizin ist in den letzten Jahren nicht zuletzt wegen des umstrittenen Einsatzes von Opioiden deutlich anspruchsvoller und komplexer geworden, ganz besonders beim älteren Menschen.
Literatur :
1. Statistik Bf. Lebenserwartung in der Schweiz, 2000-2020. Stand 25.10.2021.
2. Fletcher D, Stamer UM, Pogatzki-Zahn E, Zaslansky R, Tanase NV, Perruchoud C, et al. Chronic postsurgical pain in Europe: An observational study. Eur J Anaesthesiol. 2015;32(10):725-34.
3. Pinter G, Stromer W, Donnerer J, Geyrhofer S, Leeb B, Mitrovic N, et al. [Pain and pain management in old age: special features and recommendations]. Z Gerontol Geriatr. 2021;54(5):507-12.
4. Achterberg WP, Gambassi G, Finne-Soveri H, Liperoti R, Noro A, Frijters DHM, et al. Pain in European long-term care facilities: cross-national study in Finland, Italy and The Netherlands. Pain. 2010;148(1):70-4.
5. Brunkert T, Ruppen W, Simon M, Zuniga F. A theory-based hybrid II implementation intervention to improve pain management in Swiss nursing homes: A mixed-methods study protocol. J Adv Nurs. 2019;75(2):432-42.
6. Arnold B, Brinkschmidt T, Casser HR, Diezemann A, Gralow I, Irnich D, et al. [Multimodal pain therapy for treatment of chronic pain syndrome. Consensus paper of the ad hoc commission on multimodal interdisciplinary pain management of the German Pain Society on treatment contents]. Schmerz. 2014;28(5):459-72.
7. Gosch M, Pils K, Venkat S, Singler K. [Aspects of multimodal pain therapy in old age]. Z Gerontol Geriatr. 2021;54(8):823-32.
8. Booker SQ, Herr KA. Assessment and Measurement of Pain in Adults in Later Life. Clin Geriatr Med. 2016;32(4):677-92.
9. Schreier MM, Stering U, Pitzer S, Iglseder B, Osterbrink J. [Pain and pain-assessment in nursing homes : Results of the OSiA study]. Schmerz. 2015;29(2):203-10.
10. Puto G, Repka I, Brzyski P. Pain measurement in the older people: evaluation of the psychometric properties of the Geriatric Pain Measure (GPM-24) – polish version. BMC Geriatr. 2021;21(1):560.
11. Sirsch E. S3-Leitlinie Schmerzassessment bei älteren Menschen in der vollstationären Altenhilfe. AWMF Registernummer 145 – 001. 2017.
12. Ventafridda V, Saita L, Ripamonti C, De Conno F. WHO guidelines for the use of analgesics in cancer pain. Int J Tissue React. 1985;7(1):93-6.
13. Skolnick P. The Opioid Epidemic: Crisis and Solutions. Annu Rev Pharmacol Toxicol. 2018;58:143-59.
14. Yang J, Bauer BA, Wahner-Roedler DL, Chon TY, Xiao L. The Modified WHO Analgesic Ladder: Is It Appropriate for Chronic Non-Cancer Pain? J Pain Res. 2020;13:411-7.
15. (DGSS) DS. Leitlinie Langzeitanwendung von Opioiden bei chronischen nicht-tumorbedingten Schmerzen (LONTS). AWMF-Leitlinien-Register Nr 145/003. 2020.
16. Ruppen W, Schneider T. [Opioid crisis: What now? A pain specialist’s point of view]. Ther Umsch. 2020;77(1):3-9.
17. Hauser W, Morlion B, Vowles KE, Bannister K, Buchser E, Casale R, et al. European* clinical practice recommendations on opioids for chronic noncancer pain – Part 1: Role of opioids in the management of chronic noncancer pain. Eur J Pain. 2021;25(5):949-68.
18. Bombardier C, Laine L, Reicin A, Shapiro D, Burgos-Vargas R, Davis B, et al. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. VIGOR Study Group. N Engl J Med. 2000;343(21):1520-8, 2 p following 8.
19. Baron JA, Sandler RS, Bresalier RS, Lanas A, Morton DG, Riddell R, et al. Cardiovascular events associated with rofecoxib: final analysis of the APPROVe trial. Lancet. 2008;372(9651):1756-64.
20. Bandschapp O, Filitz J, Urwyler A, Koppert W, Ruppen W. Tropisetron blocks analgesic action of acetaminophen: a human pain model study. Pain. 2011;152(6):1304-10.
21. Haschke M, Liechti M. Metamizol : Nutzen und Risiken im Vergleich zu Paracetamol und NSAR. Swiss Medical Forum. 2017;17(48):1067-73.
22. Häuser W. European Pain Federation (EFIC) position paper on appropriate use of cannabis-based medicines and medical cannabis for chronic pain management. Eur J Pain. 2018:1547.
23. Els C, Jackson TD, Kunyk D, Lappi VG, Sonnenberg B, Hagtvedt R, et al. Adverse events associated with medium- and long-term use of opioids for chronic non-cancer pain: an overview of Cochrane Reviews. Cochrane Database Syst Rev. 2017;10:CD012509.
24. Stockings E, Campbell G, Hall WD, Nielsen S, Zagic D, Rahman R, et al. Cannabis and cannabinoids for the treatment of people with chronic noncancer pain conditions: a systematic review and meta-analysis of controlled and observational studies. Pain. 2018;159(10):1932-54.
25. Dieterle M, Zurbriggen L, Mauermann E, Mercer-Chalmers-Bender K, Frei P, Ruppen W, et al. Pain response to cannabidiol in opioid-induced hyperalgesia, acute nociceptive pain, and allodynia using a model mimicking acute pain in healthy adults in a randomized trial (CANAB II). Pain. 2022.
26. Schneider T, Zurbriggen L, Dieterle M, Mauermann E, Frei P, Mercer-Chalmers-Bender K, et al. Pain response to cannabidiol in induced acute nociceptive pain, allodynia, and hyperalgesia by using a model mimicking acute pain in healthy adults in a randomized trial (CANAB I). Pain. 2022;163(1):e62-e71.
27. Whibley D, Dean LE, Basu N. Management of Widespread Pain and Fibromyalgia. Curr Treatm Opt Rheumatol. 2016;2(4):312-20.
28. Chou R, Huffman LH, American Pain S, American College of P. Nonpharmacologic therapies for acute and chronic low back pain: a review of the evidence for an American Pain Society/American College of Physicians clinical practice guideline. Ann Intern Med. 2007;147(7):492-504.
der informierte @rzt
- Vol. 12
- Ausgabe 9
- September 2022









