- SGLT2-Hemmer in der Therapie Teil 1: Herzinsuffizienz
Bestimmte SGLT2-Hemmer, die ursprünglich als glukosesenkende Therapie bei Diabetes mellitus Typ II (T2DM) entwickelt wurden, sind inzwischen auch für Herzinsuffizienz (HI) und/oder chronische Niereninsuffizienz (CKD) zugelassen. SGLT2-H., ARNI/ACE-Hemmer, Betablocker und MRA gehören nach den ESC-Guidelines 2021 zu den «fantastic four» der HI-Basis-Therapie bei einer LV-EF <40% (HFrEF). In neueren Arbeiten zeigte sich auch ein deutlicher Benefit der SGLT2-H. bezüglich Mortalität und Hospitalisation wegen HI mit einer LV-EF >40% (HFmrEF) und einer LV-EF >50% (HFpEF). Neben der Kardioprotektion ist diese Substanzklasse auch nephroprotektiv. Kontraindiziert sind die SGLT2-H. bei einem Diabetes mellitus Typ I und bei Stresssituationen wie einer akuten Erkrankung mit Volumenmangel, einem Infekt, beim Fasten und perioperativ – cave: euglykämische Ketoazidose. Dieser Artikel beruht auf den ESC-Guidelines 2021/2023 (1-3), aktuellen Publikationen und auf zwei Vorträgen von Cardiomed- und Nephro-LIVE 2023. Wir haben im Nov. 2022 über die chronische Herzinsuffizienz (HI) eingehend berichtet (4). Im Teil 2, der in einer späteren Ausgabe erscheinen wird, betrachten wir das Thema SGLT2-H. bei der chronischen Niereninsuffizienz.
Certain SGLT2-Inhibitors, originally developed as glucose-lowering therapy for type II diabetes (T2DM), are now also approved for heart failure (HI) and/or chronic kidney disease (CKD). SGLT2-I., ARNI/ACE-Inhibitors, Beta blockers, and MRA are among the “fantastic four” of baseline HI therapy for LV-EF <40% (HFrEF) according to the 2021 ESC guidelines. Recent work has also shown a significant benefit of SGLT2-I. in terms of mortality and hospitalization for HI at an LV-EF >40% (HFmrEF) and an LV-EF >50% (HFpEF). In addition to cardioprotection, this class of compounds is also nephroprotective. SGLT2-I. are contraindicated in type I diabetes mellitus and in stressful situations such as acute illness with volume deficiency, infection, fasting and perioperative – caution: euglycemic ketoacidosis.
Key Words: SGLT2-Inhibitor, cardio- +nephroprotective, «fantastic-four», H2FPEF score, eGFR+UACR.
Die Herzinsuffizienz ist eine progrediente tödliche Erkrankung. Eine Hospitalisation verschlechtert den Verlauf und erhöht die Mortalität. Diese Einbrüche («Worsening heart failure») können immer auftreten. In solchen Situationen bedarf es von medikamentöser Seite einer evt. Optimierung der Basistherapie, zusätzlich Diuretika und einer Eskalation mit Vericiguat. Das Risiko für weitere Ereignisse kann sich dadurch reduzieren. Eventuell muss auch eine Intervention diskutiert werden – Stichworte: tachykardes VHFli, schwere MI, LSB mit LV-Dyssynchronie, Ischämie. Auch eine HI mit erhaltener LV-EF (HFpEF) hat eine relevante Mortalität. In dieser Gruppe nimmt die nicht kardiale Mortalität deutlich zu (5). Die verschiedenen Komorbiditäten müssen behandelt werden (1-3).
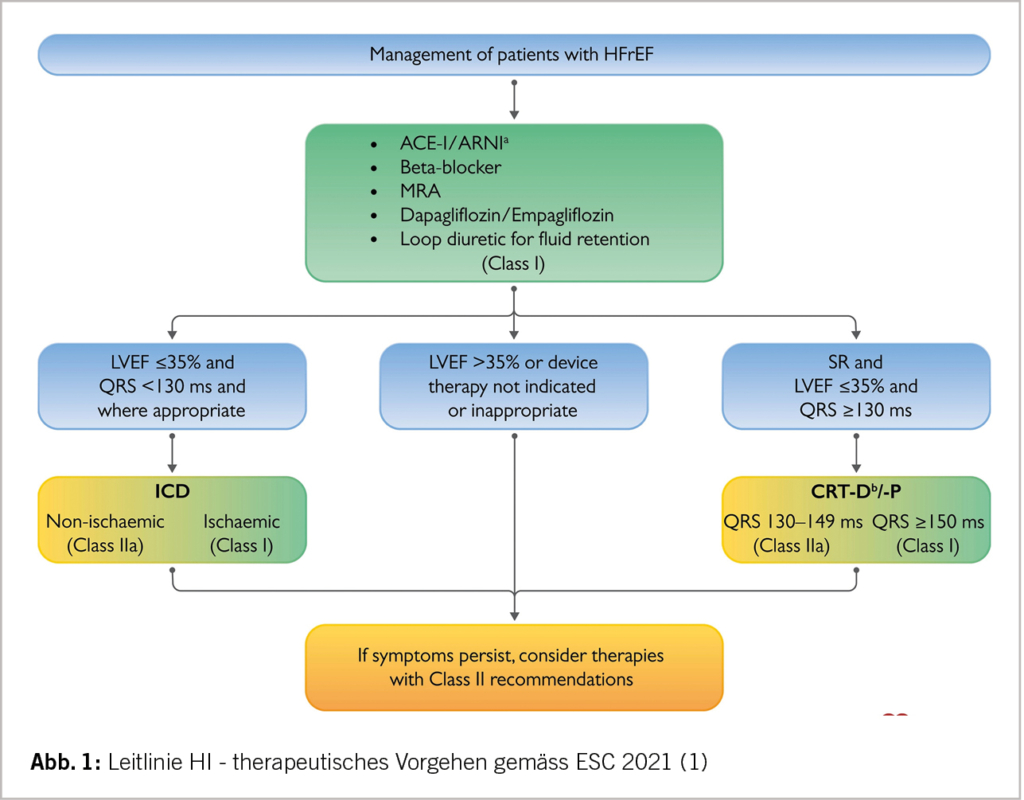
Herzinsuffizienz mit einer LV-EF≤40% (HFrEF)
Diese Gruppe der HI entspricht einer primär systolischen Funktionseinschränkung mit Kontraktionsschwäche. Am häufigsten auf Grund einer ischämischen oder dilatativen Genese. Der ESC-Therapie-Algorithmus wird in Abbildung 1 wiedergegeben.
Die vier Medikamente: ACE-Hemmer/ Betablocker/ MRA und SGLT2-H. haben eine ESC IA Indikation (MRA: Mineralkortikoid-Rezeptorantagonist/Aldosteronantagonist). Anstelle des ACE-H. kann/soll heute ein ARNI (Angiotensin-Rezeptor-Neprilysin-Inhibitor) verwendet werden (IB). Bei einer Stauung müssen auch Schleifendiuretika eingesetzt werden (1). Die «fantastic four» senken das Mortalitätsrisiko deutlich (1-6). Wichtig ist, dass die Medikamente nicht wie früher langsam nacheinander auftitriert werden, sondern dass diese alle innert kurzer Zeit eingesetzt werden (1). Ist der Patient hospitalisiert, so soll er möglichst mit diesen vier Substanzen entlassen werden. In einer ersten Kontrolle nach 1-2 Wochen muss dann die Dosis der Klinik angepasst und in nachfolgenden Besuchen in den ersten 6 Wochen nach Hospitalisation möglichst auf die Zieldosis auftitriert werden (2). Diese 4-er Kombination führt auch zu einer deutlichen Lebenszeitverlängerung – je nach Alter (55-80 Jahre) von 6,3 bis 1,4 Jahren (7).
SGLT2-H. bewiesen ihre Wirksamkeit in der DAPA-HF und in der EMPEROR Reduced Studie unabhängig vom Vorliegen eines T2DM (8.9). Diese beiden Studien zeigten eine signifikante Reduktion bezüglich der ersten Hospitalisation wegen einer HI um 30 resp. 31%. Die NNT war in beiden Studien mit 21 resp. 19 sehr tief. Auch Subgruppen wie Patienten mit T2DM, CKD, VHFLi und hohes Alter profitierten von einem SGLT2-H. Es kam auch zu einer deutlich besseren Lebensqualität bei guter Verträglichkeit. Die positive Wirkung setzte in beiden Studien bereits nach 12-28 Tagen ein. Dapa- oder Empagliflozin können resp. sollen auch bei einem tiefen Ausgangs-BD (<110mmHg) eingesetzt werden. Die Elektrolyte bleiben stabil und die beiden Medikamente dürfen primär bei einer CKD bis zu einer Kreatinin-Clearance von 25 resp. 20ml/min/1.73m2 eingesetzt werden.
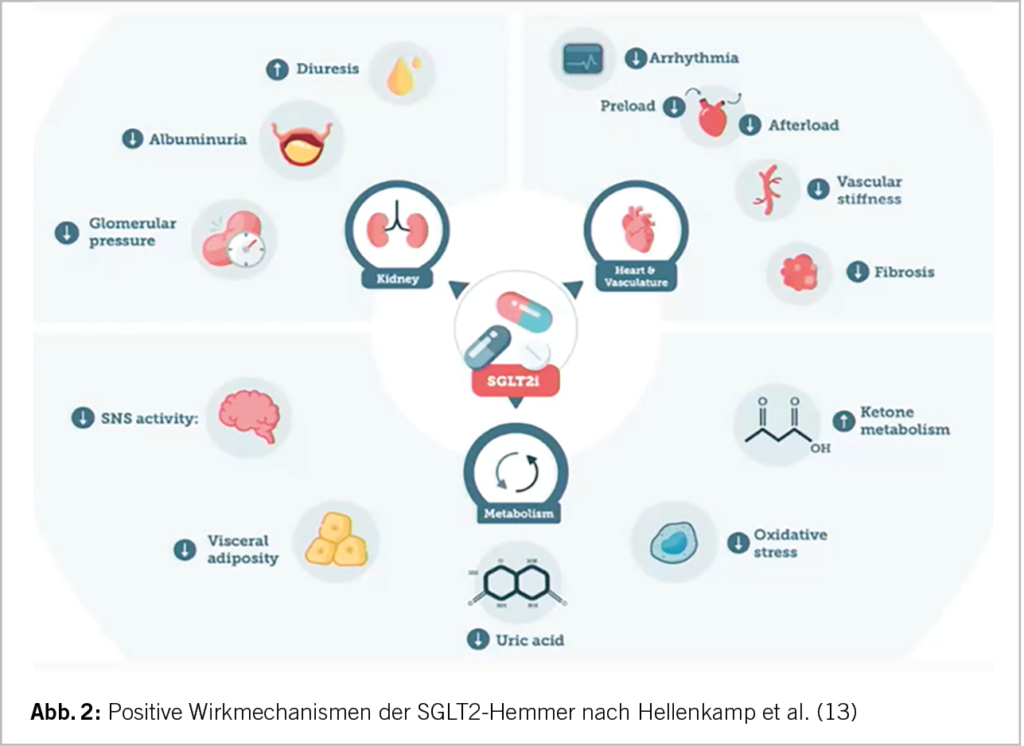
Nach der EMPULSE Studie wurde Empagliflozin 10mg auch bei einer akut dekompensierten HI erfolgreich eingesetzt (10). Verglichen mit dem Diuretikum Metazolon 5-10mg kam es ebenfalls zu einer raschen Rekompensation bei Diuretikaresistenz. Die Elektrolyte, die Harnsäure und das Kreatinin blieben stabil (10,11). Im Gegensatz zu Diuretika, welche das intravaskuläre und interstitielle Volumen reduzieren, vermindern SGLT2-H. vorwiegend das interstitielle Volumen mit minimaler Änderung des Blutvolumens. SGLT2-H. können Diuretika einsparen. Zur Reduktion des Körpergewichts von ca. 2 kg trägt initial auch der diuretische Effekt bei. SGLT2-H. reduzieren die Glucose und Natrium Rückresorption im proximalen Nierentubulus: Dies führt zu einer osmotischen Diurese mit einer Glucosurie von 60-80g/die und einer Natriurese mit Wasserausscheidung und zu einer leichten BD-Senkung. Bei einer akuten HI-Dekompensation müssen zusätzlich Schleifendiuretika eingesetzt werden. Die Einnahme eines SGLT2-H. ist meist mit einer geringeren Diuretika-Dosierung verbunden. Weitere Wirkmechanismen der SGLT2-H. sind der Abbildung 2 zu entnehmen. Auch kommt es zu einem positiven Remodeling des LV mit Verbesserung der LV-Funktion, zur Nephroprotektion mit Stabilisierung der eGFR und Abnahme der Albuminurie, Hemmung des Sympathikus, Hemmung der Entzündung und reaktiver Sauerstoffspezies, Steigerung der Erythropoetinsynthese, Gluconeogenese und Fettsäureoxidation und einer zellulären Optimierung (O2-Freisetzung, Ketonkörper- u. ATP-Synthese) mit Verbesserung der myokardialen Energieversorgung. Der ketogene Metabolismus führt zu einer Gewichtsreduktion, einer Verbesserung der mitochondrialen Dysfunktion und einem reduzierten oxidativen Stress (12, 13). Auch wird die Autophagie, ein intrazellulärer Prozess, in verschiedenen Organen verbessert (14). Der Abbau von fehlgefalteten Proteinen oder geschädigten Zellorganellen verhindert negative Auswirkungen auf die Zellvorgänge und stellt Moleküle wie Aminosäuren, Fettsäuren oder Kohlenhydrate der Zelle wieder für den Anabolismus zur Verfügung. Einer Fibrose wird entgegengewirkt, ebenso einer glomerulären und tubulären Schädigung. Durch die Natriurese kommt es zu einer intraglomerulären und pulmonal arteriellen Druckreduktion. Günstig ist auch die Senkung der Harnsäure (Prädiktor Schweregrad, Mortalität HI) und eine sich seltener entwickelnde medikamentöse Hyperkaliämie bei der Basistherapie der HI. Dies wirkt sich günstig aus bei der Gabe von ACE-H. und MRAs – Erreichen der Zieldosen. Die SGLT2-H. sind sehr gut verträglich. Häufigste NW: urogenitale Infekte.
Leider werden Sacubitril/Valsartan und ein SGLT2-H. trotz hohem kardiovaskulärem Risiko oft zu spät eingesetzt, dies verdeutlicht die EVOLUTION-HF Studie bei 270 000 Patienten in Japan, Schweden und USA. Auch wurde nach einem Jahr die 4-er Kombination nicht mehr konsequent eingenommen, resp. die Zieldosis der einzelnen Medikamente oft nicht erreicht (15). Vor allem Patienten, aber auch ein Teil der Ärzte, beurteilen das hohe Risiko einer fortgeschrittenen HI falsch. Nur 14% der Patienten schätzen das Risiko als hoch ein (16).
Herzinsuffizienz mit einer LV-EF >40% (HFmrEF: 41-49%) + ≥50% HFpEF)
Auch bei einer HI mit einer EF von 41-49% wirken die «fantastic four». Drei dieser vier Medikamente haben nach den ESC-Guidelines 2021/2023 eine IIb Indikation – können auch in dieser Patientenpopulation in Betracht gezogen werden (1, 2). Nach den 2023 focused update ESC-Guidelines HI 2021 (2) hat der SGLT2-H. Dapa- resp. Empagliflozin und Diuretika bei Flüssigkeitsretention eine IA-Indikation – reduziert das Risiko für HI-Hospitalisierungen und das Risiko des kardiovaskulären Todes. Diese positive Wirkung ist unabhängig von der LV-EF (17). SGLT2-H. verbessern auch die gestörte diastolische Funktion, welche bei der HFpEF eine sehr wichtige Rolle spielt (18). In der EMPEROR PRESERVED Studie konnte durch Empagliflozin der primäre Endpunkt kardiovaskulärer Tod und Hospitalisation wegen HI sign. gesenkt werden – HR 0,79, dies bedeutet eine RRR von 21% resp. eine NNT von 31 über eine mediane Dauer von 26 Monaten (19). Erst bei einer LV-EF ≥65% hat das Medikament bei HI keine Wirkung mehr auf die Hospitalisationsrate (20). Die DELIVER Studie bestätigte die Ergebnisse mit Dapagliflozin mit 23% weniger HI-Hospitalisationen resp. einer NNT von 32 (21).
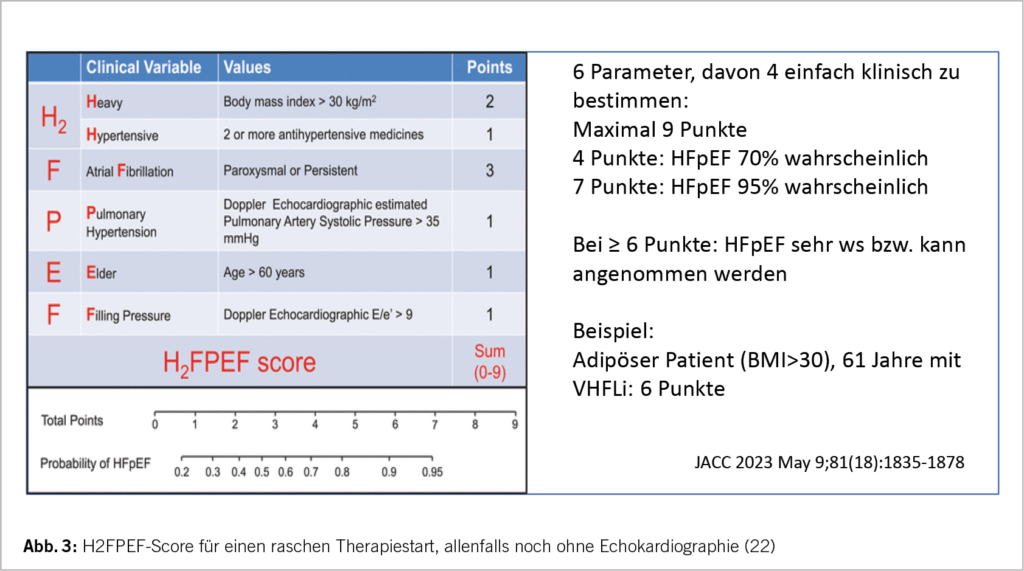
Die Diagnose einer HFpEF mit einer diastolischen Dysfunktion mit eingeschränktem linksventrikulärem Füllungsprozess kann ohne Herzecho mit Hilfe des H2FPEF-Scores klinisch bereits vermutet werden – vgl. Abbildung 3. Von den 6 Parametern sind 4 klinisch und 2 echokardiographisch zu bestimmen. Bereits mit der Klinik besteht eine hohe Wahrscheinlichkeit für eine HFpEF (22). Natürlich sollte noch ein Echo zur Bestätigung durchgeführt werden. Die klinischen Parameter erlauben aber einen vorzeitigen medikamentösen Therapiebeginn. Ein erhöhtes NT-pro-BNP von >125pg/ml im SR resp. >365pg/ml im VHFLi spricht ebenfalls für eine HI (1).
Bei einer HI sind die Komorbiditäten sehr wichtig; besonders bei der HFpEF. Die häufigste Begleiterkrankung ist die CKD mit knapp 50-60% je nach HI Typ. Weitere Erkrankungen sind: Eisenmangel mit und ohne Anämie, Übergewicht/Adipositas, Kachexie, T2DM, Schilddrüsenfunktionsstörungen, COPD, CHK, PAVK und der Schlaganfall. Zusätzliche Erkrankungen: Hypertonie, VHFli, pulmonale Hypertonie, Schlafapnoe (23, 24). Alle modifizierbaren kardiovaskulären Risikofaktoren begünstigen neben einigen nicht kardialen Erkrankungen die Entwicklung einer HFpEF. Das weibliche Geschlecht und das höhere Alter sind besonders häufig vorhanden. All diese Begleitkrankheiten sollten gesucht und behandelt werden.
Bei jeder HI mit einer LV-EF <50% sollte ein Eisenmangel (ca. 50 %), auch bei normalem Hämoglobin, gesucht und therapiert werden. Ein Eisenmangel ist definiert als: Ferritin <100ug/ml oder Ferritin 100-299ug/ml und Transferrinsättigung <20 %. Dieser sollte intravenös mit Eisencarboxymaltose oder Eisenderisomaltose substituiert werden, um die HI-Symptome zu senken, die Leistungsfähigkeit und Lebensqualität zu verbessern (IA) und die HI-Hospitalisationsrate zu senken (IIaA) (1, 2). Eine perorale Eisensubstitution ist wegen einer Eisenresorptionsstörung bei HI nicht sinnvoll.
Aktuelle Studienergebnisse
Alle Patienten mit Herzinsuffizienz können von einem telemedizinischen Überwachungsprogramm profitieren, und zwar unabhängig von der Pumpfunktion. Das ergab eine neue Analyse der Studiendaten von TIM-HF2 (25).
Versicherungsdaten von 938 Patienten aus Südkorea deuten auf eine weitere Patientengruppe, die von SGLT2-H. besonders profitieren könnte: T2DM Erkrankte in den ersten 14 Tagen eines akuten Myokardinfarkts nach einer PCI. Bei dieser Population war das Risiko innerhalb der nächsten zwei Jahre zu sterben oder wegen HI hospitalisiert zu werden, um 32% niedriger als ohne Dapa- oder Empagliflozin. Auch war das MACE-Risiko um 23% reduziert (26). Es ist eine retrospektive Auswertung, ein Kausalitätsnachweis ist nicht möglich – die Ergebnisse sind somit vorerst eine vielversprechende Hypothese. Es laufen zu dieser Fragestellung zwei randomisierte kontrollierte Studien – DAPA-MI und EMPACT-MI.
SGLT2-Hemmer als Antiarrhythmikum bei VHFli?
Dapagliflozin verringerte bei Hochrisikopatienten mit T2DM die Häufigkeit der gemeldeten Episoden von Vorhofflimmern/-Flattern. Dieser Effekt war unabhängig von der Anamnese (VHFLi, atherosklerotischen kardiovaskulären Erkrankungen, HI). Dies ergab eine retrospektive Post-hoc-Analyse der DECLARE-TIMI 58 Studie (27). Das Risiko für ein VHFLi war nach 4 Jahren um 19% reduziert.
Bei Patienten mit Vorhofflimmern und T2DM, die mit SGLT2-H. behandelt wurden, traten nach einer Katheterablation, gemäss einer retrospektiven US-Datenanalyse, behandlungsbedürftige VHFLi-Rezidive deutlich seltener auf als bei Patienten ohne SGLT2-H (28).
Die möglichen Wirkmechanismen sind noch weitgehend hypothetisch: SGLT2-H. wirken einer atrialen Dilatation entgegen und wirken günstig auf das kardiale remodeling. Auch wirken die oben beschriebenen Effekte der SGLT2-H. günstig bezüglich VHFLi/-Flattern. Für diese Hypothese eines antiarrhythmischen Wirkpotenzials bedarf es nun prospektiven Studien.
Copyright bei Aerzteverlag medinfo AG
Zelglistrasse 17
8127 Forch
u.n.duerst@ggaweb.ch
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
- Die Herzinsuffizienz ist, unabhängig von der LV-EF, eine chronisch progrediente Erkrankung mit hoher Mortalität. Sie hat ein hohes Risiko für erste und erneute Ereignisse.
- Die rasche Implementierung einer leitlinienbasierten Therapie («fantastic four») kann die Lebenszeit verlängern. SGLT2-H. sollten dabei konsequent eingesetzt werden.
- SGLT2-Hemmer können Ödeme reduzieren und Diuretika einsparen. Sie wirken kardio- und nephroprotektiv. Sie können über einen sehr breiten eGFR-Bereich eingesetzt werden, verlangsamen eine Progression und das Erreichen einer terminalen Niereninsuffizienz sowie auch das Risiko eines kardiovaskulären oder renalen Todes. SGLT2-H.
zeigen bei der HI einen Nutzen über das gesamte Spektrum der
Ejektionsfraktion (IA). - Ein SGLT2-H. wird bei Patienten mit HFmrEF und HFpEF empfohlen, um das Risiko für Hospitalisierung wegen HI oder kardiovaskulären Tod zu reduzieren (IA).
- Unter den heutigen Antidiabetika haben SGLT2-H. den stärksten Effekt auf die Verhinderung oder die Reduktion einer HI bei Patienten mit T2DM.
- Es gibt Hinweise auf positive Auswirkungen der SGLT2-H. auf ein
Vorhofflimmern.
1. McDonagh TA et al., Heart Failure Guidelines ESC 2021; EHJ 2021 Sep 21;42(36):3599-3726
2. Mc Donagh TA et al., 2023 Focused Update of the 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure, European Heart Journal (2023) 00,1–13, https://doi.org/10.1093/eurheartj/ehad195
3. Marx N et al., 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes, European Heart Journal (2023) 00, 1–98, https://doi.org/10.1093/eurheartj/ehad192
4. Dürst V et al., Chronische HI in der Hausarztpraxis; Der informierte arzt 2022;11:7-10
5. Desai AS et al., Effect of Dapagliflozin on Cause-Specific Mortality in Patients With Heart Failure Across the Spectrum of Ejection Fraction: A Participant-Level Pooled Analysis of DAPA-HF and DELIVER, JAMA Cardiol. 2022 Dec.1;7(12):1227-1234
6. Tromp J et al., The aggregate treatment benefit of pharmacological therapy for heart failure with reduced ejection fraction, JACC Heart Fail. 2022 Febr;10 (2):73-84
7. Vaduganathan M et al., Estimating lifetime benefits of comprehensive disease-modifying pharmacological therapies in patients with heart failure with reduced ejection fraction: a comparative analysis of three randomised controlled trials, Lancet 2020 Jul 11;396 (10244):121-128
8. McMurray JJV et al., Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction, DAPA-HF, N Engl J Med 2019;381 (21):1995-2008
9. Packer M et al., Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure, EMPEROR Reduced, N Engl J Med 2020;383 (15): 1413-1424
10. Voors A. et al., The SGLT2 inhibitor empagliflozin in patients hospitalized for acute heart failure: a multinational randomized trial, EMPULSE-HF, AHA 2021, Nat. Med. 2022
11. Yeoh SE et al., Dapagliflozin vs. metolazone in heart failure resistant to loop diuretics EHJ 2023 May 21 Eur Heart J, ehad341, https://doi.org/10.1093/eurheartj/ehad341
12. Mc Murray JJV et al., SGLT2 inhibitors and mechanisms of cardiovascular benefit: a state-of-the-art review, Diabetologia 2018;61:2108-2117
13. Hellenkamp K et al., Pharmacologic treatment options for heart failure with reduced ejection fraction: an update for 2022, Experte Opin Pharmacother. 2022 Apr.;23(6):673-680
14. Packer M et al., Critical Reanalysis of the Mechanisms Underlying the Cardiorenal Benefits of SGLT2 Inhibitors and Reaffirmation of the Nutrient Deprivation Signaling/Autophagy Hypothesis, Circulation 2022;146:1383-1405
15. Savarese G et al., Heart Failure Drug Treatment-Inertia, Titration, and Discontinuation: A Multinational Observational Study (EVOLUTION HF), JACC Heart Fail. 2023 Jan.11(1):1-14
16. Ambardekar AV et al., Discordant Perceptions of Prognosis and Treatment Options Between Physicians and Patients With Advanced Heart Failure, JACC Heart Fail. 2017 Sep; 5(9):663-671
17. Jhund PS et al., Dapagliflozin across the range of ejection fraction in patients with heart failure: a patient-level, pooled meta-analysis of DAPA-HF and DELIVER, Nat Med. 2022 Sep;28(9):1956-1964
18. Pabel S et al., Potential Mechanisms of SGLT2 Inhibitors for the treatment of heart failure with preserved ejection fraction, Front Physiol. 2021 Nov 5;12:752370
19. Anker S D et al., Empagliflozin in Heart Failure with a Preserved Ejection Fraction, Emperor Preserved, N Engl J Med 2021; 385 (16):1451-1461
20. Butler J et al., Effect of empagliflozin in patients with heart failure across the spectrum of left ventricular ejection fraction, Eur Heart J 2022 Feb.3; 43(5):416-426
21. Solomon S D et al., Dapagliflozin in Heart Failure with Mildly Reduced or Preserved Ejection Fraction, DELIVER, N Engl J Med 2022 Sep.22; 387(12):1089-1098
22. Kittleson MM et al., 2023 ACC Expert Consensus Decision Pathway on Management of Heart Failure With Preserved Ejection Fraction: A Report of the American College of Cardiology Solution Set Oversight Committee, J Am Coll Cardiol 2023 May 9;81(18):1835-1878
23. Streng KW et al., Non-cardiac comorbidities in heart failure with reduced, mid-range and preserved ejection fraction, Int J Cardiol. 2018 Nov.15;271:132-139
24. Groenewegen A et al., Epidemiology of heart failure, Eur J Heart Fail 2020 Aug;22(8):1342-1356
25 Kerwagen F et al. Fernbehandlung von Herzinsuffizienz über das gesamte Spektrum der Ejektionsfraktion hinweg: eine vorab spezifizierte Analyse der TIM-HF2-Studie, Eur J Heart Fail 27. June 2023,https://doi.org/10.1002/ejhf.2948
26. Kwon O et al., Sodium-Glucose Cotransporter-2 Inhibitors After Acute Myocardial Infarction in Patients With Type 2 Diabetes: A Population-Based Investigation, J Am Heart Assoc2023;12:e027824. https://doi.org/10.1161/JAHA.122.027824
27. Zelniker TA et al.; Wirkung von Dapagliflozin auf Vorhofflimmern bei Patienten mit Diabetes mellitus Typ 2: Erkenntnisse aus der DECLARE-TIMI 58-Studie, Circulation 2020;141: 1227–1234
28. Abu-Qaoud MR et al. Impact of SGLT2 Inhibitors on Atrial Fibrillation Recurrence After Catheter Ablation in Patients With ype-2-Diabetes. JACC Electrophysiology 2023; https://doi.org/10.1016/j.jacep.2023.06.008
der informierte @rzt
- Vol. 13
- Ausgabe 9
- September 2023