- Spektrum der Polyneuropathien
Polyneuropathien (PNP) als generalisierte Erkrankung des peripheren Nervensystems, oft mit autonomer Beteiligung, sind häufige Erkrankungen mit vielfältigen möglichen Ätiologien und potentiell schwerwiegenden Auswirkungen für die Betroffenen. Eine akut verlaufende PNP ist ein neurologisch-medizinischer Notfall. In diesem Artikel werden die häufigsten Formen im Kontext von Pathophysiologie, Klinik, Diagnostik und Therapie dargestellt.
Das häufigste klinische Bild ist die distale symmetrische, oft mit einer sensiblen Symptomatik beginnende Polyneuropathie. Die Erkrankung führt zu einem neuronalen, axonalen Verlust. Hierbei ist der distale Befall dadurch zu erklären, dass sich die Schädigung stärker auswirkt, je länger die betroffenen Nervenfasern sind. In den letzten Jahren sind auch Polyneuropathien der kleinen, nicht-myelinisierten Nervenfasern (Kleinfaserneuropathie) stärker in den Fokus geraten, welche ebenfalls sehr häufig vorkommen und der typischen elektroneurographischen Untersuchung (wie bei der Grossfaserneuropathie) entgehen (1). Seltenere Verteilungen sind der Multiplex-Typ und die Schwerpunktneuropathie. Besonders die immunvermittelten demyelinisierenden Neuropathien können aufgrund einer Polyradikuloneuropathie auch einen proximalen Befall haben. Die kürzlich überarbeiteten Leitlinien der DGN werden für eine weiter vertiefende Lektüre empfohlen (2).
Ursachen und Pathophysiologie
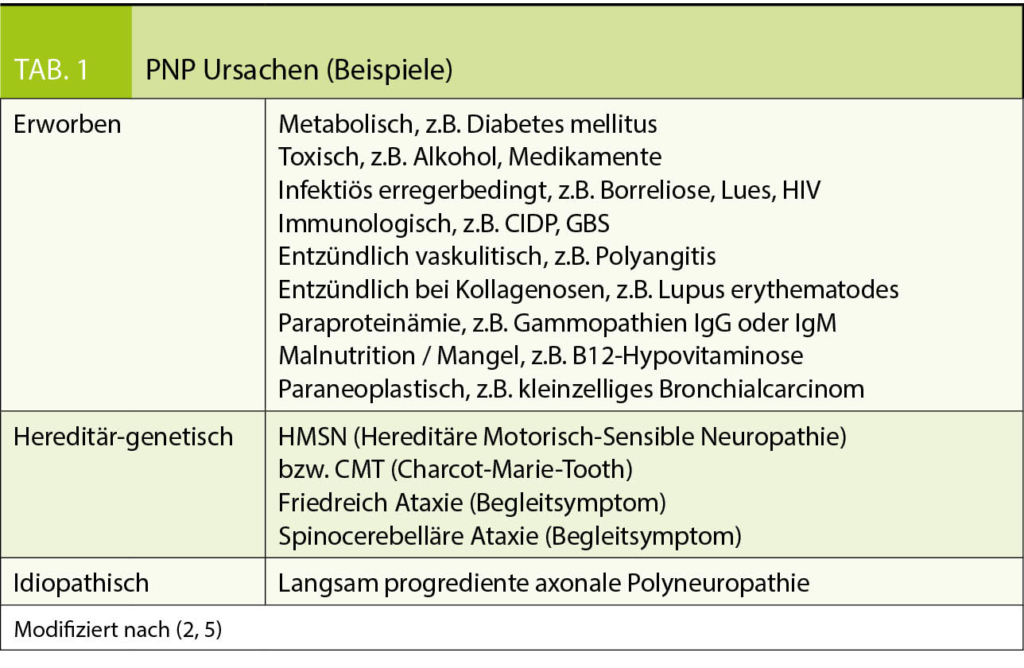
Ein gleichartiges, klinisches Bild bei der PNP kann ganz unterschiedliche Ursachen haben. Weiterhin als häufigste Ätiologien sind im metabolisch-toxischen Bereich einerseits Diabetes mellitus oder eine pathologische Glukosetoleranz zu nennen. Schädigungen des peripheren Nervensystems können zeitlich deutlich vor anderen Organschäden auftreten. Zum anderen geht man weiterhin davon aus, dass eine alkoholtoxische PNP die wahrscheinlich zweithäufigste Ursache darstellt. Problematisch ist hier das Fehlen von «Grenzwerten» im Konsumverhalten, da auch hier die neurotoxische Vulnerabilität sehr unterschiedlich sein kann.
Polyneuropathien können klinisch isoliert oder im Zusammenhang mit anderen systemisch relevanten Erkrankungen und Zustandsbildern auftreten und umfassen prinzipiell sämtliche Bereiche der Ätiologien von medizinisch-neurologischen Erkrankungen (u.a. metabolisch-toxisch, entzündlich erregerbedingt oder autoimmun, darunter auch vaskulitisch, antikörperassoziiert, genetisch-hereditär (mit regelhaft auch späten Manifestationen), sowie paraneoplastisch). Eine genaue Anamnese und eine umfassende klinische Beurteilung sind daher im Management von Polyneuropathien unerlässlich.
Eine elektrophysiologische Abklärung erfolgt, um eine axonale von einer demyelinisierenden Pathologie abzugrenzen und eine Aussage über die Akutheit des Verlaufs zu treffen und schliesslich auch die Diagnose in Abgrenzung zu weiteren Differenzialdiagnosen zu sichern. Hierbei ist es bedeutsam zu wissen, dass auch bei einer axonalen Schädigung durch die Schädigung der schnell leitenden Axone die Nervenleitgeschwindigkeit frühzeitig abnehmen kann. Auch bei einer demyelinisierenden Ätiologie kommt es in typischer Weise zu Amplitudenreduktionen. Schliesslich führen viele der häufigeren Polyneuropathie-Ursachen sowohl zu einer axonalen als auch zu einer demyelinisierenden Schädigung. Besonders relevant ist die Feststellung einer rasch progredient verlaufenden axonalen Polyneuropathie. Die frühzeitige Diagnosestellung einer autoimmun-bedingten Neuropathie vom Typ der polyradikulärer Neuropathie ist therapeutisch hoch relevant (Tab. 1.).
Diagnostische Abläufe
In der Anamnese wird besonders nach sensiblen und motorischen Reiz- und/oder Ausfallsymptomen, sowie neuropathischen Schmerzen und autonomen Störungen gefragt. Das Ausmass der Störung auf die Alltagsfunktion wird evaluiert, etwa mit Hinblick auf Gehbehinderung oder Störungen im Arm-Handgebrauch. Fussdeformitäten oder dünne Unterschenkelmuskeln können ebenso wie eine positive Familienanamnese auf eine hereditäre Neuropathie hinweisen. Frühzeitig sollte man sich ein Bild über den Verlauf, beziehungsweise die bereits bestehende Dauer der Beschwerden (akut, subakut, chronisch) machen. Häufig sind in der Anamnese auch andere Grund- und Begleiterkrankungen, welche ein Risiko für eine Polyneuropathie-Entwicklung darstellen, zu erfragen, oder diese sind bereits in der Krankengeschichte bekannt. Auch Noxen und Medikamente als Ursache für eine toxische Polyneuropathie müssen strukturiert erfasst werden. Bei der klinischen Untersuchung achtet man je nach Verteilungstyp der Polyneuropathie auf schlaffe beziehungsweise atrophe Paresen mit distaler Betonung, sowie häufig bestehender socken- oder handschuhförmige Sensibilitätsstörung, wobei alle sensiblen Qualitäten untersucht werden (beispielsweise pathologische Befunde als Hypästhesie, Pallhypästhesie, Thermhypästhesie, Lagesinn- Empfindungsstörung). Auch eine sensible Ataxie ist häufig vorliegend.
Die klinische Elektrophysiologie umfasst in der motorischen Neurographie die Untersuchung von Arm- und Beinnerven (z.B. N. peronaeus, N. tibialis, N. ulnaris). Auch F-Wellen Bestimmungen sind bei besonders demyelinisierender oder proximaler Läsion aussagekräftig. In der sensiblen Neurografie wird am Bein häufig der Nervus suralis untersucht, am Arm der Nervus ulnaris. In einer EMG-Untersuchung, am häufigsten des Musculus tibialis anterior, wird nach pathologischer Spontanaktivität in Form von vor allen Dingen positiven scharfen Wellen und Fibrillationen (als Hinweis auf einen meist rascher einsetzenden axonalen Schaden) gesucht, sowie die Muskelsummenpotenzials mit Hinblick auf Zeichen eines neurogenen Umbaus untersucht. Überhöhte Potenziale sprechen für ältere Umbauprozesse, eine erhöhte Polyphasierate bei normalen Amplituden ist bei subakuten neurogenen Umbauprozessen festzustellen, Hinweise auf Reinnervation können zusätzlich auch sogenannte Satelliten-Potenziale liefern.
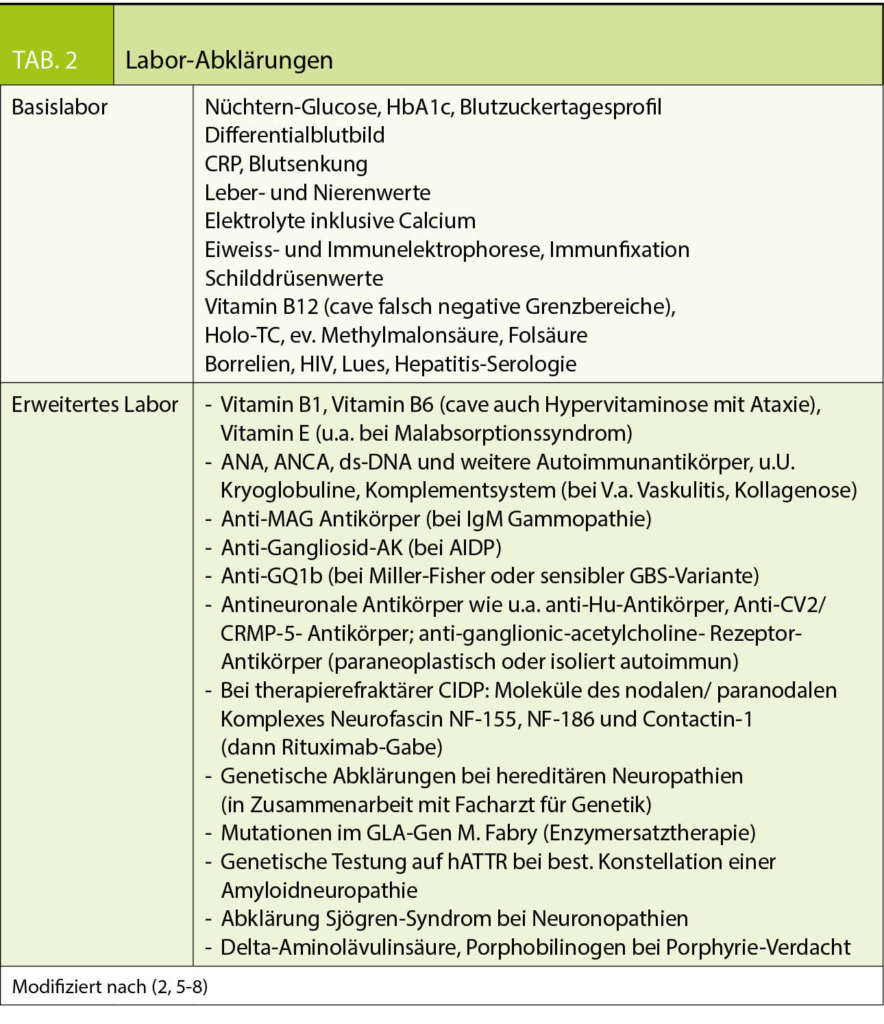
Laboruntersuchungen stellen einen wichtigen Eckpfeiler in der Abklärung von Polyneuropathien dar. Neben einem umfassenden Basis-Labor wird die Anforderung von zusätzlichen Parametern in Abhängigkeit von bestimmten Fragestellungen und Konstellationen vorgenommen. Eine Übersicht findet sich in Tabelle 2.
Eine Liquoruntersuchung gehört nicht zur vorgeschriebenen Routineuntersuchung bei der Polyneuropathie, sofern die Diagnose mit anderen Schritten gestellt werden kann. Eine Liquoruntersuchung ist indiziert bei Verdacht auf erregerbedingte entzündliche, autoimmune oder paraneoplastische Ätiologie der Polyneuropathie.
Die erweiterte Diagnostik umfasst Abklärungsschritte je nach Einzelfall. Eine Hautbiopsie als Stanzbiopsie kann intradermale, nicht-myelinisierte Nervenfasern quantifizieren und ein wichtiger diagnostischer Hinweis auf eine Small Fiber-Polyneuropathie sein (3). Nicht für alle Körperregionen gibt es jedoch hinterlegte Normalwerte. Die Auswertung erfolgt in einem ausgewiesenen Speziallabor. Auch eine strukturierte, quantitative Sensibilitätstestung kann hilfreich sein. Eine Nervenbiopsie, am häufigsten des Nervus suralis, wird heute weniger häufig indiziert und hat einen besonderen Stellenwert bei Vaskulitis-Verdacht, wenn mit anderen Methoden keine Diagnosestellung erfolgen konnte, wobei dann auch eine kombinierte Nerv-Muskelbiopsie erwogen werden sollte. Umfassendere endoskopische Abklärungen sowie Schnittbild-Verfahren kommen beim Verdacht auf paraneoplastische Genese zur Anwendung. Bildgebende Verfahren der Neurone (Nervenultraschall, evtl. MRI) können Zusatzinformationen liefern.
Praktische Hinweise
Eine Polyneuropathie mit rasch einsetzenden Paresen oder starken Schmerzen erfordert notfallmässige Abklärungen, da eine drohende axonale Schädigung beispielsweise bei Vaskulitis oder eine immunogene Polyradikuloneuropathie sofortige therapeutische Massnahmen nach sich ziehen muss. Auch spinale Prozesse (Myelitis, kompressive Erkrankungen wie zervikale Myelopathie sowie metabolische Störungen wie funikuläre Myelose) oder polyradikuläre Schädigungen (enger lumbaler Spinalkanal) sind wichtige Differentialdiagnosen. Typische Zeichen einer Schädigung des ersten Motoneurons können bei zentralen Differentialdiagnosen zudem in der Akutphase fehlen.
Die Laborabklärungen zielen zunächst auf häufige und behandelbare Ursachen von Polyneuropathien ab und werden bei negativen Befunden im Kontext von Klinik und Elektrophysiologie ausgeweitet. Bei häufigen Ursachen von Polyneuropathie muss auch an die Möglichkeit einer Kombination mehrerer Ätiologien gedacht werden, sodass in jedem Fall eine Basisdiagnostik angezeigt ist (beispielsweise Diabetes mellitus und Vitamin-B12-Mangel).
Eine pathologische Glucose-Toleranz kann bereits vor der eigentlichen Diabetesdiagnose zu einer Polyneuropathie führen, mit entsprechend strengeren Kriterien für eine Therapie. Umgekehrt kann leider die Persistenz von im Zusammenhang mit dem Glucose-Stoffwechsel stehenden PNP-Beschwerden trotz Verbesserung der diabetischen Stoffwechsellage nicht gegen diesen ätiologischen Zusammenhang sprechen.
Leider sprechen bei weitem nicht alle Patienten mit einer chronisch inflammatorischen demyelinisierenden Polyradikuloneuropathie (CIDP) auf die Standardtherapie mit Steroiden, Immunglobulin, gegebenenfalls Plasmapherese an. Diagnostisch sollten in diesen Fällen spezifische Antikörper bestimmt werden (Tab. 2.). Bei Antikörperpositivität kann eine Behandlung mit Rituximab vielversprechend sein (2).
Eine PNP als Nebenbefund im höheren Lebensalter kann in der allgemeinmedizinischen oder internistischen Praxis eine häufige klinische Situation darstellen (2). Eine neurophysiologische Diagnostik kann hier im Zusammenhang mit der klinischen Evaluation hilfreich sein, um das Ausmass der Schädigung und die mögliche Bedeutung im Einzelfall festzulegen. Laborbezogene Abklärungen sind in jedem Fall sinnvoll, um die häufigsten und kausal behandelbaren Ursachen abzuklären. Um eine rasche Progredienz nicht zu übersehen, ist eine Nachkontrolle nach 4-6 Monaten je nach Verlauf sinnvoll.
Trotz umfassenden Abklärungen bleiben ca. 25-30% der Ätiologien unklar. Eine langsam verlaufende axonale Polyneuropathie macht ca. 25% aller Polyneuropathien aus und wird als idiopathische axonale Polyneuropathie bezeichnet (2).
Therapie
Im Idealfall kann als Folge von Abklärungen eine kausale Therapie einer bestimmten Polyneuropathie-Ursache erfolgen. Dies kann beispielsweise eine Diabetes-Therapie (aus der Kenntnis einer individuell besonderen Vulnerabilität muss bei pathologischer Glukosetoleranz bereits eine frühzeitige Therapieindikation abgeleitet werden), Vitamin-B12-Substitution oder Behandlung einer Schilddrüsenfunktionsstörung umfassen. Eine Immuntherapie ist bei Polyneuropathie im Rahmen einer inflammatorischen PNP oder einer autoimmun-entzündlichen Systemerkrankung erforderlich. Weitere Behandlungen richten sich nach der festgestellten Ursache (Infektionen wie Borreliose, Hepatitiden; Behandlung einer Gammopathien, usw.).
Zusätzlich zur Standardtherapie bei CIDP müssen häufig Immunsuppressiva zum Einsatz kommen. Leider gibt es für keines der heute am häufigsten angewendeten Therapeutika eine Klasse I Evidenz. Zum Einsatz kommen unter anderem Rituximab, Mycophenolat-Mofetil, Azathioprin (4).
Sehr häufig kommen bei PNP symptomatisch ausgerichtete Therapien, insbesondere bei polyneuropathischen Schmerzen, zum Einsatz. Therapeutika umfassen trizyklische Antidepressiva, Antikonvulsiva wie Gabapentin oder Pregabalin, Carbamazepin, Opioid-Analgetika. Auch topische Therapien mit Lidocain oder Capsaicin oder eine Behandlung von Crampi (Antiepileptika oder Baclofen) kommen zum Einsatz. Physiotherapie und Ergotherapie sind zur Verbesserung der Mobilität und der manuellen Funktionen in einem ambulanten oder ggf. auch stationären Rahmen angezeigt.
Leiter Neurologie
Kantonsspital Graubünden
7000 Chur
sylvan.albert@ksgr.ch
Der Autor hat in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
- Der häufigste Verteilungstyp einer Polyneuropathie (PNP) ist die distal symmetrische sensomotorische PNP, welche meist mit sensiblen Symptomen beginnt
- Aufgrund von potentiell gravierenden Auswirkungen für die Betroffenen auf die Körperfunktionen, Mobilität und Alltagsfunktionen ist eine Evaluation mit der Fahndung nach kausal behandelbaren Krankheitsursachen ebenso wie ggf. die Anwendung von symptomlindernden Therapieverfahren angezeigt
- Wegen der Möglichkeit von multifaktoriellen Ursachen empfiehlt sich im Rahmen der Erstabklärung eine vollständige Durchführung einer Basisuntersuchung meist inklusive Elektrophysiologie. Weitere Spezialabklärungen kommen je nach individueller Konstellation zur Anwendung. Um die Dynamik einer Erkrankung zu ermitteln, können klinische und elektrophysiologische Folgeuntersuchungen sinnvoll sein.
1. de Greef BTA, Hoeijmakers JGJ, Gorissen-Brouwers CML, Geerts M, Faber CG, Merkies ISJ. Associated conditions in small fiber neuropathy – a large cohort study and review of the literature. European journal of neurology 2018;25:348-355.
2. Heuss D et al. Diagnostik bei Polyneuropathien. in: Deutsche Gesellschaft für Neurologie (Hrsg), Leitlinien für Diagnostik und Therapie in der Neurologie 2019:1-64.
3. Sommer C. Nerve and skin biopsy in neuropathies. Current opinion in neurology 2018;31:534-540.
4. Mahdi-Rogers M, Brassington R, Gunn AA, van Doorn PA, Hughes RA. Immunomodulatory treatment other than corticosteroids, immunoglobulin and plasma exchange for chronic inflammatory demyelinating polyradiculoneuropathy. The Cochrane database of systematic reviews 2017;5:Cd003280.
5. Wunderlich G. Polyneuropathien. In: SOPs Neurologie (Herausgeber GR Fink, R Gold, P Berlit), Thieme Verlag 2018:361-365.
6. McCoy SS, Baer AN. Neurological Complications of Sjogren’s Syndrome: Diagnosis and Management. Current treatment options in rheumatology 2017;3:275-288.
7. Rison RA, Beydoun SR. Paraproteinemic neuropathy: a practical review. BMC neurology 2016;16:13.
8. Rossor AM, Tomaselli PJ, Reilly MM. Recent advances in the genetic neuropathies. Current opinion in neurology 2016;29:537-548.
der informierte @rzt
- Vol. 9
- Ausgabe 8
- August 2019