- Streptokokken-Infektionen
Die Streptokokken sind eine Gattung mit mehr als 100 beschriebenen Arten, von denen einige eine hohe medizinische Relevanz besitzen. Diese als Gram-positive, zumeist in Ketten gelagerten Bakterien sind bei vielfältigen Krankheitsbildern anzutreffen und gehören sicher zu den bedeutenden Krankheitserregern im ärztlichen Alltag. Entsprechend vielfältig stellt sich die verfügbare Literatur dar. In der vorliegenden Übersicht werden zu ausgewählten Krankheitsbildern (Tonsillopharyngitis durch Streptococcus pyogenes, «Säuglingsmeningitis » durch Streptococcus agalactiae und Endocarditis durch Gruppe D Streptokokken) die verfügbaren internationalen Leitlinien beleuchtet.
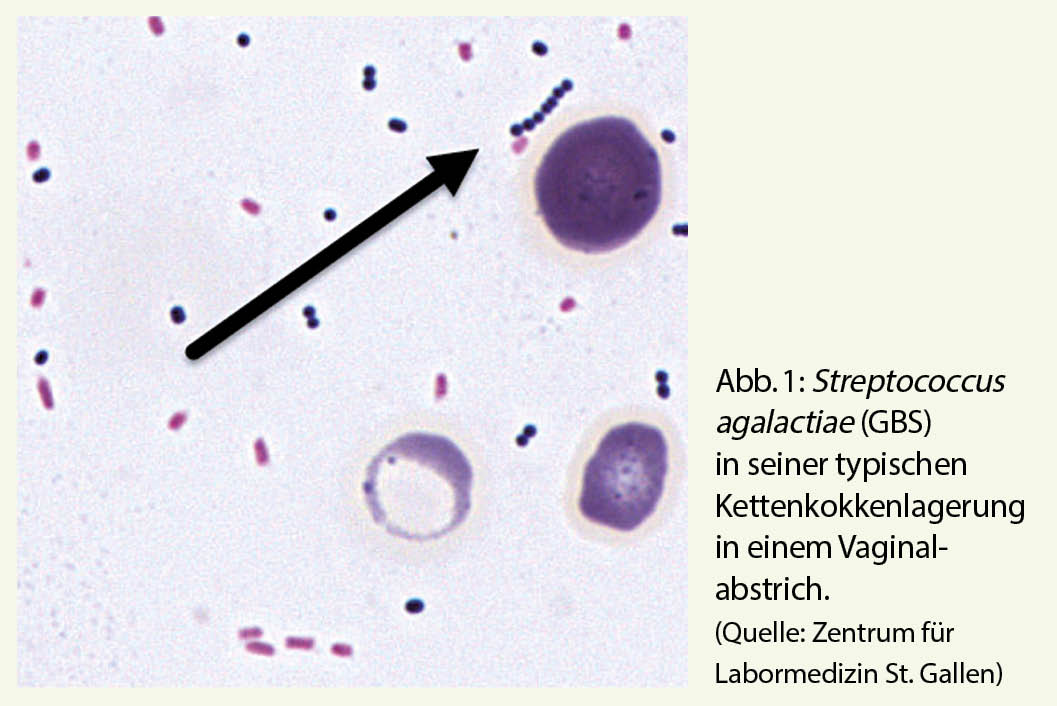
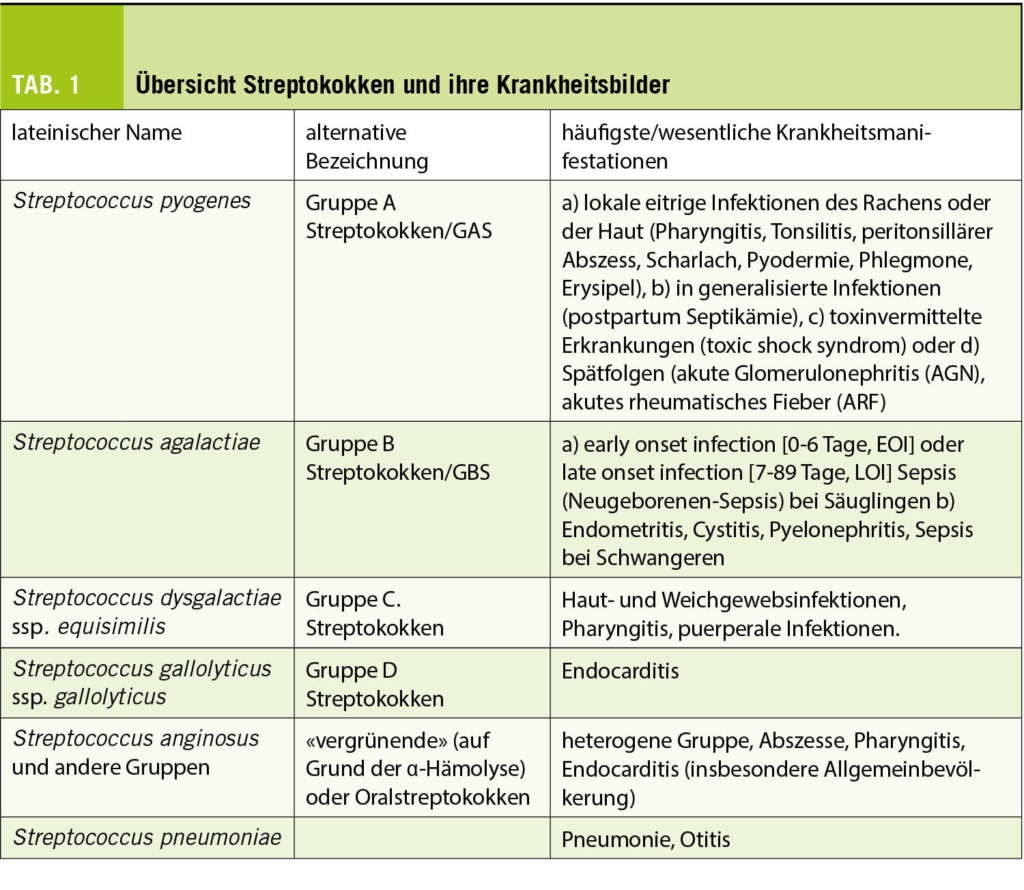
Die Gattungen Streptococcus und Enterococcus sind mit anaeroben Gattungen taxonomisch in der Familie Streptococcaceae zusammengefasst. Kennzeichnendes Merkmal ist ihre mikroskopische Erscheinung in Form von Gram-positiven Kettenkokken (Abb. 1). Das Genus Streptococcus umfasst derzeit 109 valide beschriebene Spezies, von denen nur ein kleiner Teil in der Humanmedizin eine relevante Rolle als Infektionserreger spielt (Tab. 1).
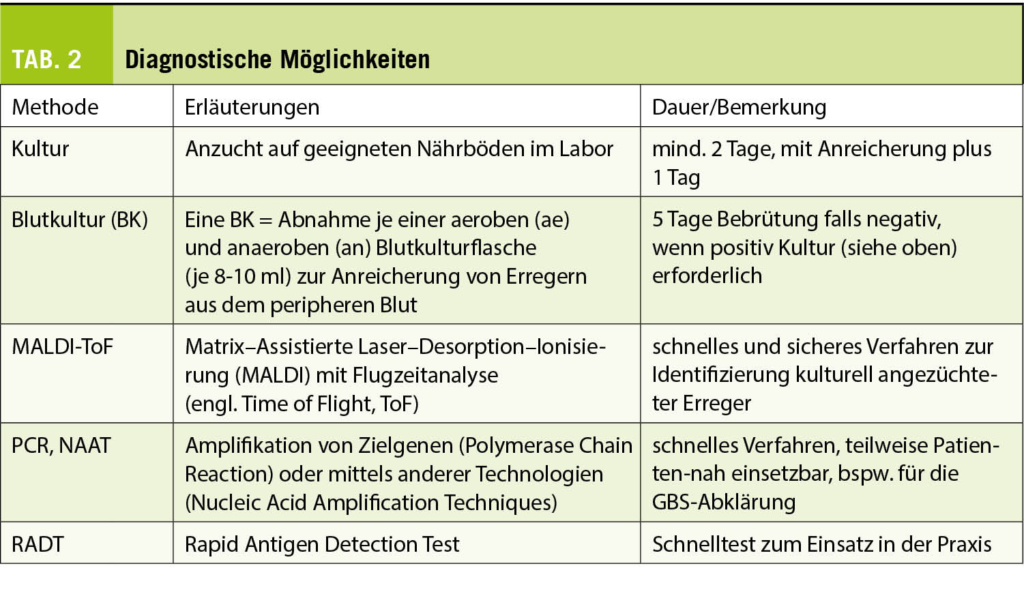
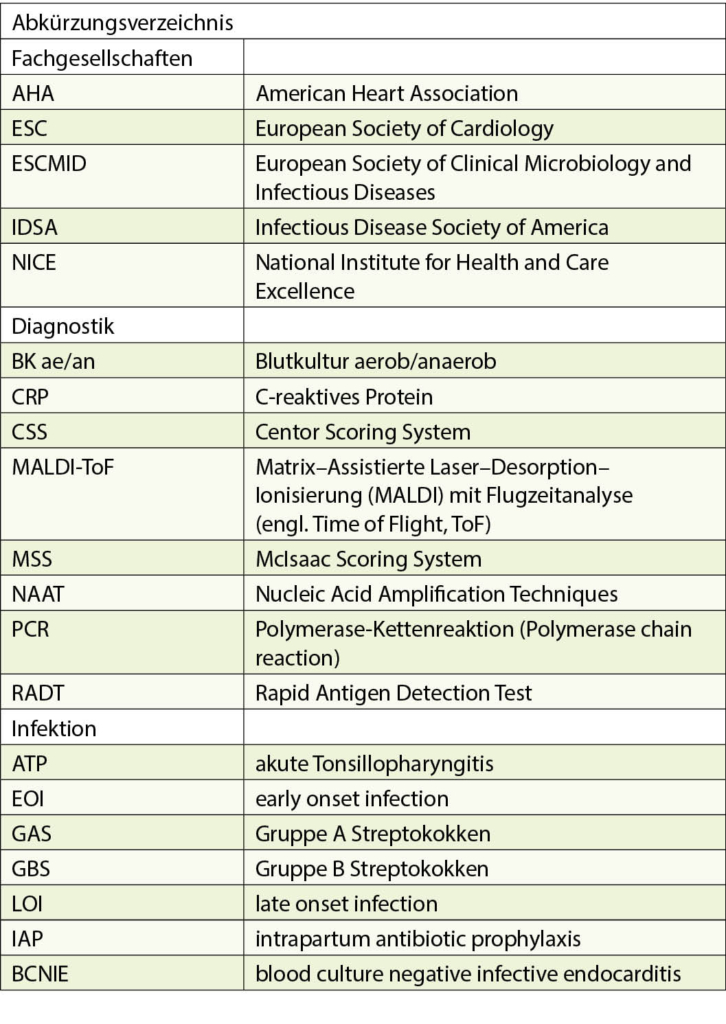
Historisch wurden Streptokokken zunächst auf Grund ihrer Hämolyse auf Blut-haltigen Nährmedien unterschieden. Lancefield teilte später die β-hämolysierenden Streptokokken auf Grund von Kapselantigenen in Gruppen ein. Die Bezeichnungen Gruppe A Streptokokken (GAS) für Streptococcus pyogenes und Gruppe B-Streptokokken (GBS) für Streptococcus agalactiae haben sich bis heute gehalten und werden oft synonym zu den wissenschaftlichen lateinischen Namen verwendet. Während GAS und GBS im Labor relativ einfach mittels massenspektrometrischer Methoden (MALDI-ToF, Tab. 2) anzusprechen sind, ist die exakte Identifizierung der Arten in der Gruppe der Oral- oder vergrünenden Streptokokken nicht immer einfach. Mikrobiologisch werden diese überwiegend im oropharyngealen Raum beheimateten Streptokokken in die Pneumokokken (Streptococcus pneumoniae) und sechs Untergruppen eingeteilt.
Nicht nur mikrobiologisch, auch hinsichtlich der durch sie ausgelösten Krankheitsbilder sehen wir eine grosse Variabilität Streptokokken-assoziierter Infektionen (Tab. 1), weshalb eine Betrachtung der aktuellen Leitlinien eine gewisse Beschränkung erfahren muss. Im Folgenden werden daher die international vorhandenen Leitlinien zur akuten Tonsillopharyngitis (ATP), zum GBS-Screening zur Prävention der Early-onset-Sepsis/Meningitis des Neugeborenen sowie Leitlinien zur Endocarditis mit Blick auf Oralstreptokokken als Erreger diskutiert und zusammengefasst.
GAS-Tonsillopharyngitis
Die weitaus häufigste Manifestation der GAS ist die akute Tonsillopharyngitis (ATP), welche eine gewisse Saisonalität zeigt (1) und in jedem Alter auftreten kann, jedoch bei Kindern im Schulalter die höchste Inzidenz hat (2).
Die Unterscheidung von Pharyngitis, Tonsillitis und Tonsillopharyngitis ist in vielen Fällen nicht einfach, der Schweregrad der Symptomatik kann stark schwanken. Das klassische Symptom der exsudativen Tonsillitis mit vergrösserten, geröteten Mandeln und eitrigem Exsudat, kann oft auch ausbleiben (3). Späte Komplikationen sind in Europa mittlerweile selten (4). Beim Auftreten von Scharlach in Zusammenhang mit der ATP steht die systemische Immunantwort auf die pyrogenen Exotoxine mit den dazugehörigen Symptomen im Vordergrund. Schwere Verlaufsformen sind die nekrotisierende Fasziitis und das Streptokokken-Toxin-Schock-Syndrom (5).
Die Infectious Disease Society of America (IDSA) (2) und die Arbeitsgruppe für akute Halsschmerzen der European Society of Clinical Microbiology and Infectious Diseases (ESCMID) (6) haben Leitlinien zur diagnostischen Aufarbeitung und dem Management von GAS ATP publiziert, das National Institute for Health and Care Excellence (NICE) (7) zur Antibiotikatherapie bei akuten Halsschmerzen.
In den Leitlinien werden für die Diagnostik der GAS-ATP v.a. das klinische Scoring System nach Centor (CSS) bzw. McIsaac (MSS), die RADTs und die klassische Anreicherungskultur diskutiert (Tab. 2). Der Nachweis mittels NAAT/PCR scheint angesichts der im Vergleich hohen Kosten nicht adäquat (7). Serologische Nachweismethoden – mit Ausnahme des Ausschlusses von ARN und AGF – haben keine Bedeutung.
Die Unterscheidung von echten Infektionen vom Trägerstatus (bis zu 25% der Bevölkerung) (8) stellt eine wesentliche Hürde dar und ist mittels RADTs und NAATs nicht möglich, der klinischen Beurteilung kommt daher die höhere Gewichtung zu. Mittels CSS werden Punkte für definierte Symptome vergeben. Beim Maximum von 4 Punkten beträgt die Wahrscheinlichkeit einer positiven GAS-Kultur 56%, beim Minimumscore hingegen nur 2.5% (9). Das ähnlich aufgebaute MSS bezieht zusätzlich die höhere Wahrscheinlichkeit für eine GAS Infektion bei Kindern ein (10).
Es besteht Konsens darüber, dass die klinische Bewertung nach CSS bzw. MSS nicht zur Diagnosestellung ausreicht. Nur hohe klinische Scores (mind. 3 Punkte) sollten mit RADTs oder Kultur bestätigt werden. RADTs sind aufgrund der sehr kurzen Wartezeit bis zum Resultat vorzuziehen, wobei grosser Wert auf die korrekte Instruktion des Personals und Durchführung gelegt werden muss. Follow-Up Beprobungen nach erfolgter Therapie sind nicht indiziert (2). Der Spontanverlauf einer ATP ist nach wenigen Tagen selbstlimitierend. Die Gabe von Antibiotika verkürzt selbst unter der Voraussetzung guter Compliance lediglich bei 20% der behandelten Patienten die Krankheitsdauer um 16 Stunden (1). Bei
schwer erkrankten Patienten oder Komplikationen sind Penicillin/Amoxicillin Wirkstoffe der Wahl. Unabhängig von der antibiotischen Therapie sollten nichtsteroidale Antiphlogistika zur Symptomlinderung verwendet werden. Hinsichtlich detaillierter Therapieempfehlungen und Optionen für Allergiker sei an dieser Stelle nochmal auf die zuvor erwähnten Leitlinien verwiesen.
GBS Screening der Schwangeren
GBS sind Teil der normalen Darmflora (11). Die vaginale Kolonisationsrate von Schwangeren beträgt in Deutschland ca. 16% (12). Bei 1-2% der GBS-besiedelten Reif- und insbesondere Frühgeborenen treten schwere Infektionen in Form von Sepsis, Meningitis und/oder Pneumonie auf (13, 15) (Tab. 1). Die S2k AWMF Guideline empfiehlt ein GBS-Screening bei Schwangeren mittels kombiniertem Rektal- und Vaginalabstrich in der 35 + 0/7 bis 37 + 0/7 SSW (13). Von tiefen Vaginalabstrichen und Zervikalabstrichen wird abgeraten (13, 14). Für die labordiagnostische Abklärung empfehlen die Guidelines den Einsatz von GBS-Anreicherungsbouillons mit anschliessender Kultur (15, 16, 18).
Ziel des Screenings ist die Infektionen (Tab. 1) wie auch deren Folgen bei Neugeborenen zu verhindern resp. zu verringern. Die Neugeborenen-Sterblichkeit bei EOI und LOI beträgt um 9.4%, die Mortalität bei Reifgeborenen um 6% und bei Frühgeborenen um 18% (14). Die Entscheidung, ob eine IAP (intrapartum antibiotic prophylaxis) nötig ist, wird aufgrund eines erhöhen EOI-Risikos getroffen (14, 17). Risikofaktoren sind die Besiedlung der Schwangeren zum Zeitpunkt der Geburt, GBS-Bakteriurie während der Schwangerschaft, frühzeitiger Blasensprung (≥18h vor Geburt), Frühgeburt, eine vorangegangene Geburt mit einem an GBS erkrankten Kind, erhöhtes CRP der Mutter (>20mg/L), Anzeichen einer intrapartalen Infektion inkl. Chorioamnionitis der Schwangeren (12, 13, 14, 17).
Die klinischen Symptome der EOI stellen sich bei Neugeborenen divers, bei Frühgeborenen oftmals dezenter dar. Ca. 95% der GBS EOI treten innerhalb der ersten 48h nach Geburt auf (13, 19). Liegen entsprechende Symptome vor wird ein Erregernachweis mit anschliessender Antibiotikatherapie (Aminoglykosid kombiniert mit Amoxicillin) empfohlen (19). Zur Diagnose einer EOI, insbesondere einer Sepsis, ist der Erregernachweis aus Blutkulturen (BK) und/oder Liquor nötig. Dabei ist nur eine aerobe BK empfohlen, welche mit mind. 1 ml Blut beimpft werden sollte (13). Bei asymptomatischen Neugeborenen wird eine 48h Infektüberwachung nur bei Vorliegen von GBS-Risikofaktoren bzw. bei Müttern mit Anzeichen einer Chorioamnionitis empfohlen (19).
Der Nutzen laborchemischer Parameter ist insbesondere für die Evaluation eines Therapiestopps nach 36-48h wichtig (13, 19). Empfohlen sind neben der Blutkulturdiagnostik die Bestimmung des kindlichen CRP, IL-6 oder IL-8 und ein Differentialblutbild (13), da eine zu lange Therapie (> 5 Tage) zu vermehrten Todesfällen und nekrotisierender Enterokolitis bei Neugeborenen geführt hat (19).
Endocarditis
Die infektiöse Endokarditis (IE) ist keine homogene Entität, weder klinisch noch mit Blick auf die sie auslösenden Erreger (20). Mikrobiologisch dominieren innerhalb eines weiten Erregerspektrums die Streptococcaceae (21). Als singuläre Spezies gehört Streptococcus gallolyticus subsp. gallolyticus (früher Streptococcus bovis) wohl zu den herausragenden ätiologisch relevanten Spezies der IE (22).
Leitlinien für das Management der Endokarditis werden von der European Society of Cardiology (ESC) zuletzt 2015 (23) und der American Heart Association (AHA) in der revidierten Fassung von 2017 (24) herausgegeben. Daneben existieren weitere Leitlinien europäischer und amerikanischer Fachgesellschaften mit teils spezialisiertem Fokus, die an dieser Stelle nicht weiter besprochen werden. Hingewiesen sei auf die von der Expertengruppe «Infective Endocarditis Prevention» für die Schweiz ganz aktuell überarbeitete Version der Richtlinie für die Antibiotika-Prophylaxe (25).
Vergrünende Oralstreptokokken gehören zu den häufigsten Keimen im Zusammenhang mit IE. Schon das morgendliche Zähneputzen reicht aus, um eine transiente Bakterämie mit Oralstreptokokken hervorzurufen. Zahnmedizinische Eingriffe sind demzufolge nur für einen geringen Anteil der IEs verantwortlich. Eine antimikrobielle Prophylaxe (AM) wird zwar diskutiert, konsequenterweise aber nur bei Eingriffen bei Patienten mit hohem Risiko bzw. bei entsprechend Risiko-assoziierten zahnärztlichen Eingriffen empfohlen (23, 25, 26). Bei Patienten mit mittlerem oder hohem Risiko wird die Sanierung von Urämien bzw. chronischen Hautinfektionen empfohlen, auf den Nutzen der antibiotischen Therapie bei bekannten bakteriellen Infektionen zur IE-Prophylaxe wird hingewiesen (23).
Die Erregerdiagnostik ist Teil einer umfassenden Diagnostik (20, 23). Zum Erregernachweis bei V.a. IE ist die Blutkultur die Methode der Wahl. Diagnostisches Hauptkriterium ist der kulturelle Nachweis in zwei separaten, peripher entnommenen BK-Sets. Empfohlen wird die Abnahme von drei BK-Paaren (je ae und an) in einem Intervall von 30 min vor Beginn der antibiotischen Therapie (23), wobei die Wahrscheinlichkeit des Keimnachweises mit der Anzahl der Paare steigt und bei Abnahme von 4 Paaren bei 100% liegt (27). Da bei der IE der bakterämische Zustand konstant anhält, muss für die Entnahme von BKs keine febrile Phase abgewartet werden (23), hinsichtlich Einzelabnahme vs. Sammelabnahme der BK-Paare ergibt sich kein Unterschied (28). Mit den modernen Automatensystemen ist eine verlängerte Bebrütung (14 oder 21 Tage) nicht mehr erforderlich, eine 5-tägige Bebrütung reicht i.d.R. auch für den Nachweis langsam wachsender Keime (bspw. Cutibacterium sp., früher Propionibacterium) aus. In selten Fällen kann eine Verlängerung von 5 auf 7 Tage in Erwägung gezogen werden. Hervorzuheben ist hingegen das Einhalten der präanalytischen Anforderungen bzgl. Anzahl und Füllvolumen der Flaschen (weder Über- noch Unterfüllung) (28).
Kultur-negative IE (BCNIE) kann je nach Studienlage in ca. 1/3 aller Fälle auftreten. Insbesondere im Hinblick auf die in dieser Übersichtsarbeit relevanten Streptokokken treten BCNIE üblicherweise bei Abnahme der BKs nach Beginn der antibiotischen Therapie auf. In solchen Fällen kann eine eubakterielle PCR sinnvoll sein (23). Eigene Erfahrungen deuten jedoch darauf hin, dass diese nicht aus den BK-Flaschen erfolgen sollte, sondern aus dafür separat abgenommenem EDTA-Blut.
Da die häufigen Erreger der IE incl. der Staphylokokken gleichzeitig auch zu den häufigen Kontaminanten positiver BKs gehören, kann eine kritische Wertung eines positiven BK-Resultats im Sinne einer Abgrenzung zu einer möglichen Kontamination schwierig sein. Daher stellt erst der Nachweis typischer Erreger wie S. gallolyticus ssp. gallolyticus oder Mitglieder der Viridans-Streptokokken in zwei unabhängigen BKs ein Hauptkriterium dar (23). Ein Einzelnachweis, insbesondere ohne Vorliegen weiterer Hauptkriterien ist hingegen vorsichtig zu bewerten. Findet sich in Urinkulturen bei Patienten mit Verdacht auf IE (wiederholt) ein typischerweise als Kontaminant zu klassifizierender Keim aus der Gruppe der Oral- oder Gruppe-D Streptokokken (S. gallolyticus ssp. gallolyticus), kann dies die Bedeutung eines korrespondierenden Keimnachweises aus der BK stärken. Bleiben BKs mit demselben Erreger auch 48-72 Stunden nach Initiation einer eigentlich wirksamen Therapie positiv, stellt dies ein prognostisch ungünstiges Kriterium dar.
Im Zusammenhang mit der chirurgischen Sanierung der IE wird die Suche nach bzw. der Ausschluss von Foci relevant. Entsprechend ist die Erhebung eines Zahnstatus, eine Kolonoskopie bei Patienten mit IE durch S. gallolyticus ssp. gallolyticus, oder die Abklärung spinaler Infektionen wie bspw. Spondylodiscitis zu empfehlen (29).
Copyright bei Aerzteverlag medinfo AG
Zentrum für Labormedizin St. Gallen
Humanmedizinische Mikrobiologie
Frohbergstrasse 3
9001 St. Gallen
oliver.nolte@zlmsg.ch
Zentrum für Labormedizin St. Gallen
Humanmedizinische Mikrobiologie
Frohbergstrasse 3
9001 St. Gallen
salome.seiffert@zlmsg.ch
Zentrum für Labormedizin St. Gallen
Humanmedizinische Mikrobiologie
Frohbergstrasse 3
9001 St. Gallen
patrick.kindle@zlmsg.ch
Die Autoren geben an, dass in Zusammenhang mit diesem Artikel kein Interessenskonflikt besteht.
◆ Die Gattung Streptococcus umfasst mehr als 100 Arten, von denen wenige eine hohe Bedeutung als Infektionserreger haben.
◆ Gruppe-A-Streptokokken sind die häufigste bakterielle Ursache für eine akute Tonsillopharyngitis, jedoch ist die Unterscheidung von
Infektion und Trägerstatus mit diagnostischen Methoden schwierig, weshalb der klinischen Beurteilung ein hoher Stellenwert zukommt.
Der Spontanverlauf ist meist günstig, Antibiotika sind zurückhaltend einzusetzen.
◆ Gruppe-B-Streptokokken stellen insbesondere für Neugeborene eine potentielle Bedrohung dar. Durch geeignete Massnahmen (GBSScreening und IPA) können schwere Infektionen der Mütter und Neugeborenen (insbesondere die EOI) wie auch deren Folgen verhindert resp. verringert werden.
◆ Streptokokken, insbesondere Oralstreptokokken und S. gallolyticus ssp. gallolyticus, dominieren innerhalb eines weiten Spektrums als
Erreger der Endocarditis. Mikrobiologisch stellt die Blutkultur die wesentliche diagnostische Säule dar, wobei der korrekten Präanalytik
(Anzahl und Füllvolumen der Flaschen) grosse Bedeutung zukommt.
1. Toepfner N, Berner R. Gruppe-A-Streptokokken-Infektionen im Kindesalter. Monatsschr Kinderheilkd 2011;159:775-786
2. Shulman ST. et al. Clinical Practice Guideline for the Diagnosis and Management of Group A Streptococcal Pharyngitis: 2012 Update by the Infectious Disease Society of America Clin Inf Dis 2012;55(10):e86-e102
3. Block SL. Streptococcal Pharyngitis: Guidelines, Treatment Issues, and Sequelae. Pediatr Ann 2014;43(1) 116
4. Gewitz HM. et al. Revision of the Jones Criteria for the Diagnosis of Acute Rheumatic Fever in the era of Doppler Echocardiography: A Scientific Statement from the American Heart Association. Circulation 2015;131(20):1806-18
5. Berner R. et al. S2k-Leitlinie 017/024: Therapie entzündlicher Erkrankungen der Gaumenmandeln – Tonsillitis. AWMF 8/2015
6. Pelucchi C. et al. ESCMID Guideline for the Management of Acute Sore Throat. Clin Microbiol Infect 2012; 18:1-28
7. NICE guideline Sore throat (acute): antimicrobial prescribing. 2018; NICE guideline NG84
8. Luo R. et al. Diagnosis and Management of Group a Streptococcal Pharyngitis in the United States, 2011-2015. BMC Infect Dis 2019;19(1):193
9. Centor RM. et al. The diagnosis of strep throat in adults in the emergency room. Med Decis Making 1981;1(3):239-46⁄
10. McIsaac WJ. et al. A clinical score to reduce unnecessary antibiotic use in patients with sore throat. CMAJ 1998;158(1):75-83
11. Shabayek S, Spellerberg B. Group B Streptococcal Colonization, Molecular Characteristics, and Epidemiology. Front. Microbiol. 2018;9:437.
12. Podbielski A, Mauch H, Kniehl E, et al. MIQ 11a: Genitalinfektionen Teil II Infektionserreger: Bakterien. ELSEVIER, 2011.
13. Zemlin M, Berger A, Franz A, et al. Leitlinie: Bakterielle Infektionen bei Neugeborenen 2021;4.2 [https://www.awmf.org/leitlinien/detail ll/024-008.html]
14. Astbury C. Clinical Guideline for: The Management of Women known to be carriers of Group B Streptococcus, 2021; 6.3 [https://www.nnuh.nhs.uk/publication/download/women-carriers-of-group-b-streptococcus-io9-v6-3/]
15. Filkins L et al. American Society for Microbiology provides 2020 guidelines for detection and identification of group B Streptococcus. J Clin Microbiol 2021; 59:e01230-20.
16. American College of Obstetricians and Gynecologists. Prevention of group B streptococcal early-onset disease in newborns. ACOG Committee Opinion No. 797. Obstet Gynecol 2020;135:e51–72.
17. Hughes RG, Brocklehurst P, Steer PJ, et al. on behalf of the Royal College of Obstetricians and Gynaecologists. Prevention of early-onset neonatal group B streptococcal disease. Green-top Guideline No. 36. BJOG 2017;124:e280–e305.
18. Filkins L, Hauser J, Robinson-Dunn B, et al. Guidelines for the Detection and Identification of Group B Streptococcus. American Society for Microbiology., 2020. [https://asm.org/Guideline/Guidelines-for-the-Detection-and-Identificationof]
19. Arbeitsgruppe der Schweizerischen Gesellschaft für Neonatologie und der Pädiatrischen Infektiologiegruppe Schweiz. Empfehlungen zur Prävention und Therapie von Termin- und knapp frühgeborenen Kindern (> 34 SSW) mit erhöhtem Risiko einer perinatalen bakteriellen Infektion (early-onset Sepsis), Paediatrica. 2013;24:1.
20. Sonderegger B, Führer U, Portmann S et al. Infektiöse Endokarditis–Update. Teil 1. Swiss Medical Forum. 2012;12(3132).
21. Mainardi JL, Utili R. Endocarditis. In: CORNAGLIA G et al eds. : European Manual of Clinical Microbiology 1st Ed. 2012
22. Corredoira J, Alonso MP, Coira A et al. Characteristics of Streptococcus bovis endocarditis and its differences with Streptococcus viridans endocarditis, European Journal of Clinical Microbiology & Infectious Diseases 2008;27:285-91
23. Habib G, Lancellotti P, Antunes MJ, et al. ESC guidelines for the management of infective endocarditis: the task force for the management of infective endocarditis of the European Society of Cardiology (ESC) endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). European Heart Journal 2015;36(44):3075-3128.
24. Nishimura RA, Otto CM, Bonow RO, et al. AHA/ACC focused update of the 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Journal of the American College of Cardiology 2017;70(2):252-289.
25. Sendi P, Hasse B, Frank M, et al. Infektiöse Endokarditis: Prävention und Prophylaxe. Empfehlungen der Expertengruppe «Infective Endocarditis Prevention» Swiss Med Forum. 2021;21(0506):84-89
26. Thornhill MH, Dayer M, Lockhart B, et al. Guidelines on prophylaxis to prevent infective endocarditis. British Dental Journal 2016;220(2):51-56.
27. Lee A, Mirrett S, Reller LB, et al. Detection of bloodstream infections in adults: how many blood cultures are needed? Journal Clinical Microbiology 2007;45:3546–3548.
28. Lamy B, Dargère S, Arendrup MC, et al. How to optimize the use of blood cultures for the diagnosis of bloodstream infections? A state-of-the art. Frontiers in microbiology 2016;7:697
29. Pettersson GB, Coselli JS, Hussain ST, et al. The American Association for Thoracic Surgery (AATS) consensus guidelines: surgical treatment of infective endocarditis: executive
der informierte @rzt
- Vol. 11
- Ausgabe 6
- Juni 2021