- Über die Behandlung der Migräne
Im Bericht über seine zweite Reise mit der Beagle schildert Charles Darwin, dass er nach seiner Ankunft in der argentinischen Stadt Santa Fe heftige Kopfschmerzen bekommen habe, die ihn für zwei Tage zu Bettruhe gezwungen hätten (1). Eine ältere Dame habe sich um ihn gekümmert und eigenartige Behandlungsmethoden empfohlen. So habe eine Therapie darin bestanden, eine Bohne in zwei Hälften zu teilen, zu befeuchten und an die Schläfen zu kleben. Diese habe dort verbleiben müssen, bis sie von alleine abgefallen sei. Manchmal habe man Menschen in der Stadt gesehen, die auch noch Tage nach dem Ende ihrer Kopfschmerzen eine Bohne am Kopf getragen hätten.
Die Methoden, die uns heute zur Schmerztherapie zur Verfügung stehen, haben im Laufe der Zeit an Komplexität gewonnen. Auch konzentriert sich die Behandlung nicht auf äussere Anwendungen. Im Mai 2019 waren in der Schweiz 18 Wirkstoffe und 186 zugelassene Medikamente für die Indikationen Kopfschmerzen und Migräne gelistet (2) – zu diesen kommen noch zahlreiche Substanzen, die off-label wirksam sind sowie nicht-pharmakologische Therapieansätze.
Wir wollen uns im Folgenden auf die Behandlung der Migräne konzentrieren, die im klinischen Alltag die häufigste Kopfschmerzerkrankung ist. Sie hat eine relativ hohe Prävalenz und ist mit deutlichen Einschränkungen im Alltag assoziiert (3). Dabei sind Attackenbehandlung und Prophylaxe (Basisbehandlung) zu unterscheiden: Erstere versucht eine bereits eingetretene Aktivierung der Schmerzwahrnehmung zu beenden, während Letztere die Empfänglichkeit des Gehirns für Migräneanfälle soweit wie möglich verringert. Beide Ansätze sind wichtig und beide haben ihre eigenen Herausforderungen.
Akuttherapie
Zur medikamentösen Behandlung von Migräneanfällen können einfache Analgetika sowie Triptane eingesetzt werden. Zusätzlich sind Antiemetika (Domperidon und Metoclopramid) oftmals hilfreich, da diese die Gastrokinetik positiv beeinflussen und in gewissem Mass schmerzlindernd wirken (4). Opiate sollten hingegen vermieden werden.
Eine grosse Metaanalyse kam dabei zu dem Schluss, dass NSAR und Triptane insgesamt vergleichbar gut wirken (5). Eine etwas bessere Wirksamkeit wurde Eletriptan (Relpax®) bescheinigt und Ibuprofen eine bessere Verträglichkeit. Neigt ein Patient zu besonders lang andauernden Anfällen, kann dem Wiederauftreten der Schmerzen durch Triptane mit langer Halbwertszeit (Frovatriptan (Menamig®) und Naratriptan (Naramig®)) oftmals vorgebeugt werden (6).
Für eine optimale Wirkung der Medikamente ist der Einnahmezeitpunkt entscheidend: In mehreren Studien wurde festgestellt, dass Triptane umso besser wirken je früher sie eingenommen werden (7 - 10). Es wurde vermutet, dass dies auf die zentrale Sensibilisierung zurückzuführen ist, die die Wirksamkeit der Medikamente verringert (7). Diese tritt auf, wenn zentral gelegene Abschnitte des nozizeptiven Systems über einen längeren Zeitraum stimuliert werden, und wird durch das Auftreten der Allodynie spürbar (11). Andere Autoren warfen ein, dass das schlechtere Ansprechen bei späterer Behandlung in erster Linie bei oraler Behandlung zu beobachten und eher Folge der durch die Migräne verzögerten Magenpassage sei (12). Ein abschliessendes Urteil ist nicht gefällt.
Auch unabhängig von diesen Überlegungen ist die Empfehlung zur möglichst frühzeitigen Akutbehandlung zu relativieren und eine individuelle Therapieplanung zu favorisieren, da Patienten durch diese Empfehlung zu einem vermehrten Akutmedikamentenkonsum verleitet werden könnten (13).
Eine zu häufige Einnahme von Akutmedikamenten ist nicht wünschenswert, da deren Wirkung dann ins Gegenteil umzuschlagen droht. Zwar wird weiterhin kurzfristig Schmerzlinderung erzielt, die Schmerzempfindlichkeit auf kortikaler Ebene nimmt aber zu (eine weitere Form der zentralen Sensibilisierung) (14, 15), sodass häufige Migräneanfälle und tägliche unspezifische Kopfschmerzen resultieren können. Dieser Medikamentenübergebrauchskopfschmerz (Tab. 1) ist äusserst häufig – eine Prävalenz von mindestens 1 bis 2% wird vermutet (16, 17) – weshalb Patienten regelmässig ermutigt werden sollten, sich bei einer Zunahme der Anfallshäufigkeit frühzeitig zu melden, damit eine Prophylaxe diskutiert werden kann.
Prophylaxe
Interessanterweise geben ca. 75% aller Migränepatienten an, dass ihre Anfälle nicht zufällig auftreten, sondern vielmehr auf benennbare Faktoren zurückzuführen sind (18). Tatsächlich ist die Erkenntnis, dass benennbare «Trigger» zu Kopfschmerzen führen nicht neu – bereits um ca. 30 n. Chr. stellte Celsus in seinem Werk «De res medicina» fest, dass Kopfschmerzen durch «Wein, Magenverstimmung, Kälte, Hitze oder die Sonne ausgelöst werden» können («vel vino vel cruditate vel frigore vel igne aut sole contrahitur») (19, 20). In Publikationen jüngeren Datums werden Stress, hormonelle Veränderungen, das Auslassen von Mahlzeiten und Wetterwechsel als häufigste Auslöser von Migräneanfällen genannt (18). Umgekehrt gelingt es aber nicht immer, durch solche Einflüsse auch tatsächlich Anfälle auszulösen (21), was darauf hindeutet, dass die Interpretation einer Migräne als Konsequenz einzelner, unabhängiger Faktoren zu kurz greift.
Grössere Einigkeit besteht hinsichtlich der Bedeutung körperlicher Aktivität. So wurde festgestellt, dass Ausdauersport im aeroben Bereich eine kostengünstige Massnahme ist, die oftmals zu einer Verringerung der Kopfschmerzfrequenz führt (22 - 24). Evidenz gibt es auch für die Wirksamkeit von Autogenem Training (25, 26) und Progressiver Muskelrelaxation nach Jacobson (27) sowie Akupunktur (28).
Oftmals genügen nichtmedikamentöse Massnahmen aber nicht, um Migräneanfällen in ausreichendem Mass vorzubeugen. Bei mehr als drei Anfällen bzw. mehr als fünf Migränetagen pro Monat sowie sehr schweren, lang andauernden Anfällen, sollte eine medikamentöse Prophylaxe erwogen werden (4). Die Entscheidung sollte aber individuell und gemeinsam mit den Patienten getroffen werden. Dabei müssen auch unrealistische Erwartungen gedämpft werden: Das Ziel ist nicht, die Migräne zu heilen – eine Therapie gilt als erfolgreich, wenn sie die Anfallshäufigkeit um mindestens 50% reduziert. In jedem Fall sollten Patienten ermutigt werden, ein Kopfschmerztagebuch zu führen, damit der Therapieerfolg überwacht werden kann. Hat sich eine Prophylaxe bewährt, darf nach ca. sechs bis zwölf Monaten eine Therapiepause erwogen werden. Da die Anfallshäufigkeit im Laufe eines Migränelebens variieren kann, ist es gut möglich, dass eine Prophylaxe nicht mehr benötigt wird.
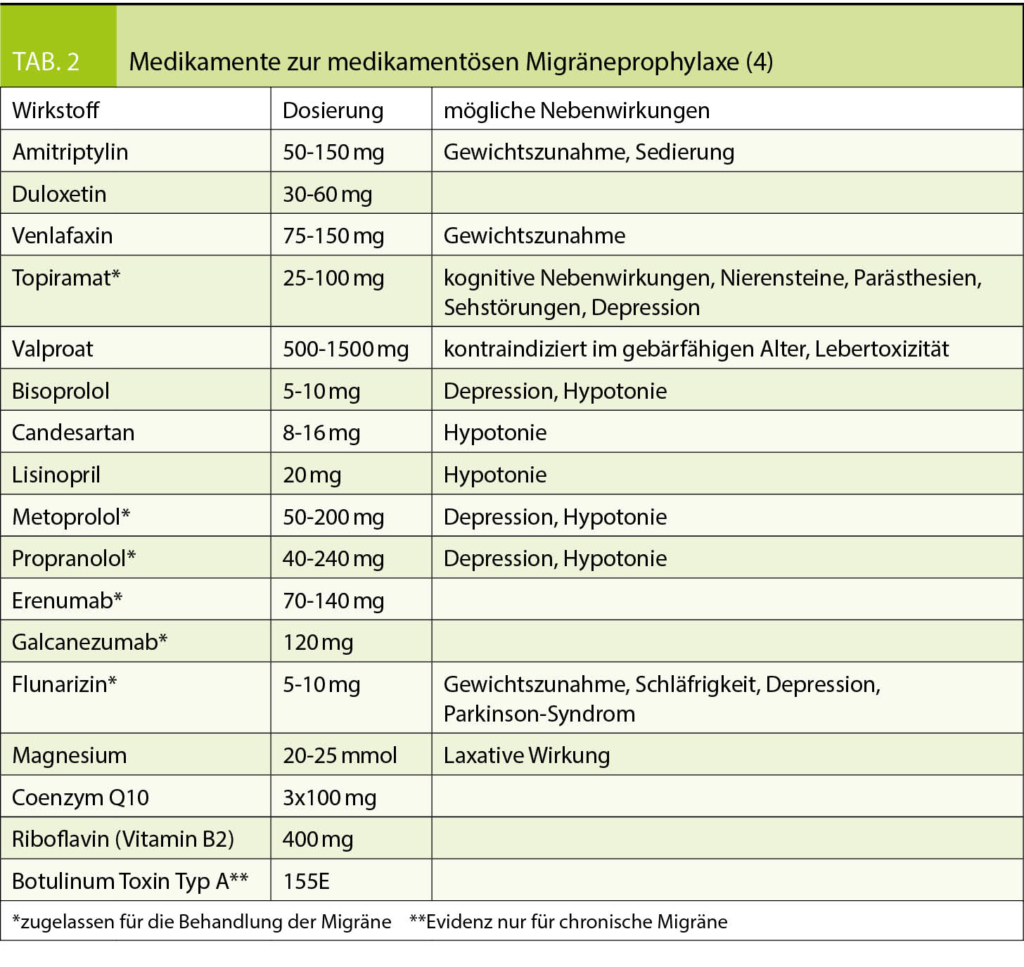
Inzwischen stehen einige Medikamente zur Verfügung, welche sich als effektiv bei der Migränevorbeugung erwiesen haben (Tab. 2) (4, 29). Die Schweizerische Kopfwehgesellschaft (SKG) hat Anfang des Jahres eine aktualisierte Therapieempfehlung publiziert (4). Mit Ausnahme der neuen CGRP-Antikörper (s.u.) wurde jedoch keines dieser Medikamente speziell für die Migräne entwickelt. Dies kann dazu führen, dass Patienten einerseits manchen Medikamentenklassen (v.a. den Antidepressiva) sehr zurückhaltend gegenüberstehen und andererseits über «Nebenwirkungen» klagen, von denen manche der tatsächlich beabsichtigten Wirkung der Substanzgruppe entsprechen (z.B. Hypotonie bei Betablockern und ACE-Hemmern). Es ist daher zweckmässig, bei der Auswahl einer Prophylaxe zu prüfen, ob der Patient auch von anderen Wirkungen bestimmter Medikamente profitieren könnte oder zumindest nicht übermässig beeinträchtigt würde.
Ganz allgemein wird empfohlen, mit niedriger Dosis zu beginnen und die Wirksamkeit der Prophylaxe erst nach einer Therapiedauer von zwei bis drei Monaten insbesondere auf Basis des Kopfschmerztagebuchs zu beurteilen.
Der erste Vertreter der monoklonalen Anti-CGRP-Antikörper kam 2018 auf den Markt, 2019 folgte ein zweiter (30, 31). Mit der Zulassung weiterer Medikamente dieser Klasse ist in den nächsten Monaten zu rechnen. Calcitonin gene-related peptide (CGRP) ist ein Botenstoff mit stark vasodilatierender Wirkung (32), dessen Konzentration im Blut während Migräneanfällen ansteigt (33). Die nun therapeutisch eingesetzten Antikörper richten sich entweder gegen den CGRP-Rezeptor oder CGRP selbst und reduzieren die Anzahl der Migränetage um durchschnittlich drei bis vier Tage pro Monat bei episodischer Migräne (34 - 37). Sie überwinden die Bluthirnschranke wahrscheinlich nicht, haben ein günstiges Nebenwirkungsprofil und werden einmal monatlich subkutan injiziert. Die Medikamente dürfen in der Schweiz nur von einem Neurologen verordnet werden. Eine Kostengutsprache kann durch einen Vertrauensarzt für Patienten mit episodischer und chronischer Migräne erteilt werden, wenn ein grosser Leidensdruck vorliegt und mindestens zwei prophylaktische Medikamente aus unterschiedlichen Klassen keinen ausreichenden Nutzen gebracht haben oder nicht vertragen wurden (30, 31).
Abkürzungen:
ACE Angiotensin Converting Enzyme
CGRP Calcitonin gene-related Peptide
NSAR Nichtsteroidales Antirheumatikum
SKG Schweizerische Kopfwehgesellschaft
Heiko Pohl
Klinik für Neurologie
Universitätsspital Zürich
Schweiz
RehaClinic Bad Zurzach und Universität Zürich
Schweiz
Facharzt Neurologie
Neurologie am Untertor
Erachfeldstrasse 2
8180 Bülach
www.neurologie-untertor.ch
andreas.gantenbein@zurzachcare.ch
A.G. erhielt Honorare für Beratung oder Referate von Allergan, Almirall, Curatis, EliLilly, Novartis, MedGate, Pfizer, Streuli, SWICA & TEVA. P.S. erhielt Honorare für Beratung oder Referate von Allergan, Almirall, EliLilly, Novartis & TEVA. H.P. hat keine Interessenskonflikte.
- Zur Akutbehandlung eines Migräneanfalls können einfache Analgetika und Triptane eingesetzt werden. Die Wirksamkeit von NSAR und Triptanen ist dabei vergleichbar.
- Eine medikamentöse Prophylaxe sollte erwogen werden, wenn mehr als drei Anfälle oder mehr als fünf Kopfschmerztage pro Monat auftreten.
- Monoklonale Anti-CGRP-Antikörper können von einem Facharzt für Neurologie verordnet werden, wenn zuvor zwei prophylaktische Medikamente aus unterschiedlichen Wirkstoffklassen erfolglos ausprobiert oder nicht vertragen wurden.
1. The Voyage of The Beagle By Charles Darwin. Available from: http://www1.biologie.uni-hamburg.de/b-online/d36_beag/beagle.htm.
2. Arzneimittel-Kompendium. (cited 2019 13.05.); Available from: https://compendium.ch/.
3. Stovner, L.J., et al., Global, regional, and national burden of migraine and tension-type headache, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet Neurology, 2018. 17(11): p. 954-976.
4. Andrée, C., et al., Therapieempfehlungen für primäre Kopfschmerzen. 2019, Schweizerische Kopfwehgesellschaft SKG
5. Xu, H., et al., Network meta-analysis of migraine disorder treatment by NSAIDs and triptans. J Headache Pain, 2016. 17(1): p. 113.
6. Geraud, G., C. Keywood, and J.M. Senard, Migraine headache recurrence: relationship to clinical, pharmacological, and pharmacokinetic properties of triptans. Headache, 2003. 43(4): p. 376-88.
7. Burstein, R., B. Collins, and M. Jakubowski, Defeating migraine pain with triptans: a race against the development of cutaneous allodynia. Ann Neurol, 2004. 55(1): p. 19-26.
8. Cady, R., et al., Randomized, placebo-controlled comparison of early use of frovatriptan in a migraine attack versus dosing after the headache has become moderate or severe. Curr Med Res Opin, 2004. 20(9): p. 1465-72.
9. Dowson, A.J., et al., Almotriptan improves response rates when treatment is within 1 hour of migraine onset. Headache, 2004. 44(4): p. 318-22.
10. Freitag, F., et al., Effect of early intervention with almotriptan vs placebo on migraine-associated functional disability: results from the AEGIS Trial. Headache, 2008. 48(3): p. 341-54.
11. Burstein, R., M.F. Cutrer, and D. Yarnitsky, The development of cutaneous allodynia during a migraine attack clinical evidence for the sequential recruitment of spinal and supraspinal nociceptive neurons in migraine. Brain, 2000. 123 ( Pt 8): p. 1703-9.
12. Linde, M., A. Mellberg, and C. Dahlof, Subcutaneous sumatriptan provides symptomatic relief at any pain intensity or time during the migraine attack. Cephalalgia, 2006. 26(2): p. 113-21.
13. Ferrari, M.D., Should we advise patients to treat migraine attacks early: methodologic issues. Eur Neurol, 2005. 53 Suppl 1: p. 17-21.
14. Ayzenberg, I., et al., Central sensitization of the trigeminal and somatic nociceptive systems in medication overuse headache mainly involves cerebral supraspinal structures. Cephalalgia, 2006. 26(9): p. 1106-14.
15. Srikiatkhachorn, A., et al., Pathophysiology of medication overuse headache–an update. Headache, 2014. 54(1): p. 204-10.
16. Zwart, J.A., et al., Analgesic overuse among subjects with headache, neck, and low-back pain. Neurology, 2004. 62(9): p. 1540-4.
17. Castillo, J., et al., Kaplan Award 1998. Epidemiology of chronic daily headache in the general population. Headache, 1999. 39(3): p. 190-6.
18. Kelman, L., The triggers or precipitants of the acute migraine attack. Cephalalgia, 2007. 27(5): p. 394-402.
19. Thayer, B. Celsus: De Medicina. (cited 2019 11.05.); Available from: http://penelope.uchicago.edu/Thayer/E/Roman/Texts/Celsus/home.html.
20. Pearce, J.M., Historical aspects of migraine. J Neurol Neurosurg Psychiatry, 1986. 49(10): p. 1097-103.
21. Hougaard, A., et al., Provocation of migraine with aura using natural trigger factors. Neurology, 2013. 80(5): p. 428-431.
22. Overath, C.H., et al., Does an aerobic endurance programme have an influence on information processing in migraineurs? J Headache Pain, 2014. 15: p. 11.
23. Darabaneanu, S., et al., Aerobic exercise as a therapy option for migraine: a pilot study. Int J Sports Med, 2011. 32(6): p. 455-60.
24. Varkey, E., et al., Exercise as migraine prophylaxis: a randomized study using relaxation and topiramate as controls. Cephalalgia, 2011. 31(14): p. 1428-38.
25. Zsombok, T., et al., Effect of Autogenic Training on Drug Consumption in Patients With Primary Headache: An 8-Month Follow-up Study. Headache: The Journal of Head and Face Pain, 2003. 43(3): p. 251-257.
26. Stetter, F. and S. Kupper, Autogenic Training: A Meta-Analysis of Clinical Outcome Studies. Applied Psychophysiology and Biofeedback, 2002. 27(1): p. 45-98.
27. Meyer, B., et al., Progressive muscle relaxation reduces migraine frequency and normalizes amplitudes of contingent negative variation (CNV). J Headache Pain, 2016. 17: p. 37.
28. Linde, K., et al., Acupuncture for the prevention of episodic migraine. Cochrane Database Syst Rev, 2016(6): p. CD001218.
29. Jackson, J.L., et al., A Comparative Effectiveness Meta-Analysis of Drugs for the Prophylaxis of Migraine Headache. PLoS One, 2015. 10(7): p. e0130733.
30. Bundesamt für Gesundheit, Aimovig, in BAG-Bulletin. 2018, Bundesamt für Gesundheit: Bern. p. 1.
31. Bundesamt für Gesundheit, Emgality, in BAG-Bulletin. 2019, Bundesamt für Gesundheit: Bern. p. 1.
32. Edvinsson, L., et al., Perivascular peptides relax cerebral arteries concomitant with stimulation of cyclic adenosine monophosphate accumulation or release of an endothelium-derived relaxing factor in the cat. Neurosci Lett, 1985. 58(2): p. 213-7.
33. Goadsby, P.J. and L. Edvinsson, The trigeminovascular system and migraine: studies characterizing cerebrovascular and neuropeptide changes seen in humans and cats. Ann Neurol, 1993. 33(1): p. 48-56.
34. Goadsby, P.J., et al., A Controlled Trial of Erenumab for Episodic Migraine. N Engl J Med, 2017. 377(22): p. 2123-2132.
35. Dodick, D.W., et al., ARISE: A Phase 3 randomized trial of erenumab for episodic migraine. Cephalalgia, 2018. 38(6): p. 1026-1037.
36. Stauffer, V.L., et al., Evaluation of Galcanezumab for the Prevention of Episodic Migraine: The EVOLVE-1 Randomized Clinical Trial. JAMA Neurol, 2018. 75(9): p. 1080-1088.
37. Skljarevski, V., et al., Efficacy and safety of galcanezumab for the prevention of episodic migraine: Results of the EVOLVE-2 Phase 3 randomized controlled clinical trial. Cephalalgia, 2018. 38(8): p. 1442-1454.
38. Headache Classification Committee of the International Headache Society (IHS) The International Classification of Headache Disorders, 3rd edition. Cephalalgia, 2018. 38(1): p. 1-211.
der informierte @rzt
- Vol. 9
- Ausgabe 12
- Dezember 2019