- Update Demenz 2021
Ernüchtert von den vielen Fehlschlägen der vergangenen Jahre hat sich die Demenzforschung neuen Ansätzen geöffnet. Diese scheinen erfolgversprechend, doch ein klarer klinischer Durchbruch ist nach wie vor nicht in Sicht. Ob zumindest ein Vertreter der Amyloid-Immunisierungstherapie eine Marktzulassung erhalten soll, wird im Juni 2021 durch die amerikanische FDA entschieden. Kognitive Störungen im Alter sind dagegen unverändert häufig und können – wenn früh und richtig diagnostiziert – auch bereits mit heute vorhandenen medikamentösen und nicht-medikamentösen Massnahmen entscheidend beeinflusst, aber eben (noch) nicht geheilt werden. Die Abklärung wie auch die Therapie sind auf den einzelnen Patienten abgestimmt und hängen wesentlich von Einverständnis, Gesundheitszustand und den sozialen Lebensumständen des Patienten ab.
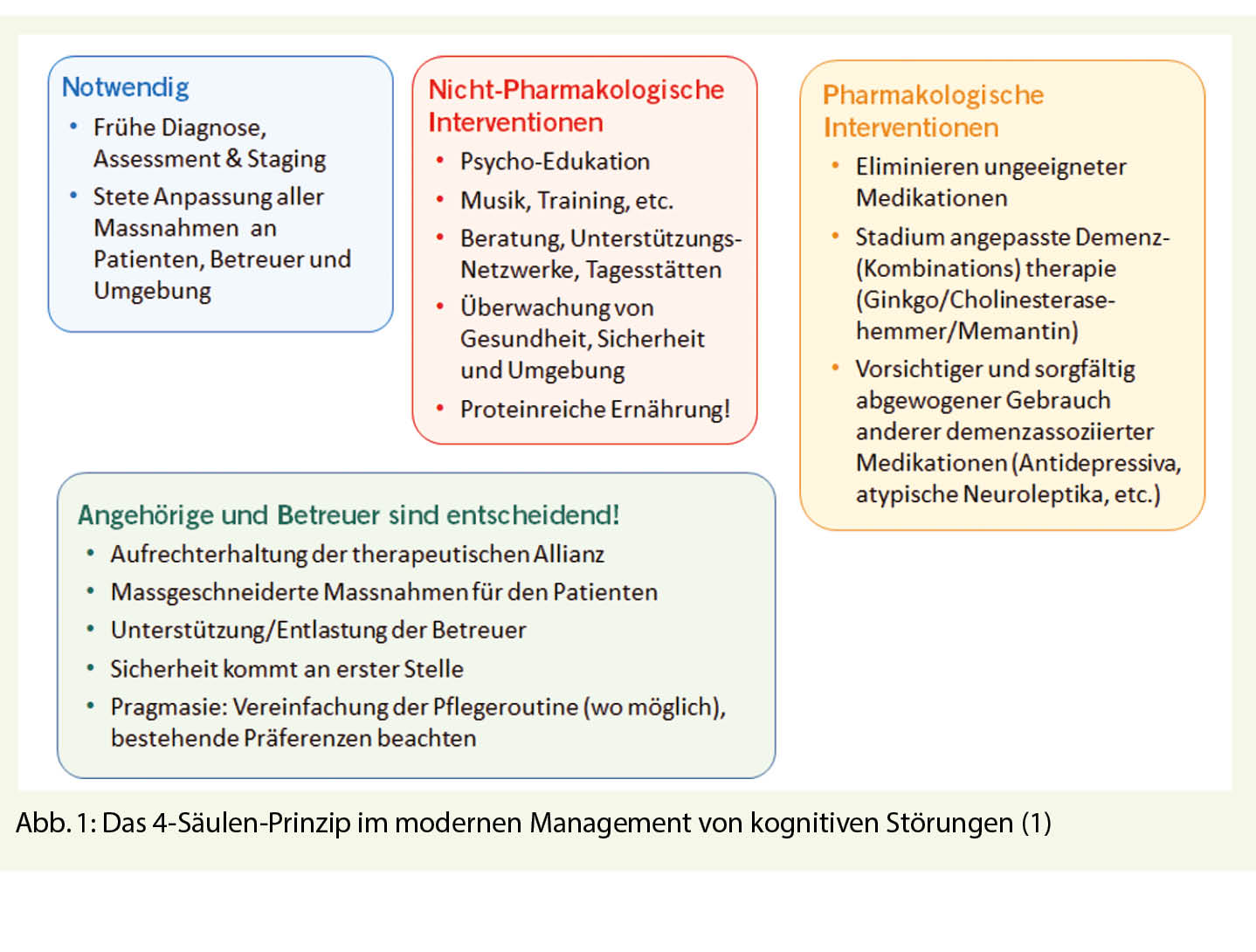
Mit Patientenklagen über kognitive Störungen können wir bei jüngeren Erwachsenen, aber ganz speziell im 3. und 4. Lebensalter konfrontiert werden. In jedem Fall müssen solche Klagen ernst genommen werden, da bei richtiger Diagnosestellung und frühzeitiger Einleitung von therapeutischen Massnahmen der weitere Verlauf massgeblich beeinflusst werden kann. Obwohl es seit Einführung der DSM-5 den Begriff «Demenz» eigentlich nicht mehr gibt, ist dieses im Alter häufige Krankheitsbild (jeder 3. über 85-Jährige ist betroffen!) natürlich nicht verschwunden. Zwar hat die Demenz-Inzidenz infolge deutlich besserer Behandlung von vaskulären Risikofaktoren in den letzten 20 Jahren bis zu 50% abgenommen – doch, der demographische Wandel hat diesen medizinischen Fortschritt zahlenmässig praktisch neutralisiert. Das moderne Management von Hirnleistungsstörungen bei dementieller Entwicklung fusst auf 4 Pfeilern (Abb. 1): Frühe und präzise Diagnostik, medikamentöse Therapie, nicht-medikamentöse Therapiemassnahmen und gezielte Unterstützung/Begleitung der Angehörigen und Betreuer (1).
Gibt es im Alter «normale» kognitive Störungen?
Ältere Patienten – wie wir Ärzte – haben die Tendenz, bei vermehrter Vergesslichkeit und anderen «kleinen» Hirnfehlleistungen das Älterwerden oder das Alter im Allgemeinen dafür verantwortlich zu machen. Die Tatsache ist eine andere. Die normale Hirn-
alterung ist wissenschaftlich sehr gut untersucht und lediglich mit einer diskreten Verlangsamung von Denk- und Reaktionsprozessen verbunden. Kann also ein Name nicht sofort, aber nach einer gewissen Zeit erinnert werden, ist dies noch «normal». Wenn man immer schon ein schlechtes Namensgedächtnis hatte, darf man im Alter keine diesbezügliche Verbesserung erwarten! Ist die Vergesslichkeit aber neu und der dadurch verursachte subjektive Leidensdruck der Patienten vorhanden (selbst bei neuropsychologischer Untersuchung mit Normalbefund), dann ist dies nach neuesten Erkenntnissen als «Subjective Cognitive Decline» zu werten, der in 25% der Fälle innerhalb von 6 Jahren zu einer Demenz führt (2). Leider werden Hirnleistungsstörungen von vielen immer noch primär auf Gedächtnis und Vergesslichkeit reduziert. Unser Hirn leistet jedoch viel mehr! Viele dementielle Prozesse beginnen denn auch in anderen Hirnleistungsbereichen, wo Verschlechterungen (bei erhaltener Gedächtnisleistung) primär über ein anderes Verhalten (z.B. mehr Probleme mit komplexen Aufgaben wie Management von finanziellen Angelegenheiten oder auch das Kochen von komplizierteren Menus!) sichtbar werden. Solche Veränderungen sind nicht normal und müssen abgeklärt werden!
Abgrenzung von «normal» versus «pathologisch»
Im Praxisalltag muss schnell und mit wenig Zeitaufwand entschieden werden können, ob kognitive Störungen schnell weiter abgeklärt werden müssen, ob weiter beobachtet werden muss oder kein weiterer Handlungsbedarf besteht! Das frühere (zeitaufwändige) Screening von kognitiven Störungen mittels MMSE und Uhrentest wurde in den letzten Jahren vom sensitiveren und gezielten «Case Finding» abgelöst (http://www.braincheck.ch/de). Die von den «Swiss Memory Clinics» und Schweizer Hausärzten entwickelte Testung «BrainCheck» trennt in wenigen Minuten «normal» von «pathologisch» mit einer Trennschärfe von 90% (3)! Dazu muss der Patient drei einfache Fragen beantworten und einen Uhrentest absolvieren. Gleichzeitig werden seinem engsten Angehörigen/Partner 7 kurze Fragen gestellt. Alle Resultate können sofort elektronisch erfasst und beurteilt werden.
Bei bestehender weiterer Abklärungsbedürftigkeit muss zusammen mit dem Patienten und seinen Angehörigen entschieden werden, wie die Diagnostik weiter vorangetrieben werden soll. Als erster Schritt ist hier sicherlich der (einfache) Ausschluss von schnellbehandelbaren Ursachen ein absolutes «Muss». Eine Schilddrüsenstörung kann mittels TSH-Bestimmung ausgeschlossen werden, eine Depression mittels Geriatric Depression Scale (GDS) und eine psychosoziale Belastungssituation (Stressbelastung) mit einer sorgfältigen Anamnese erkannt und im positiven Fall mit entsprechenden Gegenmassnahmen angegangen werden. Bei anamnestisch begründbarem Verdacht, kann auch ein Vitamin-B-Status und eine Lues-Serologie weiterführend sein. Wird man in den genannten Bereichen fündig und entsprechend therapie-aktiv, empfiehlt es sich rund 6 Monate später die Kognition mittels «BrainCheck» nachzukontrollieren.
Abklärungsbedürftige kognitive Störungen
Die Art der weiteren Abklärung von kognitiven Störungen ist sehr individuell und hängt vom Einverständnis, dem Gesundheitszustand/Lebenserwartung und den sozialen Lebensumständen des Patienten ab. Bei fitten Senioren sollte immer eine spezialisierte Abklärung bei einem Demenzspezialisten oder einer Memory Clinic erfolgen. Diese umfasst neben einer medizinischen Untersuchung mit Labor und Biomarkern eine neuropsychologische Abklärung mit Hirnbildgebung (MRI). Bei sehr hochaltrigen und fragilen Patienten kann auch eine verkürzte kognitive Abklärung (z.B. mittels MoCa-Assessment (4) erfolgen. Diese kann – mit etwas Erfahrung – in der hausärztlichen Praxis durchgeführt und diagnostisch ausgewertet werden. Dazu gehört auch hier imperativ eine Hirnbildgebung (MRI oder CT), um den wahrscheinlichsten neuropathologischen Grund der dementiellen Entwicklung festzulegen. Dies ist entscheidend für die Art der einzuleitenden Therapie.
Kognitive Störungen: Therapeutische Optionen
Handelt es sich gemäss DSM-5 um «milde» kognitive Störungen, befinden sich diese innerhalb von zwei Standardvariationen eines kognitiven Normalbefundes. Therapeutisch stehen hier neben medikamentösen (Ginkgo Biloba 240mg/d und Vitamin D (24 000 Einheiten pro Monat) v.a. nicht medikamentöse Massnahmen im Vordergrund: regelmässige körperliche und soziale (kognitive) Aktivität, gesunde altersgerechte Ernährung (regelmässig und genügend Protein (1.2 g/kg Körpergewicht pro Tag; mediterrane Diät mit genügend Omega3-Säuren) und eine gute hausärztliche Kontrolle von vaskulären Risikofaktoren (art. Hypertonie, Diabetes, Hypercholesterinämie). In der finnischen FINGER Studie (5) konnten allein mit diesen Lebensstilmassnahmen nach 2 Jahren signifikante kognitive Verbesserungen erzielt werden.
Medikamentöse Optionen
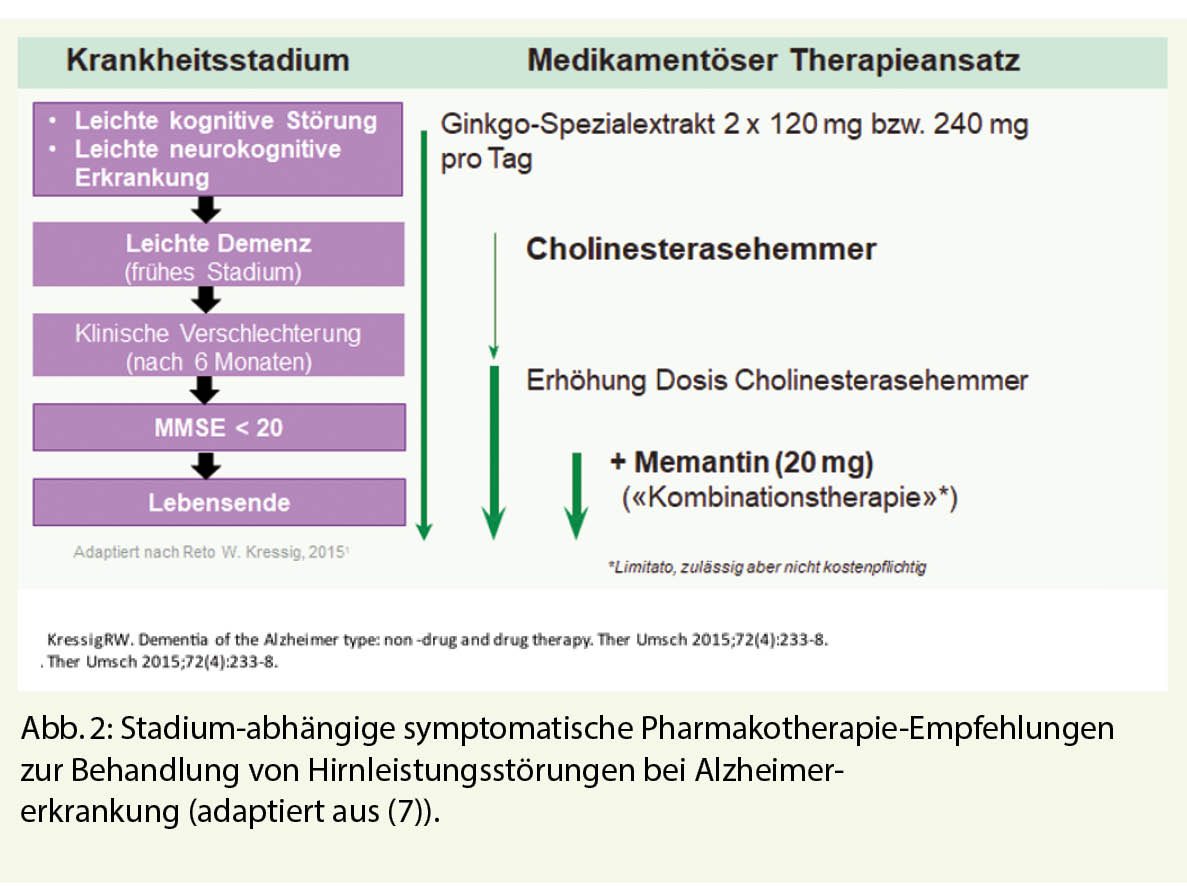
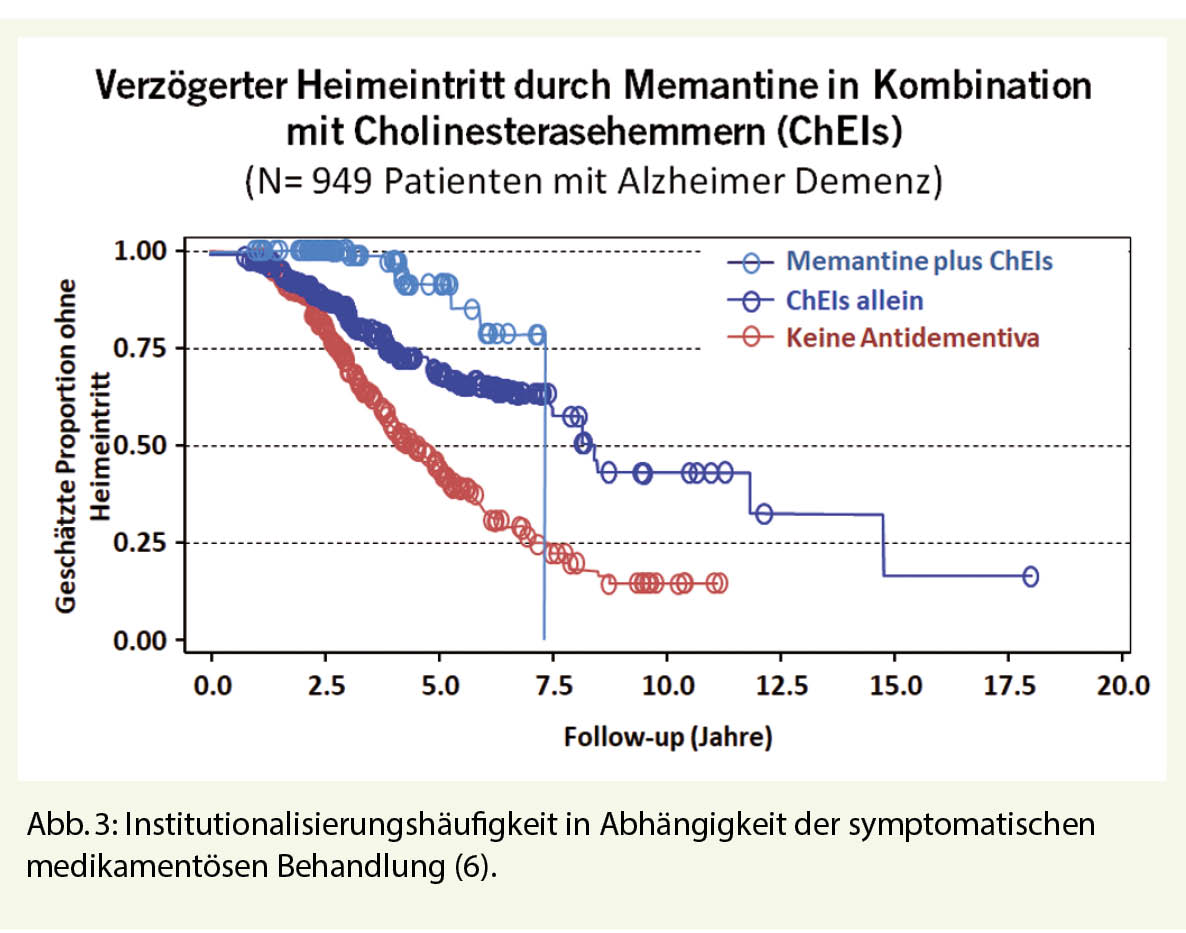
Bevor neue Medikamente zum Einsatz kommen, gilt es grundsätzlich, eine bereits vorhandene allfällige Polypharmazie auf kognitiv beeinträchtigende anticholinerge Substanzen zu überprüfen. Handelt es sich gemäss DSM-5 um «major» kognitive Störungen (Demenz) ist für die Festlegung der medikamentösen Therapie (meist mittels Bildgebung und/oder Biomarker) die dem Prozess zugrundeliegende Neuropathologie entscheidend. Handelt es sich um einen neurodegenerativen Prozess (Alzheimer Erkrankung), sind Stadium-abhängig Ginkgo, Cholinesterasehemmer und Memantine Mittel der ersten Wahl (Abb. 2). Bei dieser symptomatischen Therapie wird (bei frühzeitigem Beginn) der Verlauf der Krankheit bezüglich Funktionalitäts- und Selbständigkeitserhalt massgeblich verbessert. Diese Medikamente wirken ausgesprochen langsam, sind aber dank einer «Number Needed to Treat» (NNT) von unter 10 (für alle drei Substanzklassen!) mit einer hohen Responder-Rate versehen. Im Vergleich zu nicht-behandelten Kontrollpopulationen treten erste klinische Differenzen jedoch erst nach einem Jahr Behandlung auf; diese werden in den weiteren Jahren aber sehr relevant, da die Behandlung zu eindrücklich weniger Pflegeheimeintritten führt (Abb. 3) (6). Hier hat sich v.a. auch die Kombinationstherapie von Memantine mit Cholinesterasehemmer (bei MMSE < 20) als sehr erfolgreich erwiesen. Diese ist in der Schweiz jedoch nur off-label-mässig möglich und wegen einer Limitatio nicht voll von der Grundversicherung übernommen. Trotzdem: Viele Patienten tragen (angesichts stark gefallener Antidementiva-Preise) die paar Hundert Franken pro Jahr gerne selber, wenn damit finanziell viel höhere Kosten einer Institutionalisierung gespart oder herausgeschoben werden können. Neben der durch Antidementiva länger erhaltenen Alltagsfunktionalität treten unter dieser Therapie auch signifikant weniger demenz-assoziierte Verhaltensauffälligkeiten auf (Aggression, Schreien, motorische Unruhe etc.).
Ist die der dementiellen Entwicklung zugrundeliegende Pathologie rein vaskulär, sind obige Antidementiva (ausser Ginkgo) nicht wirksam und entsprechend nicht indiziert. Hier gilt es mit allen Mitteln, mit Lebensstilmassnahmen und der Beherrschung von vaskulären Risikofaktoren das weitere Fortschreiten der Erkrankung zu verlangsamen. Bei gemischten vaskulär-neurodegenerativen Demenzformen können Antidementiva eingesetzt werden. Bei selteneren Demenz-Pathologien wie Lewis-Body Krankheit, Parkinson- oder Fronto-Temporal-Demenz lohnt sich eine Rücksprache mit entsprechenden Spezialisten.
Nicht-medikamentöse Optionen
Nicht-medikamentöse Interventionen bei Demenzkranken werden von grossen Fachgesellschaften und Expertengruppen – ausser bei Notfallsituationen – in erster Linie und als primären Approach bei demenzassoziierten psycho-sozialen Verhaltensauffälligkeiten (BPSD) empfohlen (8). Gemäss Cohen-Mansfield (9) sind die meisten Ärzte für die Medikamentenverschreibung bei BPSD geschult und ausgebildet, jedoch nur die wenigsten verfügen über Kenntnisse zu diesbezüglichen nichtmedikamentösen Therapiemassnahmen und deren Wirkungserfolg. Entsprechend häufig werden deshalb antipsychotische Medikamente eingesetzt bevor nichtmedikamentöse Interventionen versucht werden.
Im Gegensatz zu den bei Demenz bereits früh eingeschränkten oder verlorenen kognitiven Fähigkeiten sind die emotionalen und psychosozialen Kompetenzen bis in späte Demenzkrankheitsstadien weit weniger vom Abbau betroffen. Hier setzen nicht-medikamentöse Interventionen an, in dem sie – weg vom Defizit-Fokus – auf vorhandene Hirnleistungs-Ressourcen zugreifen, diese gezielt nutzen und fördern. Körperliche Aktivität, musikbasierte Aktivitäten sowie proteinreiche, mit Vitamin D ergänzte Ernährung zum Erhalt der Muskelgesundheit bei Demenz haben sich am erfolgreichsten gezeigt (10). Spannend und immer wieder Gegenstand von Forschungen ist die Hirnwirkung von mit Musik kombinierten Bewegungsaktivitäten wie Tanz und Rhythmik. In der «Einstein-Aging» Kohortenstudie wurde regelmässiges Tanzen als Freizeitbeschäftigung mit einem bis zu 80% erniedrigten späteren Demenzrisiko assoziiert (11). In einer Interventionsstudie mittels Rhythmik nach Dalcroze konnte das motorisch-kognitive Dual-Task Vermögen von zuhause lebenden Senioren verbessert und das Sturzrisiko um über 50% reduziert werden (12). Bei fortgeschrittenen Demenzstadien scheint die Dalcroze-Rhythmik neben der positiven Beeinflussung von BPSD-Symptomen vor allem die sprachlichen Fähigkeiten zu fördern (13).
Nichtpharmakologische Interventionen bei Demenzerkrankten sind ein wesentlicher Bestandteil des modernen 4-Säulen-Demenz-Managements. Die zu erwartende Hauptwirkung solcher Massnahmen besteht in der positiven und nebenwirkungsfreien Beeinflussung von BPSD. Körperliche Aktivitätsprogramme zeigen zusätzliche Vorteile für die Alltags-Funktionalität, die insbesondere bei gleichzeitiger proteinreicher Ernährung und Vitamin-D-Supplementation deutlich länger erhalten werden kann. Musik und musikbasierte Bewegungsprogramme wie Tanz und Rhythmik scheinen besonders geeignet, Hirnreserven zu mobilisieren und damit die Kognition signifikant zu verbessern.
Aktuelle Forschungsansätze in der Alzheimer Therapie
Im Bemühen, eine Alzheimer Demenz therapeutisch zu stoppen oder gar zu heilen, hat die Forschung der letzten 20 Jahre leider keinen Durchbruch erzielt. Basiert auf die weitgehend akzeptierte Hypothese, dass die Alzheimer Erkrankung 10 bis 15 Jahre vor Sichtbarwerden von klinischen Symptomen beginnt, fokussieren neue Therapien weitgehend auf diese präklinische Phase der Erkrankung (Abb. 4).
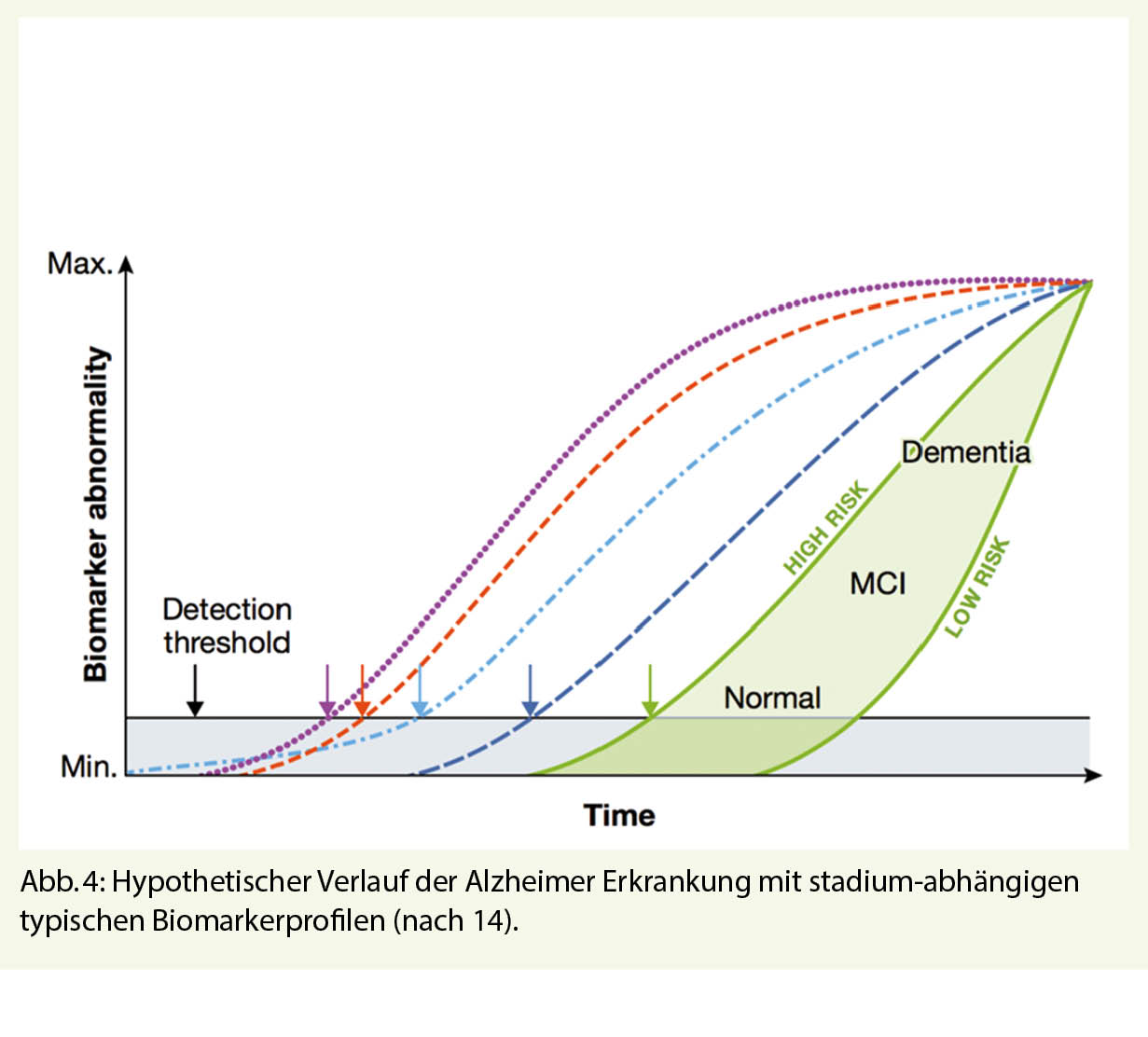
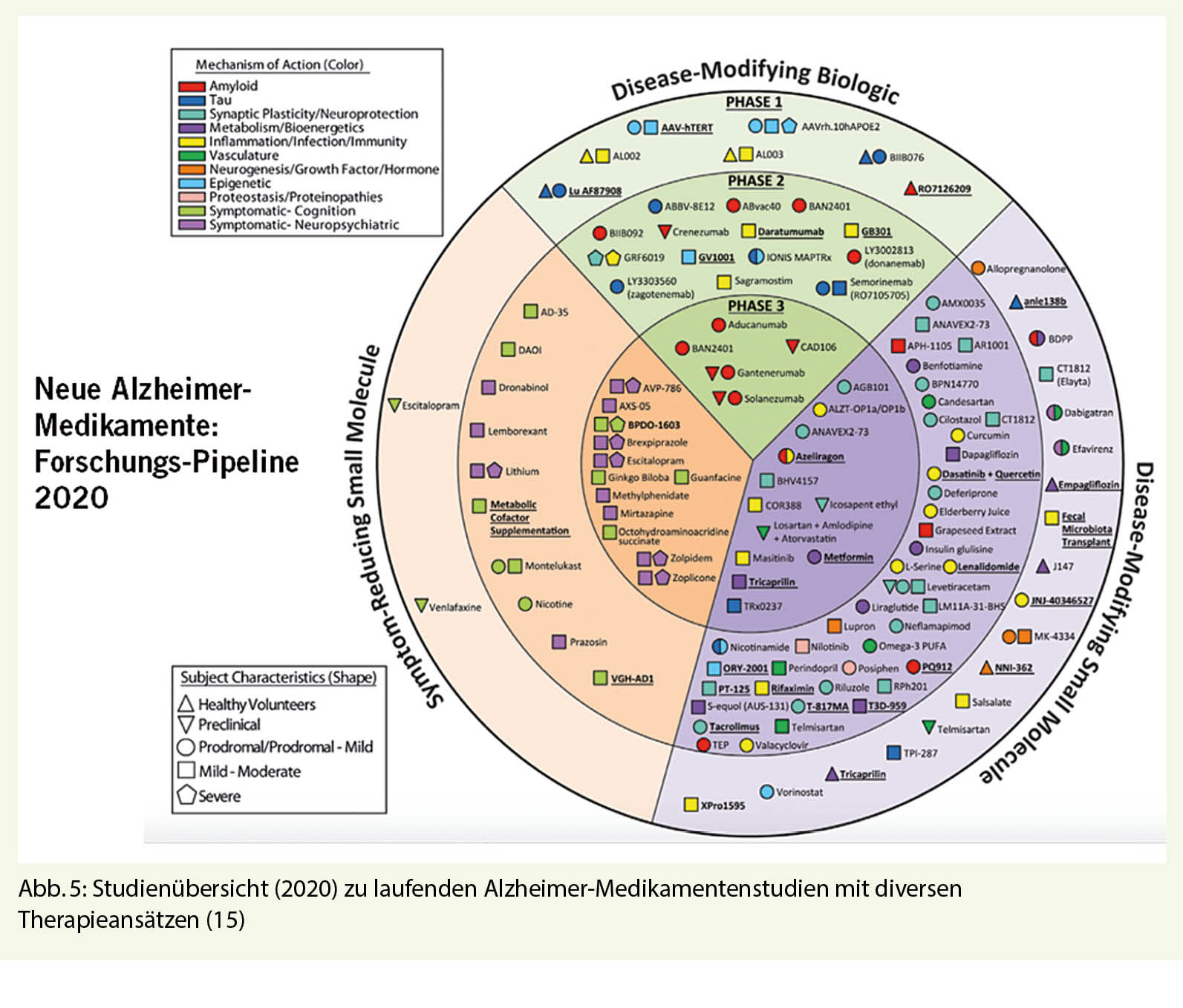
Zur Identifizierung solcher erkrankten, aber asymptomatischen Alzheimer Patienten sind Risikoprofile und entsprechende Biomarker (Amyloid, Tau-Protein, Apo-E Status etc.) entscheidend geworden. Diese können mittlerweile mit speziellen Bildverfahren, aber auch in Körperflüssigkeiten (Liquor und Blut) mehr oder weniger verlässlich nachgewiesen werden. Die für die Alzheimererkrankung typischen Amyloid-Ablagerungen im Hirn waren in vielen aktiven und passiven Immunisierungsstudien Angriffspunkt der Therapie. Die meisten dieser Immunisierungsansätze waren sehr wirksam in der zerebralen Amyloid-Abräumung bei leicht bis mittelschwer dementen Alzheimerkranken. Leider konnte damit aber keine Verbesserung oder gar «Restitutio ad integrum» der Hirnleistung gefunden werden. Alle diesbezüglich bis Phase 3 durchgeführten Studien wurden wegen Unwirksamkeit abgebrochen. Dies geschah initial auch mit der Amyloid-Antikörper Studie «Aducanumab» (Biogen). Aufgrund einer Daten-Nachanalyse mit neuen therapeutischen Wirkungserkenntnissen wurde das Molekül im Herbst 2020 bei der FDA zur Prüfung eingereicht. Ein diesbezüglicher Zulassungsentscheid wird – nach einmaliger Verschiebung – am 7. Juni 2021 erwartet. Neueste Immunisierungsansätze der Forschung fokussieren nun auf die Abräumung der zweiten Alzheimer-typischen cerebralen Ablagerungen: den Tau-Proteinen. Anders als bei Amyloid korreliert das Ausmass von Tau-Ablagerungen sehr verlässlich mit der Hirnleistung. Die meisten diesbezüglichen Studien befinden sich in Phase 1 und 2, weshalb eine Beurteilung einer möglichen Wirksamkeit verfrüht wäre. Dass möglicherweise auch dieser Ansatz nicht der Weisheit letzter Schluss ist, kann aus einer von AC-Immune im Herbst 2020 kommunizierten Pressemitteilung geschlossen werden: Eine Phase 2 Studie mit dem Tau-Antikörper Semorinemab erreichte die erwarteten klinischen Endpunkte nicht. Die verbleibende «Pipeline» neuer Alzheimermedikamente mit verschiedensten Therapieansätzen ist gross (Abb. 5). Die Zukunft wird zeigen, welche Ansätze/Kombinationen letztlich zielführend sein werden.
Anders als in der westlichen Welt wurde in China im Herbst 2019 ein auf Braunalgen basiertes Medikament (GV-971) zur Behandlung der Alzheimer Demenz zugelassen. Dieses soll über eine Modulation des Darm-Mikrobioms wirksam sein. Zwei Jahre später ist nun dazu auch eine wissenschaftliche Publikation veröffentlicht worden (16), eine Phase-3-Studie («Green Memory») ist in Europa und Nordamerika geplant, aber noch nicht initiiert.
Inwieweit ketogene Therapien mit Zuführung von mittelkettigen Triglyzeriden in der Behandlung von Demenzerkrankungen eine Rolle spielen könnten, ist Gegenstand einer anderen neuen Forschungsrichtung. Erste Resultate mit gezeigter Wirkung auf aktuelle und im weiteren Verlauf auftretende Hirnleistungseinbussen bei «Mild Cognitive Impairment» und leichter Alzheimer-Demenz werden als erfolgsversprechend geschildert (17).
Copyright bei Aerzteverlag medinfo AG
Ärztlicher Direktor & Klinischer Professor für Geriatrie
Universitäre Altersmedizin FELIX PLATTER & Universität Basel
Burgfelderstrasse 101
4002 Basel
RetoW.Kressig@felixplatter.ch
Geriatrische Beratungstätigkeit auf Anfrage bei Novartis, Roche, Takeda, Vifor, Schwabe, Biogen, Idorsia, Nestle, Omanda.
◆ Der kurative Ansatz in der Behandlung der Alzheimer-Krankheit lässt weiter auf sich warten. Es bleiben uns deshalb «nur» die nicht-medikamentösen und medikamentösen symptomatischen Therapie von Hirnleistungsstörungen, die jedoch im Verlauf einer Demenzerkrankung – im Vergleich zu keiner Therapie – einen wesentlichen Unterschied machen können.
◆ Nichtmedikamentöse Ansätze zeigen marginale bis nicht nachweisbar kognitive Effekte, sind aber wirksam bei Verhaltensstörungen, psychiatrischen Symptomen und Betreuerbelastung.
◆ Bei der pharmakologischen Therapie gilt es, eine vorhandene Polymedikation soweit wie möglich zu reduzieren und potentiell schädliche Substanzen (Priscus-Liste) abzusetzen.
◆ Zum heutigen Zeitpunkt gibt es keine rationalen Gründe, die heute zur Verfügung stehenden symptomatisch wirkenden Antidementiva (Cholinesterasehemmer, Memantine und Ginkgo Extrakt) nicht einzusetzen.
◆ Bei klinisch relativ gering ausfallenden Sofortwirkungen bei Therapiebeginn stehen hier vor allem Vorteile im Langzeitverlauf (um Jahre verzögerte Institutionalisierung, signifikant weniger Verhaltensstörungen) im Vordergrund.
1. Kressig RW. Kognitive Störungen im Salter – Therapeutische Optionen. info@herz&gefäss 2019; 5: 13-15
2. Wolfsgruber S et al. Differential risk of incident Alzheimers Disease Dementia in stable versus unstable patients of subjective cognitive decline. J Alzheimers Dis 2016 ; 54 : 1135-1146
3. Ehrensperger MM et al BrainCheck – a very brief tool to detetc incipeint cognitive decline : optimized case-finding combining patient- and informant-based data- Alz. Res Ther 2014 ;6 : 69
4. Nasreddine ZS et al. The Montreal Cognitive Assessment, MOCA : A brief screening tool for mild cognitive impairment. J Am Geriatric Soc. 2005 ;53 :695-699
5. Kivipelto M et al. The Finnish Geriatric intervention Study tp prevent cognitive impairment and disability (FINGER) : Study design and progress. Alzmeiner’s and Demetia 2013 ;9 :657-665
6. Lopez OL et al. Long-term effects of the concomitant use of memantine with cholinesterase inhibition in Alzheimer’s disease. J Neurol Neurosurg Psychiatry 2009; 80 : 600-607
7. Kressig RW. Demenz vom Alzheimer-Typ: Nicht medikamentöse und medikamentöse Therapie. Ther Umschau 2015;72: 233-238
8. Savaskan E et al. Empfehlungen zur Diagnostik und Therapie der behavioralen und psychologischen Symptome der Demenz (BPSD). Praxis 2014; 103: 135-148
9. Cohen-Mansfield J. Nonpharmacologic interventions for inappropriate behaviour in dementia: a review, summary , and critique. Am J Geriatr Psychiatry 2001 ;9 :361-381
10. Krumm S et al. Internistische Praxis 2017;58:1-7.
11. Verghese J et al. Leisure activities and the risk of dementia in the elderly. N Engl J Med 2003;248:2508-2516
12. Trombetti A et al. Effect of music-based multitask training on gait, balance, and fall risk in elderly people. A randomized controlled trial Arch Intern Med. 2011 ;17 :525-533
13. Johnson DK et al Nicht medikamentöse Behandlungsmöglichkeiten bei Demenz. Gériatrie Pratique 2005;3:1-5
14. Selkoe DJ and Hardy J. The amyloid hypothesis of Alzheirr’s disease at 25 years. EMBO Mol Med 2016;8:595-608
15. Cummings et al. Alzheimers disease drug development pipeline 2020. Translational research & Clin Interventions.DOII 10.1002/trr2.12050 2020 ;
16. Xiao S et al. A 36-week multicenter, randomized, double-blind, parallel-group, phase 3 clinical trial of sodium oligomannate for mild-to-moderate Alzheimer’s dementia. Alzheimers Res Ther 2021;13(1):62. doi: 10.1186/s13195-021-00795-7.
17. Grammatikopoulou MG et al. To keto or not to keto. A systematic review of randomized controlled trials assessig the effects of ketogenic therapy on Alzheimer disease. Adv Nutr 2020;00:1-20.
der informierte @rzt
- Vol. 11
- Ausgabe 6
- Juni 2021