- Update zur Therapie des idiopathischen Parkinsonsyndroms
Das idiopathische Parkinsonsyndrom (iPS) zählt zu den häufigsten neurodegenerativen Erkrankungen. Als wesentlicher Pathomechanismus ist die Degeneration dopaminerger Neurone in der Substantia nigra zu sehen, welche zu einer Bradykinese, Rigor und/oder einem Ruhetremor und zahlreichen nicht-motorischen Symptomen führen kann. Die Verbesserung der Lebensqualität steht im Vordergrund der Behandlung. Für das fortgeschrittene Krankheitsstadium stellen invasive Therapien wie die tiefe Hirnstimulation und kontinuierliche Pumpentherapien etablierte und evidenzbasierte Optionen dar. Der vorliegende Artikel beschäftigt sich mit der Therapie des iPS mit Fokus auf den aktuellen Therapiestand, zukünftige orale und invasive Behandlungsmöglichkeiten sowie auf potenzielle neuroprotektive Ansätze.
Parkinson’s disease (PD) is one of the most common neurodegenerative diseases. The main pathomechanism is the degeneration of doperminergic neurons in the substantia nigra. It can lead to bradykinesia, rigidity, resting tremor, and numerous non-motor symptoms. Treatment is focused on improving the patient’s quality of life. For the advanced stages of the disease, invasive therapies such as deep brain stimulation and continuous pump treatment, are established and evidence-based options. This article deals with the therapy of PD with a focus on the current therapy, future oral and invasive treatment options, and potential neuroprotective approaches.
Key Words: parkinson’s disease, deep brain stimulation, continuous pump treatment, neuroprotective approaches
Die Parkinson-Krankheit (auch Morbus Parkinson oder idiopathisches Parkinson-Syndrom, iPS, genannt) ist mit einer Prävalenz von 100-200/100’000 Einwohnern die zweithäufigste neurodegenerative Erkrankung. Sie ist auf die Degeneration dopaminerger Neurone in der Substantia nigra zurückzuführen. Gemäss aktueller Diagnosekriterien wird für die Diagnose u.a. eine Bradykinese und entweder Rigor und/oder Ruhetremor (4-6 Hz) gefordert (1).
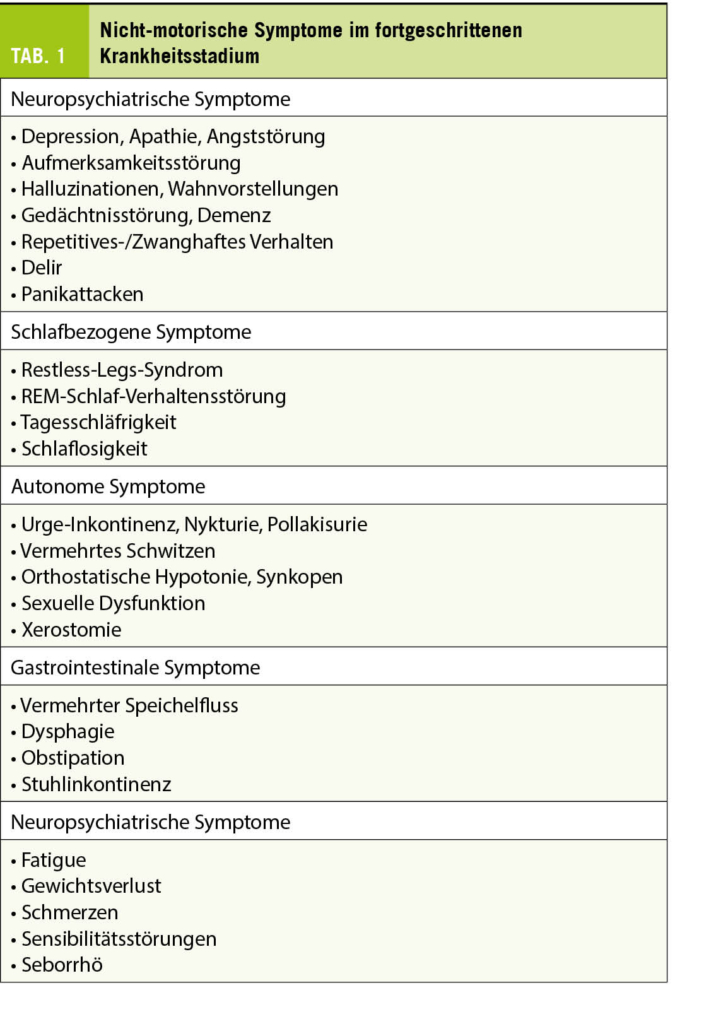
Neben motorischen Symptomen können auch zahlreiche nicht-motorische Symptome auftreten, welche für die Patienten meist sehr störend und somit wesentliche Determinanten der Lebensqualität sind (Tab. 1). Nach mehrjähriger Behandlung kommt es bei nahezu allen Patienten zu motorischen und teilweise auch nicht-motorischen Wirkfluktuationen (z.B. Verschlechterung der Stimmung oder der Kognition im Off Zustand) und Dyskinesien.
Aktueller Therapiestand – orale Medikation
Die derzeitige Therapie zielt auf eine symptomatische Behandlung ab und sollte dann begonnen werden, wenn Alltagseinschränkungen auftreten. Nach mehr als 50 Jahren ist Levodopa nach wie vor die wirksamste Therapie des iPS. Typischerweise verspüren Patienten mit einem iPS hierdurch eine wesentliche Verbesserung ihrer motorischen Symptome, wobei zur Besserung des Tremors oft höhere Dosierungen notwendig sind. Ein positives Ansprechen auf L-Dopa (>30% UPDRS III) unterstützt die Diagnose eines iPS, wohingegen ein fehlendes Ansprechen an ein atypisches Parkinson-Syndrom denken lassen sollte.
Lange wurde spekuliert, ob L-Dopa neurotoxisch wirken könnte. Zudem wurde zur Vermeidung von Dyskinesien und Wirkfluktuationen als Spätkomplikationen eine Behandlung mit L-Dopa insbesondere bei jüngeren Patienten so lange wie möglich hinausgezögert und Dopaminagonisten (DA) bevorzugt eingesetzt. Neuere Studien konnten diese Zweifel entkräften und zeigen, dass sich eine frühere Behandlung mit L-Dopa nicht negativ auf den Krankheitsverlauf auswirkt und das Auftreten der Spätkomplikationen in erster Linie mit der Erkrankungsdauer selbst und weniger mit der Dauer der L-Dopa-Therapie zusammenhängt. Zudem ist L-Dopa den DA in Bezug auf die Verbesserung der Lebensqualität überlegen (2, 3). Als weiteren Vorteil von L-Dopa gegenüber DA ist auch das günstigere Risikoprofil mit weniger Nebenwirkungen wie Halluzinationen, Impulskontrollstörungen und Schlafstörung zu nennen.
Kommt es im fortgeschrittenen Stadium zur Entwicklung motorischer Fluktuationen, sind eine Verkürzung der Einnahmeintervalle, eine Verlängerung der L-Dopa-Wirkdauer durch eine Hemmung des Dopaminabbaus mittels MAO-B- und COMT-Hemmer oder die Zugabe eines langwirksamen DA möglich. Zur Behandlung von Dyskinesien wird eine Reduktion der L-Dopa-Dosis u./o. eine Add-on-Therapie mit Amantadin erwogen.
Bei der Auswahl der verschiedenen Substanzklassen gilt es, die unterschiedlichen Effektstärken im Hinblick auf die Wirkung, die Nebenwirkungen, das Alter des Patienten, Komorbiditäten und das psychosoziale Anforderungsprofil zu berücksichtigen.
Kürzlich zugelassene orale Medikamente
Mit Opicapon (Ongentys) wurde in der Schweiz 2018 ein weiterer COMT-Hemmer für die Zusatzbehandlung von «End of dose» Fluktuationen, bei denen unter Levodopa/Kombinationen keine Stabilisierung erreicht werden kann, zugelassen. Hiermit kann die OFF-Zeit um durchschnittlich zwei Stunden reduziert werden. Im Vergleich zu den bisherigen COMT-Hemmern (Tolcapon und Entacapon) wirkt Opicapon nicht lebertoxisch und muss wegen seiner hohen Bindungsaffinität nur einmal täglich eingenommen werden. Um Nebenwirkungen wie Dyskinesien, Obstipation, Mundtrockenheit sowie Ein- und Durchschlafstörungen zu vermeiden, hat es sich bewährt, die L-Dopa-Dosis zu Beginn der Behandlung um 25-30% zu reduzieren (4).
In Deutschland ist seit Mai 2022 das erste inhalative L-Dopa-Medikament (Inbrija) zur akuten Behandlung von OFF-Symptomen bei PD zugelassen. In den klinischen Studien zeigte sich bereits nach zehn Minuten eine Symptomverbesserung im Vergleich zu Placebo mit einem statistisch signifikanten Wirkungsmaximum nach 30 min., d.h. um ca. 15 min. früher als nach oraler Einnahme (5).
Invasive Therapien des fortgeschrittenen iPS
Lassen sich motorische Fluktuationen und Dyskinesien trotz optimierter oraler Therapie nicht kontrollieren, sollten invasive Therapien wie die tiefe Hirnstimulation (THS), meist in den Nucleus subthalamicus, oder eine kontinuierliche, durch Pumpen unterstützte Infusionsbehandlung in Betracht gezogen werden. Für die Pumpentherapie stehen ein gastroduodenal, über eine perkutane endoskopische Jejunostomie (PEJ-Sonde) verabreichtes Levodopa/Carbidopa-Gel (LCIG) oder subkutan appliziertes Apomorphin zur Verfügung.
Durch die kontinuierliche Verabreichung bzw. möglichst konstante Medikamentenspiegel im Blut können Zeiten reduzierter Wirksamkeit signifikant reduziert und Dyskinesien gemildert werden. Die Patienten sollten ebenso wie die Angehörigen in die Therapieentscheidung mit einbezogen werden und über die Vor- und Nachteile der jeweiligen Therapieoptionen informiert sein.
Eine Pumpentherapie kommt v.a. für Patienten in Frage, bei denen eine THS kontraindiziert ist, z.B. bei älteren Patienten mit leichter oder moderater Demenz, psychiatrischen Komorbiditäten oder Kontraindikation für einen neurochirurgischen Eingriff. Nicht angezeigt ist die Infusionstherapie bei Medikamenten-resistentem Tremor und Impulskontrollstörung. Entscheidend für die Wahl zwischen den beiden Pumpsystemen sind mögliche Nebenwirkungen und praktisch-klinische Aspekte: Die für die L-Dopa-Pumpe notwendige Anlage einer PEJ ist mit einem Risiko lokaler Komplikationen wie einer Peritonitis oder Stomainfektionen sowie Problemen mit der Sonde (z.B. Dislokation) verbunden. Seltener kommt es aufgrund der hohen L-Dopa-Dosierungen zu einer Polyneuropathie.
Apomorphin, ein Dopaminagonist, der neben der kontinuierlichen Injektionsform auch als s.c. Injektion (Pen) zur Behandlung einzelner Off-Phasen zum Einsatz kommt, hat den Vorteil, dass er im Vergleich zu Duodopa und THS als am wenigsten invasiv erachtet werden kann. Eine kürzlich publizierte Studie konnte zudem zeigen, dass eine kontinuierliche nächtliche Apomorphin-Infusion zusätzlich die Schlafqualität von iPS-Patienten signifikant verbessern kann (6). Als häufigste Nebenwirkungen der s.c. Apomorphin-Infusion sind eine lokale Noduli-Bildung und Hautirritationen zu nennen, welche bei nahezu allen Patienten vorkommen, aber selten zum Therapieabbruch führen (7).
Zukünftige neue Applikationsformen von L-Dopa und Apomorphin
Die Wirkung einer subkutanen Applikation von L-Dopa (in Form von Foslevodopa/Foscarbidopa) wurde in einer Phase-III-Studie untersucht und die Zulassung beantragt (NCT04380142). Aufgrund der s.c. Verabreichung ist keine Anlage einer PEJ-Sonde notwendig. Gleichzeitig sind im Vergleich zur Apomorphininfusion weniger systemische Komplikationen wie Nausea, Tagesmüdigkeit, periphere Ödeme, orthostatische Dysregulation, Halluzinationen und Impulskontrollstörungen zu erwarten. Ein limitierender Faktor könnten Hautreaktionen sein (8).
Als neue Applikationsform wurde ein Apomorphin-Film für eine sublinguale Applikation (Kynmobi) entwickelt, welche eine wichtige Alternative für die Behandlung von Off-Phasen darstellt und in Europa derzeit in einer Phase-III-Studie getestet wird. Innerhalb von 15 Min. wird eine systemische Wirkung erreicht. Zu den am häufigsten berichteten Nebenwirkungen zählen oropharyngeale Reaktionen (9).
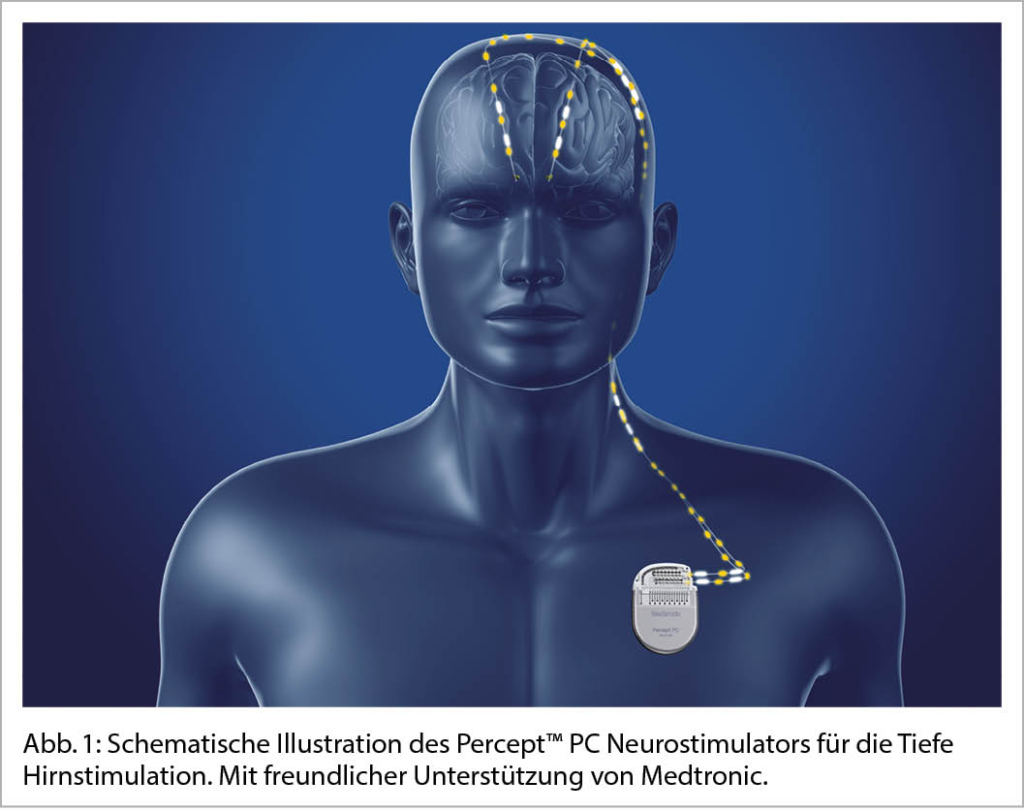
Neues zu THS (tiefe Hirnstimulation)
Die Daten der 2013 veröffentlichten EARLY-STIM-Studie haben gezeigt, dass eine THS bei iPS-Patienten im Vergleich mit der bestmöglichen medikamentösen Behandlung bereits in einem früheren Krankheitsstadium zu einer signifikanten Verbesserung der Lebensqualität führt (10, 11). Dies eröffnete die Möglichkeit eine THS nicht als Ultima Ratio, sondern viel mehr als Therapiealternative bei Patienten mit beginnenden motorischen Fluktuationen und Dyskinesien anzusehen, d.h. zu einem früheren Zeitpunkt in Bezug auf den Krankheitsverlauf.
Zur Optimierung der Stimulationsparameter haben sich in den letzten Jahren neue vielversprechende Entwicklungen ergeben. Durch den Einsatz direktionaler Elektroden besteht mittels «Steering» die Möglichkeit, die Stimulation räumlich exzentrisch auszurichten, um somit das therapeutische Fenster unter Reduktion stimulationsbedingter Nebenwirkungen zu vergrössern (12). In der Vergangenheit bedurfte es oft wiederholter Sitzungen zur Programmierung der THS zur Optimierung der Stimulationsparameter. Mittlerweile stehen bildgebende und elektrophysiologische Ansätze zur Verfügung, die eine raschere Bestimmung der optimalen Stimulationskonfiguration erlauben und den Aufwand zur Austestung der Stimulation reduzieren (13). Eine sogenannte «adaptive» oder «closed-loop»-Technik, d.h. die Registrierung eines krankheitsspezifischen elektrophysiologischen Biomarkers (Betawellen-Aktivität) mit daran gekoppelter bedarfsadaptierter Stimulation, stellt seit Längerem eine Zukunftsperspektive zur Verbesserung der Effizienz der THS dar. Erste THS-Systeme verfügen bereits über eine Sensing-Technologie, die es erlaubt Betaaktivität aufzuzeichnen. Deren Technologie könnte in Zukunft im Rahmen von adaptiven oder «closed-loop» THS-Systemen zum Einsatz kommen (14).
Potenziell neuroprotektive Ansätze
Ein immer besseres Verständnis der molekularen Grundlagen des iPS könnte den Weg für neue, kausale Behandlungsmöglichkeiten bereiten. Derzeit befinden sich mehrere vielversprechende, potenziell krankheitsmodifizierende Therapieansätze in der z.T. fortgeschrittenen klinischen Testung:
- Glucagon-like Peptide 1 (GLP1)-Rezeptoragonisten: Eine Insulinresistenz ist mit einem erhöhten iPS Risiko vergesellschaftet. Der neuroprotektive Effekt von GLP1-Agonisten, die bereits beim Diabetes zugelassen sind, wurde bereits im Tiermodell gezeigt und scheint sich in ersten Studien zu bestätigen. Die vielversprechendste, in der klinischen Testung befindende Substanz ist der GLP-1-Agonist Exenatide (15).
- Immunisierungstrategien: Aktive und passive Immunisierungsstrategien zielen darauf ab, die pathologische Aggregation von α-Synuclein zu verhindern.
- c-ABL-Kinase-Inhibitoren: Einzelne Substanzen dieser Kategorie sind bereits für die Behandlung der CLL zugelassen. Beim iPS kommt es ebenfalls zu einer Überaktivität dieser Kinase. Durch ein Herunterregulieren der Kinaseaktivität soll der Krankheitsverlauf positiv beeinflusst werden (16).
- Glucocerebrosidase: Mutationen im GBA stellen einen starken Risikofaktor für ein iPS dar. Aktuelle Therapieansätze zielen auf eine Steigerung der Glucocerebrosidase-Aktivität ab (17).
- LRRK2: Eine Mutation im LRRK2-Gen kann zu einem monogenetisch vererbten Parkinson-Syndrom führen. Aktuelle Therapieansätze versuchen die pathologisch veränderte Aktivität (meist Gain-of-Function) dieser Kinase zu modifizieren (18).
Copyright bei Aerzteverlag medinfo AG
Klinik für Neurologie
Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
Klinik für Neurologie
Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
Klinik für Neurologie, Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
◆ Das iPS zählt zu den häufigsten neurodegenerativen Erkrankungen. Die Diagnose wird klinisch anhand Vorliegens einer Bradykinesie, Rigor und/oder Ruhetremor gestellt.
◆ L-Dopa ist nach wie vor die wirksamste orale Parkinsontherapie.
Der frühzeitige Einsatz ist sicher und dem Einsatz von DA überlegen.
◆ Es stehen viele weitere symptomatische orale Therapiemöglichkeiten zu Verfügung. Neue Formulierungen von L-Dopa und Apomorphin sind derzeit in Entwicklung.
◆ Im fortgeschrittenen Stadium stellen kontinuierliche Pumpsysteme oder die THS gute Alternativen zur oralen Behandlung dar.
◆ Neue Erkenntnisse über die Entstehungsmechanismen der Erkrankung wecken die Hoffnung auf die Entwicklung krankheitsmodifizierender Therapien.
1. Postuma RB, Berg D, Stern M, Poewe W, Olanow CW, Oertel W, et al. MDS clinical diagnostic criteria for Parkinson’s disease. Mov Disord. 2015;30(12):1591-601.
2. Verschuur CVM, Suwijn SR, Boel JA, Post B, Bloem BR, van Hilten JJ, et al. Randomized Delayed-Start Trial of Levodopa in Parkinson’s Disease. N Engl J Med. 2019;380(4):315-24.
3. Cilia R, Akpalu A, Sarfo FS, Cham M, Amboni M, Cereda E, et al. The modern pre-levodopa era of Parkinson’s disease: insights into motor complications from sub-Saharan Africa. Brain. 2014;137(Pt 10):2731-42.
4. Feldman M, Margolesky J. Opicapone for the treatment of Parkinson’s disease: a review. Int J Neurosci. 2021:1-12.
5. Lipp MM, Hickey AJ, Langer R, LeWitt PA. A technology evaluation of CVT-301 (Inbrija): an inhalable therapy for treatment of Parkinson’s disease. Expert Opin Drug Deliv. 2021;18(11):1559-69.
6. De Cock VC, Dodet P, Leu-Semenescu S, Aerts C, Castelnovo G, Abril B, et al. Safety and efficacy of subcutaneous night-time only apomorphine infusion to treat insomnia in patients with Parkinson’s disease (APOMORPHEE): a multicentre, randomised, controlled, double-blind crossover study. Lancet Neurol. 2022;21(5):428-37.
7. Katzenschlager R, Poewe W, Rascol O, Trenkwalder C, Deuschl G, Chaudhuri KR, et al. Apomorphine subcutaneous infusion in patients with Parkinson’s disease with persistent motor fluctuations (TOLEDO): a multicentre, double-blind, randomised, placebo-controlled trial. Lancet Neurol. 2018;17(9):749-59.
8. Poewe W, Stocchi F, Arkadir D, Ebersbach G, Ellenbogen AL, Giladi N, et al. Subcutaneous Levodopa Infusion for Parkinson’s Disease: 1-Year Data from the Open-Label BeyoND Study. Mov Disord. 2021;36(11):2687-92.
9. Olanow CW, Factor SA, Espay AJ, Hauser RA, Shill HA, Isaacson S, et al. Apomorphine sublingual film for off episodes in Parkinson’s disease: a randomised, double-blind, placebo-controlled phase 3 study. Lancet Neurol. 2020;19(2):135-44.
10. Schuepbach WM, Rau J, Knudsen K, Volkmann J, Krack P, Timmermann L, et al. Neurostimulation for Parkinson’s disease with early motor complications. N Engl J Med. 2013;368(7):610-22.
11. Deuschl G, Schupbach M, Knudsen K, Pinsker MO, Cornu P, Rau J, et al. Stimulation of the subthalamic nucleus at an earlier disease stage of Parkinson’s disease: concept and standards of the EARLYSTIM-study. Parkinsonism Relat Disord. 2013;19(1):56-61.
12. Steigerwald F, Muller L, Johannes S, Matthies C, Volkmann J. Directional deep brain stimulation of the subthalamic nucleus: A pilot study using a novel neurostimulation device. Mov Disord. 2016;31(8):1240-3.
13. Horn A, Kuhn AA. Lead-DBS: a toolbox for deep brain stimulation electrode localizations and visualizations. Neuroimage. 2015;107:127-35.
14. Beuter A, Lefaucheur JP, Modolo J. Closed-loop cortical neuromodulation in Parkinson’s disease: An alternative to deep brain stimulation? Clin Neurophysiol. 2014;125(5):874-85.
15. Brauer R, Wei L, Ma T, Athauda D, Girges C, Vijiaratnam N, et al. Diabetes medications and risk of Parkinson’s disease: a cohort study of patients with diabetes. Brain. 2020;143(10):3067-76.
16. Zhou ZH, Wu YF, Wang XM, Han YZ. The c-Abl inhibitor in Parkinson disease. Neurol Sci. 2017;38(4):547-52.
17. Schapira AH. Glucocerebrosidase and Parkinson disease: Recent advances. Mol Cell Neurosci. 2015;66(Pt A):37-42.
18. Vuletic V, Racki V, Papic E, Peterlin B. A Systematic Review of Parkinson’s Disease Pharmacogenomics: Is There Time for Translation into the Clinics? Int J Mol Sci. 2021;22(13).
der informierte @rzt
- Vol. 12
- Ausgabe 11
- November 2022