- VAD-Patienten in der Allgemeinarztpraxis
Die Behandlung von Patienten mit Herzinsuffizienz hat in den letzten Jahren eine enorme Entwicklung durchlaufen. Die Zahl der Patienten mit einem ventrikulären Herzunterstützungssystem (kurz VAD «ventricular assist device»), d.h. einem Pumpsystem zur Unterstützung einer insuffizienten Herztätigkeit, wächst. Die meisten dieser Patienten führen zu Hause ein (fast) normales Leben. Sie können (leichten) Sport treiben (1), manche können sogar wieder arbeiten (2). Sowohl für die Nachsorge ihrer Herzinsuffizienz als auch für nicht-kardiale Probleme sollen diese Patienten von ihrem Hausarzt mitbetreut werden (3).
The treatment of patients with heart failure has undergone a tremendous development in recent years and there are now more and more patients with a ventricular assist device (VAD), a pump system to support an insufficient left heart. Most of these patients lead an (almost) normal life at home. They can do (light) sports (1) and some can even go back to work (2). For the follow-up of their heart failure and also for non-cardiac problems, these patients are and must be cared for by their family doctor (3).
Key Words: heart failure, ventricular assist device, follow-up
Die VAD-Implantation ist bei therapierefraktärer Herzinsuffizienz im Endstadium indiziert, um Patienten das Überleben bis zur Transplantation zu ermöglichen (4) oder als Dauertherapie, wenn eine Transplantation keine Option ist. In der Regel führt diese Therapie zu einer erheblichen Verbesserung der Lebensqualität (5, 6). Die VAD-Implantation kann mit anderen chirurgischen Eingriffen kombiniert werden, z. B. mit einer Herzklappen- oder Koronararterien-Bypass-Operation (7).
Technische Aspekte des ventrikulären Unterstützungssystems (VAD)
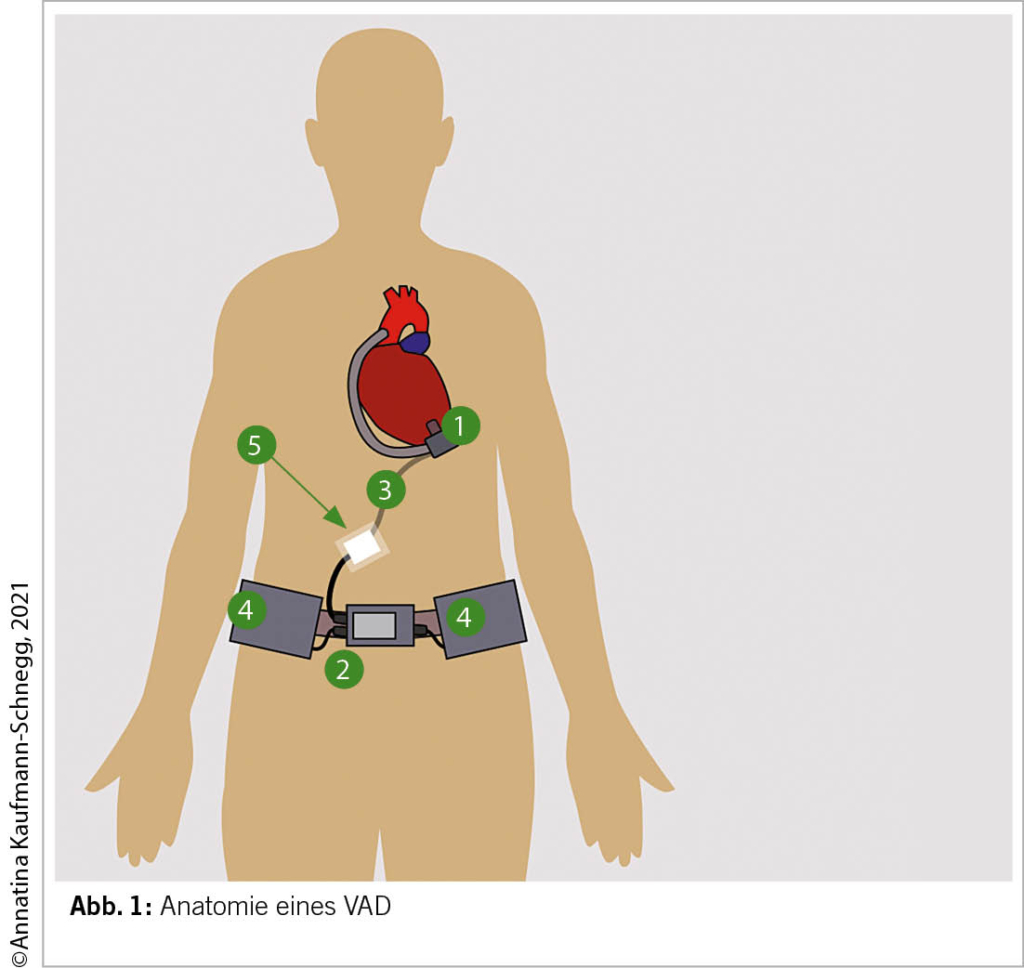
Das Herzstück des VAD ist eine Pumpe, die aus einem Metallrotor besteht, der das Blut durch eine Kanüle in der linken Herzkammer ansaugt und es durch eine Goretex-Leitung in die aufsteigende Aorta ausstößt, parallel zum verbleibenden linksventrikulären Blutstrom in die Aorta (8). Die Pumpe wird über ein in die Haut getunneltes Kabel, welches mit einem externen Monitor verbunden ist, mit Strom versorgt und gesteuert. Die Stromversorgung erfolgt über 2 Batterien (Abbildung 1). Der Patient hat zu Hause eine Batterieladestation und verschiedene Kabel, darunter ein Notfallkabel, mit dem eine der Batterien durch Strom aus dem Zigarettenanzünder im Auto ersetzt werden kann.
Die «Programmierung» der Pumpe erfolgt im Operationssaal und wird dann während des Krankenhausaufenthalts angepasst. Die wichtigste Einstellung ist die Drehzahl der Pumpe. Da sich die Bedürfnisse des Patienten im Laufe der Behandlung ändern, kann die Pumpendrehzahl vom Herzinsuffizienz Spezialisten auf der Grundlage von Funktionstests wie Echokardiographie (9), hämodynamischen Untersuchungen mit einem Rechtsherzkatheter oder einer Kombination dieser beiden Methoden (10) angepasst werden.
Nachsorge
Die kardiologische Nachsorge von Patienten mit VADs wird im Zentrum für Herzinsuffizienz durch den Facharzt und die Pflege durchgeführt. Sie findet in regelmäßigen Abständen statt, mindestens alle 3 Monate. Die nicht fachärztliche medizinische Betreuung kann unverändert durch den Hausarzt erfolgen (3). Technische Probleme (Probleme mit dem Akku, dem Ladegerät oder dem Trägergerät) müssen von der Fachstelle gelöst werden und liegen nicht in der Verantwortung des Hausarztes. Die Patienten werden darin geschult, wie sie ihr Gerät täglich bedienen (11).
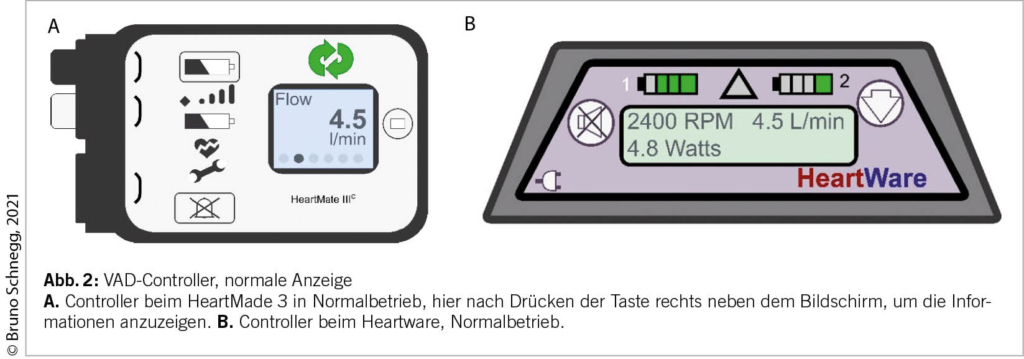
Die Konsultation in der Allgemeinpraxis erfolgt auf die übliche Weise. Der Hausarzt sollte sich jedoch darüber im Klaren sein, dass aufgrund des kontinuierlichen Flusses, der von der Pumpe erzeugt wird, kein messbarer Puls (keine Systole/Diastole), sondern ein relativ konstanter Flussdruck vorhanden ist. Der Blutdruck ist schwer zu messen und die Sauerstoffsättigung oft nicht zu erfassen. Bei der Auskultation von Herz und Lunge dominiert das maschinelle Geräusch des Systems. Die Untersuchung des Abdomens kann auf die übliche Weise durchgeführt werden, wobei jedoch Vorsicht mit dem Drive Line Anschluss (DL) geboten ist.
Mit welcher Art von Situationen kann der Hausarzt konfrontiert werden?
VAD-Patienten sind auf ärztliche Unterstützung angewiesen und haben ein Risiko für Komplikationen, die sich aus dieser Behandlung ergeben: Ein technisches Problem mit dem System kann schnell zu einer Notfallsituation führen. Diese Patienten haben ein hohes Infektionsrisiko, da das System ein komplexer Fremdkörper mit einer ständigen potenziellen Eintrittsstelle am Ausgang des Steuerkabels ist, und schließlich müssen sie kontinuierlich antikoaguliert werden, was das Risiko von Blutungen erhöht.
Notfälle
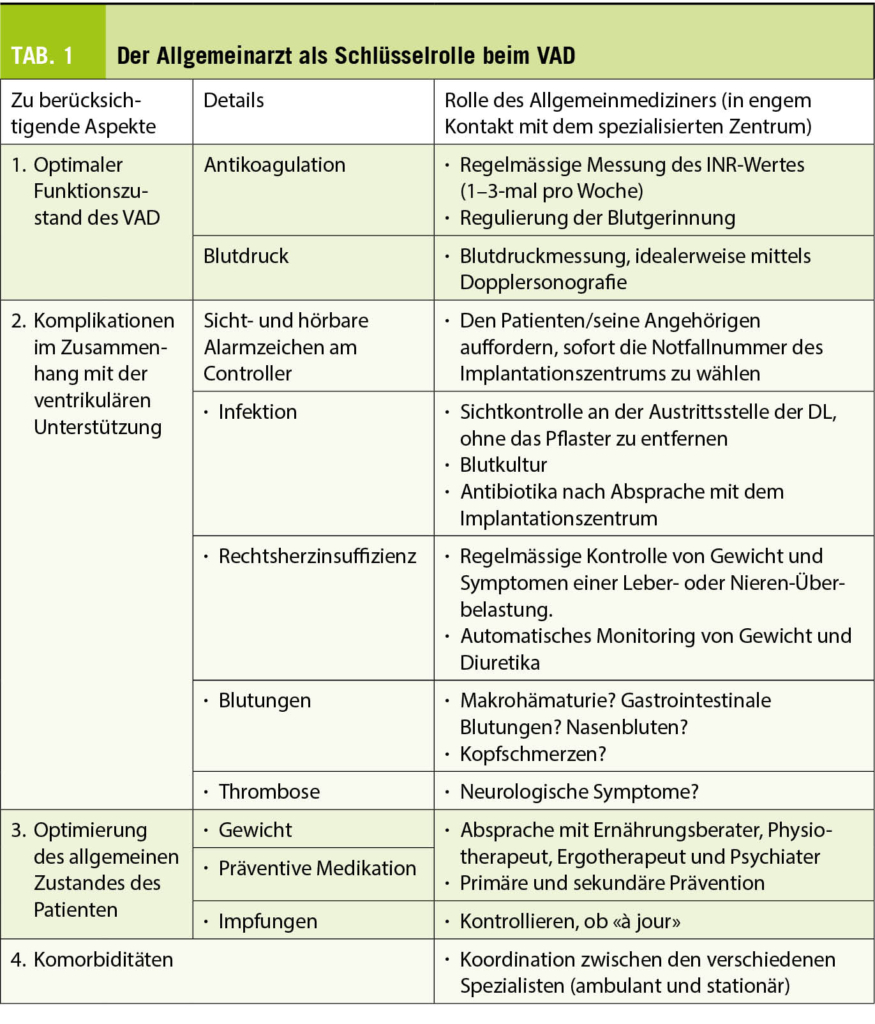
Die bedrohlichsten Situationen ergeben sich in der Regel aus einer Systemstörung, einem Schlaganfall oder einer Blutungskomplikation. Für den Allgemeinmediziner gibt es vier spezifische Probleme von VAD-Trägern, die er kennen sollte (siehe Tabelle 1):
– Überwachung optimaler Pumpenbetriebsbedingungen (VAD)
Patienten mit einem VAD müssen streng antikoaguliert werden, da der Kontakt des Blutes mit den Bestandteilen des Systems (Metall, Titan) zur Aktivierung des Gerinnungssystems führt (12). Die regelmäßige Überwachung der Antikoagulation und die sofortige Reaktion, wenn der INR-Wert außerhalb des vorgegebenen Bereiches (in der Regel zwischen 2,0 und 3,0) liegt, ist wahrscheinlich der wichtigste Punkt bei der Behandlung dieser Patienten in der Allgemeinarztpraxis.
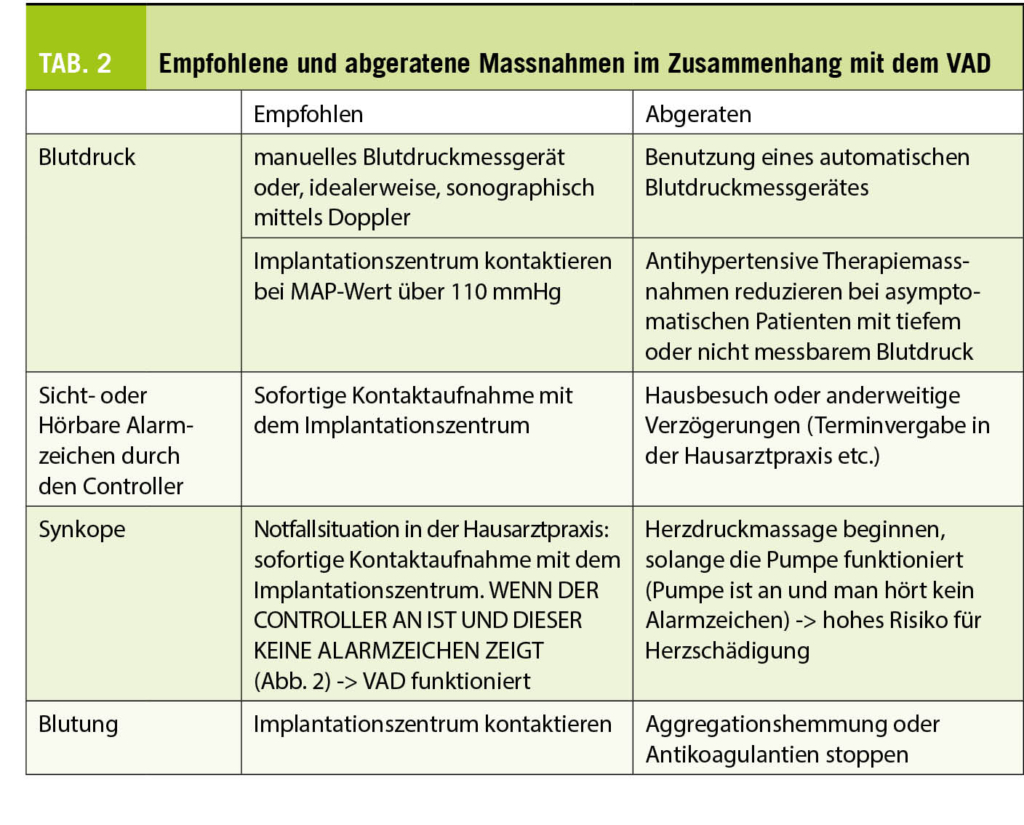
Der Blutdruck spielt eine wichtige Rolle für die Leistung der Pumpe. Genauer gesagt, die Druckdifferenz zwischen der linken Herzkammer und dem Druck in der Aorta (dem arteriellen Druck). Je größer die Differenz (je “hypertensiver” der Patient), desto weniger Fluss kann die Pumpe erzeugen (13). Idealerweise wird der mittlere arterielle Druck (MAP) bei etwa 80-90 mmHg gehalten (14). Dieser Druck sollte mit einer Handmanschette und einem Doppler (3) gemessen werden. Der fehlende Puls macht eine Messung mit einem automatischen Messgerät oft unmöglich. Ungewöhnliche MAP-Werte und/oder MAP-Werte über 110 mmHg sollten dem Implantationszentrum gemeldet werden.
– Komplikationen im Zusammenhang mit der Therapie
Die häufigste Komplikation ist eine Infektion (15). Zwischen 10 und 50 % der Patienten sind davon betroffen (16, 17). Infektionen entstehen in der Regel an der kutanen Austrittsstelle der Drive Line (DL). Schmerzen, Rötung, lokaler Juckreiz und vermehrte Sekretion sind Zeichen, welche eine genauere Untersuchung erfordern. Ein Wundabstrich sowie ein Entzündungslabor sind sinnvoll (CRP, Leuk Diff.). Eine empirische oder gesteuerte Antibiotikatherapie sollte nur nach Rücksprache mit dem Implantationszentrum begonnen werden.
Desweiteren werden Komplikationen im Zusammenhang mit der Antikoagulation und Antiaggregation befürchtet, wobei sowohl Thrombosen als auch Blutungen vorkommen können. Neben den klassischen neurologischen Symptomen (Schlaganfall und transitorische ischämische Attacke), ist das Auftreten einer Hämoglobinurie («Coca-Cola»-Urin) ein «subtiles» Zeichen für eine Thrombose. Dies kann ein Zeichen für eine Destabilisierung der Pumpenspirale sein, die zu einer massiven Hämolyse führt, und kann mit einem typischen rauen Auskultationsgeräusch verbunden sein. Neue Kopfschmerzen sollten ebenfalls konsequent abgeklärt werden, da Blutungen, insbesondere subdurale Hämatome, atypisch auftreten können. Die Antikoagulation sollte niemals ohne Rücksprache mit dem Fachzentrum abgebrochen werden.
Eine Rechtsherzinsuffizienz, die in der Regel durch eine Volumenüberlastung und manchmal auch durch Nieren- oder Leberversagen gekennzeichnet ist, ist häufig. Während periphere Ödeme fast allgegenwärtig und oft multifaktoriell bedingt sind (z.B. Veneninsuffizienz, Nebenwirkung von Calciumkanalblockern), sind die Abnahme des Bedarfs an Vitamin-K-Antagonisten zur Aufrechterhaltung des gleichen INR-Wertes, Appetitlosigkeit und/oder ein rechtsseitiges subdiaphragmatisches Spannungsgefühl (Bendopnoe) alarmierende Zeichen. Das Gewicht sollte sehr regelmäßig kontrolliert werden. Wenn möglich, sollte der Patient in das Gewichtsmanagement einbezogen werden.
– Allgemeiner Zustand des Patienten
Unabhängig davon, ob Patienten mit einem VAD auf eine Transplantation warten oder nicht, hängen Lebensqualität, Transplantationsfähigkeit und Überleben nach der Transplantation von der allgemeinen körperlichen Verfassung ab (19). Eine Optimierung des Lebensstils und des Körpergewichts ist daher von entscheidender Bedeutung. Auch hier ist die Zusammenarbeit mit dem behandelnden Arzt wichtig, um eine effektive Koordination zwischen stationärer und ambulanter Versorgung (Ernährungsberater, Physiotherapeut, Ergotherapeut, Psychiater) zu gewährleisten.
– Komorbiditäten des Patienten
Damit Patienten mit VAD von der Behandlung profitieren können, ist es wichtig, dass mögliche Komorbiditäten weiterhin behandelt werden. Besondere Aufmerksamkeit sollte depressiven Störungen (20), chronisch obstruktiver Bronchitis und Diabetes (21) gewidmet werden. Diese Komorbiditäten können auf klassische Weise in der Allgemeinarztpraxis angegangen werden. Für Vorsorgeuntersuchungen, zahnärztliche Behandlungen und Biopsien muss allenfalls die Antikoagulation angepasst werden. Da der Patient auf eine gute Antikoagulation angewiesen ist, soll im Zweifelsfall immer Rücksprache mit dem Implantationszentrum gehalten werden. Aufgrund der Interaktion zwischen dem Immunsystem und den Metalloberflächen der Pumpe (22), aber auch aufgrund der Herzinsuffizienz selbst (23), ist die Immunabwehr dieser Patienten geschwächt. Daher ist es wichtig, dass die Impfungen in der Arztpraxis aufgefrischt werden (Pneumokokken, Hepatitis A und B …) und die Grippeimpfung jährlich durchgeführt wird.
Zweitabdruck und übersetzt aus «la gazette médicale» 05-2021
Copyright bei Aerzteverlag medinfo AG
Clinique Universitaire de Cardiologie
Inselspital, Freiburgstrasse 18,
3010 Berne
Bruno.schnegg@insel.ch
Cabinet médical du Chauderon
Chemin du Chauderon 1
1071 Chexbres
Clinique Universitaire de Cardiologie
Inselspital
Freiburgstrasse 18
3010 Berne
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ VAD-Patienten sind heute eine Realität in der ambulanten Medizin.
◆ Für eine gute Lebensqualität brauchen sie aber nach der Entlassung aus dem Krankenhaus systematische Unterstützung durch ihr gesamtes Versorgungsnetz.
◆ Diese Patienten können und sollten von ihren Hausärzten betreut
werden, aber diese müssen sich der besonderen Aspekte dieser Art von Behandlung bewusst sein.
◆ Außerdem kennen Allgemeinmediziner ihre Patienten, ihr Umfeld
und ihre Vorgeschichte in der Regel gut, was die Früherkennung von Komplikationen erleichtert.
◆ Schließlich ist auch die Präventivmedizin (Impfungen, Optimierung des Allgemeinzustandes des Patienten) sehr wichtig (3).
◆ Der VAD-Patient ist daher ein hervorragendes Beispiel dafür, wie
wichtig gut organisierte Versorgungsnetze mit einer guten Kommunikation zwischen Krankenhausärzten und Allgemeinmedizinern für die Behandlung komplexer Patienten sind.
1. Fresiello L, Jacobs S, Timmermans P, et al.: Limiting factors of peak and submaximal exercise capacity in LVAD patients PLoS One 15: e0235684, 2020
2. Overgaard D, Grufstedt Kjeldgaard H, Egerod I: Life in Transition: A Qualitative Study of the Illness Experience and Vocational Adjustment of Patients With Left Ventricular Assist Device Journal of Cardiovascular Nursing 27: 394–402, 2012
3. Estep JD, Trachtenberg BH, Loza LP, Bruckner BA: Continuous flow left ventricular assist devices: shared care goals of monitoring and treating patients Methodist Debakey Cardiovasc J 11: 33–44, 2015
4. Rose EA, Gelijns AC, Moskowitz AJ, et al.: Long-term use of a left ventricular assist device for end-stage heart failure N Engl J Med 345: 1435–1443, 2001
5. MacIver Jane, Ross Heather J.: Quality of Life and Left Ventricular Assist Device Support Circulation 126: 866–874, 2012
6. Stehlik Josef, Estep Jerry D., Selzman Craig H., et al.: Patient-Reported Health-Related Quality of Life Is a Predictor of Outcomes in Ambulatory Heart Failure Patients Treated With Left Ventricular Assist Device Compared With Medical Management Circulation: Heart Failure 10: e003910, 2017
7. Mehta P, Imamura T, Juricek C, et al.: Combined Left Ventricular Assist Device and Coronary Artery Bypass Grafting Surgery: Should We Bypass the Bypass? ASAIO J 66: 32–37, 2020
8. Miera O, Potapov EV, Redlin M, et al.: First Experiences With the HeartWare Ventricular Assist System in Children The Annals of Thoracic Surgery 91: 1256–1260, 2011
9. Couperus LE, Delgado V, Khidir MJH, et al.: Pump Speed Optimization in Stable Patients with a Left Ventricular Assist Device ASAIO J 63: 266–272, 2017
10. Uriel N, Sayer G, Addetia K, et al.: Hemodynamic Ramp Tests in Patients With Left Ventricular Assist Devices JACC Heart Fail 4: 208–217, 2016
11. Cook JL, Colvin M, Francis GS, et al.: Recommendations for the Use of Mechanical Circulatory Support: Ambulatory and Community Patient Care: A Scientific Statement From the American Heart Association Circulation 135, 2017
12. Hulander M, Hong J, Andersson M, et al.: Blood interactions with noble metals: coagulation and immune complement activation ACS Appl Mater Interfaces 1: 1053–1062, 2009
13. Salamonsen RF, Mason DG, Ayre PJ: Response of rotary blood pumps to changes in preload and afterload at a fixed speed setting are unphysiological when compared with the natural heart Artif Organs 35: E47-53, 2011
14. Bennett MK, Adatya S: Blood pressure management in mechanical circulatory support J Thorac Dis 7: 2125–2128, 2015
15. Ahmed AR, Nikolaus P, Achim K, et al.: Survival analysis and postoperative complications after ventricular assist device implantation; prognostic value of INTERMACS scale Annals of Cardiovascular and Thoracic Surgery 1, 2018
16. Zinoviev R, Lippincott CK, Keller SC, Gilotra NA: In Full Flow: Left Ventricular Assist Device Infections in the Modern Era Open Forum Infectious Diseases 7, 2020
17. Topkara VK, Kondareddy S, Malik F, et al.: Infectious complications in patients with left ventricular assist device: etiology and outcomes in the continuous-flow era Ann Thorac Surg 90: 1270–1277, 2010
18. Kamboj M, Kazory A: Left Ventricular Assist Device and the Kidney: Getting to the Heart of the Matter BPU 48: 289–298, 2019
19. Healy AH, Stehlik J, Edwards LB, McKellar SH, Drakos SG, Selzman CH: Predictors of 30-day post-transplant mortality in patients bridged to transplantation with continuous-flow left ventricular assist devices—An analysis of the International Society for Heart and Lung Transplantation Transplant Registry The Journal of Heart and Lung Transplantation 35: 34–39, 2016
20. Cascino Thomas M., Kittleson Michelle M., Lala Anuradha, et al.: Comorbid Conditions and Health-Related Quality of Life in Ambulatory Heart Failure Patients Circulation: Heart Failure 13: e006858, 2020
21. Tao J, Bannister W, Wu C, Irwin FD: Impact of Patient Comorbidities on Post-Implant Outcomes Among Patients Receiving Ventricular Assist Devices in a Commercially Insured Population Journal of Cardiac Failure 21: S32, 2015
22. Itescu S, John R: Interactions between the recipient immune system and the left ventricular assist device surface: immunological and clinical implications The Annals of Thoracic Surgery 75: S58–S65, 2003
23. The activated immune system in congestive heart failure – from dropsy to the cytokine paradigm: Journal of Internal Medicine 243: 87–92, 1998
der informierte @rzt
- Vol. 12
- Ausgabe 12
- Dezember 2022