- Was tun bei stabiler Kreatininerhöhung?
Eine stabile Kreatininerhöhung, die länger als 3 Monaten besteht, wird als chronische Niereninsuffizienz («chronic kidney disease, CKD») definiert. Die genaue Stadieneinteilung sowie Prognoseabschätzung erfolgt anhand der mittels Formel geschätzten glomerulären Filtrationsrate («estimated glomerular f iltration rate, eGFR») sowie der Albuminurie. Rund 1% der Patienten mit CKD benötigt eine Nierenersatztherapie in Form von Dialyse oder Nierentransplantation, welche mit erhöhter Morbidität und Mortalität sowie enormen gesundheitsökonomischen Kosten verbunden ist. In diesem ersten Teil des Artikels werden nach einer Begriffsklärung die aktuellen Empfehlungen zur Diagnostik und Stadieneinteilung sowie zum Monitoring einer chronischen Niereninsuffizienz diskutiert.
Was ist stabile Kreatininerhöhung?
Bestimmung der Nierenfunktion
Für lange Zeit wurde die Nierenfunktion anhand des Kreatininwerts oder der Bestimmung der Kreatinin-Clearance mittels einer 24-Stunden-Urinsammlung beurteilt. Es gibt einige Faktoren, die einen Einfluss auf das Kreatinin bzw. die Kreatininbestimmung haben, die bei der Interpretation dieses Laborwerts beachtet werden sollten. Dazu gehört die Methode der Kreatininbestimmung. So ist der ältere kinetische Farbtest (Jaffé) empfindlich für Einflüsse von Glukose und Protein. Die weniger anfällige neuere enzymatische Methode wie der häufig in Arztpraxen verwendete trockenchemische Enzymtest (Reflotron®, Roche Diagnostics) ergibt jedoch unter dem selten in Serum vorhandenen Sarkosin falsch hohe Werte.
Weitere Einflussfaktoren auf das Kreatinin
Der Einfluss von Alter, Muskelmasse und des Geschlechts sowie der ethnischen Herkunft (Kaukasier mit geringerer Muskelmasse im Vergleich zu Afrikaner oder Afroamerikaner) auf das Kreatinin ist seit langem bekannt und muss bei der Interpretation des Kreatininwerts in Betracht gezogen werden (1).
In den letzten Jahren hat im Rahmen der Fitness-Kultur die Einnahme von Nahrungsergänzungsmitteln, Muskelaufbaupräpa-raten oder Sporternährungszusätzen, die Kreatin enthalten können, zugenommen. Dies kann zu einem Anstieg des Serum-Kreatinins führen, ohne dass eine Nierenerkrankung vorliegt (2).
Kreatinin wird glomerulär filtriert und zusätzlich tubulär sezerniert. Daher würde eine Beurteilung der Nierenfunktion, welche nur auf das Serum-Kreatinin basiert, grundsätzlich die tatsächliche Nierenfunktion überschätzen. Sowohl bei eingeschränkter Nierenfunktion als auch durch bestimmte Medikamente wie z. B. Cotrimoxazol oder Cimetidin kann die tubuläre Kreatinin-Sekretion verändert werden, was ebenfalls einen Einfluss auf die Bestimmung der Kreatinin-Clearance und somit Beurteilung der Nierenfunktion hätte.
Bestimmung der Kreatinin-Clearance
Die früher häufig durchgeführte 24-Stunden-Urinsammlung zur Bestimmung der Kreatinin-Clearance wurde inzwischen aufgrund des Aufwands und der hohen Fehlerquote aufgrund einer nicht adäquaten Sammlung (Unter- oder Übersammlung) verlassen und durch die Abschätzung der GFR mittels Formeln (siehe unten) ersetzt. In bestimmten Fällen jedoch wie z.B. bei deutlicher Abweichung der Muskelmasse (Muskelerkrankungen, instabile Nierenfunktion, ausgeprägte Adipositas oder Malnutrition etc.) kann diese Methode weiterhin angewandt werden und hilfreich sein.
Beurteilung der Nierenfunktion anhand der geschätzten GFR (eGFR)
Aufgrund der oben genannten Limitationen bei der Beurteilung der Nierenfunktion anhand des Serum-Kreatinins bzw. der gemessenen Kreatinin-Clearance wurden verschiedene Formeln für die Abschätzung der GFR entwickelt.
Die vermutlich älteste Formel zur Abschätzung der GFR ist die Cockcroft und Gault Formel (3). Diese Formel ist für das Alter, Körpergewicht und Geschlecht adjustiert, wird heute jedoch kaum mehr verwendet. Da jedoch viele Dosierungsempfehlungen für die Gabe von Medikamenten auf dieser Formel beruhen (z.B. die Dosisanpassung bei der Gabe von den immer häufiger eingesetzten neuen oralen Antikoagulanzien), sollte man sie kennen. Die vermutlich am weitesten verbreitete Formel für die Abschätzung der GFR war die Modification of Diet and Renal Disease (MDRD) Formel, welche erstmalig in den Richtlinien der National Kidney Foundation- Kidney Disease Outcomes Quality Initiative (NKF-KDOQI) im Jahre 2002 für die Beurteilung der Nierenfunktion sowie die Diagnose einer chronischen Niereninsuffizienz empfohlen wurde (4, 5). Die MDRD Formel ist ebenfalls Kreatinin-basiert und für Alter, schwarze Hautfarbe und Geschlecht korrigiert. Diese Formel hat jedoch gewisse Einschränkungen bei Patienten < 18 oder > 75 Jahre, Schwangere sowie bei extremer Abweichung der Muskelmasse oder des Körpergewichts. Des Weiteren gibt es bei Patienten mit einer eGFR > 60 ml/min Ungenauigkeiten für eine präzise Beurteilung der Nierenfunktion. Den heutigen Goldstandard für die Abschätzung der GFR stellt die Chronic Kidney Disease-Epidemiology Collaboration (CKD-EPI) Formel dar (1, 6). Diese Formel ist ebenfalls Kreatinin-basiert. Sie verbesserte und präzisierte die MDRD Formel insbesondere für eine eGFR > 60 ml/min. Gemäss den Kidney Disease Improving Global Outcome (KDIGO) Richtlinien sollte für die Diagnose einer Niereninsuffizienz bei Erwachsenen primär die Kreatinin-basierte eGFR (eGFRKrea) anhand der CKD-EPI Formel (Version aus dem Jahr 2009) errechnet werden (1), am einfachsten mit Online-Kalkulatoren, z. B. unter https://www.kidney.org/professionals/kdoqi/gfr_calculator.
Als Alternative zu Kreatinin kann die Nierenfunktion in speziellen Situationen beim Facharzt anhand von Cystatin C oder mittels externer Filtrationsmarker beurteilt werden (6).
Diagnose und Stadien der chronischen Niereninsuffizienz
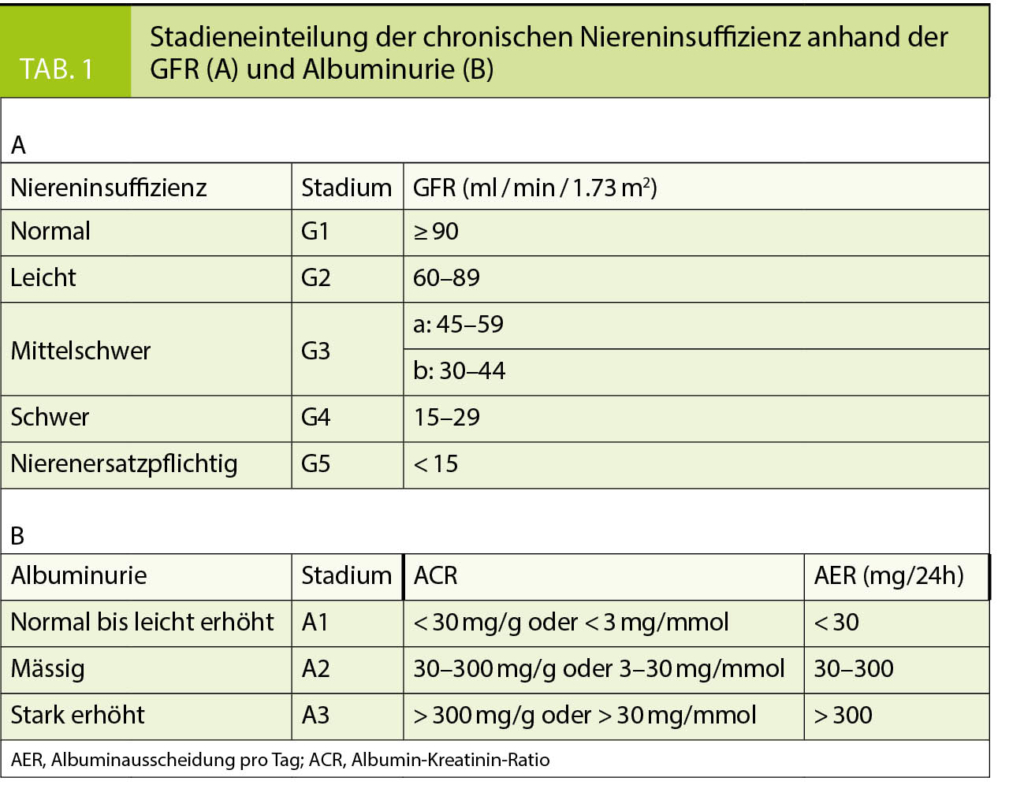
Gemäss den KDIGO Richtlinien wird eine chronische Niereninsuffizienz anhand der eGFR definiert und klassifiziert (1). Die Diagnose einer chronischen Niereninsuffizienz liegt entweder beim Nachweis eines strukturellen Nierenschadens (histologisch, radiologisch, laborchemisch, etc.) oder bei einer GFR von < 60 ml/min/1.73m2, welche seit mindestens 3 Monaten besteht, vor. Entsprechend erfolgt die Stadieneinteilung anhand der zugrundeliegenden Erkrankung sowie der GFR- und Albuminurie-Kategorie. Die Hinzunahme der Albuminurie erfolgte aufgrund von mehreren Studien, die gezeigt haben, dass eine chronische Niereninsuffizienz und Albuminurie unabhängige Risikofaktoren für Tod und Auftreten einer terminalen Niereninsuffizienz darstellen (7–9). Die verschiedenen GFR- und Albuminurie-Kategorien sind in Tabelle 1 aufgeführt. Es ist zu bemerken, dass die Einführung dieser Klassifikation zu einer deutlichen Zunahme der Diagnose einer chronischen Niereninsuffizienz geführt hat. Um somit eine «Überdiagnose» der chronischen Niereninsuffizienz zu vermeiden, wäre es sehr wünschenswert, Informationen bezüglich der Alters- und Geschlechts-bezogenen Referenzwerte für die GFR in der jeweiligen Population zu haben, welche leider für die Schweiz nicht zur Verfügung stehen (10).
Was tun bei stabiler Kreatininerhöhung?
Nephrologische Standortbestimmung / Zuweisung
Eine chronische Niereninsuffizienz sollte bei allen Patienten mit Diabetes mellitus, Hypertonie, kardiovaskulärer Erkrankung, Systemerkrankungen mit möglicher Nierenbeteiligung (z. B. Systemischer Lupus Erythematodes), chronischem Gebrauch von potentiell nephrotoxischen Substanzen (z. B. NSAR, Lithium etc.), sowie familiärer oder genetischer Nierenerkrankung gesucht werden. Falls es sich bei der Diagnose der CKD in der hausärztlichen Praxis um einen Zufallsbefund bzw. Erstdiagnose handelt und die zugrundeliegende Nierenerkrankung unklar ist, sollte eine nephrologische Zuweisung erfolgen. Eine genaue Diagnosestellung der zugrundeliegenden Nierenerkrankung ist nicht nur für eine optimale Therapie, sondern auch für die Prognoseabschätzung und Progressionsverlangsamung der Niereninsuffizienz sowie ggf. der Planung einer Nierentransplantation entscheidend. In Zusammenarbeit mit dem Hausarzt können in Folge die Komplikationen der Niereninsuffizienz rechtzeitig und adäquat behandelt und der Patient für eine Nierenersatztherapie zeitgerecht (GFR < 30 ml/min) vorbereitet werden. Die frühe Erkennung und Therapie von Komplikationen sowie die rechtzeitige Vorbereitung und Einleitung der Nierenersatztherapie haben einen direkten Einfluss auf die Prognose dieser Patienten (1).
Weitere Indikationen für eine zeitnahe nephrologische Zuweisung bei Patienten mit chronischer Niereninsuffizienz stellen ein starker Abfall der eGFR (> 5 ml / min / Jahr) oder neuer Nachweis von Akanthozyten, dysmorphen Erythrozyten oder Erythrozytenzylindern im Urinsediment dar. Ebenfalls sollte bei Zunahme einer Proteinurie oder Albuminurie sowie Auftreten einer therapierefraktären Hypertonie eine vorzeitige nephrologische Standortbestimmung erfolgen.
Je nach Stadium der chronischen Niereninsuffizienz sind jährliche nephrologische Kontrollen (z.B. CKD Stadium G1 bis G3a nach KDIGO) bis zu engmaschigeren nephrologischen Kontrollen (CKD Stadium G3b bis G5 nach KDIGO) empfehlenswert.
Monitoring der Nierenfunktion und der renalen Folgeerkrankungen
Bei Patienten mit erstmaligem Nachweis einer Kreatininerhöhung und Verdacht auf eine chronische Niereninsuffizienz ohne Vorlage von Vorwerten sollte das Kreatinin innerhalb sowie nach dem Zeitraum von 3 Monaten wiederholt bestimmt werden, um die Diagnose einer chronischen Niereninsuffizienz zu bestätigen. Des Weiteren sollte wie bereits erwähnt für die Stadieneinteilung sowie Abschätzung des kardiovaskulären Risikos die Albuminurie gemessen werden. Die Indikationen für eine nephrologische Zuweisung bzw. Standortbestimmung bei chronischer Niereninsuffizienz sind oben aufgeführt.
Je nach Stadium der chronischen Niereninsuffizienz sollten 1 – 2 x jährliche (z. B. CKD Stadium G1 bis G3va nach KDIGO) bzw. 3 – 4 x jährliche (z. B. CKD Stadium G3 a bis G5 nach KDIGO) Laborkontrollen durchgeführt werden. Je nach Stadium und Verlauf können die Kontrollen sowie die Behandlung inkl. der nephroprotektiven Massnahmen mehrheitlich vom Hausarzt durchgeführt werden.
Bei fortgeschrittener Niereninsuffizienz (z. B. CKD Stadium G4 und G5 nach KDIGO) wird jedoch meistens eine engmaschige Kontrolle durch den Nephrologen notwendig, um sowohl die Komplikationen adäquat zu behandeln als auch die Nierenersatztherapie rechtzeitig vorzubereiten und einzuleiten.
Die regelmässigen Laborkontrollen bei Patienten mit chronischer Niereninsuffizienz beinhalten folgende Parameter:
1. Nierenfunktion: Elektrolyte (Natrium, Kalium, Calcium, Phosphat, Bikarbonat, ggf. Chlorid), Kreatinin, Harnstoff, Cystatin C (in Einzelfällen), eGFR, Albuminurie, Urinsediment
2. Anämie: Blutbild inkl. Retikulozyten, Ausschluss von Substratmangel (Eisenstatus, Vitamin B12, Folsäure), Hämolyseparameter (LDH, Haptoglobin)
3. Renale Knochenstoffwechselkrankheit («CKD-Mineral Bone Disorder, CKD-MBD»): Calcium, Phosphat, intaktes Parathormon, (alkalische Phosphatase, 25-OH-Vitamin D3)
4. Lipidstatus: LDL-Cholesterin, HDL-Cholesterin, Triglyceride
5. Gesamteiweiss und Albumin im Serum 1-2x jährlich
6. Bei Diabetikern HbA1c alle 3 Monate
7. Nierensonographie 1x jährlich
Wie oft die o. g. Parameter bestimmt werden sollen, hängt vom Stadium der CKD sowie einer bereits eingeleiteten Therapie ab. Vereinfacht sollte die Nierenfunktion bei CKD Stadium G1 bis G2 mindestens 1-2x jährlich und ab Stadium G3 mindestens 3-4x jährlich bestimmt werden.
In einem zweiten Teil werden in der Septemberausgabe spezifische Befunde und ihre Behandlungsmöglichkeiten diskutiert.
Klinik für Nephrologie
Universitätsspital Zürich
Rämistrasse 100
8091 Zürich
Praxis und Dialysezentrum Zürich-City AG
Stockerstrasse 50
8002 Zürich
Nilufar.Mohebbi@usz.ch
Die Autorin hat keine Interessenskonflikte im Zusammenhang mit diesem Beitrag deklariert.
- Für die Definition, Stadieneinteilung sowie Abschätzung der Prognose bei chronischer Niereninsuffizienz ist die Bestimmung der eGFR und Albuminurie notwendig.
- Eine chronische Niereninsuffizienz ist durch einen Abfall der eGFR < 60 ml/min seit mindestens 3 Monaten definiert.
- Die rechtzeitige nephrologische Zuweisung sowie die enge Zusammenarbeit zwischen Hausärzten und Nephrologen ermöglichen nicht nur eine optimale Therapie, sondern sind auch für die Progressionsverlangsamung, Erkennung und Behandlung von Komplikationen sowie die rechtzeitige Planung einer Nierenersatztherapie inkl. Nierentransplantation von grosser Bedeutung.
1. Group KDIGOKCW. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney International Suppl. 2013;3(1):150.
2. T W. Kreatin Supplementation und Nierenfunktion: Reines Kreatin ist nicht schädlich für die Nieren! Swiss medical forum. 2013;13(42):3.
3. Cockcroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron. 1976;16(1):31-41. Epub 1976/01/01.
4. Levey AS, Bosch JP, Lewis JB, Greene T, Rogers N, Roth D. A more accurate method to estimate glomerular filtration rate from serum creatinine: a new prediction equation. Modification of Diet in Renal Disease Study Group. Annals of internal medicine. 1999;130(6):461-70. Epub 1999/03/13.
5. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. American journal of kidney diseases : the official journal of the National Kidney Foundation. 2002;39(2 Suppl 1):S1-266. Epub 2002/03/21.
6. Inker LA, Schmid CH, Tighiouart H, Eckfeldt JH, Feldman HI, Greene T, et al. Estimating glomerular filtration rate from serum creatinine and cystatin C. The New England journal of medicine. 2012;367(1):20-9. Epub 2012/07/06.
7. Coresh J, Turin TC, Matsushita K, Sang Y, Ballew SH, Appel LJ, et al. Decline in estimated glomerular filtration rate and subsequent risk of end-stage renal disease and mortality. Jama. 2014;311(24):2518-31. Epub 2014/06/04.
8. Gansevoort RT, Matsushita K, van der Velde M, Astor BC, Woodward M, Levey AS, et al. Lower estimated GFR and higher albuminuria are associated with adverse kidney outcomes. A collaborative meta-analysis of general and high-risk population cohorts. Kidney international. 2011;80(1):93-104. Epub 2011/02/04.
9. Astor BC, Matsushita K, Gansevoort RT, van der Velde M, Woodward M, Levey AS, et al. Lower estimated glomerular filtration rate and higher albuminuria are associated with mortality and end-stage renal disease. A collaborative meta-analysis of kidney disease population cohorts. Kidney international. 2011;79(12):1331-40. Epub 2011/02/04.
10. Wetzels JF, Kiemeney LA, Swinkels DW, Willems HL, den Heijer M. Age- and gender-specific reference values of estimated GFR in Caucasians: the Nijmegen Biomedical Study. Kidney international. 2007;72(5):632-7. Epub 2007/06/15.
11. de Brito-Ashurst I, Varagunam M, Raftery MJ, Yaqoob MM. Bicarbonate supplementation slows progression of CKD and improves nutritional status. Journal of the American Society of Nephrology : JASN. 2009;20(9):2075-84. Epub 2009/07/18.
12. Phisitkul S, Khanna A, Simoni J, Broglio K, Sheather S, Rajab MH, et al. Amelioration of metabolic acidosis in patients with low GFR reduced kidney endothelin production and kidney injury, and better preserved GFR. Kidney international. 2010;77(7):617-23. Epub 2010/01/15.
13. Mahajan A, Simoni J, Sheather SJ, Broglio KR, Rajab MH, Wesson DE. Daily oral sodium bicarbonate preserves glomerular filtration rate by slowing its decline in early hypertensive nephropathy. Kidney international. 2010;78(3):303-9. Epub 2010/05/07.
14. KDIGO 2017 CLINICAL PRACTICE GUIDELINE UPDATE FOR THE DIAGNOSIS, EVALUATION, PREVENTION, AND TREATMENT OF CHRONIC KIDNEY DISEASE–MINERAL AND BONE DISORDER (CKD-MBD). Kidney International Suppl. 2017;7(1):60.
15. KDIGO Clinical Practice Guideline for Lipid Management in Chronic Kidney Disease. Kidney International Suppl. 2013;3(3):47.
16. KDIGO Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease Kidney International Suppl. 2012;2(5):77.
17. Wenzel UO. Angiotensin-converting enzyme inhibitors and progression of renal disease: evidence from clinical studies. Contributions to nephrology. 2001(135):200-11. Epub 2001/11/14.
18. Wilhelm-Leen E, Montez-Rath ME, Chertow G. Estimating the Risk of Radiocontrast-Associated Nephropathy. Journal of the American Society of Nephrology : JASN. 2017;28(2):653-9. Epub 2016/10/01.
19. Perazella MA. Current status of gadolinium toxicity in patients with kidney disease. Clinical journal of the American Society of Nephrology : CJASN. 2009;4(2):461-9. Epub 2009/02/10.
der informierte @rzt
- Vol. 8
- Ausgabe 6
- Juni 2018