- Werden FXI Hemmer die neue Generation von Antikoagulantien?
Thrombosen und Blutungen unter Antikoagulantientherapie bleiben ein bedeutendes klinisches Problem mit lebensbedrohlichen Konsequenzen. Trotz bedeutender Fortschritte mit den direkten oralen Antikoagulantien persistieren relevante Blutungs- und Thrombose-Risiken. Besonders bei Patienten mit Begleiterkrankungen wie Tumore, Niereninsuffizienz und Leber-Zirrhose, sowie bei Patienten mit mechanischen Devices (Klappen, künstliches Herz, ECC), resp. Blutkontakt mit künstlichen Oberflächen – bekannt als «künstliche Kontaktflächen-assoziierten Thrombosen». Die FXI-Hemmung ist hier ein vielversprechender, neuer Ansatz mit alternativen Wirkmechanismen und Verabreichungsoptionen, was Flexibilität für die klinische Applikation bietet. Aktuellste Resultate aus Phase-II-Studien zeigen eine vielversprechende Tendenz zur Reduzierung des Blutungsrisikos bei venösen und arteriellen Thromboembolien. Die Ergebnisse, insbesondere der laufenden Phase-III-Studien, werden wertvolle Erkenntnisse zur Wirksamkeit und Sicherheit von FXI-Hemmern in der Thromboseprävention liefern.
Thrombosis and (anticoagulant) bleeding remain significant clinical challenges with potential life-threatening consequences. Despite major progress in anticoagulant development, concerns about residual thrombosis and induced bleeding persist, especially in patients with typical comorbidities such as oncological diseases, renal failure, liver cirrhosis, and those with mechanical devices and blood exposed to artificial surfaces — commonly referred to as “Artificial Contact Surfaces Associated Thrombosis” (ACSAT). FXI inhibitors have been developed as a promising novel approach using different mechanisms of action, routes of administrations, and half-lives, offering flexibility for specific clinical conditions and applications. Recent findings from phase II trials have shown a promising trend of reduced bleeding risks in both venous and arterial thromboembolism. The results of these trials and particularly of the ongoing phase III trials, will yield valuable insights into the efficacy and safety of FXI inhibitors in thromboembolic disease.
Key Words: FXI inhibitors; Anticoagulation; Thrombosis; ACSAT; Bleeding
Rational für die Hemmung von FXI als neues Antikoagulans
Antikoagulanzien werden sehr häufig zur Prävention und Therapie von venösen Thrombosen (VT), Lungenembolien (LE) und arteriellen Thromboembolien, z.B. von Schlaganfällen bei Vorhofflimmern (1, 2), angewendet. In den letzten Jahren wurden wirksame und gut verträgliche orale Antikoagulanzien entwickelt – die «direkten oralen Antikoagulanzien» (DOACs) – welche die FIIa und FXa hemmen. Die DOACs haben herkömmliche Vitamin-K-Antagonisten (VKA) und in einigen Fällen parenterale Antikoagulanzien wie niedermolekulare Heparine (NMH) weitgehend, wenn auch nicht vollständig, ersetzt.
Dennoch besteht nach wie vor der Bedarf zur weiteren Reduktion des verbleibenden Blutungs- und Thromboserisikos auch unter der Anwendung der DOACs. Patienten, die speziell eine verbesserte Antikoagulationsstrategie benötigen, lassen sich in zwei Gruppen unterteilen. Die erste Gruppe umfasst Patienten mit erhöhtem Blutungsrisiko, darunter auch solche mit Niereninsuffizienz, Leber-Zirrhose und Blutungen in der Vorgeschichte sowie Krebspatienten und ältere Menschen im Allgemeinen. Die zweite Gruppe umfasst Patienten, bei denen die Wirksamkeit von DOACs getestet wurde und die sich entweder als ungenügend gegenüber VKA erwiesen haben oder für deren Verwendung keine ausreichende Evidenz vorliegt. Hierzu zählen Patienten mit kardiovaskulären Devices und/oder künstlichen Oberflächen, die entsprechend dem Blut ausgesetzt sind, und Patienten mit Antiphospholipid-Syndrom (3-5).
Bei Patienten mit mechanischen Herzklappen erwiesen sich beispielsweise Dabigatran und Rivaroxaban als weniger wirksam als VKA (6). Das Nutzen-Risiko-Verhältnis von oralen Antikoagulantien ist bei Dialysepatienten umstritten (7). Patienten mit linksventrikulären Support Devices oder solche, die einer extrakorporalen Membranoxygenierung (ECMO) unterzogen wurden, waren nicht Bestandteil randomisierter kontrollierter Studien zur Bewertung von DOACs (8).
Entwicklung von FXI-Hemmer
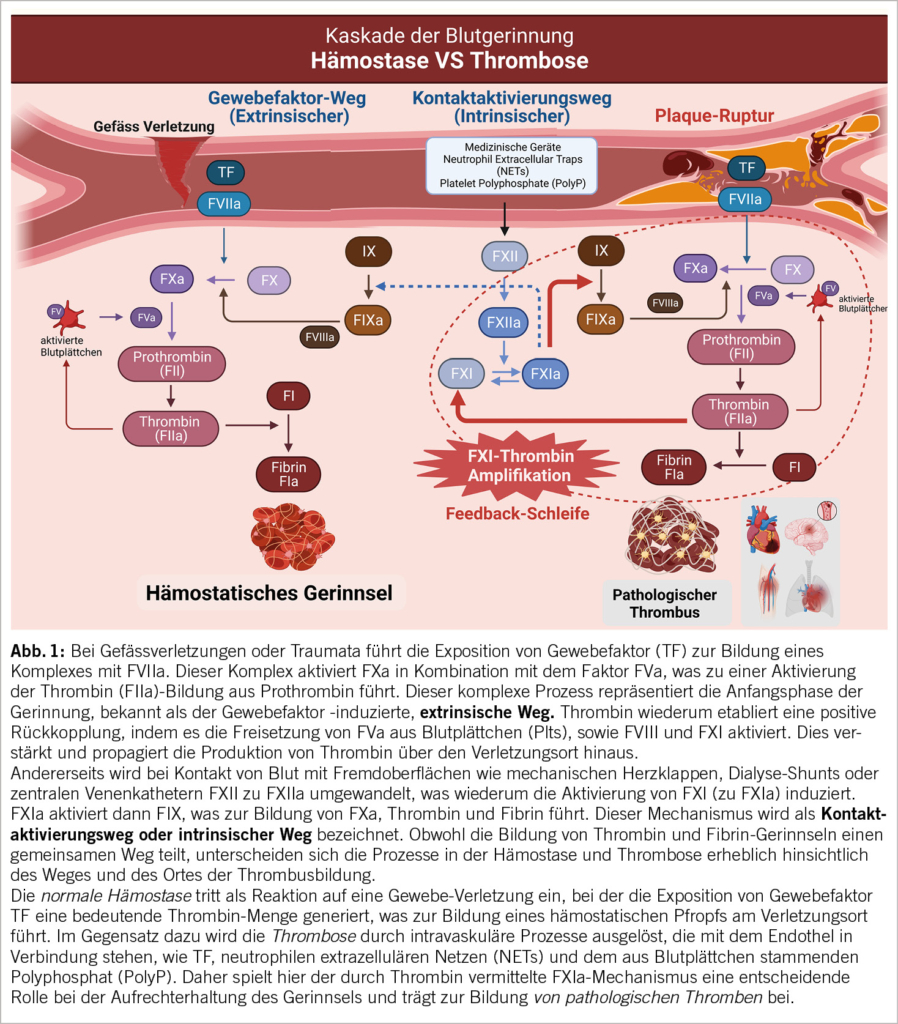
Faktor XI (FXI) ist eine inaktive Form der Blutgerinnungsprotease, die zum Faktor XIa (FXIa) aktiviert wird (9). FXI kann nicht nur durch FXIIa, sondern auch durch FXIa selbst und Thrombin in einer positiven Rückkopplungsschleife aktiviert werden. Diese Rückkoppelung führt zu einer erhöhten Thrombinproduktion und verstärkt die Gerinnungskaskade. Die detaillierte Gerinnungskaskade ist in unserer zentralen Abbildung 1 dargestellt.
Der Kontaktaktivierungsweg (intrinsic pathway) wird ausgelöst, wenn Blut mit künstlichen Oberflächen in Kontakt kommt, was zur Aktivierung von FXII führt. Das FXIIa löst dann die Aktivierung von FXI aus, was wiederum zur Aktivierung von FIX, FX und Prothrombin führt. Obwohl FXII ein natürliches Ziel für die Hemmung des intrinsischen Weges sein könnte, sind die Daten aus FXII-Studien noch widersprüchlich. Studien an Patienten mit FXII-Mangel ergaben keinen Hinweis auf ein geringeres Risiko für thrombotische Ereignisse, und es gibt keinen Zusammenhang zwischen FXII und VTE, ischämischem Schlaganfall oder Myokardinfarkt (MI) (10, 11). Ein möglicher Grund dafür könnte sein, dass niedrige Konzentrationen von FXII die Verringerung der Thrombose durch eine Verminderung der Thrombus-Stabilität unterstützen, was zu einer stärkeren Embolisierung führen könnte. Andererseits ist zu beachten, dass die Thrombingeneration, die aus der Kontaktaktivierung stammt, ausreicht, um die Bildung eines hämostatischen Pfropfens einzuleiten, so dass eine Thrombinverstärkung nicht erforderlich ist. Dies könnte darauf hindeuten, dass FXI bei der normalen Hämostase nicht zwingend benötigt wird. Diese Ergebnisse stimmen mit der Beobachtung relativ leichter Blutungen bei Patienten mit ausgeprägtem FXI-Mangel überein (12). Interessanterweise haben Personen mit genetischem FXI-Mangel niedrigere Raten von VTE, Schlaganfall und möglicherweise auch MI im Vergleich zur Allgemeinbevölkerung (13, 14). Umgekehrt sind erhöhte FXI-Werte mit einem erhöhten Thromboserisiko, einschliesslich VTE und Schlaganfall/TIA, assoziiert (10, 15).
FXI-Hemmer
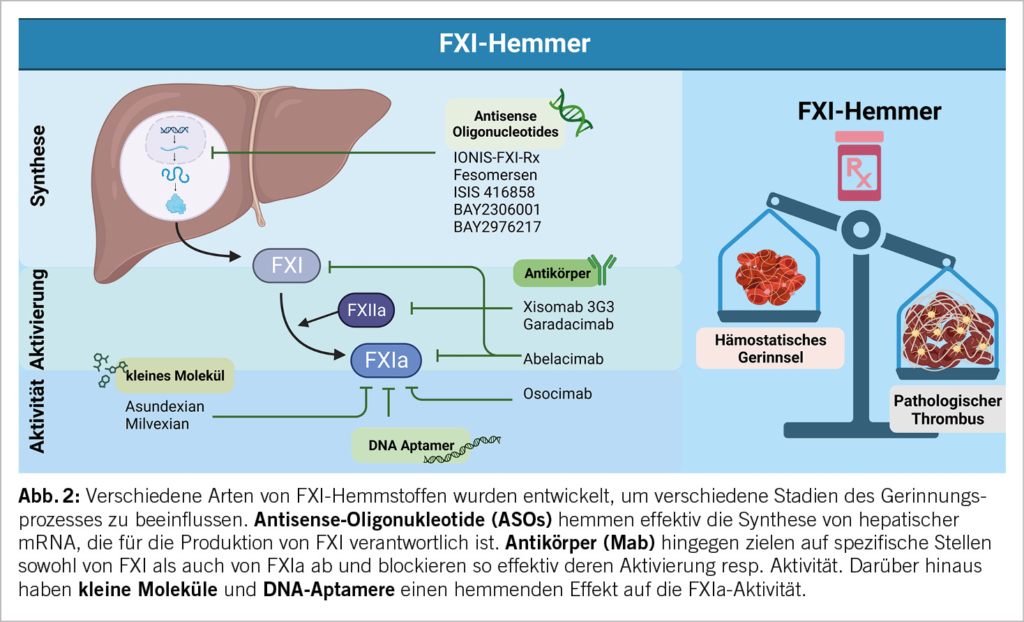
Aufgrund der verfügbaren Daten hat sich die pharmakologische Reduktion von FXI resp. die Hemmung von FXIa als potenzieller therapeutischer Ansatz mit (hoffentlich) minimalen Blutungen herauskristallisiert. Derzeit werden grundverschiedene Ansätze als mögliche therapeutische Strategien zur Hemmung der Bildung und Aktivität von FXI untersucht, wie in Abbildung 2 dargestellt. Dazu gehören Antisense-Oligonukleotide (ASOs), die auf Hepatozyten abzielen, um die FXI-Synthese zu reduzieren, kleine Moleküle, die an der aktiven Stelle von FXIa binden, monoklonale Antikörper (Mab), die die Aktivierung blockieren oder die FXIa-Aktivität hemmen, sowie DNA-Aptamere (16). Diese Medikamente weisen unterschiedliche pharmakologische Eigenschaften auf. Kleine Moleküle werden oral verabreicht, während ASOs und Mab parenteral gegeben werden müssen. Der Mab zeigt eine schnelle Wirkung, wenn intravenös injiziert, während kleine Moleküle 1-4 Stunden nach der oralen Einnahme den Plasma-Spitzenspiegel erreichen. ASOs, die subkutan verabreicht werden, benötigen etwa 6 Stunden, um den Peakwert zu erreichen. ASOs und die Mab weisen dagegen wie erwartet bemerkenswert lange Halbwertszeiten von bis zu 4-6 Wochen auf, während kleine Moleküle kurze Halbwertszeiten von wenigen Stunden haben und ein- oder zweimal täglich verabreicht werden müssen.
Klinische Daten zu FXI-Hemmern
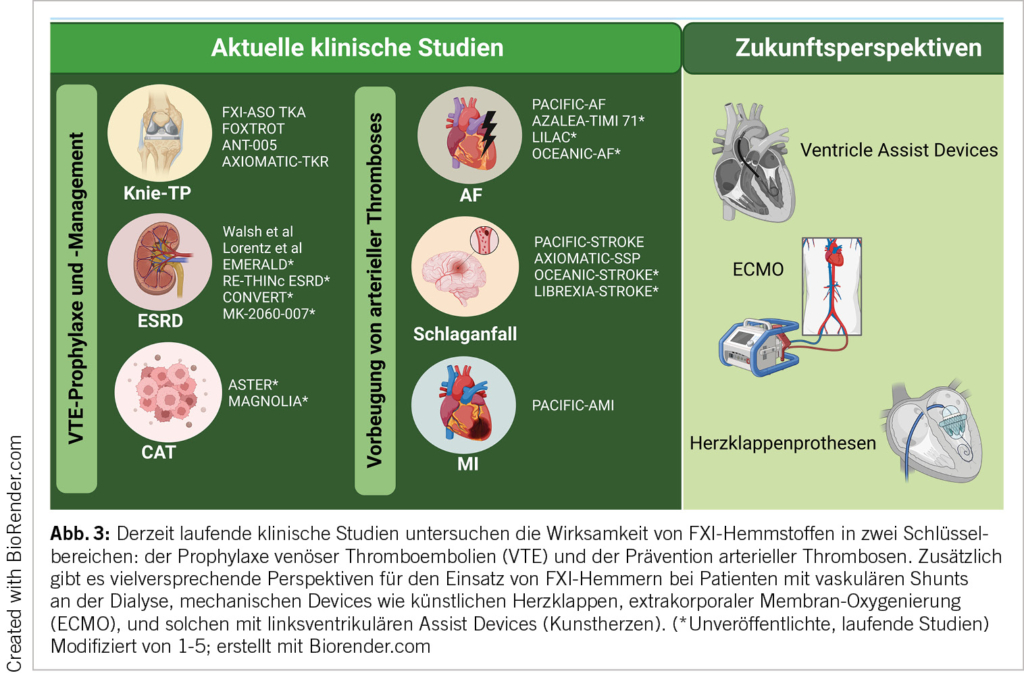
Derzeit laufen klinische Studien der Phasen II und III, in denen der Einsatz von FXI-Hemmern in verschiedensten klinischen Situationen untersucht wird. Dazu zählen die VTE-Prophylaxe in spezifischen Szenarien wie Knie-Totalendoprothesen Operationen (Knie-TP), Nierenerkrankungen im Endstadium, bei Krebs-assoziierten Thrombosen sowie die Schlaganfallprävention bei Patienten mit Vorhofflimmern, die Therapie nach Schlaganfall oder nach MI. Detaillierte Zusammenfassungen der einzelnen klinischen Studien sind in Abbildung 3 sowie in Tabelle 1 zu finden.
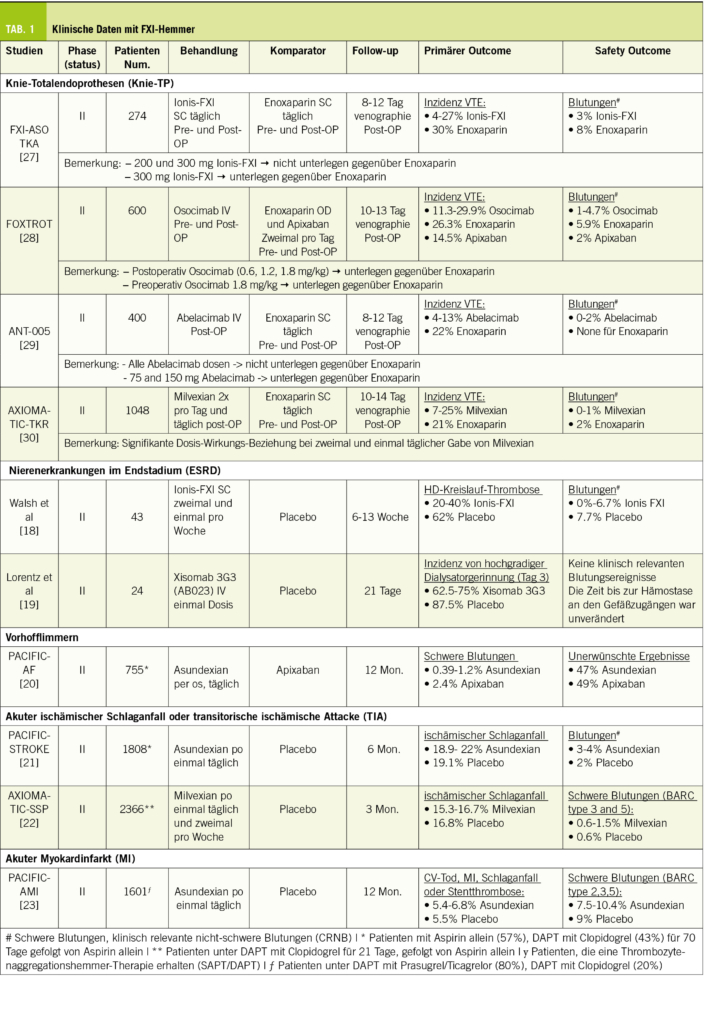
Patienten, die sich einer Knie-TP Operation unterziehen mussten, waren die ersten, die mit den FXI Hemmern behandelt wurden, einerseits weil die VTE-Inzidenz ohne Prophylaxe hoch ist und andererseits, weil die VTE durch die Venographie standardmässig erfasst werden kann. Eine kürzlich durchgeführte Metaanalyse von vier randomisierten, kontrollierten Studien bestätigte, dass FXI-Hemmer bei Patienten, die sich einer TKA unterzogen, mit einer signifikanten Verringerung der Inzidenz von VTE und Blutungsereignissen jeglicher Art assoziiert waren (Odds Ratio [OR] 0.50, 95%CI 0,36-0,69) (17).
Später konzentrierten sich zwei separate Phase-II-Studien auf Patienten mit klarem Bedarf an verbesserter Antikoagulanzien-Therapie wie terminaler Niereninsuffizienz (ESRD) [18,19]. Die Studien zeigten, dass ASOs und Mab gut verträglich sind und minimale Blutungsrisiken aufweisen.
Grosse Phase-III-Studien wurden inzwischen bereits abgeschlossen und ergaben positive Ergebnisse hinsichtlich reduzierter Blutungsrisiken im Vergleich zum Placebo bei ASOs, dies bei Patienten mit ESRD. Zum Beispiel traten Blutungsereignisse mit 3,8 % bei 200 mg Ionis-Fx im Vergleich zu 5,7 % beim Placebo auf [NCT03358030], und 6,1 % bei 120 mg Fesomersen im Vergleich zu 9,7 % beim Placebo [NCT04534114], sowie bei monoklonalen Antikörpern; Blutungsevents lagen zwischen 3,6 % und 4,3 % bei Osocimab im Vergleich zu 6 % beim Placebo [NCT04523220, NCT05027074].
FXI-Inhibitoren haben ausserdem ein interessantes Potenzial zur Vorbeugung von krebsbedingten Thrombosen (Cancer-Associated Thrombosis, CAT) gezeigt. Derzeit laufen Phase-III-Studien, nämlich ASTER [NCT05171049] und MAGNOLIA [NCT05171075]. Diese Studien untersuchen die Auswirkungen von Abelacimab auf das Wiederauftreten von VTEs und Blutungen im Vergleich zu Apixaban (ASTER) und Dalteparin (MAGNOLIA) bei Tumorpatienten.
In Bezug auf die Schlaganfallprävention bei Vorhofflimmern zeigte sich, dass 20 und 50 mg Asundexian nach 12 Monaten im Vergleich zu Apixaban das Blutungsrisiko reduzierten, ohne signifikante Unterschiede in den unerwünschten (Schlaganfall) Ereignissen (20). Eine Phase-III-Studie ist derzeit im Gange, um die Schlaganfallinzidenz mit einer Beobachtung von 30 Monaten zu bestimmen [NCT05643573]. Neben Asundexian sind Phase-II- [NCT04755283] und Phase-III-Studien [NCT05712200] von Abelacimab im Gange und sollten voraussichtlich 2024 bzw. 2025 abgeschlossen werden.
Für die Sekundärprävention von Schlaganfällen wurden Milvexian und Asundexian bei Patienten mit ischämischem Schlaganfall oder TIA untersucht, die gleichzeitig eine Therapie mit Thrombozytenaggregationshemmern erhielten. Nach 90 und 180 Tagen zeigten diese Inhibitoren im Vergleich zu einem Placebo keine Verringerung des zusammengesetzten Ergebnisses von stillen Hirninfarkten oder ischämischen Schlaganfällen. Die fehlende Reduktion könnte darauf zurückzuführen sein, dass die Studien keine ausreichende statistische Power hatten und sich zunächst korrekterweise auf die Bestimmung der Sicherheitsdosis für die Schlaganfallprävention konzentrierten. Bemerkenswert ist, dass keines dieser kleinen Moleküle einen Anstieg der Blutungsrate zeigte (21-22). Weitere grosse Phase-III-Studien befinden sich derzeit in der Rekrutierungsphase und sollen voraussichtlich 2026 abgeschlossen sein [NCT05686070, NCT05702034].
Neben den Analysen zu Schlaganfällen hat Asundexian in Phase II Studien positive Tendenzen auf den Myokardinfarkt gezeigt, insbesondere bei hohen Dosierungen von 50 mg. Die Studien hatten keine ausreichende statistische Power, um die Wirksamkeit zu beweisen, die Anzahl der Todesfälle, wiederholter MIs, Schlaganfälle und Stentthrombosen waren aber numerisch geringer, obwohl die Anzahl der Ereignisse in jedem Arm äusserst niedrig war (etwa 20 Ereignisse pro Arm) (23).
Zusammenfassend haben die Ergebnisse der neuesten Phase-II-Studien trotz der begrenzten Teilnehmerzahl wertvolle Einblicke in das Sicherheitsprofil von FXI-Hemmer geliefert. Eine kürzlich durchgeführte Meta-Analyse, die acht veröffentlichte klinische Phase-II-Studien mit FXI-Hemmern einschließlich Knie-TP, Schlaganfall bei Vorhofflimmern/Sekundärprävention und MI einbezog, ergab eine um 51 % niedrigere Rate an Blutungen jeglicher Art, unabhängig von der verwendeten Dosierung (24). Zudem wurde im Vergleich zu LMWH eine 38 % Verringerung des in der Studie definierten Wirksamkeits-Endpunkts, wie beispielsweise der Inzidenz von VTE, MI und Schlaganfall festgestellt. Andererseits wurden beim Vergleich von FXI-Hemmern mit DOACs keine signifikanten Unterschiede in Bezug auf schwere Blutungen oder Wirksamkeitsendpunkte festgestellt.
Zukünftige Entwicklungen der FXI-Hemmer
Die verfügbaren klinischen Daten der FXI-Hemmer zeigen vielversprechende Ergebnisse in verschiedenen klinischen Szenarien, insbesondere im Hinblick auf ihr Sicherheitsprofil. Es gibt jedoch noch bedeutende, ungeklärte Fragen bezüglich der Wirksamkeit und Dosierung in Studien mit grossen Patientenzahlen und bezüglich der Dosisanpassungen unter bestimmten Bedingungen (Niereninsuffizienz). Die Überlegenheit oder mindestens die Nicht-Unterlegenheit im (direkten) Vergleich zu dokumentiert wirksamen Antikoagulantien (DOACs, LMWH) nachzuweisen, wird die grösste Herausforderung darstellen. Die laufenden, grossen Phase-III-Studien werden die Antworten auf diese Fragen liefern.
Zusätzlich könnten FXI-Hemmer aufgrund ihrer Wirksamkeit in der Kontaktaktivierung auch bei Patienten mit hohem Thromboserisiko aufgrund mechanischer Geräte oder wegen Blutkontakt an künstlichen Oberflächen eine sehr nützliche Rolle spielen (bspw. mechanische Herzklappen, Dialyse-Shunts, ECMO-Therapie, liegende zentrale Venenverweilkanülen und Port-à Caths oder ventrikuläre Unterstützungsgeräten und «künstliche Kontaktflächen-assoziierte Thrombosen» (ACSAT). In solchen Fällen, in denen DOACs nur begrenzt wirksam oder kontraindiziert sind, könnten FXI-Hemmer eine interessante Option bieten (25). Entsprechend wurde auch festgestellt, dass hier FXII, welcher eine wichtige Rolle in der Kontakt-Aktivierung spielt, bei ACSAT vorteilhaft sein könnte (26). Eine Phase-II-Studie mit Xisomab 3G3, einem FXII-Hemmer, läuft derzeit, um seine Rolle bei der Prävention von Katheter-assoziierter Thrombose bei Krebspatienten, die eine Chemotherapie erhalten, zu untersuchen [NCT04465760].
Kurze Zusammenfassung aus der Publikation im Cardiovascular Medicine 2024: P. Lee and JH. Beer, Factor XI Inhibition: A New Therapeutic Principle in Anticoagulation, Cardiovascular Medicine 2024, in press.]
Copyright bei Aerzteverlag medinfo AG
Labor für Molekulare Kardiologie
Universität Zürich
Wagistrasse 12
8952 Schlieren
Leiter Gerinnungssprechstunde Kantonsspital Baden, 5404 Baden
Labor für Molekulare Kardiologie, Leiter Plättchenforschung,
Universität Zürich
Wagistrasse 12
8952 Schlieren
hansjuerg.beer@ksb.ch
JHB deklariert die Unterstützung durch den schweizerischen Nationalfonds (No. 324730_163339), Schweiz. Herzstiftung, Kardio-Stiftung Baden, Fortschungsbeiträge von Bayer und Vortrags-Honorare von Astra-Zeneca, Sanofi-Aventis und Daiichi Sankyo an die Institution. PL deklariert die Unterstützung durch die Jubiläumsstiftung SwissLife, die Theodor und Ida Herzog-Egli-Stiftung und die Schweiz. Herzstiftung.
◆ Die FXI-Hemmung ist ein vielversprechender Ansatz zur Verringerung von Thrombosen bei gleichzeitiger Minimierung des Blutungsrisikos.
◆ FXI-Inhibitoren aus Phase-II-Studien zeigten einen positiven Trend zur Reduzierung von Blutungsrisiken. Laufende Phase-III-Studien werden wichtige Einblicke in die Wirksamkeit von FXI-Inhibitoren in den verschiedenen klinischen Szenarien liefern.
◆ Bestimmte Patientengruppen, einschliesslich solcher mit mechanischen Geräten und diejenigen mit Blutkontakt mit künstlichen Oberflächen, könnten von FXI-Inhibitoren speziell profitieren und werden derzeit intensiv erforscht.
1. Caterina, R. D., Prisco, D. & Eikelboom, J. W. Factor XI inhibitors: cardiovascular perspectives. Eur. Hear. J. 44, 280–292 (2022).
2.Harrington, J., Piccini, J. P., Alexander, J. H., Granger, C. B. & Patel, M. R. Clinical Evaluation of Factor XIa Inhibitor Drugs JACC Review Topic of the Week. J Am Coll Cardiol 81, 771–779 (2023).
3.Greco, A. et al. Pharmacology and Clinical Development of Factor XI Inhibitors. Circulation 147, 897–913 (2023).
4.Cohen, O. & Ageno, W. Coming soon to a pharmacy near you? FXI and FXII inhibitors to prevent or treat thromboembolism. Hematology 2022, 495–505 (2022).
5.Badimon, J. J., Escolar, G. & Zafar, M. U. Factor XI/XIa Inhibition: The Arsenal in Development for a New Therapeutic Target in Cardio- and Cerebrovascular Disease. J Cardiovasc Dev Dis 9, 437 (2022).
6.Eikelboom, J. W. et al. Dabigatran versus Warfarin in Patients with Mechanical Heart Valves. New Engl. J. Medicine 369, 1206–1214 (2013).
7.Parker, K. et al. A systematic review of the efficacy and safety of anticoagulants in advanced chronic kidney disease. J. Nephrol. 35, 2015–2033 (2022).
8.Shirejini, S. Z. et al. Current and future strategies to monitor and manage coagulation in ECMO patients. Thromb. J. 21, 11 (2023).
9.Emsley, J., McEwan, P. A. & Gailani, D. Structure and function of factor XI. Blood 115, 2569–2577 (2010).
10.Cushman, M., O’Meara, E. S., Folsom, A. R. & Heckbert, S. R. Coagulation factors IX through XIII and the risk of future venous thrombosis: the Longitudinal Investigation of Thromboembolism Etiology. Blood 114, 2878–2883 (2009).
11.Siegerink, B., Rosendaal, F. R. & Algra, A. Antigen levels of coagulation factor XII, coagulation factor XI and prekallikrein, and the risk of myocardial infarction and ischemic stroke in young women. J. Thromb. Haemost. 12, 606–613 (2014).
12. Colucci, M. et al. Reduced fibrinolytic resistance in patients with factor XI deficiency. Evidence of a thrombin-independent impairment of the thrombin-activatable fibrinolysis inhibitor pathway. J. Thromb. Haemost. 14, 1603–1614 (2016).
13.Calderara, D. B., Zermatten, M., Aliotta, A. & Alberio, L. How to Capture the Bleeding Phenotype in FXI-Deficient Patients. Hämostaseologie 40, 491–499 (2020).
14.Preis, M. et al. Factor XI deficiency is associated with lower risk for cardiovascular and venous thromboembolism events. Blood 129, 1210–1215 (2017).
15.Yang, D. T., Flanders, M. M., Kim, H. & Rodgers, G. M. Elevated Factor XI Activity Levels Are Associated With an Increased Odds Ratio for Cerebrovascular Events. Am. J. Clin. Pathol. 126, 411–415 (2006).
16.Campello, E., Simioni, P., Prandoni, P. & Ferri, N. Clinical Pharmacology of Factor XI Inhibitors: New Therapeutic Approaches for Prevention of Venous and Arterial Thrombotic Disorders. J Clin Medicine 11, 6314 (2022).
17.Presume, J., Ferreira, J., Ribeiras, R. & Mendes, M. Achieving higher efficacy without compromising safety with factor XI inhibitors versus low molecular weight heparin for the prevention of venous thromboembolism in major orthopedic surgery—Systematic review and meta-analysis. J Thromb Haemost 20, 2930–2938 (2022).
18.Walsh, M. et al. Phase 2 Study of the Factor XI Antisense Inhibitor IONIS-FXIRx in Patients With ESRD. Kidney Int Reports 7, 200–209 (2022).
19.Lorentz, C. U. et al. The contact activation inhibitor AB023 in heparin-free hemodialysis: results of a randomized phase 2 clinical trial. Blood 138, 2173–2184 (2021).
20.Piccini, J. P. et al. Safety of the oral factor XIa inhibitor asundexian compared with apixaban in patients with atrial fibrillation (PACIFIC-AF): a multicentre, randomised, double-blind, double-dummy, dose-finding phase 2 study. Lancet 399, 1383–1390 (2022).
21.Shoamanesh, A. et al. Factor XIa inhibition with asundexian after acute non-cardioembolic ischaemic stroke (PACIFIC-Stroke): an international, randomised, double-blind, placebo-controlled, phase 2b trial. Lancet 400, 997–1007 (2022).
22.Sharma, M. et al. Rationale and design of the AXIOMATIC-SSP phase II trial: Antithrombotic treatment with factor XIa inhibition to Optimize Management of Acute Thromboembolic events for Secondary Stroke Prevention. J. Stroke Cerebrovasc. Dis. 31, 106742 (2022).
23.Rao, S. V. et al. A Multicenter, Phase 2, Randomized, Placebo-Controlled, Double-Blind, Parallel-Group, Dose-Finding Trial of the Oral Factor XIa Inhibitor Asundexian to Prevent Adverse Cardiovascular Outcomes Following Acute Myocardial Infarction. Circulation 146, 1196–1206 (2022).
24.Galli, M. et al. Factor XI Inhibitors in Early Clinical Trials: A Meta-analysis. Thromb Haemostasis (2023)
25.Tillman, B. & Gailani, D. Inhibition of Factors XI and XII for Prevention of Thrombosis Induced by Artificial Surfaces. Semin Thromb Hemost 44, 060–069 (2017).
26.Konrath, S., Mailer, R. & Renné, T. Mechanism, Functions, and Diagnostic Relevance of FXII Activation by Foreign Surfaces. Hämostaseologie 41, 489–501 (2021).
27.Büller, H. R. et al. Factor XI Antisense Oligonucleotide for Prevention of Venous Thrombosis. New Engl J Med 372, 232–240 (2015).
28.Weitz, J. I. et al. Effect of Osocimab in Preventing Venous Thromboembolism Among Patients Undergoing Knee Arthroplasty. Jama 323, 130–139 (2020).
29.Verhamme, P. et al. Abelacimab for Prevention of Venous Thromboembolism. New Engl J Med 385, 609–617 (2021).
30.Weitz, J. I. et al. Milvexian for the Prevention of Venous Thromboembolism. New Engl J Med 385, 2161–2172 (2021).
der informierte @rzt
- Vol. 14
- Ausgabe 2
- Februar 2024