- Zöliakie
Die Zöliakie ist eine durch das Immunsystem vermittelte immunologisch vermittelte, lebenslange, entzündliche Erkrankung des Dünndarms. Zöliakie-Betroffene haben eine genetische Prädisposition und die Erkrankung hat mit sowohl intestinalen als auch extraintestinalen Symptomen eine sehr grosse Variabilität, weshalb die Erkrankung auch als das «Chamäleon der Gastroenterologie» bezeichnet wird. Die Erkrankung betrifft ca. 1% der Bevölkerung und bestimmte Risikopopulationen haben eine höhere Prävalenz der Zöliakie, dazu zählen u.a. Verwandte ersten und zweiten Grades mit Zöliakie, Typ-1-Diabetes, autoimmuner Thyreoiditis sowie Down- und Turner-Syndrom. Die Diagnose der Zöliakie beruht auf der Anamnese, der klinischen Untersuchung, Serologie und der Histologie aus dem Duodenum. Die einzig bisher verfügbare Therapie ist eine strikte lebenslange glutenfreie Ernährung.
Celiac disease is an immune-mediated, lifelong, inflammatory disease of the small intestine. Celiac disease sufferers have a genetic predisposition and the disease has a wide variability with both intestinal and extraintestinal symptoms which is why the disease is also referred to as the «chameleon of gastroenterology». The disease affects approximately 1% of the population, and certain at-risk populations have a higher prevalence of celiac disease, including first- and second-degree relatives with celiac disease, type 1 diabetes, autoimmune thyroiditis, and Down syndrome and Turner syndrome. The diagnosis of celiac disease is based on history, clinical examination, serology, and histology from the duodenum. The only therapy available to date is a strict lifelong gluten-free diet.
Key Words: Celiac disease, gastroenterology, genetic predisposition
Die Zöliakie ist eine lebenslange, immunologisch vermittelte, chronisch entzündliche Erkrankung des Dünndarms. Gluten ist eine Proteinkomponente von verschiedenen Getreidesorten, wozu unter anderem Roggen, Weizen, Gerste und Dinkel zählen. Die Aufnahme von Gluten führt bei der Erkrankung zu einer Schädigung des Dünndarms, welche durch Schleimhautentzündung, Kryptenhyperplasie und Zottenatrophie gekennzeichnet ist. Die Erkrankung betrifft genetisch prädisponierte Individuen (1) und der Dünndarmschaden kann im Verlauf zu einer Malabsorption von Nährstoffen und damit verbundenen Komplikationen führen (2).
Die erste neuere Beschreibung der Zöliakie geht auf das Jahr 1888 zurück durch den englischen Arzt Samuel Gee. Erste Einblicke in die Pathogenese der Erkrankung wurden während des Zweiten Weltkrieges durch den Arzt Willem K. Dicke ermöglicht. Er beobachtete, dass sich der Zustand von Patienten mit chronischer Diarrhoe verbesserte, wenn in Zeiten der Nahrungsmittelknappheit Brot durch nicht weizenhaltige Lebensmittel wie Kartoffeln ersetzt wurde (3). Die ersten Beschreibungen des durch Gluten vermittelten Dünndarmschadens erfolgten 1954 durch JW Paulley (4). Lange Zeit galt die Zöliakie als eine seltene Kindererkrankung, im Verlauf wurde jedoch eine zunehmende Verschiebung des Diagnosealters in Richtung Erwachsenenalter beobachtet (5). Durch eine verbesserte Diagnostik der Erkrankung mit Entwicklung von Nachweismethoden für Endomysium- und Transglutaminase-Antikörpern kam es zu einer signifikanten Zunahme der Diagnose der Zöliakie in den 1980er und 1990er Jahren.
Epidemiologie
Durch die grosse Variabilität des klinischen Erscheinungsbildes und oft nur milden Symptomen kam es in der Vergangenheit zu einer Unterdiagnose der Erkrankung. Durch die Entwicklung serologischer Tests konnte die Einschätzung der Inzidenz und Prävalenz der Erkrankung jedoch stark verbessert werden (6, 7). In einer finnischen Studie konnte eine Prävalenz bei Schulkindern von 1% nachgewiesen werden (8). Bei Erwachsenen wurden in den USA und in europäischen Ländern ähnliche Prävalenzen festgestellt (9-13).
Es konnte ein deutlicher Anstieg der Prävalenz der Zöliakie in den letzten Jahrzehnten beobachtet werden. In einer finnischen Studie liess sich über ungefähr 20 Jahre eine Verdopplung der Prävalenz nachweisen. In den USA zeigte sich eine 4- bis 4,5-fache Zunahme der Prävalenz über die letzten 50 Jahre (14-15).
Galt die Erkrankung früher in Asien und Afrika als selten, kam es in diesen Regionen zu einer steigenden Prävalenz bedingt unter anderem durch die Globalisierung des Weltmarktes, welcher zu einer Änderung der Ernährungsgewohnheiten in den Entwicklungsländern geführt hat. Während früher die Ernährung in diesen Ländern auf glutenfreien Getreidesorten wie Reis und Mais beruhte, wurden mit der Zeit zunehmend weizenhaltige Lebensmittel in die Ernährung integriert (16).
Bei bestimmten Risikopopulationen wie z.B. Typ-1-Diabetes, autoimmune Thyreoiditis, Verwandte ersten und zweiten Grades mit Zöliakie sowie Down- und Turner-Syndrom ist eine höhere Prävalenz für Zöliakie zu verzeichnen (17).
Im Vergleich mit Erwachsenen kommt es bei Kindern mit Zöliakie häufiger zu Diarrhoe, Bauchschmerzen und Zeichen der Malabsorption und es ist eine Wachstumsverzögerung zu beobachten (18). Bei erwachsenen Zöliakie-Patienten kommt es eher zu extraintestinalen Manifestationen der Erkrankung wie Eisenmangelanämie und Osteoporose und seltener zu Darmsymptomen.
Bei der Geschlechterverteilung ist eine weibliche Dominanz zu verzeichnen von ca. 2-3 : 1 (19). Des Weiteren ist bei Frauen die Wahrscheinlichkeit einer symptomatischen Zöliakie höher als bei männlichen Zöliakie-Patienten (20).
Pathogenese
Der Hauptfaktor bei der Pathogenese der Zöliakie ist die Exposition gegenüber Gluten. Daneben werden weitere umweltbedingte und genetische Faktoren in der Pathogenese der Zöliakie unterschieden.
Die adaptive als auch die angeborene Immunantwort führen zu den pathologischen Veränderungen des Dünndarms, die durch intraepitheliale Lymphozytose, Kryptenhyperplasie und Zottenatrophie gekennzeichnet sind.
Bei der Pathogenese der Zöliakie spielt die angeborene Immunantwort eine entscheidende Rolle. Diese spielt sich im Epithel der Darmschleimhaut ab und führt unter anderem zu einer erhöhten Produktion von Zytokinen. Im Rahmen dieser Immunreaktion differenzieren sich die intraepithelialen Lymphozyten dann zu zytotoxischen CD8+-T-Zellen (21).
Neben der angeboreren Immunantwort spielt auch die adaptive Immunantwort eine wichtige Rolle. Dadurch, dass Gluten im Gastrointestinaltrakt nicht vollständig enzymatisch gespalten wird, kommt es zu einer adaptiven Immunantwort. Das primäre Autoantigen der Zöliakie ist das Enzym Transglutaminase (TTG), welches Gliadinmoleküle deamidiert (22). Dadurch wird die Immunogenität von Gliadin erhöht, anschliessend kommt es zu einer Bindung von Gliadin über HLA-DQ2- oder HLA-DQ8-Moleküle an antigenpräsentierende Zellen. Diese Gliadinpeptide werden dann CD4 + -T-Zellen präsentiert (23, 24). Im weiteren Verlauf der Immunkaskade sezernieren die aktivierten T-Helferzellen Zytokine wie Tumor necrosis factor α, Interferon γ und IL-2. Diese lösen unter anderem eine Expression von Matrixmetalloproteinasen in Makrophagen und Fibroblasten aus, welche dann zu einem direkten Schaden der Mukosa im Dünndarm führen (25).
Zusätzlich werden auch verschiedene Umweltfaktoren bei der Pathogenese der Zöliakie diskutiert. Es wird angenommen, dass Infektionen, das Stillen und Veränderungen der Darmflora Faktoren in der Pathogenese der Zöliakie eine Rolle spielen (26-28).
Bezüglich der Genetik wird nach aktuellem Wissensstand angenommen, dass fast 100% aller Zöliakie-Patienten Träger der Varianten der HLA-Klasse-II-Gene HLA-DQA1 und HLA-DQB1 sind. Diese kodieren für die α- und β-Kette der Heterodimer-Proteine DQ2 und DQ8 und sind mit der Zöliakie assoziiert (29). Da ca. ein Drittel der Allgemeinbevölkerung Träger von DQ2 und/oder DQ8 sind, ist der HLA-Test allein nicht für die Diagnose von Zöliakie ausreichend. Aufgrund seines sehr hohen negativen Vorhersagewerts von fast 100% kann dieser Test jedoch zum Ausschluss der Zöliakie verwendet werden.
Diagnose
Die Diagnose der Zöliakie stützt sich auf die Kombination von Anamnese, klinischer Untersuchung, Serologie und der histologischen Untersuchung von Duodenalbiopsien, welche im Rahmen einer Ösophagogastroduodenoskopie entnommen werden. Bei klinischem Verdacht auf eine Zöliakie sollte zunächst immer eine serologische Untersuchung erfolgen. Die Gewebetransglutaminase-IgA-Antikörper (tTG) (ELISA) weist eine gute Spezifität und Sensitivität auf, um eine Zöliakie zuverlässig zu dedektieren. Die Sensitivität beträgt 74% - 100% und die Spezifität 78% - 100% (30, 31). Wichtig ist jedoch zu wissen, dass die serologischen Tests nur unter einer glutenhaltigen Ernährung aussagekräftig sind, da diese sonst falsch-negativ ausfallen können. Bei der serologischen Untersuchung muss zudem auch eine Bestimmung des Gesamt-IgA erfolgen, um einen IgA-Mangel auszuschliessen, insbesondere da bei Zöliakie-Patienten ein selektiver IgA Mangel häufiger als in der Allgemeinbevölkerung anzutreffen ist. Bei Vorliegen eines IgA-Mangels sind die tTG-IgA-Antikörper nicht zuverlässig nachzuweisen.
Liegt eine positive Zöliakie-Serologie vor, sollte eine Endoskopie mit Biopsieentnahme aus dem Duodenum erfolgen, um die Diagnose zu bestätigen. Es wird empfohlen, mindestens vier Biopsien aus dem distalen Duodenum und zwei Biopsien aus dem Bulbus duodeni zu entnehmen. Bei pädiatrischen Patienten muss nicht in allen Fällen eine histologische Sicherung erfolgen: die Diagnose einer Zöliakie kann gestellt werden, wenn Symptome, die auf eine Zöliakie hinweisen und zusätzlich ein positiver EmA-Test und ein hoher tTG-IgA-Wert (≥ 10-fache der Obergrenze des Normalwerts) vorliegen (32, 33).
In besonderen Situationen kann eine HLA-Diagnostik erfolgen. Man geht davon aus, dass bei so gut wie 100% der Zöliakie-Patienten die Haplotypen HLA-DQ2 oder DQ8 vorhanden sind. Da die Haplotypen aber auch in ca. 30% der Normalbevölkerung nachweisbar sind, hat der Gentest einen niedrigen positiven Vorhersagewert von nur 12%. Daher ist die HLA-DQ2 und -DQ8 Bestimmung nur geeignet eine Zöliakie auszuschliessen (34). Die Untersuchung kann bei Verdacht auf Zöliakie bei Patienten unter bereits erfolgter glutenfreier Ernährung hilfreich sein, bei denen eine mehrwöchige Gluten-Belastung vor der serologischen Bestimmung nicht möglich oder nicht gewünscht ist, oder falls nicht-eindeutige histologische Befunde aus dem Dünndarm vorliegen.
Da bei bestimmten Risikopopulationen, wie Verwandte ersten und zweiten Grades mit Zöliakie, Patienten mit autoimmuner Thyreoiditis, Patienten mit Typ-1-Diabetes sowie Down- und Turner-Syndrom eine erhöhte Zöliakie-Prävalenz besteht (17), empfiehlt sich bei diesen zumindest einmalig eine serologische Bestimmung von Gesamt-IgA und tTG-IgA-Antikörpern.
Klinik
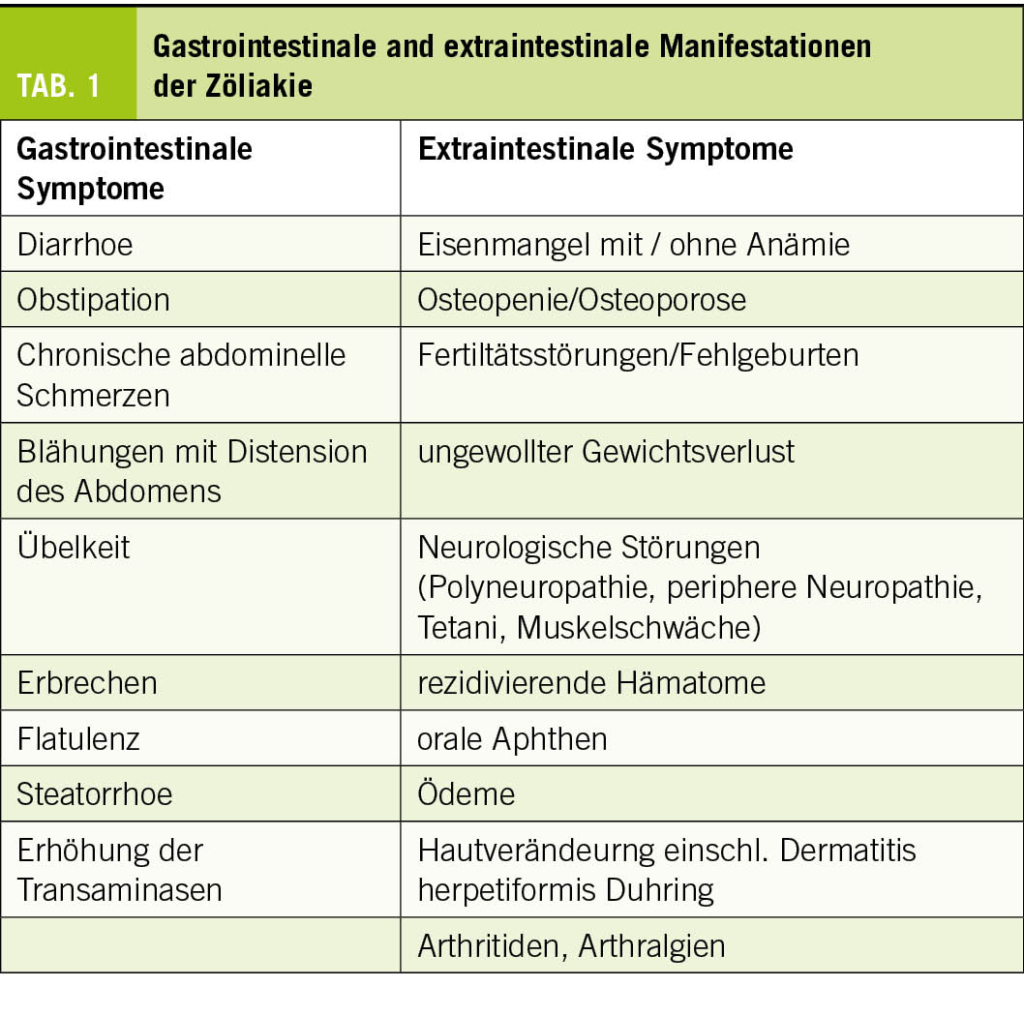
Zöliakie wird oft als Chamäleon der Gastroenterologie bezeichnet, da die klinischen Symptome und deren Schweregrad individuell sehr unterschiedlich ausgeprägt sein können. Dies erschwert die Definition und Charakterisierung typischer Symptome und kann zu einer Verzögerung bei der Diagnosestellung führen (35). Insbesondere bei Frauen kommt es zu einer signifikanten Verzögerung, die dem sogenannten «Doctor’s Delay» zuzuschreiben ist; bei Frauen werden die unspezifischen Symptome von Fachpersonen vermutlich häufig anderen Ursachen zugeschrieben. Während die Zöliakie früher als eine Erkrankung im Kindesalter angesehen wurde, erfolgt die Diagnosestellung heute häufiger im Erwachsenenalter (zwischen 40 und 59 Jahren) und auch bei älteren Menschen (35). Die Symptome der Zöliakie können in gastrointestinale und extraintestinale Manifestationen unterteilt werden. Tabelle 1 gibt einen Überblick über die Vielfalt der klinischen Präsentation.
Zu den klassischen gastrointestinalen Symptomen zählen Diarrhoe, Blähungen mit abdomineller Distension, Flatulenz oder Steatorrhoe, die auf eine Malabsorption hindeuten können. Diese Malabsorption kann wiederum die Anämie und ungewollten Gewichtsverlust verursachen und im Kindesalter zu Gedeihstörungen führen. Neurologische Symptome sind seltener, können aber durch einen Mangel an B-Vitaminen (insbesondere B1, B6, B12) verursacht werden und sich als unspezifische Nausea oder Kopfschmerzen bis hin zu peripherer Neuropathie oder Polyneuropathie manifestieren (36). Bis zu 50% der Patienten mit Zöliakie zeigen letztere Symptome, die sich als Kribbeln, Brennen und Taubheitsgefühl in den Händen und Füssen bemerkbar machen können (37). Mit Beginn einer glutenfreien Ernährung und der entsprechenden Supplementation mit einem hochdosierten B-Komplex können diese Symptome oft vollständig regredieren.
Die Osteopenie und Osteoporose sind häufige extraintestinale Manifestationen der Zöliakie und werden bei bis zu 75% aller Betroffenen diagnostiziert. Diese Erkrankungen sind auf eine Malabsorption von Vitamin D und Kalzium zurückzuführen und können auch ohne gleichzeitige gastrointestinale Symptome auftreten (38-40). Das Frakturrisiko bei Patienten mit Zöliakie wird um 40% höher geschätzt als bei alters- und geschlechtsangepassten gesunden Kontrollpersonen (41). Das Ausmass der Osteopenie/Osteoporose bei Erstdiagnose der Zöliakie korreliert ebenfalls mit dem Ausmass der Zottenschädigung (42). Eine DEXA nach der Diagnosestellung der Zöliakie ist deswegen bei adulten Betroffenen empfehlenswert.
Bei unbehandelter Zöliakie treten gehäuft folgende Mangelerscheinungen auf: Eisen, Vitamin B12, Folsäure, Vitamin A, B6, Vitamin D, Kupfer und Zink (43). Eisenmangel wird durch okkulten Blutverlust der Dünndarmschleimhaut und die gleichzeitige Malabsorption verursacht. Die anderen Nährstoffe werden auf Grund der verringerten Resorptionsfläche der Zottenatrophie nur mangelhaft aufgenommen. So zeigen Zöliakie-Betroffene mit Eisenmangelanämie auffallend häufig eine ausgeprägte Zottenatrophie (44). Bei Vorliegen einer Eisenmangelanämie ist immer eine Eisensubstitution empfohlen. Weiter soll die probatorische Behandlung von Mangelerscheinungen durch den Einsatz eines Multivitaminsupplements (mit oder ohne Eisen) bei Diagnosestellung erfolgen.
Als Hautmanifestationen der Zöliakie gelten die Dermatitis herpetiformis Duhring sowie orale und pharyngeale Aphthen. Die Dermatitis herpetiformis Duhring ist eine Autoimmunerkrankung, die mit Blasenbildung der Haut einhergeht und sich durch herpesartige gruppierte Bläschen zeigt. Die Betroffenen leiden häufig unter starkem Juckreiz und Brennen. Betroffen sind häufig Ellbogen, Knie, und Gesäss. Der Brustkorb und die Kopfhaut sind ebenso häufig betroffen. Männer sind häufiger von dieser Hauterkrankung betroffen als Frauen. Als Pathogenese wird eine Ablagerung von Komplexen aus epidermaler Transglutaminase (eTG) und eTG-gerichtetem IgA an der Basalmembran beschrieben (45). Bei einem Grossteil der Betroffenen mit Dermatitis herpetiformis Duhring wird eine subklinische Zöliakie als Grunderkrankung diagnostiziert. Unter einer glutenfreien Ernährung ist eine vollständige Remission dieser Hauterkrankung zu erwarten (46).
Zusätzlich zur intestinalen Manifestation kann auch eine Gelenkbeteiligung auftreten. Zöliakie-Patienten zeigen häufiger frühe Anzeichen einer Arthritis in den unteren Gliedmassen im Vergleich zur Normalbevölkerung und es treten gehäuft Arthralgien auf.
Bei Frauen mit unerklärter Infertilität ist die Prävalenz von undiagnostizierter Zöliakie erhöht. Es wurden auch Fehlgeburten bei undiagnostizierter Zöliakie beschrieben, weshalb eine Zöliakieabklärung in diesen Fällen durchgeführt werden sollte (47, 48).
Die seltenste Manifestation der Zöliakie ist die sogenannte «Zöliakie-Krise». Dabei kommt es zu einer akuten klinischen Verschlechterung mit rascher Progression von Durchfall und Erbrechen. Die damit einhergehende Dehydrierung, verschiedene Elektrolytstörungen und die deutliche Abnahme des Körpergewichts führen meist zu einer stationären Betreuung (49, 50).
Therapie
Noch immer ist eine lebensbegleitende, strikt glutenfreie Ernährung die einzige verfügbare Therapieoption bei Zöliakie. Daher sollten alle Patientinnen und Patienten nach der Diagnosestellung eine qualifizierte und auf Zöliakie spezialisierte Ernährungsberatung erhalten. Eine solche Fachperson kann über die Fachgruppe Zöliakie (https://zoeliakiernaehrungsberatung.ch) vermittelt werden.
Ziele der glutenfreien Diät sind die vollständige histologische Remission, die Verbesserung der gastrointestinalen oder extraintestinalen Beschwerden, die Behandlung als auch Prävention von Nährstoffdefiziten und deren Komplikationen sowie eine Verbesserung der ernährungsbezogenen Lebensqualität. Insbesondere Letzteres stellt in der Ernährungstherapie eine Herausforderung dar, da diese einschränkende Ernährungsform verschiedenste Lebensbereiche tangiert und auch psychosoziale Herausforderungen birgt (51).
Wichtig zu wissen ist der Umstand, dass es mehrere Monate dauern kann, bis sich die Symptome nach Beginn einer glutenfreien Ernährung zurückbilden. Oftmals dauert es ebenso bis zu einem Jahr, bis sich die histologischen Veränderungen im Dünndarm sowie die Serologie vollständig normalisieren. Wenn trotz adhärenter glutenfreier Ernährung unspezifische Magen-Darm-Beschwerden persistieren, lohnt es sich, auch andere Trigger für die Symptome zu evaluieren (52, 53). Bei vielen Zöliakiebetroffenen besteht anfangs eine sekundäre Laktoseintoleranz, (und interessanterweise findet sich auch bei Patienten mit einer Laktoseintoleranz überaus häufig eine Zöliakie (54)), die mittels einer lactosearmen Ernährung gut kontrolliert werden kann. Es empfiehlt sich Milch, Joghurt und Frischkäse durch lactosearme Alternativen zu ersetzen, Käse kann weiterhin uneingeschränkt konsumiert werden, da er keine klinisch relevante Lactosemenge enthält und eine gute Calciumquelle darstellt. Oftmals ist eine Regression der Beschwerden unter diesen einfachen Anpassungen möglich (55).
Auch andere funktionelle Beschwerden sind bei Betroffenen gehäuft vorhanden, die mittels des FODMAP-Konzepts ergänzend zur glutenfreien Ernährung erfolgreich behandelt werden können (56).
Innerhalb der Ernährungstherapie ist es besonders wichtig, Fragen zu unbeabsichtigten Kontaminationen mit Gluten zu besprechen sowie zu klären, ob und wann kontrolliert glutenfreier Hafer in die Ernährung eingeführt werden soll.
In den letzten Jahren hat sich in beiden Fragen ein Umdenken vollzogen: Glutenfreier Hafer wird mittlerweile generell als sicher für Zöliakiebetroffene eingestuft (57), und bereits nach der Diagnosestellung kann er in die Ernährung eingeführt werden (58). Allerdings empfehlen internationale Leitlinien eine Wartezeit von 6 Monaten nach Diagnosestellung und/oder vollständiger Remission, da es einige wenige Fallbeschreibungen gibt, die eine Sensitivität von Zöliakiebetroffenen gegenüber Hafer gezeigt haben (59). In der Schweiz ist kein Fall einer Hafer-sensitiven Zöliakie bekannt.
Aktuell geht man davon aus, dass Kontaminationen bei der Zubereitung von glutenfreien Gerichten weitaus seltener sind als bisher angenommen. Vor allem Mehlstaub kann zu relevanten Kontaminationen führen, während die Verwendung von denselben Kochutensilien unproblematisch ist (60, 61).
Schliesslich haben sich auch glutenfreie Spezialprodukte in den letzten 10 Jahren deutlich verändert. Der Zucker- und Fettzusatz wurde reduziert, und es besteht ein Trend, vermehrt auf vollwertige glutenfreie Getreide zurückzugreifen, anstelle von nährstoffarmen Stärkemehlen und Verdickungsmitteln. Diese Entwicklungen sind sehr erfreulich und erleichtern die Durchführung dieser doch einschränkenden Ernährungsform (62, 63).
Prognose
Wenn die Zöliakie rechtzeitig diagnostiziert und korrekt behandelt wird, ist die Prognose der Erkrankung sehr gut (64). Erfreulicherweise sprechen mehr als 90% der Zöliakie-Betroffenen auf eine glutenfreie Diät an. Etwa 1% aller Erkrankten entwickeln jedoch eine refraktäre Zöliakie. Diese ist gekennzeichnet durch eine fortbestehende Zottenatrophie und intestinale oder extraintestinale Symptome, trotz einer korrekt durchgeführten glutenfreien Diät über einen Zeitraum von mindestens 12 Monaten (65). Die Diagnosestellung und Behandlung der refraktären Zöliakie gestaltet sich oft herausfordernd und sollte an spezialisierten Zentren vorgenommen werden, um den Betroffenen ebenso eine gute Lebensqualität zu ermöglichen.
Insgesamt zeigt sich, dass die Zöliakie eine Systemerkrankung ist, die verschiedene Organsysteme betreffen kann und somit ein breites Spektrum an Symptomen hervorruft. Eine frühzeitige Diagnose und konsequente glutenfreie Ernährung können jedoch dazu beitragen, eine Vielzahl von Komplikationen und Folgeerkrankungen zu vermeiden.
Copyright bei Aerzteverlag medinfo AG
– GastroZentrum Hirslanden, Witellikerstrasse 40, 8008 Zürich
– Zöliakie Zentrum am GastroZentrum Hirslanden, Zürich
– Klinik für Gastroenterologie und Hepatologie, Universitätsspital Zürich, Rämistrasse 100, 8091 Zürich
– Ernährungstherapie Basel, Klosterberg 11, 4051 Basel
– GastroZentrum Hirslanden, Witellikerstrasse 40, 8008 Zürich
– Zöliakie Zentrum am GastroZentrum Hirslanden, Zürich
– Ernährungstherapie Basel, Klosterberg 11, 4051 Basel
diana@foodonrecord.com
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Green PH, Cellier C. Celiac disease. N Engl J Med 2007;357(17):1731-43. doi: 10.1056/NEJMra071600 [published Online First: 2007/10/26]
2. Green PH, Krishnareddy S, Lebwohl B. Clinical manifestations of celiac disease. Dig Dis 2015;33(2):137-40. doi: 10.1159/000370204 [published Online First: 2015/05/01]
3. Booth C. History of celiac disease. BMJ 1989;298:527.
4. Paulley JW. Observation on the aetiology of idiopathic steatorrhoea; jejunal and lymph-node biopsies. Br Med J 1954;2(4900):1318-21. doi: 10.1136/bmj.2.4900.1318 [published Online First: 1954/12/04]
5. Riddle MS, Murray JA, Porter CK. The incidence and risk of celiac disease in a healthy US adult population. Am J Gastroenterol 2012;107(8):1248-55. doi: 10.1038/ajg.2012.130 [published Online First: 2012/05/16]
6. Green PH, Lebwohl B, Greywoode R. Celiac disease. J Allergy Clin Immunol 2015;135(5):1099-106; quiz 107. doi: 10.1016/j.jaci.2015.01.044 [published Online First: 2015/05/10]
7. Lebwohl B, Sanders DS, Green PHR. Coeliac disease. Lancet 2018;391(10115):70-81. doi: 10.1016/S0140-6736(17)31796-8 [published Online First: 2017/08/02]
8. Maki M, Mustalahti K, Kokkonen J, et al. Prevalence of Celiac disease among children in Finland. N Engl J Med 2003;348(25):2517-24. doi: 10.1056/NEJMoa021687 [published Online First: 2003/06/20]
9. Di Sabatino A, Corazza GR. Coeliac disease. Lancet 2009;373(9673):1480-93. doi: 10.1016/S0140-6736(09)60254-3 [published Online First: 2009/04/28]
10. Dube C, Rostom A, Sy R, et al. The prevalence of celiac disease in average-risk and at-risk Western European populations: a systematic review. Gastroenterology 2005;128(4 Suppl 1):S57-67. doi: 10.1053/j.gastro.2005.02.014 [published Online First: 2005/04/13]
11. West J, Logan RF, Hill PG, et al. Seroprevalence, correlates, and characteristics of undetected coeliac disease in England. Gut 2003;52(7):960-5. doi: 10.1136/gut.52.7.960 [published Online First: 2003/06/13]
12. Fasano A, Berti I, Gerarduzzi T, et al. Prevalence of celiac disease in at-risk and not-at-risk groups in the United States: a large multicenter study. Arch Intern Med 2003;163(3):286-92. doi: 10.1001/archinte.163.3.286 [published Online First: 2003/02/13]
13. Lebwohl B, Green P. Risk of celiac disease according to HLA haplotype and country. N Engl J Med 2014;371(11):1073-4. doi: 10.1056/NEJMc1409252 [published Online First: 2014/09/11]
14. Rubio-Tapia A, Kyle RA, Kaplan EL, et al. Increased prevalence and mortality in undiagnosed celiac disease. Gastroenterology 2009;137(1):88-93. doi: 10.1053/j.gastro.2009.03.059 [published Online First: 2009/04/14]
15. Lohi S, Mustalahti K, Kaukinen K, et al. Increasing prevalence of coeliac disease over time. Aliment Pharmacol Ther 2007;26(9):1217-25. doi: 10.1111/j.1365-2036.2007.03502.x [published Online First: 2007/10/20]
16. Kearney J. Food consumption trends and drivers. Philos Trans R Soc Lond B Biol Sci 2010;365(1554):2793-807. doi: 10.1098/rstb.2010.0149 [published Online First: 2010/08/18]
17. Du Y, Shan LF, Cao ZZ, et al. Prevalence of celiac disease in patients with Down syndrome: a meta-analysis. Oncotarget 2018;9(4):5387-96. doi: 10.18632/oncotarget.23624 [published Online First: 2018/02/13]
18. Reilly NR, Aguilar K, Hassid BG, et al. Celiac disease in normal-weight and overweight children: clinical features and growth outcomes following a gluten-free diet. J Pediatr Gastroenterol Nutr 2011;53(5):528-31. doi: 10.1097/MPG.0b013e3182276d5e [published Online First: 2011/06/15]
19. Bardella MT, Fredella C, Saladino V, et al. Gluten intolerance: gender- and age-related differences in symptoms. Scand J Gastroenterol 2005;40(1):15-9. doi: 10.1080/00365520410008169 [published Online First: 2005/04/22]
20. Dixit R, Lebwohl B, Ludvigsson JF, et al. Celiac disease is diagnosed less frequently in young adult males. Dig Dis Sci 2014;59(7):1509-12. doi: 10.1007/s10620-014-3025-6 [published Online First: 2014/01/22]
21. Schuppan D, Junker Y, Barisani D. Celiac disease: from pathogenesis to novel therapies. Gastroenterology 2009;137(6):1912-33. doi: 10.1053/j.gastro.2009.09.008 [published Online First: 2009/09/22]
22. Dieterich W, Ehnis T, Bauer M, et al. Identification of tissue transglutaminase as the autoantigen of celiac disease. Nat Med 1997;3(7):797-801. doi: 10.1038/nm0797-797 [published Online First: 1997/07/01]
23. Molberg O, McAdam SN, Korner R, et al. Tissue transglutaminase selectively modifies gliadin peptides that are recognized by gut-derived T cells in celiac disease. Nat Med 1998;4(6):713-7. doi: 10.1038/nm0698-713 [published Online First: 1998/06/12]
24. Lundin KE, Scott H, Hansen T, et al. Gliadin-specific, HLA-DQ(alpha 1*0501,beta 1*0201) restricted T cells isolated from the small intestinal mucosa of celiac disease patients. J Exp Med 1993;178(1):187-96. doi: 10.1084/jem.178.1.187 [published Online First: 1993/07/01]
25. Daum S, Bauer U, Foss HD, et al. Increased expression of mRNA for matrix metalloproteinases-1 and -3 and tissue inhibitor of metalloproteinases-1 in intestinal biopsy specimens from patients with coeliac disease. Gut 1999;44(1):17-25. doi: 10.1136/gut.44.1.17 [published Online First: 1998/12/24]
26. Riddle MS, Murray JA, Cash BD, et al. Pathogen-specific risk of celiac disease following bacterial causes of foodborne illness: a retrospective cohort study. Dig Dis Sci 2013;58(11):3242-5. doi: 10.1007/s10620-013-2733-7 [published Online First: 2013/07/03]
27. Welander A, Tjernberg AR, Montgomery SM, et al. Infectious disease and risk of later celiac disease in childhood. Pediatrics 2010;125(3):e530-6. doi: 10.1542/peds.2009-1200 [published Online First: 2010/02/24]
28. Akobeng AK, Ramanan AV, Buchan I, et al. Effect of breast feeding on risk of coeliac disease: a systematic review and meta-analysis of observational studies. Arch Dis Child 2006;91(1):39-43. doi: 10.1136/adc.2005.082016 [published Online First: 2005/11/17]
29. Sollid LM, Lie BA. Celiac disease genetics: current concepts and practical applications. Clin Gastroenterol Hepatol 2005;3(9):843-51. [published Online First: 2005/10/20]
30. Giersiepen K, Lelgemann M, Stuhldreher N, et al. Accuracy of diagnostic antibody tests for coeliac disease in children: summary of an evidence report. J Pediatr Gastroenterol Nutr 2012;54(2):229-41. doi: 10.1097/MPG.0b013e318216f2e5 [published Online First: 2012/01/24]
31. Kurppa K, Rasanen T, Collin P, et al. Endomysial antibodies predict celiac disease irrespective of the titers or clinical presentation. World J Gastroenterol 2012;18(20):2511-6. doi: 10.3748/wjg.v18.i20.2511 [published Online First: 2012/06/02]
32. Werkstetter KJ, Korponay-Szabo IR, Popp A, et al. Accuracy in Diagnosis of Celiac Disease Without Biopsies in Clinical Practice. Gastroenterology 2017;153(4):924-35. doi: 10.1053/j.gastro.2017.06.002 [published Online First: 2017/06/19]
33. Husby S, Koletzko S, Korponay-Szabo IR, et al. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease. J Pediatr Gastroenterol Nutr 2012;54(1):136-60. doi: 10.1097/MPG.0b013e31821a23d0 [published Online First: 2011/12/27]
34. Kaukinen K, Partanen J, Maki M, et al. HLA-DQ typing in the diagnosis of celiac disease. Am J Gastroenterol 2002;97(3):695-9. doi: 10.1111/j.1572-0241.2002.05471.x [published Online First: 2002/04/02]
35. Vavricka SR, Vadasz N, Stotz M, et al. Celiac disease diagnosis still significantly delayed – Doctor’s but not patients’ delay responsive for the increased total delay in women. Dig Liver Dis 2016;48(10):1148-54. doi: 10.1016/j.dld.2016.06.016 [published Online First: 2016/07/13]
36. Kennedy DO. B Vitamins and the Brain: Mechanisms, Dose and Efficacy–A Review. Nutrients 2016;8(2):68. doi: 10.3390/nu8020068 [published Online First: 2016/02/02]
37. Chin RL, Sander HW, Brannagan TH, et al. Celiac neuropathy. Neurology 2003;60(10):1581-5. doi: 10.1212/01.wnl.0000063307.84039.c7 [published Online First: 2003/05/29]
38. Kemppainen T, Kroger H, Janatuinen E, et al. Osteoporosis in adult patients with celiac disease. Bone 1999;24(3):249-55. doi: 10.1016/s8756-3282(98)00178-1 [published Online First: 1999/03/11]
39. Shaker JL, Brickner RC, Findling JW, et al. Hypocalcemia and skeletal disease as presenting features of celiac disease. Arch Intern Med 1997;157(9):1013-6. [published Online First: 1997/05/12]
40. Mustalahti K, Collin P, Sievanen H, et al. Osteopenia in patients with clinically silent coeliac disease warrants screening. Lancet 1999;354(9180):744-5. doi: 10.1016/S0140-6736(99)01990-X [published Online First: 1999/09/04]
41. Lucendo AJ, Garcia-Manzanares A. Bone mineral density in adult coeliac disease: an updated review. Rev Esp Enferm Dig 2013;105(3):154-62. doi: 10.4321/s1130-01082013000300006 [published Online First: 2013/06/06]
42. Garcia-Manzanares A, Tenias JM, Lucendo AJ. Bone mineral density directly correlates with duodenal Marsh stage in newly diagnosed adult celiac patients. Scand J Gastroenterol 2012;47(8-9):927-36. doi: 10.3109/00365521.2012.688217 [published Online First: 2012/05/17]
43. Wierdsma NJ, van Bokhorst-de van der Schueren MA, Berkenpas M, et al. Vitamin and mineral deficiencies are highly prevalent in newly diagnosed celiac disease patients. Nutrients 2013;5(10):3975-92. doi: 10.3390/nu5103975 [published Online First: 2013/10/03]
44. Abu Daya H, Lebwohl B, Lewis SK, et al. Celiac disease patients presenting with anemia have more severe disease than those presenting with diarrhea. Clin Gastroenterol Hepatol 2013;11(11):1472-7. doi: 10.1016/j.cgh.2013.05.030 [published Online First: 2013/06/13]
45. Donaldson MR, Zone JJ, Schmidt LA, et al. Epidermal transglutaminase deposits in perilesional and uninvolved skin in patients with dermatitis herpetiformis. J Invest Dermatol 2007;127(5):1268-71. doi: 10.1038/sj.jid.5700682 [published Online First: 2007/01/06]
46. Sticherling M, Erfurt-Berge C. Autoimmune blistering diseases of the skin. Autoimmun Rev 2012;11(3):226-30. doi: 10.1016/j.autrev.2011.05.017 [published Online First: 2011/06/07]
47. Choi JM, Lebwohl B, Wang J, et al. Increased prevalence of celiac disease in patients with unexplained infertility in the United States. J Reprod Med 2011;56(5-6):199-203. [published Online First: 2011/06/21]
48. Grode LB, Agerholm IE, Humaidan P, et al. Unrecognised coeliac disease among men and women undergoing fertility treatment: A screening study. United European Gastroenterol J 2018;6(10):1477-84. doi: 10.1177/2050640618796750 [published Online First: 2018/12/24]
der informierte @rzt
- Vol. 13
- Ausgabe 4
- April 2023