- Zunehmende Relevanz HPV- induzierter Mesopharynxkarzinome
HPV-induzierte Mesopharynxkarzinome zeigen einen raschen Inzidenzanstieg und werden voraussichtlich 2030 die wichtigste Krebserkrankung im HNO-Bereich sein. Trotz der Tatsache, dass die Diagnose häufig anhand einer Lymphknotenmetastase gestellt wird, ist die Prognose besser als diejenige von Nicht-HPV-induzierten Mesopharynxkarzinomen. Auch die aktuelle Auflage der TNM-Klassifikation trägt dieser Tatsache Rechnung. Die Therapie erfolgt dennoch aktuell noch sehr ähnlich, wobei in Zukunft allfällige Deeskalation von Therapieregimes ebenso wie die epidemiologischen Auswirkungen der HPV-Immunisierung abzuwarten bleiben.
HPV-associated oropharyngeal carcinomas demonstrate a rapid increase of incidence and will be the predominant malignant tumor in the head and neck area by 2030. Even though cervical lymph node metastases lead to the diagnosis in many cases, the prognosis is better than in its HPV-negative counterparts. This is also reflected by the actual edition of the TNM classification. Currently, treatment is still very similar, whereas potential de-escalation of treatment regimens can be expected in the future as well as a potential decrease of incidence as a result of the HPV immunization campaigns.
Key Words: Human Papillomavirus, Oropharyngeal cancer, Head and Neck cancer
Hintergrund
Bei den mukosalen Plattenepithelkarzinomen des HNO-Bereichs zeichnete sich in den letzten Jahren ein Paradigmenwechsel ab: Breit angelegte Tabakpräventionskampagnen führten zu einem sukzessiven Rückgang von Tumorerkrankungen wie beispielsweise Mundhöhlen- oder Larynxkarzinomen, nicht aber zu jenem von Karzinomen des Mesopharynx (welche sogar ansteigend waren). Dieser epidemiologische Trend konnte mit dem vermehrten Auftreten von karzinogenen Hochrisikotypen der humanen Papillomaviren (HPV) im lymphoepithelialen Gewebe der Gaumen- und Zungengrundtonsillen in Verbindung gebracht werden. In Anbetracht des raschen Anstiegs der Inzidenz HPV-induzierter Mesopharynxkarzinome, die bereits heute die häufigste HPV-induzierte Krebserkrankung bei Männern repräsentiert, muss davon ausgegangen werden, dass diese Entität ab ca. 2030 das vorherrschende Malignom im HNO-Bereich darstellen wird (1-4). Dies möchten wir zum Anlass nehmen, um dieses noch relativ junge Krankheitsbild, welches sich doch in einigen Details von den Nicht-HPV-assoziierten Malignomen im HNO-Bereich unterscheidet, etwas genauer zu beleuchten.
Karzinogenese
Für mehr als 90% der HPV-induzierten Mesopharynxkarzinome ist HPV Typ 16 das ursächliche Karzinogen, gefolgt von HPV Typ 18, 33 und 35. HPV weist eine Prädilektion für das lymphoepitheliale Gewebe der Krypten der Gaumen- und Zungengrundtonsillen auf, die bis dato nicht geklärt ist. Eine mögliche Rolle könnte eine Biofilmbildung spielen, von welchen aus eine Infektion des Kryptenepithels erfolgt. Die Integration der HPV-DNA ins Genom der Wirtszelle führt zur Expression der Onkoproteine E6 und E7. Ersteres verhindert über eine Interferenz mit dem Tumorsuppressor p53 die DNA-Reparatur und die Apoptose. Letzteres führt über die Inaktivierung des Retinoblastomproteins zur Akkumulation genetisch alterierter Zellen, was beides zur onkogenen Transformation führt. Die Inaktivierung des Retinoblastomproteins führt zur Akkumulation des p16-Proteins, was – wie wir später diskutieren werden – Implikation auf die Diagnostik besitzt (5-8).
Klinik
In den meisten Fällen führt bei Patienten mit einem noch unbekannten HPV-induzierten Mesopharynxkarzinom eine zervikale Lymphadenopathie zur ärztlichen Konsultation. Diese kann zystisch sein und auf den ersten Blick benigne anmuten, was zur Fehldiagnose einer lateralen Halszyste führen kann. Es wird vermutet, dass zelluläre Abbauprodukte des Tumorstoffwechsels zu einer Blockade des lymphatischen Abflusses und so zur zystischen Transformation der Lymphknotenmetastasen führen können. Nicht selten ist der ursächliche Primärtumor klinisch nur schwer oder gar nicht zu erkennen. Diese frühen, teils okkulten HPV-induzierten Karzinome können über die diskontinuierliche Basalmembran der Tonsillenkrypten früh Anschluss an das Lymphsystem erhalten, was zu der beschriebenen früh im Verlauf auftretenden regionären Lymphknotenmetastasierung führen kann (9, 10).
Diagnostik
Die Diagnostik bei Verdacht auf ein Malignom des HNO-Bereichs fusst stets auf einer kompletten HNO-Untersuchung inklusive einer transnasalen Fiberendoskopie. Zeigt sich hierbei ein sichtbarer und zugänglicher Primärtumor, wird eine Biopsie in Lokalanästhesie entnommen. Als nächster Schritt schliesst sich eine Ultraschalluntersuchung der Halsweichteile mit einer Feinnadelpunktion (FNP) an. Hierbei gilt es zu beachten, dass die bei soliden Tumoren hochsensitive FNP (>95%) bei zystischen Läsionen (wie einer zystischen Lymphknotenmetastase) weniger zuverlässig ist (Sensitivität 50-75%). Beim adulten Patienten ist daher das Vorliegen einer zystischen Läsion der lateralen Halsweichteile bis zum Beweis des Gegenteils nicht mit einer lateralen Halszyste gleichzusetzen, sondern verdächtig auf eine zystische Lymphknotenmetastase. Dies wiederum impliziert, dass eine für Tumorzellen negative FNP in diesem Kontext grundsätzlich als «falsch-negativ» betrachtet und die Diagnose auf histologischer Ebene durch eine Exzision mit Schnellschnittuntersuchung in Neck dissection-Bereitschaft erzwungen werden muss. Zeigt sich in der klinischen Untersuchung weiterhin ein der Biopsie zugänglicher Primarius, wird dieser in Oberflächen- oder Lokalanästhesie biopsiert. Das gewonnene zytologische und histologische Material wird standardmässig immunhistochemisch auf eine p16-Expression untersucht. Dieser Surrogatmarker weist eine Sensitivität von 94-97% und eine Spezifität von 83-84% für eine HPV E6/E7 mRNA-Expression auf. Bei Unklarheiten oder für wissenschaftliche Fragestellungen kann zusätzlich eine HPV-PCR oder eine In-Situ-Hybridisierung durchgeführt werden (11-15).
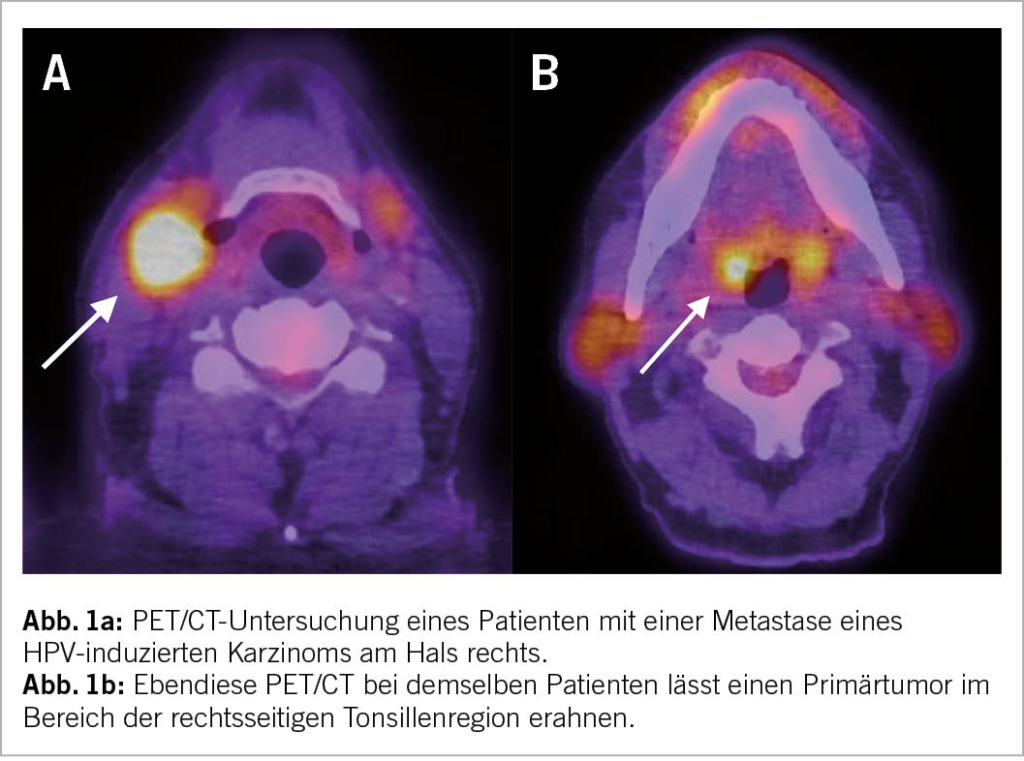
Die Abklärung eines HPV-induzierten Mesopharynxkarzinoms beinhaltet immer auch ein oder mehrere Verfahren der Schichtbildgebung: Hierfür stehen sowohl die Computertomographie (CT), die Magnetresonanztomographie (MRT) als auch die Positron Emissions Tomographie (PET)/CT zur Verfügung. Gerade letztere Untersuchung kommt häufig zur Anwendung, da – bei der oft vorkommenden Konstellation einer Lymphknotenmetastase mit (noch) okkultem Primarius – das Staging eine Primärtumorlokalisation erfordert oder bei Diagnose bereits mehrere Lymphknotenmetastasen vorhanden sind (Abb. 1a und 1b). Auch bei ausgedehnten Primärtumoren (T4) kommt die PET/CT zur Anwendung (11, 12).
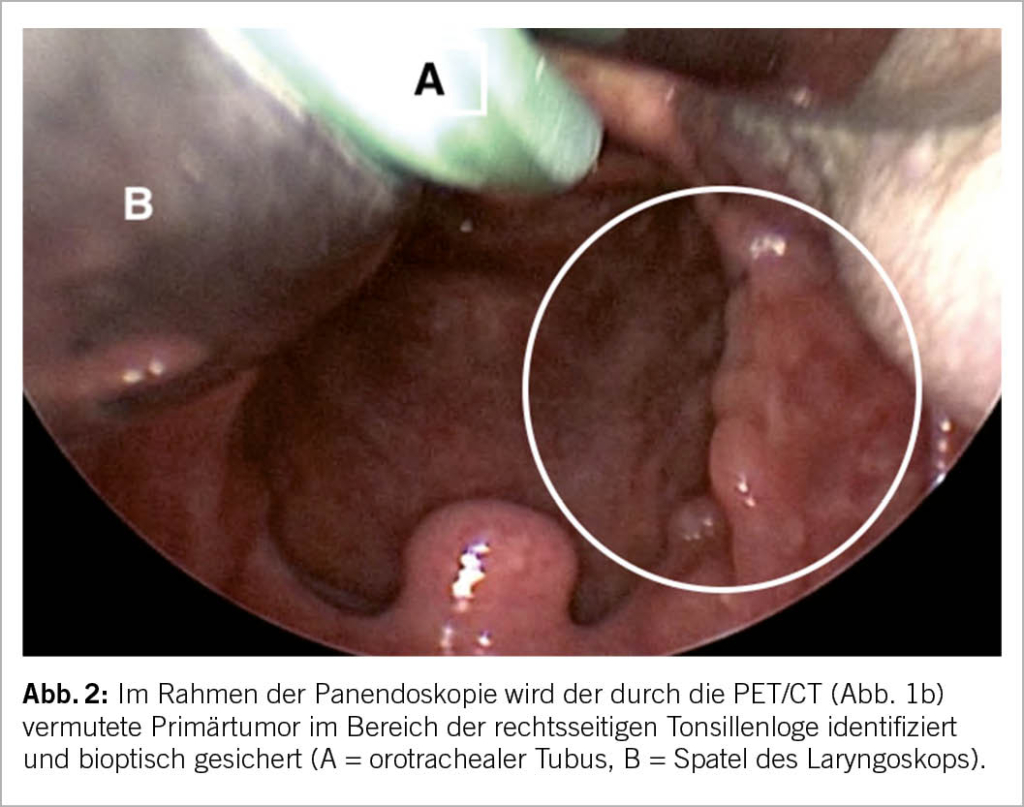
Die Untersuchung in Narkose im Rahmen einer sogenannten Panendoskopie beinhaltet in aller Regel den letzten Abklärungsschritt und beinhaltet eine Inspektion und Palpation von Mundhöhle und Mesopharynx, eine direkte Laryngoskopie, eine Oesophagoskopie und eine Bronchoskopie. Ziel der Panendoskopie ist die Suche nach dem Primarius (Abb. 2), eine Biopsie desselben, eine Beurteilung hinsichtlich seiner Resektabilität und – bei Patienten mit gleichzeitigen Risikofaktoren wie Alkohol- und Nikotinabusus – ein Ausschluss synchroner Primärtumoren. Ist auch im Rahmen der Panendoskopie kein Primärtumor sichtbar, schliesst sich in derselben Narkose eine ipsilaterale diagnostische Tonsillektomie an. Zur Verfügung steht in ausgewählten Fällen zudem eine transorale Zungengrundmukosektomie mit dem CO2-Laser oder dem Operationsroboter (11, 12).
TNM-Staging
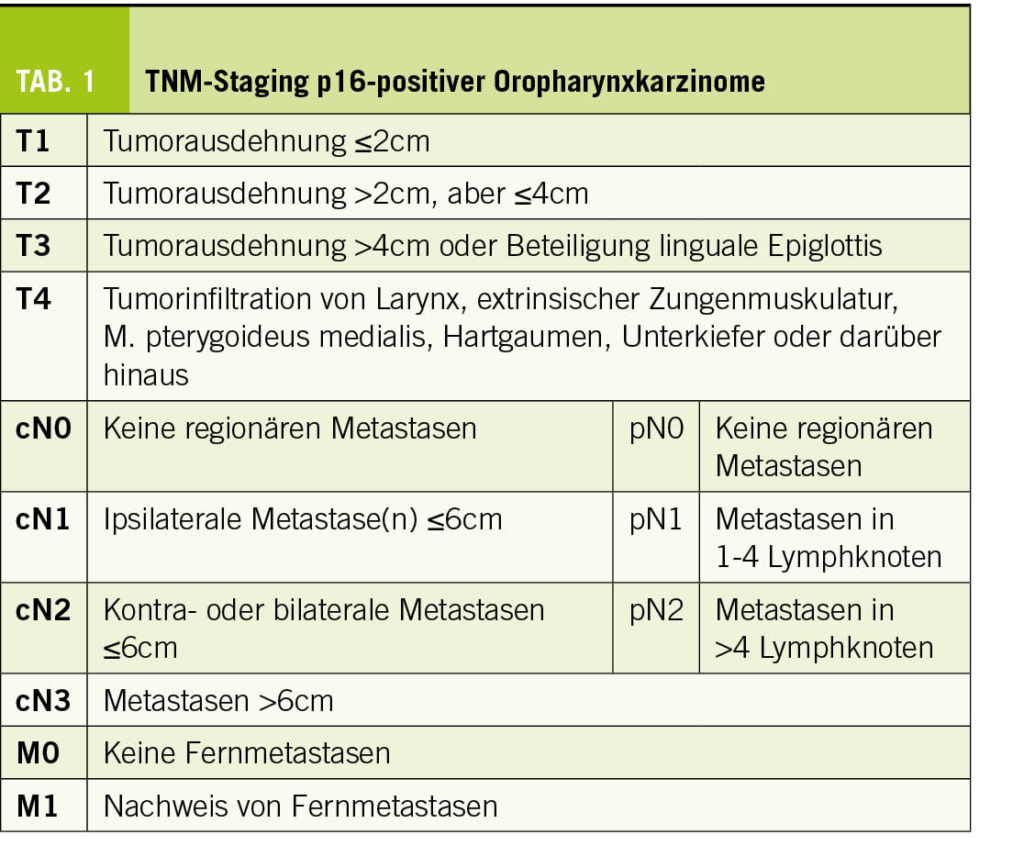
Seit dem Erscheinen der 8. Auflage des TNM-Stagings existiert eine eigene TNM-Klassifikation für p16-positive Mesopharynxkarzinome. Diese unterscheidet sich von derjenigen der p16-negativen Mesopharynxkarzinome und von der 7. Auflage dahingehend, dass die T4a- und T4b- in eine T4-Kategorie zusammengefasst wurden. Ebenso ähnelt die N-Klassifikation derjenigen des Nasopharynxkarzinoms; zudem ist bemerkenswert, dass – anders als bei p16-negativen Karzinomen – die extrakapsuläre Ausdehnung von Lymphknotenmetastasen nicht mehr in das Staging miteinfliesst (Tab. 1 und 2) (11, 16).
Therapie und Prognose
Sämtliche Therapieempfehlungen müssen an einem interdisziplinären Kopf-Hals-Tumorboard besprochen werden. Das Therapieansprechen und die Prognose von HPV-assoziierten Mesopharynxkarzinomen ist signifikant besser als dasjenige von Patienten ohne HPV-Assoziation. Mangels prospektiver Studien werden p16-positive und -negative Mesopharynxkarziome derzeit noch ähnlich behandelt und es findet noch keine Risikostratifizierung statt. Es ist zu erwarten, dass sich in Zukunft die Therapieempfehlungen von HPV-positiven und -negativen Mesopharynxkarzinomen unterscheiden werden. Zur Verfügung stehen grundsätzlich die Chirurgie, die Radiotherapie und die Systemtherapie. Der Stellenwert letzterer ist vor allem durch die konkomittierenden Chemotherapien mit Cisplatin während Radiotherapien gegeben; eine alleinige Systemtherapie findet im palliativen Setting oder – in Ausnahmefällen – als Induktionschemotherapie Anwendung.
Frühe Tumorstadien. Grundsätzlich sollten Patienten mit frühen Tumorstadien (T1-T2, N0-N1 mit einer singulären Lymphknotenmetastase <3cm ohne extrakapsuläre Ausdehnung) wenn immer möglich unimodal behandelt werden. Grund hierfür sind die hohen Heilungsraten von 80-90% sowohl bei chirurgischer als auch bei radiotherapeutischer Therapie, aufgrund derer auf eine Kumulation der Toxizität beider Behandlungsmethoden nach Möglichkeit verzichtet werden soll. Verschiedene prospektive multizentrische Studien sind derzeit im Gange und fokussieren sich auf funktionelle Endpunkte (wie beispielsweise die Schluckfunktion).
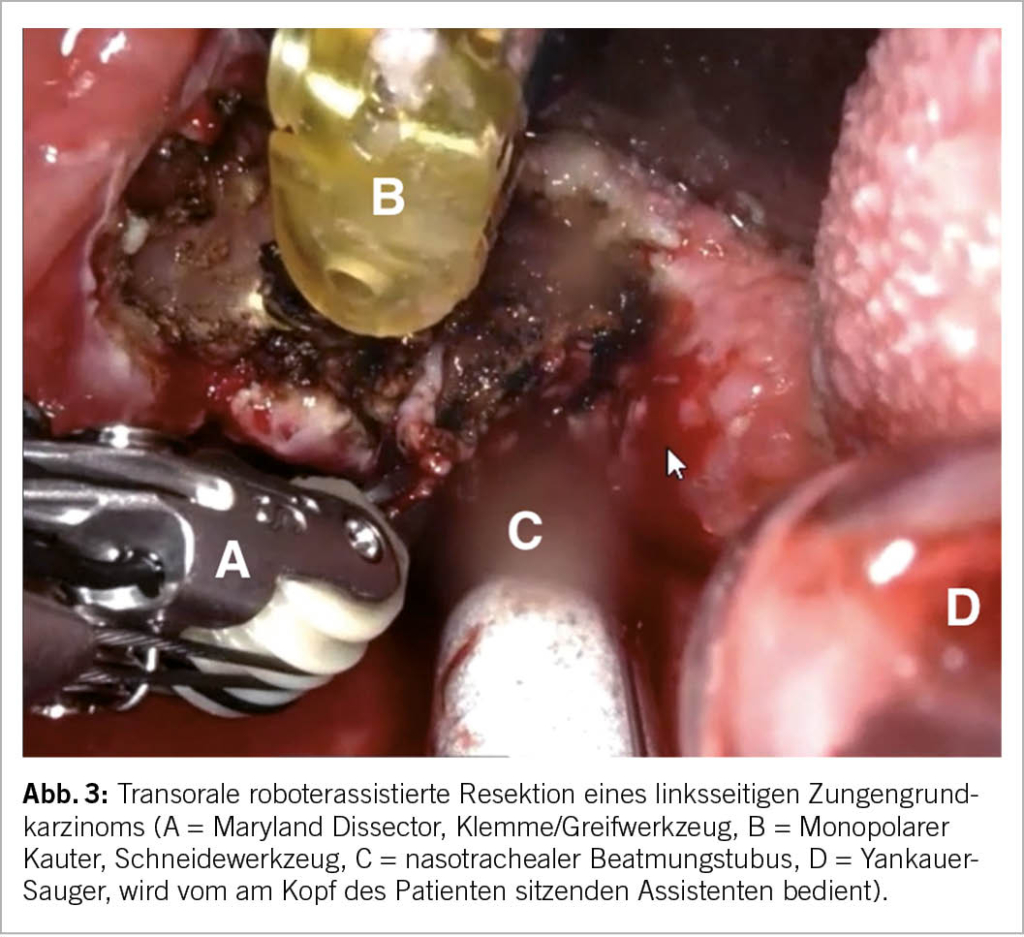
Eine Resektion des Primärtumors kann auf konventionelle chirurgische Weise, transoral mikrochirurgisch unter Verwendung des CO2-Lasers oder – ebenfalls auf transoralem Wege – unter Verwendung des Operationsroboters erfolgen (Abb. 3). Immer beinhaltet der onkologische Eingriff auch eine Dissektion der zervikalen Lymphknoten (Neck dissection), da in rund 30% auch bei einem klinischen/prätherapeutischen N0-Hals mit okkulten Halslymphknotenmetastasen zu rechnen ist. Als äquivalente Therapieoption steht eine perkutane Radiotherapie zur Verfügung, wobei auch hier stets eine Behandlung der Primärtumorregion und des zervikalen Lymphabflusses erfolgt (11, 12, 17, 18).
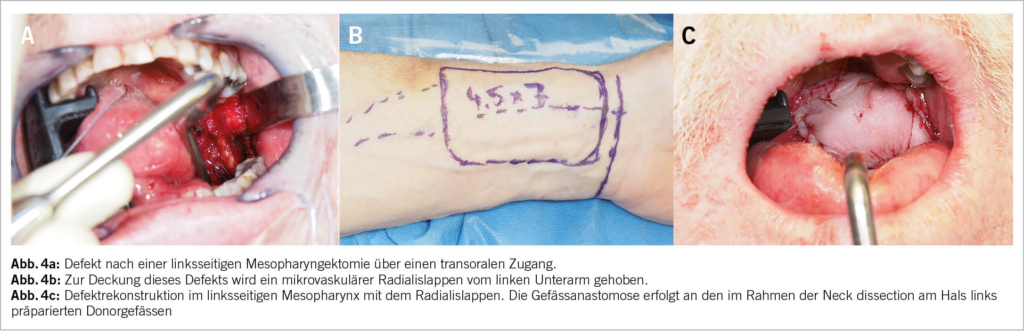
Loko-regionär fortgeschrittene Stadien. Die Behandlung von Patienten mir loko-regionär fortgeschrittenen Stadien erfolgt in vielen Fällen durch eine primäre Radiotherapie, wenn immer möglich kombiniert mit einer konkomittierenden Systemtherapie (meistens einer Cisplatin-Chemotherapie). Bei grossen Primärtumoren oder einer ausgedehnten regionären Lymphknotenmetastasierung sinkt das 5-Jahres-Überleben auf 60-70%. Lässt sich ein Karzinom mit einem zu erwartenden guten funktionellen Outcome operieren, ist auch ein chirurgisches Vorgehen zu diskutieren. Hier gilt es aber zu beachten, dass dieses häufig mit einer postoperativen Radio(chemo)therapie kombiniert werden muss. Ebenso kann eine mikrovaskuläre Lappenrekonstruktion notwendig werden (11, 12, 17, 18).
Tumorpersistenz und -rezidiv. Im Falle einer Persistenz von Tumorgewebe nach einer Strahlentherapie, sowohl lokal im Bereich der Primärtumorregion oder regionär in den Lymphknoten oder bei einem Rezidiv, bleibt einzig ein chirurgisches Vorgehen im Sinne einer sogenannten «Salvage-Operation». Das Ausmass des operativen Eingriffs reicht hierbei von einer Neck dissection aufgrund einer Persistenz einer Lymphknotenmetastase bis zur ausgedehnten ablativen Chirurgie über beispielsweise einen transmandibulären Zugang mit Notwendigkeit zur temporären Tracheotomie und zur mikrovaskulären Lappenrekonstruktion. Bei einer nicht resektablen Tumorpersistenz oder einem nicht resektablen Tumorrezidiv muss eine systemtherapeutische Behandlung diskutiert werden (11, 12).
Tumornachsorge
Sämtliche Patienten nach Behandlung eines Kopf-Hals-Malignoms werden engmaschig begleitet. Klinische Nachsorgeuntersuchungen finden in den ersten zwei Jahren nach Therapieabschluss alle 2-3 Monate, danach halbjährlich statt. Nach fünf Jahren unauffälliger Tumornachsorge dürfen Patienten als geheilt betrachtet werden. In vielen Fällen wird die Tumornachsorge anschliessend im jährlichen Abstand auf freiwilliger Basis weitergeführt (11).
Prävention und Screening
Der Schweizerische Impfplan empfiehlt polyvalente Impfungen gegen die Hochrisiko-HPV-Typen für Mädchen und Jungen. Es ist damit zu rechnen, dass diese – in erster Linie auf die Primärprävention anogenitaler Krebserkrankungen ausgerichteten – Impfstoffe auch einen zuverlässigen Schutz gegen die mesopharyngeale Infektion mit onkogenen HPV bietet (19-21).
Screeningprogramme zur Früherkennung HPV-assoziierter Mesopharynxkarzinome werden derzeit diskutiert. Es wurde demonstriert, dass der serologische Nachweis von Antikörpern gegen das Onkoprotein E6 mit hoher Sensitivität und Spezifität mit dem späteren Auftreten eines HPV-induzierten Malignoms korreliert, dieser aber der Krebsdiagnose bis 15 Jahre vorausgehen kann. Die Vorläuferläsion des HPV-assoziierten Mesopharynxkarzinoms oder der sehr frühe Primärtumor sind jedoch nicht bekannt respektive können nicht zuverlässig erkannt werden, so dass – im Kontext der zudem verhältnismässig niedrigen Prävalenz – ein solches Screening derzeit noch nicht praktikabel ist (22-24).
Schlussfolgerungen
HPV-induzierte Mesopharynxkarzinome sind eine in ihrer Inzidenz zunehmende Krebserkrankung, die sich häufig anhand von zervikalen Lymphknotenmetastasen manifestiert, dennoch aber mit einer besseren Prognose als andere Krebserkrankungen im HNO-Bereich vergesellschaftet ist. Seit einigen Jahren besteht eine eigene TNM-Klassifikation für HPV-induzierte Mesopharynxkarzinome, die jedoch noch keine Implikation auf die Behandlung bzw. eine Deeskalation des Therapieregimes hat. Sicherlich wird in Zukunft über eine Anpassung der Behandlungsrichtlinien diskutiert werden müssen, ebenfalls bleibt der Einfluss der polyvalenten HPV-Impfung auf den derzeit raschen Inzidenzanstieg abzuwarten.
Am Zentrum für Kopf-Hals-Chirurgie wird das gesamte Spektrum an Diagnostik und Therapie an beiden Standorten Cham und Luzern angeboten.
Copyright bei Aerzteverlag medinfo AG
Zentrum für Kopf-Hals-Chirurgie AG
Dorfstrasse 1, 6330 Cham
Lützelmattstrasse 3, 6006 Luzern
Zentrum für Kopf-Hals-Chirurgie AG
Dorfstrasse 1, 6330 Cham
Lützelmattstrasse 3, 6006 Luzern
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Sturgis EM, Cinciripini PM. Trends in head and neck cancer incidence in relation to smoking prevalence: an emerging epidemic of human papillomavirus-associated cancers? Cancer. 2007;110(7):1429-35.
2. Sturgis EM, Ang KK. The epidemic of HPV-associated oropharyngeal cancer is here: is it time to change our treatment paradigms? J Natl Compr Canc Netw. 2011;9(6):665-73.
3. Carvalho AL, Nishimoto IN, Califano JA, Kowalski LP. Trends in incidence and prognosis for head and neck cancer in the United States: a site-specific analysis of the SEER database. Int J Cancer. 2005;114(5):806-16.
4. Chaturvedi AK, Engels EA, Anderson WF, Gillison ML. Incidence trends for human papillomavirus-related and -unrelated oral squamous cell carcinomas in the United States. J Clin Oncol. 2008;26(4):612-9.
5. Rieth KKS, Gill SR, Lott-Limbach AA, Merkley MA, Botero N, Allen PD, et al.
Prevalence of High-Risk Human Papillomavirus in Tonsil Tissue in Healthy Adults and Colocalization in Biofilm of Tonsillar Crypts. JAMA Otolaryngol Head Neck Surg. 2018;144(3):231-7.
6. Bishop JA, Lewis JS, Rocco JW, Faquin WC. HPV-related squamous cell carcinoma of the head and neck: An update on testing in routine pathology practice. Semin Diagn Pathol. 2015;32(5):344-51.
7. Wiest T, Schwarz E, Enders C, Flechtenmacher C, Bosch FX. Involvement of intact HPV16 E6/E7 gene expression in head and neck cancers with unaltered p53 status and perturbed pRb cell cycle control. Oncogene. 2002;21(10):1510-7.
8. Saraiya M, Unger ER, Thompson TD, Lynch CF, Hernandez BY, Lyu CW, et al. US assessment of HPV types in cancers: implications for current and 9-valent HPV vaccines. J Natl Cancer Inst. 2015;107(6):djv086.
9. Koch WM. Clinical features of HPV-related head and neck squamous cell carcinoma: presentation and work-up. Otolaryngol Clin North Am. 2012;45(4):779-93.
10. Goldenberg D, Begum S, Westra WH, Khan Z, Sciubba J, Pai SI, et al. Cystic lymph node metastasis in patients with head and neck cancer: An HPV-associated phenomenon. Head Neck. 2008;30(7):898-903.
11. Arbeitsgemeinschaft für Hals- und Gesichtschirurgie der Schweizerischen Gesellschaft für ORL H-uG. Empfehlungen für die Betreuung (Abklärung, Behandlung und Nachsorge) von Patienten mit Karzinomen des Kopf-Hals-Bereichs. 2019.
12. Network NCC. NCCN Clinical Practice Guidelines in Oncology. Head and Neck Cancers. Version 1.2019. www.nccn.org.
13. Cantley RL, Gabrielli E, Montebelli F, Cimbaluk D, Gattuso P, Petruzzelli G. Ancillary studies in determining human papillomavirus status of squamous cell carcinoma of the oropharynx: a review. Patholog Res Int. 2011;2011:138469.
14. Jordan RC, Lingen MW, Perez-Ordonez B, He X, Pickard R, Koluder M, et al. Validation of methods for oropharyngeal cancer HPV status determination in US cooperative group trials. Am J Surg Pathol. 2012;36(7):945-54.
15. Prigge ES, Arbyn M, von Knebel Doeberitz M, Reuschenbach M. Diagnostic accuracy of p16. Int J Cancer. 2017;140(5):1186-98.
16. Wittekind C. TNM: Klassifikation maligner Tumoren, 8. Auflage. Hoboken,
New Jersey: Wiley; 2017.
17. Ang KK, Harris J, Wheeler R, Weber R, Rosenthal DI, Nguyen-Tân PF, et al. Human papillomavirus and survival of patients with oropharyngeal cancer.
N Engl J Med. 2010;363(1):24-35.
18. Price JM, West CM, Mistry HB, Betts G, Bishop P, Kennedy J, et al. Improved survival prediction for oropharyngeal cancer beyond TNMv8. Oral Oncol. 2021;115:105140.
19. Schweizerischer Impflan. www.bag.admin.ch/dam/bag/de/dokumente/mt/i-und-b/richtlinien-empfehlungen/allgemeine-empfehlungen/schweizerischer-impfplan.pdf.download.pdf/schweizerischer-impfplan-de.pdf.
20. Schlecht NF, Masika M, Diaz A, Nucci-Sack A, Salandy A, Pickering S, et al. Risk of Oral Human Papillomavirus Infection Among Sexually Active Female Adolescents Receiving the Quadrivalent Vaccine. JAMA Netw Open. 2019;2(10):e1914031.
21. Chaturvedi AK, Graubard BI, Broutian T, Pickard RKL, Tong ZY, Xiao W, et al. Effect of Prophylactic Human Papillomavirus (HPV) Vaccination on Oral HPV Infections Among Young Adults in the United States. J Clin Oncol. 2018;36(3):262-7.
22. Kreimer AR, Johansson M, Waterboer T, Kaaks R, Chang-Claude J, Drogen D,
et al. Evaluation of human papillomavirus antibodies and risk of subsequent head and neck cancer. J Clin Oncol. 2013;31(21):2708-15.
23. Kreimer AR, Shiels MS, Fakhry C, Johansson M, Pawlita M, Brennan P, et al. Screening for human papillomavirus-driven oropharyngeal cancer: Considerations for feasibility and strategies for research. Cancer. 2018;124(9):1859-66.
24. Kreimer AR, Chaturvedi AK, Alemany L, Anantharaman D, Bray F, Carrington M, et al. Summary from an international cancer seminar focused on human papillomavirus (HPV)-positive oropharynx cancer, convened by scientists at IARC and NCI. Oral Oncol. 2020;108:104736.
der informierte @rzt
- Vol. 13
- Ausgabe 2
- Februar 2023