- Adenomyose und Kinderwunsch
Adenomyose ist durch das Vorhandensein ektopen Endometriumgewebes im Myometrium definiert. Sie ist oft mit Endometriose assoziiert (versprengtes Endometrium ausserhalb des Uterus) und tritt mit zunehmendem Alter immer häufiger auf. Adenomyose verursacht chronische Schmerzen sowie Blutungsstörungen und vermindert die Fertilität. Die Diagnose erfolgt primär sonographisch. Im Rahmen einer Behandlung mit assistierter Reproduktion gibt es Hinweise, dass eine 6-wöchige Vorbehandlung mit einem lang-wirkenden GnRH-Agonisten die Konzeptionschancen erhöht.
L’ adénomyose est la présence ectopique de tissue endometrial dans le myomètre. Souvent elle est associée à l’ endométriose (tissue endometrial ectopique en dehors de l’ utérus). Sa fréquence augmente avec l’ âge de la femme. L’ adénomyose provoque des douleurs chroniques, des troubles des règles et diminue la fertilité. Le diagnostic se pose en premier lieu par échographie endovaginale. Dans le cadre de traitements par procréation médicalement assistée (PMA) on a observé qu’un prétraitement de 6 semaines avec un analogue de la GnRH améliore les chances de conception
Unter Adenomyose versteht man ektope Lokalisationen von benignem Endometriumgewebe mit glandulären und stromalen Anteilen im Myometrium des Uterus (1). Durch die spezifische Lokalisation im Myometrium unterscheidet sich Adenomyose von Endometriose, welche durch die extrauterine Ansiedlung von endometrialem Gewebe definiert ist. Die Ausbreitung von Adenomyose im Myometrium kann entweder fokal oder diffus sein. Bei einer diffusen Ausbreitung ist gelegentlich das gesamte Myometrium von Adenomyose befallen und bewirkt in der Folge einer Vergrösserung der Gebärmutter. Sehr häufig ist Adenomyose auch mit Endometriose vergesellschaftet und in der Bildgebung ist die Abgrenzung von oftmals ebenfalls vorhandenen Leiomyomata nicht immer einfach. Adenomyose betrifft je nach Studie und je nach Altersverteilung mindestens 20% der Frauen im reproduktionsfähigen Alter und stellt somit ein wesentliches Problem in der Frauenheilkunde dar. Das Beschwerdebild einer Adenomyose ist nicht spezifisch und setzt sich aus Dysmenorrhoe, Hypermenorrhoe und azyklischen Blutungsstörungen, sowie Sterilität und Infertilität zusammen.
Der Nachweis ektopen Endometriumgewebes im Myometrium kann definitionsgemäss nur histologisch erfolgen. Dieser Nachweis setzt eine Biopsie des Befundes voraus. Jedoch ist eine Entnahme des befallenen Gewebes bei vorhandenem Kinderwunsch kaum möglich oder sinnvoll, so dass heute die Verdachtsdiagnose primär mittels der Vaginosonographie gestellt wird. Jedoch ist eine Bestätigung anhand einer Magnetresonanztomographie oftmals ratsam.
Entstehung der Adenomyose
Zwei Entstehungsmechanismen werden derzeit kontrovers diskutiert (2): 1. die Migration von Zellen aus der Lamina basalis des Endometriums durch die Basalmembran zwischen dem Endometrium und dem Myometrium in das Muskelgewebe des Uterus hinein oder 2. die Metaplasie oder Differenzierung von residualen embryonalen oder adulten Stammzellen des Müllerschen Ganges in der junktionalen Zone des Myometriums, welche sich direkt unter dem Endometrium befindet.
Ersterer Mechanismus wird heute als der häufigste betrachtet. Bei der Entstehung der Adenomyose ist eine übermässige lokale (parakrine) Östrogenwirkung entscheidend, da bei Patientinnen mit Adenomyose im Menstrualblut erhöhte Östrogenspiegel gemessen wurden (3), welche möglicherweise im Uterus auf eine verminderte enzymatische Metabolisierung des potenteren 17ß-Östradiol in weniger potenten Östrogenmetaboliten zurückzuführen ist (2, 3). Zudem ist in den adenomyotischen Endometriumzellen die sekretorische Transformation durch Gestagene aufgrund einer geringeren Progesteronrezeptordichte weniger effizient (4). Die erhöhte lokale Östrogenwirkung verursacht zudem die Bildung von Oxytozinrezeptoren im endometriumnahen Myometrium (5), welche in der Folge eine verstärkte Kontraktilität der Gebärmutter auslösen (6). Die vermehrten Kontraktionen der uterinen Muskulatur bewirken zusätzlich eine kontinuierliche Dislozierung von undifferenzierten Progenitorzellen aus der Lamina basalis des Endometriums in das Myometrium (7). Die vermehrte Kontraktilität verursacht zudem Mikrotraumata im Gewebe, welche einen chronisch-inflammatorischen Prozess auslösen. Dieser inflammatorische Prozess wurde mit erhöhten lokalen Interleukin-1-Spiegeln, mit COX-2-Aktivierung und vermehrter Prostaglandin-E2-Synthese belegt (8). Das Menstrualblut, welches sich in den adenomyotischen Krypten im Myometrium sammelt, fliesst verspätet ab, was sich wiederum typischerweise als azyklische Schmierblutungen oder Spotting bemerkbar macht. Nach und nach wird das Myometrium aufgrund der chronischen Inflammation mit Narbenbildung immer weniger elastisch und verliert seine Dehnbarkeit, was bei einem fortgeschrittenen Verlauf elastosonographisch nachgewiesen werden kann (9). So entsteht ein typischer «circulus viciosus», der im Laufe der Zeit die Entwicklung und die Verbreitung der Adenomyose zusätzlich fördert.
Obwohl die Entstehung und Weiterentwicklung der Adenomyose in den meisten Fällen auf eine lokal erhöhte Östrogenwirkung zurückzuführen ist, dürfte auch in einigen Fällen die Entstehung einer Adenomyose auf Differenzierung embryonaler Stammzellen oder Progenitorzellen der Müllerschen Gänge zurückzuführen sein. Am eindrücklichsten sind hier Fallberichte zu erwähnen, bei der Adenomyose im Myometriumrudiment bei Rokitansky-Küster-Hauser-Syndrom nachgewiesen wurde (10).
Adenomyose kommt häufiger bei Frauen im fortgeschrittenen reproduktionsbiologischen Alter vor. Wiederholte Traumata, wie rezidivierende Fehlgeburten, wiederholte Sectiones und vermehrte chirurgische Eingriffe an der Gebärmutter, begünstigen nachweislich die Entwicklung einer Adenomyose.
Diagnose
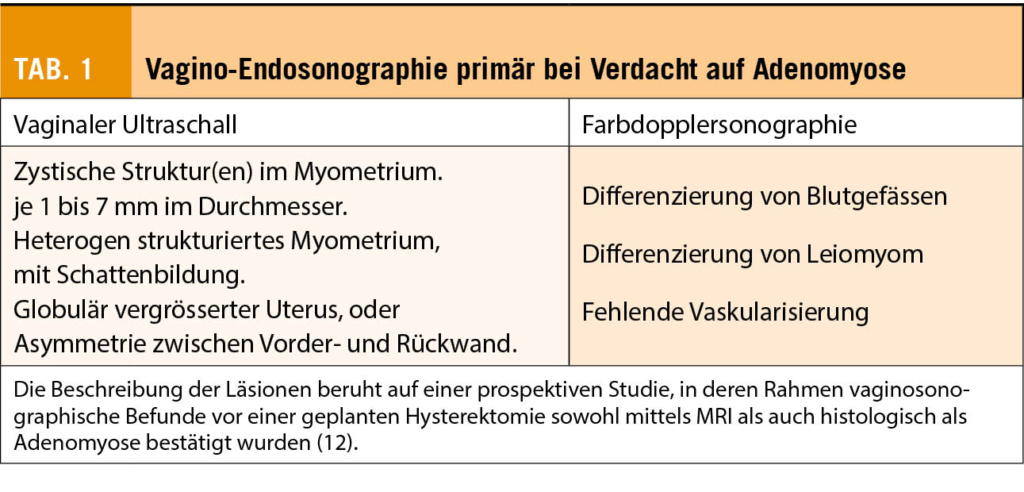
Obwohl das ektope Vorhandensein von endometrialem Gewebe im Myometrium einer histologischen Bestätigung bedarf, ist die dafür erforderliche Biopsie bei Patientinnen mit Kinderwunsch nur selten möglich. Heute steht deshalb die Bildgebung der Läsionen in der Gebärmutter im Vordergrund, was einem Paradigmenwechsel gleicht (11). Hier stehen zwei Methoden zur Verfügung: die Vagino-Endosonographie und das sogenannte Magnet-Resonanz-Imaging (MRI) (12, 13). Die in Tabelle 1 aufgelisteten morphologischen Kriterien wurden im Rahmen einer prospektiven Studie mit histologischer Bestätigung der Läsionen evaluiert und basieren alle auf Unterschieden in der Textur des Myometriums, besonders im sub-endometrialen Bereich. Ein wichtiges Merkmal einer Adenomyose sind Unterschiede der Dicke der Vorder- oder Rückwand des Myometriums. Die Farbdoppleruntersuchung ermöglicht zudem die Differenzierung zwischen Adenomyose und Myom, da bei Adenomyose vermehrt Blutgefässe innerhalb der Läsion nachweisbar sind, während bei einem Myom die Durchblutung eher um die rundliche Struktur umgeleitet ist.
Da die diagnostische Genauigkeit der vaginalen Endosonographie sehr abhängig von der Expertise des jeweiligen Untersuchers ist, bleibt die Bestätigung mittels MRI in vielen Fällen sinnvoll, besonders dann, wenn eine langwierige oder kostspielige hormonelle Behandlung oder ein umfangreiches chirurgisches Vorgehen geplant ist. Die Kriterien der diagnostischen Genauigkeit der vaginalen Endosonographie oder MRI, wie Spezifität und Sensitivität, sind miteinander vergleichbar (12, 13).
Infertilität
Obwohl der Zusammenhang zwischen Adenomyose und Infertilität seit langem immer wieder postuliert wurde (1), ist die verminderte Konzeptionswahrscheinlichkeit bei Adenomyose aufgrund der vorhin beschriebenen Ungenauigkeiten der diagnostischen und bildgebenden Kriterien und aufgrund der vielen Kovariablen (Alter der Betroffenen, Begleiterkrankungen wie Endometriose und Leiomyomata) unsicher und wird nach wie vor kontrovers diskutiert. Erst eine Metaanalyse mit vielen kleinen Kohortenstudien hat kürzlich aufgezeigt, dass die Fertilitätschancen betroffener Frauen mit Adenomyose auch unter Berücksichtigung der vorhandenen Kovariablen signifikant vermindert sind (14).
Inwieweit Adenomyose das Ergebnis einer Behandlung mit assistierter Reproduktionsmedizin beeinflusst, ist ebenfalls nicht ganz sicher. Obwohl eine Mehrzahl von Studien geringere embryonale Implantationsraten aufweisen (15), konnte im Rahmen einer pro-
spektiven Kohortenstudie bei 4002 Paaren mit ungewollter Kinderlosigkeit nach Behandlung mit assistierter Reproduktionsmedizin in einer einzigen Institution keine statistisch signifikante Korrelation zwischen dem Vorhandensein adenomyotischer Läsionen im Ultraschallbild und der Lebendgeburtenrate festgestellt werden (16). Allerdings war die Lebendgeburtenrate nach Stimulationsbehandlung für die assistierte Reproduktionsmedizin deutlich niedriger als in der Kontrollgruppe ohne Adenomyose. Nach Auftauung und Übertragung von zuvor kryokonservierten Embryonen waren die Lebendgeburtenraten vergleichbar (16).
Adenomyose ist nicht nur für die Entstehung einer Schwangerschaft nachteilhaft, sondern auch für den späteren Verlauf der Schwangerschaft (15). Im Rahmen einer gross angelegten Metaanalyse wurden signifikant häufiger Fehlgeburten (Wahrscheinlichkeit: +3.49 - mal), Präeklampsie (Wahrscheinlichkeit: + 7.87-mal) und Frühgeburtlichkeit (Wahrscheinlichkeit: + 2.74-mal), sowie Wachstumsretardierung des Neugeborenen (Wahrscheinlichkeit: + 3.9 - mal) nachgewiesen. Betroffene Patientinnen und der Geburtshelfer müssen unbedingt über das Vorhandensein einer Adenomyose und über deren mögliche Auswirkungen auf den Schwangerschaftsverlauf und die damit einhergehenden Risiken informiert werden. Auch Plazentationsstörungen, wie Plazenta praevia und Plazenta in- und accreta, sind bei einer vorbestehenden Adenomyose häufiger.
Operative Möglichkeiten bei Adenomyose
Hysteroskopisch schimmern adenomyotische Herde oftmals unmittelbar durch das Endometrium durch und imponieren als hypervaskularierte Areale («strawberry pattern») oder als zystische Vorwölbungen. Diese können resektoskopisch exzidiert oder eröffnet werden (17). Bislang wurden allerdings keine Studien durchgeführt, welche einen fertilitätsfördernden Effekt der hysteroskopischen Resektion subendometrialer Herde aufgezeigt haben.
Bei fokal-begrenzter Adenomyose wurde die Exzision des betroffenen Areals aus dem Myometrium, ähnlich wie bei der Resektion von Leiomyomata, vorgeschlagen. Die chirurgische Vorgehensweise ähnelt derjenigen beim Uterus myomatosus (18). Die Wirksamkeit (und mögliche Komplikationen) einer solchen chirurgischen Resektion wurde bislang im Rahmen von prospektiv-randomisierten Studien nicht evaluiert.
Medikamentöse Möglichkeiten
Behandlung mit Gestagenen
Gestagene bewirken im gesunden Endometrium eine sekretorische Transformation und anschliessend eine Dezidualisierung. Eine langanhaltende Behandlung mit einem Gestagen wirkt auf dem Niveau des Endometriums mitosehemmend. So wurden sowohl ein Levonorgestrel-IUD (Mirena) sowie Dienogest (Visanne, 2 mg) erfolgreich bei Adenomyose eingesetzt (19). Sie wirken schmerzlindernd und reduzieren auch den Blutverlust. Eine langfristige vorteilhafte Wirkung von Dienogest hält bis zu 12 Monate nach Behandlungsstopp an. Allerdings treten bei einer dauerhaften Behandlung mit einem Gestagenpräparat bei Adenomyose typischerweise leichte und immer wiederkehrende Blutungsstörungen auf. Diese entstehen durch die Entleerung von altem Blut aus den adenomyotischen Läsionen in der junktionalen (subendometrialen) Zone des Myometriums.
Langwirkende GnRH-Agonisten
Bei Kinderwunsch hat sich eine 6-wöchige Downregulation mit einem langwirkenden GnRH-Agonisten bewährt (20, 21). Sie ermöglicht durch die Induktion einer Amenorrhoe über einen längeren Zeitraum ein langsames Abklingen der chronischen Inflammation im Endometrium und die Entleerung der subendometrialen Adenomyosezysten. Wichtig ist, dass die erste Dosis unmittelbar nach Beginn der Menstruation verabreicht wird und dass die Patientin mindestens über einen Zeitraum von sechs Wochen wirklich blutungsfrei ist. Erst dann kann mit dem Endometriumaufbau mit einem Östrogenpräparat (wie im Falle eines Auftauzyklus mit Transfer eines zuvor kryokonservierten Embryos) oder bei einer Ovulationsinduktion mit einem Gonadotropinpräparat begonnen werden. Die Wirksamkeit wurde im Rahmen retrospektiver Studien belegt.
Eigene Erfahrung mit der Downregulation mit einem Depot-GnRH-Agonist bei nachgewiesener Adenomyose
Das vorhin beschriebene Behandlungsprotokoll wurde in unserer Institution übernommen (20). Acht Patientinnen erhielten aufgrund wiederholten Ausbleibens einer Schwangerschaft trotz Übertragung von jeweils einem Embryo im Blastozystenstadium und bei sonographischem Verdacht auf Adenomyose eine MRI-Untersuchung der Gebärmutter (Abbildung 1). Bei sieben der acht Patientinnen wurde mittels MRI das Vorhandensein einer Adenomyose bestätigt. Bei allen Patientinnen wurde daraufhin ab Beginn der Menstruation eine sechswöchige Downregulation mit einem langwirkenden GnRH-Agonisten eingeleitet (Triptorelin Acetat, 3.75 mg, Pamorelin, Debiopharm). Die zweite Dosis des GnRH-Agonisten wurde vier Wochen nach der ersten Gabe verabreicht. Nach einem mindestens sechswöchigen blutungsfreien Intervall wurde anschliessend der Endometriumaufbau mit Östradiolvalerat (täglich 6 mg, Progynova®, Bayer) eingeleitet. Nach Sicherstellung des adäquaten Endometriumaufbaus wurde die sekretorische Transformation mit vaginaler Progesteronapplikation (600 mg, Utrogestan®, Vifor) eingeleitet. Fünf Tage später wurde jeweils ein Embryo im Blastozystenstadium aufgetaut und übertragen. Fünf der sieben bislang so behandelten Patientinnen erzielten jeweils eine Schwangerschaft (71.4%, Tabelle 2). Bei einer Patientin kam es allerdings zur Fehlgeburt.
Copyright bei Aerzteverlag medinfo AG
Reproduktionsmedizin und gynäkologische Endokrinologie (RME)
Universitätsspital
Universität Basel, Vogesenstrasse 134
4031 Basel
Reproduktionsmedizin und gynäkologische Endokrinologie (RME)
Frauenspital
Universitätsspital Basel, Universität Basel
Vogesenstrasse 134
4031 Basel
Reproduktionsmedizin und gynäkologische Endokrinologie (RME)
Frauenspital
Universitätsspital Basel, Universität Basel
Vogesenstrasse 134
4031 Basel
Die Autoren haben im Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
◆ Die Bedeutung der Adenomyose hat in der Kinderwunschsprechstunde zugenommen, zum Teil wegen des fortschreitenden Alters der Patientinnen mit Kinderwunsch, zum Teil auch aufgrund der besseren Visualisierung mit hochauflösender Vaginosonographie.
◆ Obwohl weiterhin kontrovers diskutiert, ist es wahrscheinlich, dass Adenomyose bei Kinderwunsch die Konzeptionschancen reduziert und zur Infertilität beiträgt.
◆ Immer mehr Studien zeigen, dass die Induktion einer länger anhaltenden Amenorrhoe mit einem GnRH-Agonisten vor Beginn der Endometriumproliferation die Konzeptionschancen nach assistierter Reproduktion erhöht.
◆ Bei präkonzeptionell nachgewiesener Adenomyose ist es für den Reproduktionsmediziner unerlässlich, auf höhere Komplikationsraten im Falle einer Schwangerschaft hinzuweisen.
Messages à retenir
◆ L’ adénomyose occupe une place de plus en plus importante dans les consultations pour désir de grossesse. D’une part ces patientes sont de plus en plus âgées, et d’autre part, les sondes d’ultrason endovaginales à haute résolution ont améliorée la visualisation.
◆ Il est probable que l’adénomyose diminue les chances de conception et contribue à l’infertilité, mais la discussion scientifique à ce sujet n’est pas close.
◆ Un nombre croissant d’études indique que l’induction d’une aménorrhée prolongée, initiée à l’aide d’un analogue de la GnRH avant le début de la prolifération de l’endomètre, améliore les chances de conception dans une patientèle traitée par PMA.
◆ En cas d’adénomyose avérée avant de concevoir, le médecin traitant spécialiste en médecine de reproduction se doit d’informer la patiente des risques augmentés de complications en cas de grossesse.
1. Devlieger R, D’Hooghe T, Timmerman D. Uterine adenomyosis in the infertility clinic. Hum Reprod Update. 2003 Mar-Apr;9(2):139-47.
2. García-Solares J, Donnez J, Donnez O, Dolmans MM. Pathogenesis of uterine adenomyosis: invagination or metaplasia? Fertil Steril. 2018 Mar;109(3):371-379.
3. Rižner TL. The Important Roles of Steroid Sulfatase and Sulfotransferases in Gynecological Diseases. Front Pharmacol. 2016 Feb 18;7:30.
4. Mehasseb MK, Panchal R, Taylor AH, Brown L, Bell SC, Habiba M. Estrogen and progesterone receptor isoform distribution through the menstrual cycle in uteri with and without adenomyosis. Fertil Steril. 2011 Jun;95(7):2228-35,
5. Zhang Y, Yu P, Sun F, Li TC, Cheng Jm, Duan H. Expression of oxytocin receptors in the uterine junctional zone in women with adenomyosis. Acta Obstet Gynecol Scand. 2015 Apr;94(4):412-8.
6. Guo SW, Mao X, Ma Q, Liu X. Dysmenorrhea and its severity are associated with increased uterine contractility and overexpression of oxytocin receptor (OTR) in women with symptomatic adenomyosis. Fertil Steril. 2013 Jan;99(1):231-240.
7. Shaked S, Jaffa AJ, Grisaru D, Elad D. Uterine peristalsis-induced stresses within the uterine wall may sprout adenomyosis. Biomech Model Mechanobiol. 2015 Jun;14(3):437-44.
8. Leyendecker G, Wildt L, Mall G. The pathophysiology of endometriosis and adenomyosis: tissue injury and repair. Arch Gynecol Obstet. 2009 Oct;280(4):529-38.
9. Liu X, Ding D, Ren Y, Guo SW. Transvaginal Elastosonography as an Imaging Technique for Diagnosing Adenomyosis. Reprod Sci. 2018 Apr;25(4):498-514.
10. Enatsu A, Harada T, Yoshida S, Iwabe T, Terakawa N. Adenomyosis in a patient with the Rokitansky-Kuster-Hauser syndrome. Fertil Steril. 2000 Apr;73(4):862-3.
11. Exacoustos C, Zupi E. A new era in diagnosing adenomyosis is coming. Fertil Steril. 2018 Oct;110(5):858.
12. Bazot M, Cortez A, Darai E, Rouger J, Chopier J, Antoine JM, Uzan S. Ultrasonography compared with magnetic resonance imaging for the diagnosis of adenomyosis: correlation with histopathology. Hum Reprod. 2001 Nov;16(11):2427-33.
13. Tellum T, Nygaard S, Lieng M. Noninvasive Diagnosis of Adenomyosis: A Structured Review and Meta-analysis of Diagnostic Accuracy in Imaging. J Minim Invasive Gynecol. 2020 Feb;27(2):408-418.
14. Vercellini P, Consonni D, Dridi D, Bracco B, Frattaruolo MP, Somigliana E. Uterine adenomyosis and in vitro fertilization outcome: a systematic review and meta-analysis. Hum Reprod. 2014 May;29(5):964-77.
15. Horton J, Sterrenburg M, Lane S, Maheshwari A, Li TC, Cheong Y. Reproductive, obstetric, and perinatal outcomes of women with adenomyosis and endometriosis: a systematic review and meta-analysis. Hum Reprod Update. 2019 Sep 11;25(5):592-632.
16. Higgins C, Fernandes H, Da Silva Costa F, Martins WP, Vollenhoven B, Healey M. The impact of adenomyosis on IVF outcomes: a prospective cohort study. Hum Reprod Open. 2021 Apr 19;2021(2):hoab015.
17. Gordts S, Campo R, Brosens I. Hysteroscopic diagnosis and excision of myometrial cystic adenomyosis. Gynecol Surg. 2014;11(4):273-278.
18. Younes G, Tulandi T. Conservative Surgery for Adenomyosis and Results: A Systematic Review. J Minim Invasive Gynecol. 2018 Feb;25(2):265-276.
19. Dueholm M. Minimally invasive treatment of adenomyosis. Best Pract Res Clin Obstet Gynaecol. 2018 Aug;51:119-137.
20. Volodarsky-Perel A, Eldar-Geva T, Holzer HE, Schonberger O, Reichman O, Gal M. Cryopreserved embryo transfer: adjacent or non-adjacent to failed fresh long GnRH-agonist protocol IVF cycle. Reprod Biomed Online. 2017 Mar;34(3):267-273.
21. Lan J, Wu Y, Wu Z, Wu Y, Yang R, Liu Y, Lin H, Jiao X, Zhang Q. Ultra-Long GnRH Agonist Protocol During IVF/ICSI Improves Pregnancy Outcomes in Women With Adenomyosis: A Retrospective Cohort Study. Front Endocrinol (Lausanne). 2021 May 31;12:609771.
info@gynäkologie
- Vol. 11
- Ausgabe 5
- Oktober 2021