- Adjuvante endokrine Therapie
Die grösste Gruppe aller Brustkrebsformen zeigt mit einem Anteil von 75% eine Expression von Östrogen- und/oder Progesteronrezeptoren und ist somit Kandidat für eine endokrine Therapie. Aus diesem Merkmal ergibt sich ein entscheidender Therapieansatz in der adjuvanten Behandlung nach erfolgter Primärtherapie (Operation / (neo-) adjuvanter Chemotherapie /Radiotherapie). Tamoxifen und Aromataseinhibitoren sind die beiden Hauptakteure und haben ein grundsätzlich günstiges Nebenwirkungsprofil.
75 % des cancers du sein expriment des récepteurs aux oestrogènes et/ou à la progestérone. Ces caractéristiques qualifient ce grand groupe (3 cas sur 4) pour un traitement hormonal / endocrinien adjuvant après la prise en charge initiale (par opération et / ou chimio- et / ou radiothérapie (néo-) adjuvante).
Le tamoxifen et les inhibiteurs de l’aromatase sont les acteurs principaux du traitement hormonal des cancers du sein. Le profil de leurs effets non-désirables est en principe favorable.
How long and which endocrine therapy to prescribe, whether the two groups of substances should be administered in sequence, and in what order, or in combination with ovarian suppression in the premenopausal patient, has been investigated in many studies.
Current studies and meta-analyzes are addressing the issue of the benefits of advanced endocrine therapy with an aromatase inhibitor after 5 years of postmenopausal aromatase inhibitor therapy. This is based on published data on the 20-year relapse risk after discontinuation of a 5-year endocrine therapy, after which there is a continuous increase in risk for recurrence. Likewise the subject of ongoing studies in the (neo-) adjuvant are the CDK 4/6 inhibitors, which already represent an established combination therapy in hormone-dependent, metastatic breast cancer in combination with standard endocrine therapy. Based on the most recent data, standards for adjuvant endocrine therapy will be presented below.
Breast cancer, with an incidence of 12% of the female population, is the most common cancer of women and the leading cause of death in women between the ages of 40 and 50 years. Breast cancer mortality has been greatly reduced in recent years due to effective treatment options, largely due to endocrine therapy for hormone-dependent breast cancer. Although the common denominator of this 75% of breast cancer diagnoses is positivity for estrogen and progesterone receptors, despite established treatment standards, an individualized relapse risk assessment will be needed to help decide how and for how long to treat endocrine treatment.

The premenopausal patient
Die Standard-endokrine Therapie der prämenopausalen Patientin ist das Tamoxifen. Tamoxifen über 5 Jahre senkt die Brustkrebssterblichkeit um mindestens einen Drittel und hält über die Therapiedauer von 5 Jahren an (carryover Benefit) (1). Wird die Patientin während dieser 5 Jahre postmenopausal, ist ein Wechsel (Switch) auf einen Aromatasehemmer sinnvoll (2). Da der Aromatasehemmer eine Reaktivierung der Ovarialfunktion bewirken kann, sollte der Menopausestatus, nebst dem klinischen Zeichen einer Amenorrhoe unter Tamoxifen, biochemisch durch postmenopausale Werte des Follikelstimulierenden Hormons (FSH) und des Estradiols (E2) bestätigt werden.
Ausgedehnte endokrine Therapie mit ovarieller Suppression (OS)
Es stehen 3 zugelassene Aromataseinhibitoren zur Verfügung: Anastrozol, Exemestan und Letrozol. Bislang waren Aromatasehemmer eine Substanzklasse mit ausschliesslicher Zulassung in der Postmenopause. Ob bei der prämenopausalen Patientin eine ausgedehnte endokrine Therapie mit ovarieller Suppression (OS) über 5 Jahre einen Vorteil zeigt, wurde in der TEXT- und der SOFT Studie untersucht (3-5) (Abb. 1).
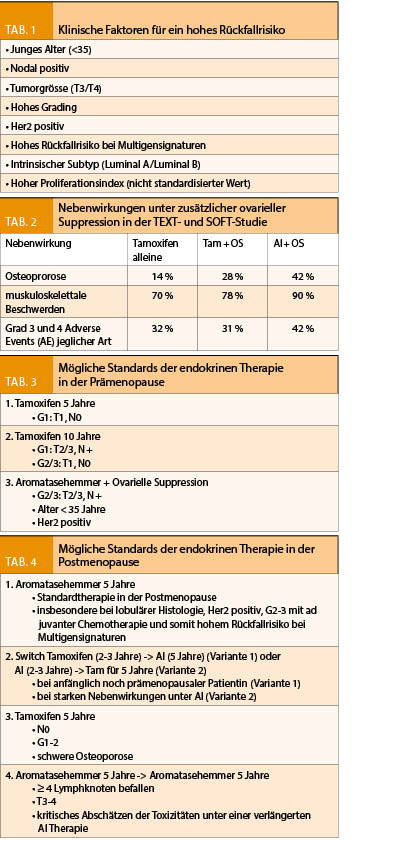
Das Hauptargument zur ausgedehnten endokrinen Therapie ist das individuelle Rückfallrisiko, was in die Therapieempfehlungen einfliessen soll. Denn nicht alle prämenopausalen Patientinnen profitieren von einer OS. Diejenigen mit hoch eingestuftem Rückfallrisiko zeigen den grössten Nutzen. Dies sind insbesondere Patientinnen, die aufgrund der Risikokonstellation (Tab. 1) eine Chemotherapie erhalten haben und nach Chemotherapie-Ende im Verlauf wieder prämenopausal wurden sowie sehr junge Patientinnen < 35 Jahre. In den 8 Jahres-Daten der TEXT- und SOFT Studie zeigte sich in der Gruppe der Patientinnen mit hohem Risiko, welche eine Chemotherapie erhalten haben ein krankheitsfreies Überleben mit Tamoxifen alleine von 71%, bei Tamoxifen + OS von 77% und bei Aromatasehemmer + OS von 80%. Dabei ist die OS in Kombination mit einem Aromatasehemmer der Kombination mit Tamoxifen überlegen. Dieser Unterschied war bei Frauen mit niedrigem oder mittlerem Risiko deutlich geringer und rechtfertigt in Anbetracht der Nebenwirkungen und konsekutiv schlechteren Lebensqualität (Tab. 2) unter ausgedehnter endokriner Therapie die OS nicht. Die Daten zum Gesamtüberleben sind nach 8 Jahren follow up-noch nicht reif. Ein geringer Vorteil auf das Gesamtüberleben konnte jedoch bei der Hochrisikogruppe der Patientinnen mit vorgängiger Chemotherapie gezeigt werden, auch wenn bei der Gesamtpopulation die OS auf das Gesamtüberleben nach 8 Jahren noch keinen Einfluss hat.
Daten zur optimalen Therapiedauer
Die Standard Therapiedauer der adjuvanten endokrinen Therapie mit Tamoxifen ist 5 Jahre. Daten haben jedoch gezeigt, dass eine erweiterte Therapiedauer das krankheitsfreie Überleben und teils das Gesamtüberleben verlängern kann. Um die verlängerte Tamoxifengabe über 10 Jahre gegenüber 5 Jahren zu vergleichen wurden in der ATLAS- und aTTom Studie, 5- gegenüber 10 Jahren Tamoxifen randomisiert und nicht Plazebo-kontrolliert untersucht (6). Unabhängig vom Menopausenstatus zeigte sich eine Reduktion der Brustkrebsrezidivrate nach 10 Jahren um 25% und eine Senkung der Brustkrebssterblichkeit um 29%. Auch hier zeigte sich nach den 10 Jahren Tamoxifen ein therapeutischer Effekt (carryover Benefit), welcher nach den 10 Therapiejahren weiter anhielt. Somit ist eine 10-jährige Therapiedauer mit Tamoxifen insbesondere bei jungen Patientinnen sinnvoll, sofern die Patientin während der 10 Jahre prämenopausal bleibt. Sollte sie während der erweiterten Therapiedauer postmenopausal werden, ist der Nutzen einer Aromatasehemmertherapie grösser mit Empfehlung zur Therapieumstellung (7).
Von einer erweiterten Therapiedauer profitieren jedoch nicht alle Patientinnen gleich stark, wonach der Entscheid darüber nach individueller Nutzen-Risiko-Abwägung getroffen werden sollte (8). Erneut profitieren Patientinnen mit hohem Rückfallrisiko (nodal positiv, grössere Tumoren, höheres Grading, junges Erkrankungsalter) stärker, so dass ein entsprechend grösseres Nebenwirkungsrisiko durch die Therapieverlängerung gerechtfertigt werden kann. Bedenken bestehen insbesondere betreffend erhöhter Inzidenz thromboembolischer Ereignisse unter Tamoxifen. Eine erhöhte Inzidenz des Endometriumkarzinoms als Nebenwirkung des Tamoxifens ist in der Postmenopause nur geringfügig erhöht und stellt in der Prämenopause kein Risiko dar. Somit ist die Verschreibung einer erweiterten Tamoxifentherapie über 10 Jahre bei entsprechender Indikation bedenkenlos (6). (Zusammenfassend siehe Tab. 3).
Die postmenopausale Patientin
Sowohl Tamoxifen wie auch Aromataseinhibitoren sind bei der postmenopausalen Patientin zur adjuvanten Therapie zugelassen. Fünf Jahre Aromatasehemmer sind gegenüber 5 Jahren Tamoxifen im Gesamtüberleben klar überlegen (9). Fünf Jahre Kombinationstherapie, bestehend aus Tamoxifen und einem Aromatasehemmer in der Sequenz über insgesamt 5 Jahre wurde ebenfalls in Studien untersucht. Eine Verbesserung des krankheitsfreien Überlebens in der Sequenz (Tamoxifen 2-3 Jahre gefolgt von einem Aromatasehemmer über 2-3 Jahre) im Vergleich zur alleinigen Tamoxifen-Therapie konnte ebenso gezeigt werden. Die Sequenz ist jedoch der alleinigen Therapie mit einem Aromatasehemmer etwas unterlegen. Somit gilt die Empfehlung zu einer 5-jährigen Aromatasehemmer-Therapie bei der postmenopausalen Frau als Standard (10). Bei ausgeprägten Nebenwirkungen unter Therapie mit einem Aromatasehemmer kann, ohne therapeutisch signifikanten Nachteil, nach 2-3 Jahren auf Tamoxifen gewechselt werden (11). Die alleinige Tamoxifentherapie kann in der Postmenopause bei niedrigem Risiko (nodal negativ, tubuläre Histologie, hoher Differenzierungsgrad) in Anbetracht der Nebenwirkungsprofile durchaus verschrieben werden (8). Bei höher eingestuftem Rückfallrisiko oder lobulärer Histologie besteht ein deutlicher Vorteil zu Gunsten der Aromatasehemmertherapie (12).
Erweiterte endokrine Therapie in der Postmenopause
In der Metaanalyse von Pan et al. (13) wurde das 20 Jahre Rückfallrisiko nach Sistieren einer 5-jährigen endokrinen Therapie untersucht mit der Frage nach dem Vorteil einer erweiterten endokrinen Therapie über 10 Jahre; auch nach 5 Jahren Aromatasehemmer. Ein stetiger Anstieg der Fernrezidivrate über die nächsten 15 Jahre könnte eine Begründung für das Fortführen der endokrinen Therapie nach 5 Jahren sein. Nimmt eine Patientin während 5 Jahren Tamoxifen ein und wechselt bei Eintritt in die Menopause auf einen Aromatasehemmer, kann sie ihr Rückfallrisiko für die nächsten 5 Jahre signifikant um 1/3 reduzieren. Wenn die Patientin nach 5 Jahren Aromatasehemmer-Therapie den Aromatasehemmer weiterführt, zeigt sich dieser deutliche Vorteil nicht innerhalb der nächsten 2-5 Jahre. Dies gründet auf dem carryover Benefit der Aromatasehemmer. Bis sich ein Vorteil herauskristallisiert dauert es länger, hält aber wahrscheinlich nach 10 Jahren weiter an. Die stärksten Einflussfaktoren auf die jährliche Rückfallrate waren dabei der Nodalstatus (insbesondere bei ≥ 4 befallenen Lymphknoten) sowie die Tumorgrösse, worauf der Vorteil zur Fortführung der endokrinen Therapie gründet. Je grösser der Tumor und je ausgedehnter der Lymphknotenbefall, desto grösser der Vorteil zur erweiterten endokrinen Therapie im Hinblick auf die Fernrezidivrate und die Mortalität. Dies im Gegenzug zu einer erhöhten Rate anhaltender, postmenopausaler Beschwerden (Hitzewallungen, Fatigue, Arthralgien, Myalgien, kardiovaskuläre Nebenwirkungen, neu aufgetretene Osteoporose oder Knochenfrakturen). Die Abschätzung des Rückfallrisikos, das individuelle Sicherheitsbedürfnis und die Toxizität unter anhaltender endokriner Therapie sind tägliche Herausforderungen in der Beratung der endokrin sensitiven Patientin. (Zusammenfassend siehe Tab. 4).
Neue Substanzgruppen in der Adjuvanz
Die CDK 4/6 Inhibitoren
Die zugelassenen CDK 4/6 Inhibitoren (Palbociclib, Ribociclib und Abemaciclib) stellen in Kombination mit Aromatasehemmern oder Fulvestrant bei hormonsensitivem, Her2 negativem, metastasiertem Brustkrebs eine Standardtherapie dar. In den Zulassungsstudien konnte einheitlich eine Verdopplung des krankheitsfreien Überlebens im Vergleich zur alleinigen endokrinen Therapie gezeigt werden (14). Der Vorteil dieser Substanzgruppe betreffend krankheitsfreiem Überleben und Gesamtüberleben in der Adjuvanz wird in aktuell laufenden Studien untersucht. In der PALLAS-Studie (bereits geschlossen), einer randomisierten, nicht Plazebo-kontrollierten Phase III Studie wird die Kombination Palbociclib und Standard endokrine Therapie versus Standard endokrine Therapie alleine bei Hormonrezeptor positivem, HER2 negativem, nicht metastasiertem Brustkrebs untersucht. Dabei wird Palbociclib im Untersuchungsarm die ersten 2 Jahre der insgesamt 5 Jahre Aromatasehemmertherapie (+/- OS) eingenommen. Primärer Endpunkt ist das invasive krankheitsfreie Überleben. In verschiedenen Phase II Studien in der Neoadjuvanz liegt der Focus unter anderem auf der Identifikation von Biomarkern, die Patienten identifizieren können, welche von einer CDK 4/6 Inhibitor-Therapie profitieren. Andrerseits wird auch die Effizienz der CDK 4/6 Inhibitoren im Vergleich zu einer Chemotherapie verglichen. Ob die CDK 4/6 Inhibitoren zukünftig in der (neo-) Adjuvanz Standard sein werden, wird sich erst zeigen.
Brustzentrum
Klinik für Gynäkologie
Universitätsspital Zürich
Frauenklinikstr. 10
8091 Zürich
denise.vorburger@usz.ch
Brustzentrum
Klinik für Gynäkologie
Universitätsspital Zürich
Frauenklinikstr. 10
8091 Zürich
K.D.: Beraterhonorare und Kongresskostenbeteiligung von Roche, Astrazeneca, Eli Lilly und Amgen.
- Bei hohem Rückfallrisiko in der Prämenopause, insbesondere bei jungem Erkrankungsalter und hohem Risiko bietet die ovarielle Suppression in Kombination mit einem Aromatasehemmer einen zusätzlichen Vorteil in Bezug auf das krankheitsfreie Überlegen als auch auf das Gesamtüberleben.
- Eine verlängerte Tamoxifengabe für gesamthaft 10 Jahre verbessert das Gesamtüberleben insbesondere in der 2. Dekade nach Erkrankung (carryover Benefit) und ist insbesondere bei jungen Patientinnen zu empfehlen.
- Die verlängerte Therapie mit einem Aromatasehemmer über mehr als 5 Jahre nach Aromatasehemmer-Vorbehandlung kann bei hohem Rückfallrisiko, insbesondere in Anbetracht des Lymphknotenbefalls (≥ 4 Lymphknoten) und grosser Tumorgrösse (T3/T4) mit der Patientin diskutiert werden. Immer unter Einbezug der Toxizitäten und anhaltender Therapie.
- Die Wirksamkeit und der Nutzen der CDK 4/6 Inhibitoren (bekannt bei metastasiertem, endokrin sensitivem Brustkrebs) in der (neo-)Adjuvanz werden zurzeit in Studien geprüft.
Message à retenir
- Chez la patiente en préménopause avec un haut risque de rechute
(surtout chez la patiente jeune dont la tumeur présente d’autres
facteurs de haut risque de récidive), la suppression de la fonction
ovarienne associée au traitement par inhibiteur de l’aromatase apporte un avantage supplémentaire, et ceci pour la survie sans récidive comme pour la survie globale. - Le prolongement du traitement par tamoxifen à 10 ans au total améliore la survie globale, surtout dans les 10 ans après l’arrêt du médicament (carryover benefit). Cette manière de traiter est donc à recommander surtout chez la patiente jeune.
- Il est justifié de discuter la poursuite du traitement par inhibiteur de l’aromatase après 5 ans de prétraitement quand la patiente présente un risque de rechute élevé (en particulier ≥ 4 ganglions positifs et grosse tumeur (T3/T4)). Cette discussion doit prendre en compte la toxicité sous traitement prolongé.
- Le bénéfice et l’efficacité d’un traitement par inhibiteur CDK 4/6 (admis pour les cancers hormono-sensibles métastasés) dans la situation (néo-)adjuvante sont actuellement sous étude.
Literatur:
1. (EBCTCG) EBCTCG. Relevance of breast cancer hormone receptors and other factors to the efficacy of adjuvant tamoxifen: patient-level meta-analysis of randomised trials. The Lancet. 2011;378(9793):771-84.
2. Goldhirsch A, Winer EP, Coates AS, Gelber RD, Piccart-Gebhart M, Thurlimann B, et al. Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013. Ann Oncol. 2013;24(9):2206-23.
3. Pagani O, Regan MM, Walley BA, Fleming GF, Colleoni M, Lang I, et al. Adjuvant exemestane with ovarian suppression in premenopausal breast cancer. N Engl
J Med. 2014;371(2):107-18.
4. Regan MM, Francis PA, Pagani O, Fleming GF, Walley BA, Viale G, et al. Absolute Benefit of Adjuvant Endocrine Therapies for Premenopausal Women With Hormone Receptor–Positive, Human Epidermal Growth Factor Receptor 2–Negative Early Breast Cancer: TEXT and SOFT Trials. Journal of Clinical Oncology. 2016;34(19):2221-31.
5. Francis PA, Pagani O, Fleming GF, Walley BA, Colleoni M, Láng I, et al. Tailoring Adjuvant Endocrine Therapy for Premenopausal Breast Cancer. New England Journal of Medicine. 2018;379(2):122-37.
6. Davies C, Pan H, Godwin J, Gray R, Arriagada R, Raina V, et al. Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years after
diagnosis of oestrogen receptor-positive breast cancer: ATLAS, a randomised trial. The Lancet. 2013;381(9869):805-16.
7. Goss PE, Ingle JN, Pritchard KI, Robert NJ, Muss H, Gralow J, et al.
Extending Aromatase-Inhibitor Adjuvant Therapy to 10 Years. N Engl J Med. 2016;375(3):209-19.
8. Empfehlungen gynäkologische Onkologie Kommission Mamma. 2018(Version 21.11.2018).
9. (EBCTCG)* EBCTCG. Aromatase inhibitors versus tamoxifen in early breast cancer: patient-level meta-analysis of the randomised trials. The Lancet. 2015;386(10001):1341-52.
10. Coates AS, Winer EP, Goldhirsch A, Gelber RD, Gnant M, Piccart-Gebhart M,
et al. Tailoring therapies–improving the management of early breast cancer:
St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015. Ann Oncol. 2015;26(8):1533-46.
11. Regan MM, Neven P, Giobbie-Hurder A, Goldhirsch A, Ejlertsen B, Mauriac L, et al. Assessment of letrozole and tamoxifen alone and in sequence for postmenopausal women with steroid hormone receptor-positive breast cancer: the BIG 1-98 randomised clinical trial at 8·1 years median follow-up. The Lancet
Oncology. 2011;12(12):1101-8.
12. Metzger Filho O, Giobbie-Hurder A, Mallon E, Gusterson B, Viale G, Winer EP, et al. Relative Effectiveness of Letrozole Compared With Tamoxifen for Patients With Lobular Carcinoma in the BIG 1-98 Trial. J Clin Oncol. 2015;33(25):2772-9.
13. Pan H, Gray R, Braybrooke J, Davies C, Taylor C, McGale P, et al. 20-Year Risks of Breast-Cancer Recurrence after Stopping Endocrine Therapy at 5 Years. N Engl J Med. 2017;377(19):1836-46.
14. Kwapisz D. Cyclin-dependent kinase 4/6 inhibitors in breast cancer: palbociclib, ribociclib, and abemaciclib. Breast Cancer Res Treat. 2017; 166 (1): 41-54.
info@gynäkologie
- Vol. 9
- Ausgabe 3
- Juni 2019







