- Das Mikrobiom peripartal – was wissen wir darüber?
Über ein Jahrhundert galt das Paradigma, dass der Fet in einer sterilen Umgebung heranwächst und erst durch die Geburt sein Mikrobiom erhält und bildet. Neue Forschungen stellen diese Hypothese in Frage und postulieren eine «in utero-Kolonisation». Sollten diese Erkenntnisse zutreffen, hätte dies einen grossen Einfluss auf das Verständnis der fetomaternalen Einheit.
Henri Tissier hat 1899 als Erster das Bifidus Bakterium isoliert. Der französische Pädiater arbeitete am Pasteur-Institut in Paris und untersuchte Stuhlproben von Säuglingen. Dabei stellte er einen Unterschied zwischen gestillten und nicht gestillten Kindern fest. Die Stuhlproben der gestillten Kinder zeigten eine Dominanz von Bifidusbakterien, ein Bakterium, dem gute Eigenschaften zugesprochen wurden. Heute wissen wir, dass eben diese Bakterien einen positiven Einfluss auf unsere Darmflora haben und als Therapeutikum eingesetzt werden.
Gemäss Henri Tissier wächst der Fet in einer sterilen Umgebung auf und wird erst durch die Geburt und das Stillen mit Bakterien besiedelt. Lange Zeit herrschte die Meinung, dass jedes Bakterium, das in utero nachgewiesen wurde, pathogen sei. Die Forschung der folgenden Jahre konzentrierte sich dann auch darauf und schnell war der Zusammenhang zwischen Infektionen und Aborten oder Frühgeburten klar (1). Über ein Jahrhundert behauptete sich dieses Dogma des «sterile womb». Bei dieser Theorie stellt die feto-maternale Einheit ein steriles System dar: Plazenta, Fruchtwasser und fetaler Darm sind «keimfrei». Die ersten Mikroben werden erst durch die Geburt akquiriert und später wird das kindliche Mikrobiom durch das Stillen weiter angereichert.
Wird das Kind vaginal geboren, so handelt es sich um die mütterlichen Bakterien der Vagina und des Darmes; wird es per Sectio geboren, so wird es vor allem von Hautkeimen der Mutter und Bakterien der Spitalumgebung besiedelt (2-4).
Die Rolle der «Sooners»
Aber ist das wirklich so? Oder gibt es sogenannte «Sooners»? So nannte man die europäischen Siedler, die im 19. Jahrhundert das Gebiet Oklahoma bevölkert haben, bevor das Land offiziell freigegeben wurde. Es entstand die Hypothese der «in utero Kolonisation». Dabei beginnt die Kolonisierung lange vor der Geburt. Die mütterlichen Keime gelangen via Plazenta und Fruchtwasser zum Feten. In vielen Studien konnten dank neuer Techniken mit der Möglichkeit der DNA Sequenzierung, Bakterien in der Plazenta, im Fruchtwasser und im Mekonium nachgewiesen werden. Es handelte sich um kommensale Bakterien, nicht um pathogene Keime (5).
Das feto-maternale System bildet eine symbiotische Einheit, bei der Mutter und Kind in Abhängigkeit voneinander dafür sorgen, dass die Schwangerschaft intakt bleibt und sich das Kind normal entwickeln kann. Nun kommt aber das mütterliche Mikrobiom dazu. Es bildet wiederum mit der Mutter eine eigene symbiotische Kommune, das sogenannte Holobiont, zusammengesetzt aus verschiedenen Spezies, die meisten davon sind Bakterien. Diese metabolisieren Nährstoffe, und somit ist das Blut, das den Feten erreicht, durch diese Mikroben verändert worden (30-35% der Metaboliten im mütterlichen Blut sind bakteriellen Ursprungs). Wenn das Gefüge aus dieser Sicht betrachtet wird, also Holobiont (Mutter und ihr Mikrobiom) und Fet, so ist es fast nicht vorstellbar, dass keine Interaktion zwischen dem mütterlichen Mikrobiom und dem Feten stattfindet. Und da Mikrobiota ein wichtiger Stimulus für die Entwicklung des Immunsystems sind, würde gemäss dieser Vorstellung die Immunoprogrammierung deutlich früher beginnen als bisher angenommen.
Mit der Geburt beginnt für den Feten ein Prozess: die Symbiose zu verlassen und eine neue, eigene zu bilden. Nach der Geburt wird dann das kindliche Mikrobiom weiter ausgebildet, zum Beispiel durch den Einfluss der Ernährung. Das Zusammenspiel zwischen Mensch und seinen Mikrobiom geht also weiter, d.h. es bleibt immer eine Abhängigkeit, oder anders gesagt: man ist immer ein Holobiont (5).
Dass der Geburtsmechanismus eine entscheidende Rolle bei der Bildung des kindlichen Mikrobioms spielt, ist unbestritten. Vaginal geborene Kinder zeigen eine Dominanz von Lactobacillen und Prevotella spec, also analog der mütterlichen Vagina und des Darmes. Bei Kindern, die via Sectio entbunden werden, dominieren Staphylokokken, Corynebakterien und Propionbakterien vor, analog zu Hautkeimen, oralen Bakterien und Bakterien aus der Spitalumgebung. In vielen Studien wurde dieser Unterschied nachgewiesen. Sectio-geborene Kinder haben deutlich weniger Diversität in ihrem Mikrobiom, und es dauert ca. ein Jahr, bis sie dieses Defizit aufgeholt haben (2). Ein Konzept, diese Situation zu verbessern ist das vaginal seeding. Dabei wird eine zuvor in die Scheide gelegte Gaze postpartal über Mund und Nase des Neugeborenen gewischt. Aufgrund der Datenlage wird von diesem Prozedere aber ausserhalb von Studien abgeraten (6, 7).
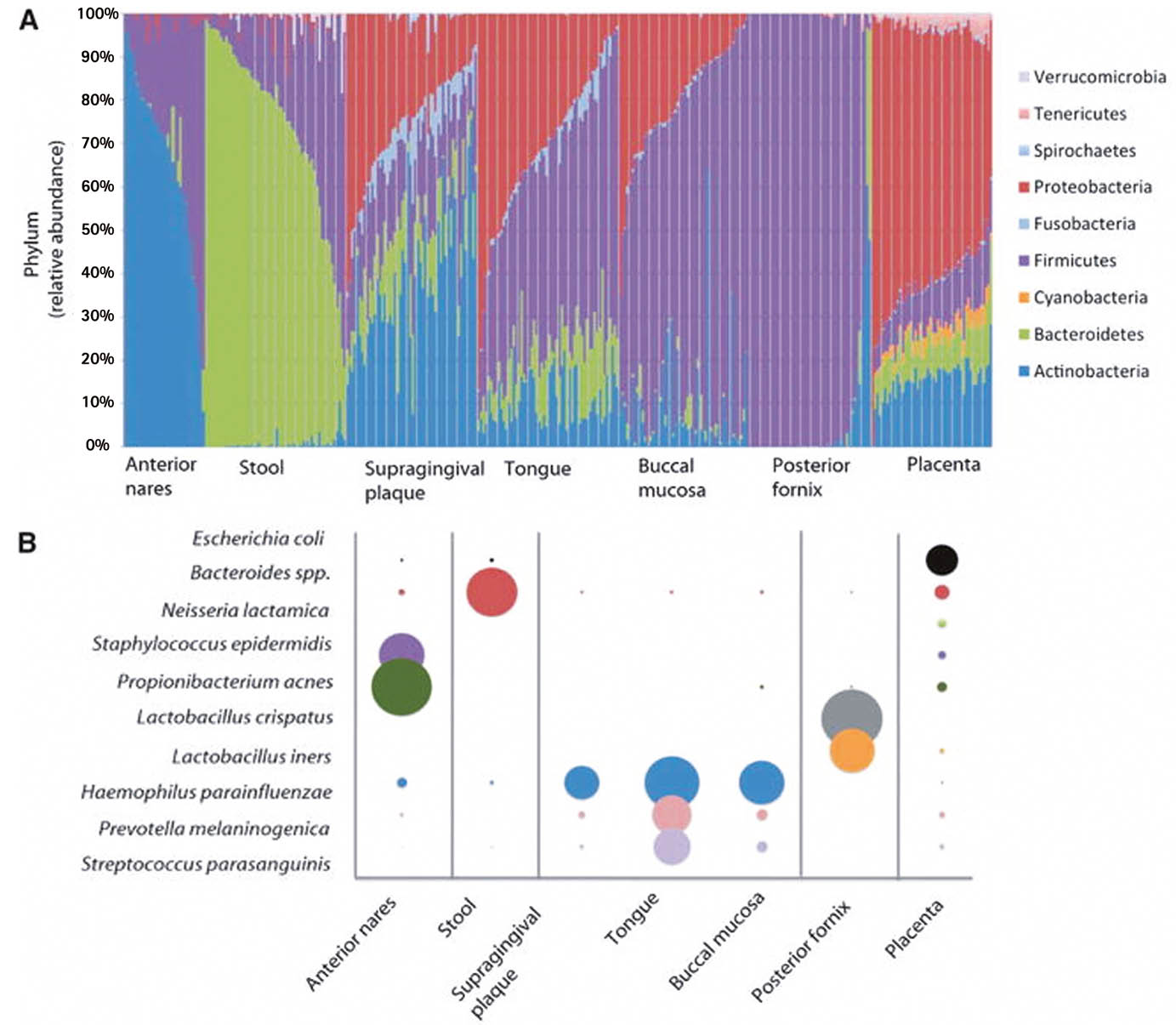
A: Grösste Ähnlichkeit der Mikrobiome zwischen dem Mikrobiom (Dominanz Proteobakterien) der Plazenta und dem der Mundschleimhaut (Rachen, Speichel, Zahnfleisch)
B: Der Stamm der Proteobakterien (Art: E.coli) ist in der Plazenta am meisten vertreten.
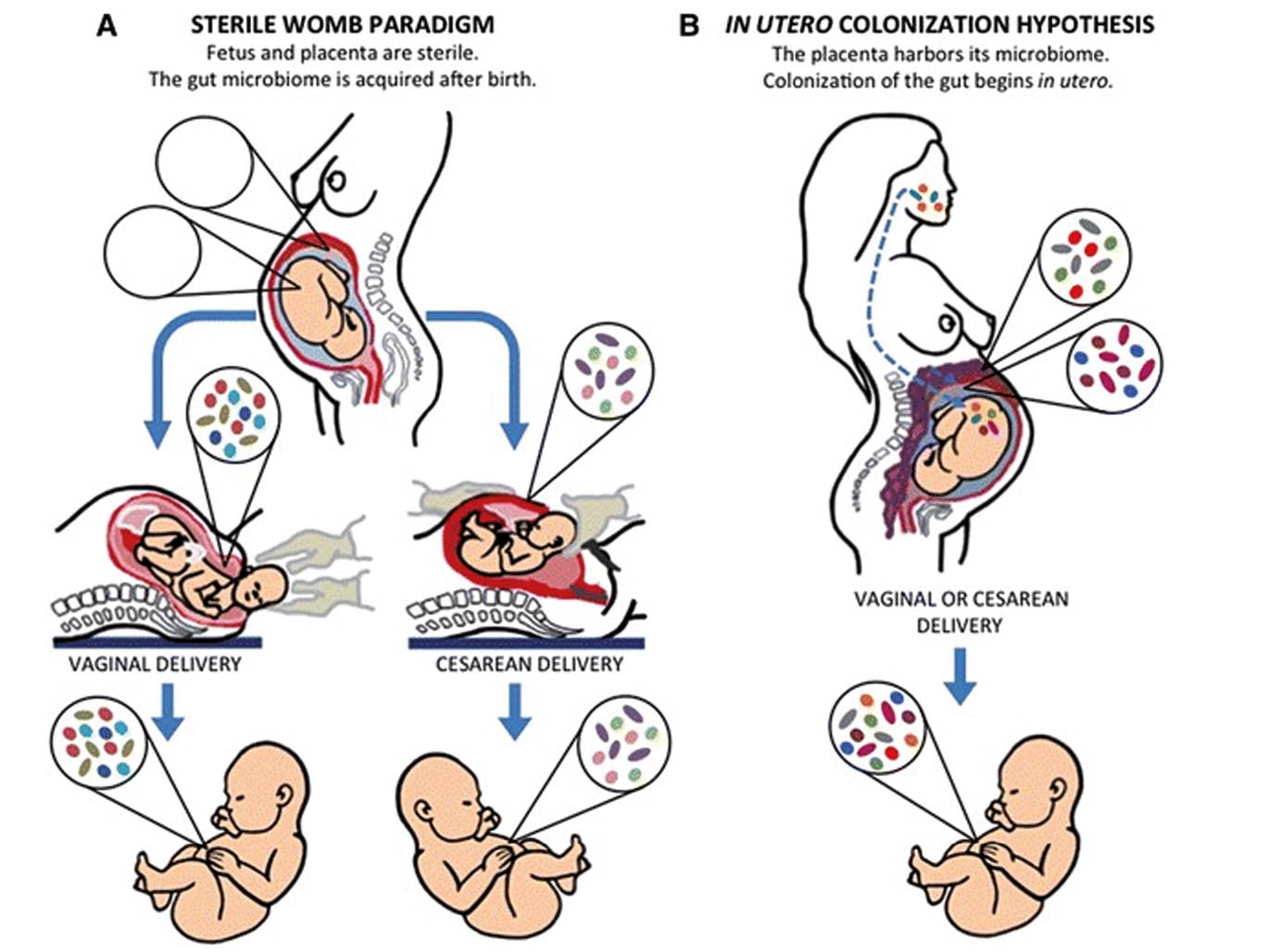
colonization, wo der Fet bereits präpartal Kontakt mit einem plazentaren Mikrobiom hat, das seinen Ursprung im mütterlichen Darm und Mund-Rachenraum hat. (nach Ref. 14)
Was stellt die Mutter zur Verfügung?
Koren et al. haben Stuhlproben von Schwangeren untersucht (8). Dabei wurde ein Unterschied im Mikrobiom zwischen dem ersten und dritten Trimester deutlich. Im dritten Trimenon beobachtete man eine relative Häufung von Proteo- und Actinobakterien. Im Mäuseexperiment wurden die verschiedenen Stuhlproben auf sterile Mäuse übertragen. Mäuse, die Stuhl von Schwangeren im 3. Trimenon erhielten, entwickelten ein metabolisches Syndrom (Adipositas und Insulinresistenz), also eine Stoffwechsellage, die in der Schwangerschaft grundsätzlich für das Wachstum des Feten sinnvoll ist und auf die Laktation vorbereitet. Eine andere Forschungsgruppe um Jimenez stellte die Hypothese auf, dass das maternale Darmmikrobiom auf den Feten übertragen würde (9). Sie konnte dies anhand eines Mäusemodells auch bestätigen. Schwangere Mäuse wurden mit genetisch markiertem Enterococcus faecium gefüttert und dann via Sectio entbunden. Bei den Nachkommen konnte im Mekonium E. faecium mit dem genetischen Label nachgewiesen werden, hingegen gab es in der Kontrollgruppe keinen Nachweis. Damit bewiesen Jimenez et al. dass von der Mutter oral aufgenommene Bakterien in den fetalen Darm aufgenommen werden können. Doch wie gelangen diese «Sooners» dorthin und wo ist ihr Ursprungsort? Dieser Frage ist die Gruppe um Aagard et al. nachgegangen (10). Sie untersuchten 320 humane Plazenten und haben diese mit anderen Körperregionen (Mund-Nase-Rachenraum, Vagina und Darm) verglichen. Dabei haben die Forschenden die grösste Ähnlichkeit der Mikrobiome zwischen dem Mikrobiom der Plazenta und dem der Mundschleimhaut (Rachen, Speichel, Zahnfleisch) beobachten können (Abb. 1A). Das Vorkommen der einzelnen Bakterienstämme der sieben Körperregionen wurde untersucht und auch die relative Prävalenz gemessen. Wie in Abbildung 1 B zu sehen, ist der Stamm der Proteobakterien (Art: E.coli) in der Plazenta am meisten vertreten. Nach wie vor ist aber der Weg der Bakterien von der Mundschleimhaut zum Feten nicht vollständig geklärt. Klar ist, dass die dendritischen Zellen dabei eine Schlüsselrolle spielen. Am Beispiel des Darmes lässt sich folgender Weg vorstellen (man stellt sich einen analogen Weg beim oralen Ursprungsort vor). Die dendritischen Zellen nehmen die Bakterien aus dem intestinalen Lumen auf, transportieren sie durch das Darmepithel und dann via intestinale Lymphbahnen zu den mesenterialen Lymphknoten. Dort werden die Bakterien den Lymphozyten präsentiert und gelangen so in die Blutbahn und schliesslich zur Plazenta. Dort existiert eine lymphoide Region, die in der Lage ist, dendritische Zellen zu empfangen. Im Tierexperiment konnte eine gesteigerte Aktivität eben dieser Region beobachtet werden. Der Fet nimmt schliesslich die Bakterien via Plazenta auf, verdaut sie und scheidet sie im Mekonium aus (3, 11). Collado et al. haben Mekoniumproben untersucht und dabei Ähnlichkeiten mit dem Mikrobiom von Fruchtwasser und Plazenta feststellen können (12). Eine andere Studie sah in diesem Zusammenhang eine Möglichkeit zur Prävention. Sie untersuchten Stuhl-Mikrobiom von Schwangeren und verglichen dieses mit der mütterlichen Gewichtszunahme während der Schwangerschaft. Dabei wurde eine Assoziation zwischen mütterlichem Mikrobiom und Gewichtszunahme beobachtet. Somit wäre eine Modifikation des Mikrobioms ein möglicher Ansatzpunkt zur Prävention von Adipositas (3, 13).
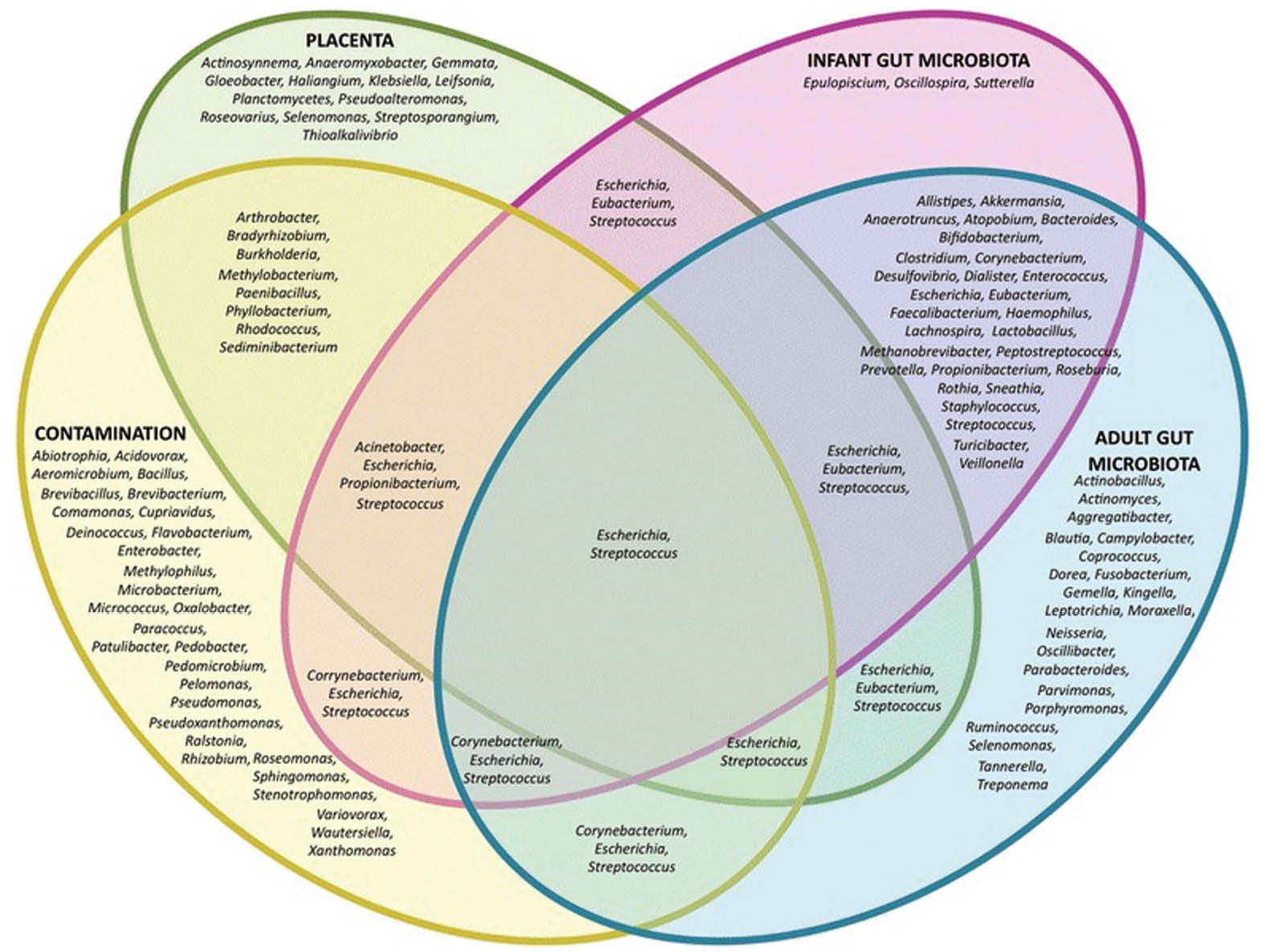
36% der Bakterienarten sind auch bei kontaminierten Proben zu finden. (nach Ref. 14)
Die Hypothese der in utero Kolonisation
Wenn wir also diese neue Hypothese, die in utero Kolonisation ernst nehmen und davon ausgehen, dass die Besiedelung des Feten lange vor der Geburt stattfindet, indem die Mutter dem Feten ihr Mikrobiom überträgt, verabschieden wir uns vom Paradigma des «sterilen Bauches», welches über ein Jahrhundert vorherrschend war. Dies hätte eine grosse Auswirkung auf das Verständnis der fetomaternalen Einheit, auf die Entwicklung des Immunsystems und die Evolution im Allgemeinen. Liest man die vielen Studien, die eben diese Zusammenhänge beobachtet haben, so erscheint einem das auch plausibel (Abb. 2). Doch es gibt auch kritische Stimmen. In einer Übersichtsarbeit von Maria Perez wurden beide Hypothesen unter die Lupe genommen. Das abschliessende Urteil war ernüchternd: Die Evidenz für eine in utero Kolonisation sei sehr schwach. Bei allen Arbeiten konnten lediglich sehr niedrige Raten an bakterieller DNA nachgewiesen werden, nirgends gab es eine positive bakteriologische Kultur und somit kein Nachweis von «lebenden» Mikroben. Bei fehlenden Kontrollgruppen sei eine Kontamination nicht vollständig ausgeschlossen. Diese falsch positiven Resultate seien gerade bei niedriger Biomasse wahrscheinlich, wie das bei der Plazenta vorliegt (Abb. 3). Der angenommene Weg der Bakterien via Plazenta sei aufgrund der Anatomie nicht möglich, da die Plazentaschranke kommensale Bakterien nicht passieren lassen würde. Zudem macht sich die Autorin Gedanken, dass durch die neuen Erkenntnisse der Geburtsmodus an Wichtigkeit verlieren und somit in den Hintergrund rücken würde (14).
Sterile womb oder in utero-Kolonisation? Die Frage ist nach wie vor nicht vollends beantwortet. Die Studien und Tierexperimente zeigen zwar mögliche Wege und bieten Erklärungen für eine präpartale Kolonisation. Aber auch die Kritikpunkte gilt es zu beachten, auch sie scheinen plausibel. Das Thema bleibt spannend und es sind sicher noch weitere Untersuchungen notwendig, damit wir definitiv wissen, ob wir in utero «Sooners» bewirten oder nicht.
Stadtspital Triemli
Birmensdorferstrasse 497
8063 Zürich
Natalia.Conde@triemli.zuerich.ch
Die Autorin hat keine Interessenskonflikte in Zusammenhang mit diesem Artikel.
- Gegenübergestellt werden zwei Hypothesen: das sterile womb Paradigma und die Hypothese der in utero-Kolonisation.
- In vielen Studien konnte dank moderner Techniken bakterielle DNA in Plazenta, Fruchtwasser und Mekonium nachgewiesen werden.
- Wenn die in utero Kolonisation tatsächlich bestätigt würde, hätte dies eine grosse Auswirkung auf das Verständnis der fetomaternalen Einheit, der Entwicklung des Immunsystems und die Evolution im Allgemeinen.
- Es gibt kritische Stimmen, die die Evidenz für eine in utero Kolonisation als sehr schwach bezeichnen.
1. Prince AL.; The placental microbiome is altered among subjects with spontaneous preterm birth with and without chorionamnionitis, Am J Obstet Gynecol 2016; 214(5): 627
2. Kundu P, Our gut microbiome: The Evolving Inner Self, Cell 2017; 171, Dec 14
3. Stinson LF., Planting the seed: Origins, composition, and postnatal health significance of fetal gastrointestinal microbiota, Ciritcal reviews in microbiology 2017; Vol 43, No 3; 352-369
4. Funkhouser LJ., Mom knows best: The Universality of matgernal microbiome transmission, PLOS Biology 2013; 11(8)
5. Gilbert SF., Al holobiont birth narrative: The epogenetic transmission oft he huan microbiome, Frontiers in Genetics 2014; Vol 5, Article 282
6. Committee Opinion No.725, Obstet Gynecol. 2017; 130(5):1178
7. Haahr T., Vaginal seeding or vaginal microbial transfer from the mother tot he caesarean-born neonate: a commentary regarding clinical management, BJOG, 2018;125(5):533
8. Koren O, Host remodelling oft he gut microbiome and metabolic changes during pregnancy, Cell 2012; 150(3): 470-480
9. Jiménez E, Is meconium from healthy newborns actually sterile? Res Microbiol 2008; 159:187-93
10. Aagaard K, The placenta harbors a unique microbiome, Sci Transl Med 2014; 6(237)
11. Bischoff SC, Darm und Immunsystem: Abwehr aus dem Bauch heraus, Ars medici 2014
12. Collado MC, Human gut colonisation may initiated in utero by distinct micobial communities in the placenta and amniotic fluid, Scientific Reports 2015; 6:23129
13. Collado MC, Distinct compostion of gut microbiota during pregnancy in overweight and normal-weight women, Am J Clin 2008; 88(4):894-9
14. Perez-Muñoz ME, A critical assessment of the «sterile womb» and «in utero colonisation» hypotheses: implications for research on the pioneer infant microbiome, Microbiome 2017; 5:48
info@gynäkologie
- Vol. 9
- Ausgabe 1
- Februar 2019






