- Diabetes mellitus Typ 1 in der Schwangerschaft
Ein vorbestehender Diabetes mellitus stellt in der Schwangerschaft eine Herausforderung für das gesamte Behandlungsteam dar. Die Betreuung umfasst eine präkonzeptionelle Beratung sowie eine engmaschige interdisziplinäre Betreuung während der Schwangerschaft, Geburt und Postpartum. In folgendem Artikel möchten wir speziell auf die verschiedenen Aspekte eines Diabetes mellitus Typ 1 (T1DM) in der Schwangerschaft eingehen.
Une grossesse chez une femme avec diabète sucré préexistant représente un vrai défi pour toute l’ équipe médicale la prenant en charge. Cette prise en charge va du counselling préconceptionnel à l’accompagnement étroit interdisciplinaire pendant toute la grossesse, l’ accouchement et le postpartum. L’ article présent donne un aperçu sur les différents aspects d’ un diabète sucré de type 1 (T1DM) pendant la grossesse.
Pathophysiologie
T1DM ist eine progrediente, zell-vermittelte Autoimmunerkrankung der insulinproduzierenden ß-Zellen in den Langerhans´schen Inseln des Pankreas (1). Im Gegensatz zu anderen Diabetesformen fehlt bei Patientinnen mit einem T1DM die endogene Insulinproduktion, insofern ist eine stetige exogene Insulinzufuhr, auch ausserhalb der Schwangerschaft, zwingend. Genetische Faktoren können prädisponierend sein, jedoch besteht nur bei 10% der Menschen mit T1DM eine positive Familienanamnese. Die Prävalenz eines T1DM liegt bei ca. 0.2-0.5% der Schwangerschaften (3).
Die Insulinsensitivität verändert sich im Schwangerschaftsverlauf. In der Frühschwangerschaft ist die Insulinsensitivität erhöht, weshalb Schwangere mit einem T1DM im ersten Trimenon ein erhöhtes Hypoglykämierisiko aufweisen (4). Ab der 16. Schwangerschaftswoche (SSW) nimmt die Insulinresistenz bis zur 36. SSW kontinuierlich zu. Während dieser Zeit kommt es zu einer stetigen Zunahme des Insulinbedarfs.
Mütterliche wie fetale Schwangerschaftskomplikationen, wie erhöhte mütterliche Mortalität und Morbidität, perinatale Mortalität des Kindes, kongenitale Fehlbildungen, Frühgeburten, Präeklampsie und Sectio können die Schwangerschaft bei T1DM verkomplizieren (5). Vor allem in der Frühschwangerschaft reagiert die Plazenta empfindlich auf metabolische und inflammatorische Störungen des mütterlichen Stoffwechsels. Die Plazenta kann durch die Zunahme an oxidativem Stress zu reduziertem Wachstum mit der Entwicklung einer Plazentainsuffizienz oder auch zu einem übermässigen Wachstum und verstärktem feto-maternalen Glukosetransport mit der Entwicklung einer Makrosomie und einer Organomegalie des Kindes führen. In der Frühschwangerschaft besteht ein enger Zusammenhang zwischen dem HbA1c-Wert und der kindlichen Fehlbildungsrate sowie der kindlichen Mortalität. Daher ist eine Optimierung der Blutzuckereinstellung bereits präkonzeptionell wichtig.
Präkonzeptionelle Beratung und Stoffwechseloptimierung
Schwere Fehlbildungen kommen in durchschnittlich 8% der Schwangerschaften mit T1DM vor (6). Eine gute perikonzeptionelle Stoffwechseleinstellung kann das Risiko für Abort und für eine diabetische Embryopathie auf das Risiko von nicht-diabetischen Schwangeren reduzieren. Der perikonzeptionelle HbA1c-Wert spielt hierbei eine wichtige Rolle (6, 7). Präkonzeptionell wird ein HbA1c-Wert < 7% während mindestens 3 Monate angestrebt. Sofern Hypoglykämien weitestgehend vermieden werden können, wird ein HbA1c-Wert < 6.5% als optimaler Grenzwert angesehen. Neben einer Anpassung der Insulintherapie ist eine Besprechung von Lifestyle-Massnahmen, insbesondere bei Übergewichtigen, wichtig. Die Familienplanung sollte bei Frauen mit T1DM im gebärfähigen Alter im Rahmen der diabetologischen Routinekontrollen regelmässig angesprochen werden.
Folsäure sollte idealerweise täglich in einer Dosis von 400-800µg über 2-3 Monate präkonzeptionell zur Senkung der Rate an Neuralrohrdefekten und Fehlbildungen im Bereich des Lippen-Kiefer-Gaumens und des Herzens begonnen werden.
Zur präkonzeptionellen Betreuung gehört neben der Stoffwechseloptimierung auch der Ausschluss von assoziierten Autoimmunerkrankungen wie z.B. der Hypothyreose und die Minimierung von weiteren Risikofaktoren wie präexistente Hypertonie, Hyperlipidämie, Adipositas, das Einschätzen des kardiovaskulären Risikos und das Screening nach diabetischen Spätkomplikationen.
Monitoring diabetischer Spätkomplikationen
Diabetische Retinopathie
Die diabetische Retinopathie ist die häufigste Komplikation bei diabetischen Schwangeren und kann erstmals während der Schwangerschaft manifest werden. Eine verbesserte Blutzuckerkontrolle in der Schwangerschaft und damit verbundene Veränderung der Volämie führt zu einer Konstriktion der retinalen Blutgefässe und kann dadurch, insbesondere bei Patientinnen mit einer vorbestehenden diabetischen Retinopathie zu einer Verschlechterung führen. Eine ophthalmologische Kontrolle inkl. Funduskontrolle ist deshalb präkonzeptionell, bei Eintritt der Schwangerschaft sowie einmal pro Trimenon während der Schwangerschaft empfohlen (8). Bei auffälligem Befund sollte eine Lasertherapie oder eine intravitreale operative Medikamentengabe erwogen und vor Eintritt einer Schwangerschaft abgeschlossen werden.
Diabetische Neuropathie
Im Rahmen der präkonzeptionellen Beratung, insbesondere bei langjährigem T1DM sollte geprüft werden, ob Hinweise für eine diabetische Gastroparese oder einer weiteren Neuropathie, insbesondere einer Hypoglykämie-Wahrnehmungsstörung, bestehen.
Humangenetische Beratung und Pränataldiagnostik
Zur humangenetischen Beratung gehört die Aufklärung über das 10-fach erhöhte Risiko des Nachwuchses an einem T1DM oder an einer Autoimmunerkrankung zu erkranken. Die genetische Prädisposition ist stark mit dem HLA-System assoziiert (in Europa haben 90% der Menschen mit T1DM die Allele HLA-DR3 oder -DR4). Über das dreifach erhöhte Abort-Risiko und das Risiko der diabetischen Feto-/ Embryopathie sollte behutsam aufgeklärt werden. Wie schon unter dem Abschnitt zur präkonzeptionellen Beratung angesprochen, sind die Risiken stark abhängig von der Glucoseeinstellung gemessen am HbA1c-Wert v.a. prä- und perikonzeptionell sowie in der Frühschwangerschaft. Die Risiken steigen über einem HbA1c-Wert von 6.3% um 30% pro 1% HbA1c-Anstieg.
Die diabetische Embryopathie führt auf eine frühe Störung der Organogenese zwischen 3. und 7. Schwangerschaftswoche zurück, variiert stark und kann als isolierte Fehlbildung auftreten oder als Multiorganfehlbildung. Das Fehlbildungsrisiko ist insgesamt um ca. das Vierfache erhöht und betrifft vor allem die Fehlbildungen des Herzens (30-40%), des zentralen Nervensystems (10-15%), des Skeletts (10-20%), des Gesichts, des Gastrointestinal- und Urogenitaltrakts. Das kaudale Regressionssyndrom ist bei T1DM um ein hundertfaches häufiger als in Schwangerschaften ohne Diabetes, aber mit einer Inzidenz von 0,1-0,5% immer noch eine seltene Komplikation (9, 10).
Bei der diabetischen Fetopathie kommt es bei bis zu 50% der Kinder von Müttern mit T1DM zu einer Myokardhypertrophie im Sinne einer diabetischen Kardiomyopathie, die schon in der Frühschwangerschaft beginnt und sonographisch im 3. Trimenon zu ihrem Vollbild kommt. Die diabetische Kardiomyopathie bildet sich im Neugeborenenalter von selbst zurück und hat eine gute Prognose.
Es sollte allen Schwangeren mit T1DM ein detailliertes Ersttrimesterscreening mit Nackentransparenzmessung in 11 - 14. SSW und ein Organscreening mit Echokardiographie in 19 - 22. SSW (bei schlechter Blutzuckereinstellung auch schon früher um 16/17. SSW) angeboten werden. Chromosomale Anomalien sind nicht erhöht (6). Beim Berechnen des Ersttrimesterrisikos sollte beachtet werden, dass bei Schwangeren mit T1DM die beiden Biomarker zur Abschätzung von Trisomie 13, 18 und 21, das PAPP-A und das free ß-HCG einen 5-19% niedrigeren Wert aufweisen als bei Frauen ohne T1DM (11, 12). Anschliessend sollten Verlaufsultraschalle mit Wachstum und Doppleruntersuchungen je nach Blutzuckereinstellung und Schätzgewicht des Kindes alle 2-4 Wochen geplant werden.
Glucosemonitoring
Neben den mehrmals täglich, kapillären Blutzuckermessungen (häufig 6-Punkt-Messung mit 3 Nüchtern- und 3 postprandialen Blutzuckerwerten) werden zunehmend kontinuierliche Blutzuckermesssysteme (CGM) eingesetzt (Abb. 1). Diese Messsysteme messen den Blutzuckergehalt in der interstitiellen Flüssigkeit im Unterhautfettgewebe. Zunehmende Sensorgenauigkeit und Benutzerfreundlichkeit mit einfacher Anzeige aller Werte 24h/7d und Trends sowie Follower-Funktion durch betreuende Ärzte, haben die breite Akzeptanz der CGM bei T1DM gefördert. Ein weiterer Vorteil stellt die meist integrierte Alarmfunktion (bei tiefen oder hohen Blutzuckerwerten) dar. Eine Metaanalyse aus 3 randomisierten Studien bestätigte einen besseren HbA1c-Wert in der Schwangerschaft, mehr Zeit im Zielbereich und ein günstigeres neonatales Outcome unter CGM im Vergleich zur kapillären Standardmessung (13).
Insulintherapie und Therapieziele
Die Therapie bei T1DM ist die Insulintherapie. Zugelassene Basalinsuline der Wahl sind während der Schwangerschaft Humaninsuline (Insulatard®, Huminsulin® Basal NPH) und Insulin detemir (Levemir®). Insulin Glargin (Lantus®) kann in der Schwangerschaft ebenfalls verwendet werden, insbesondere wenn ein Wechsel des Insulinpräparates mit einer Verschlechterung der Blutzuckereinstellung verbunden wäre (14). Als kurzwirksame Insuline sind Insulin aspart (Novorapid®) und Insulin lispro (Humalog®) zugelassen. Als mögliche Applikationsformen der Insulintherapie stehen die intensivierte, konventionelle Insulintherapie (ICT=Spritzschema) oder die kontinuierliche subkutane Insulininfusion (CSII=Pumpe) mittels Insulinpumpe zur Verfügung. Eine Insulinpumpe besteht aus einem Insulinreservoir, welches kontinuierlich kurzwirksames Insulin abgibt, und je nach Modell, einem zusätzlichen Infusionsset/Katheter. Dem individuellen Insulinbedarf über 24 Stunden mit tageszeitlichen Schwankungen kann mit der Pumpe besser Rechnung getragen werden. Hinsichtlich der Blutzuckereinstellung sind die beiden Therapiestrategien (ICT und CSII) gleichwertig. Bei Menschen mit einem unzureichend eingestellten T1DM konnte in einer Metaanalyse eine leichte Verbesserung des HbA1c-Wertes unter CSII beschrieben werden (15). Im klinischen Alltag stehen die Patientenpräferenzen und -motivation für die Wahl der geeigneten Insulinapplikation im Vordergrund.
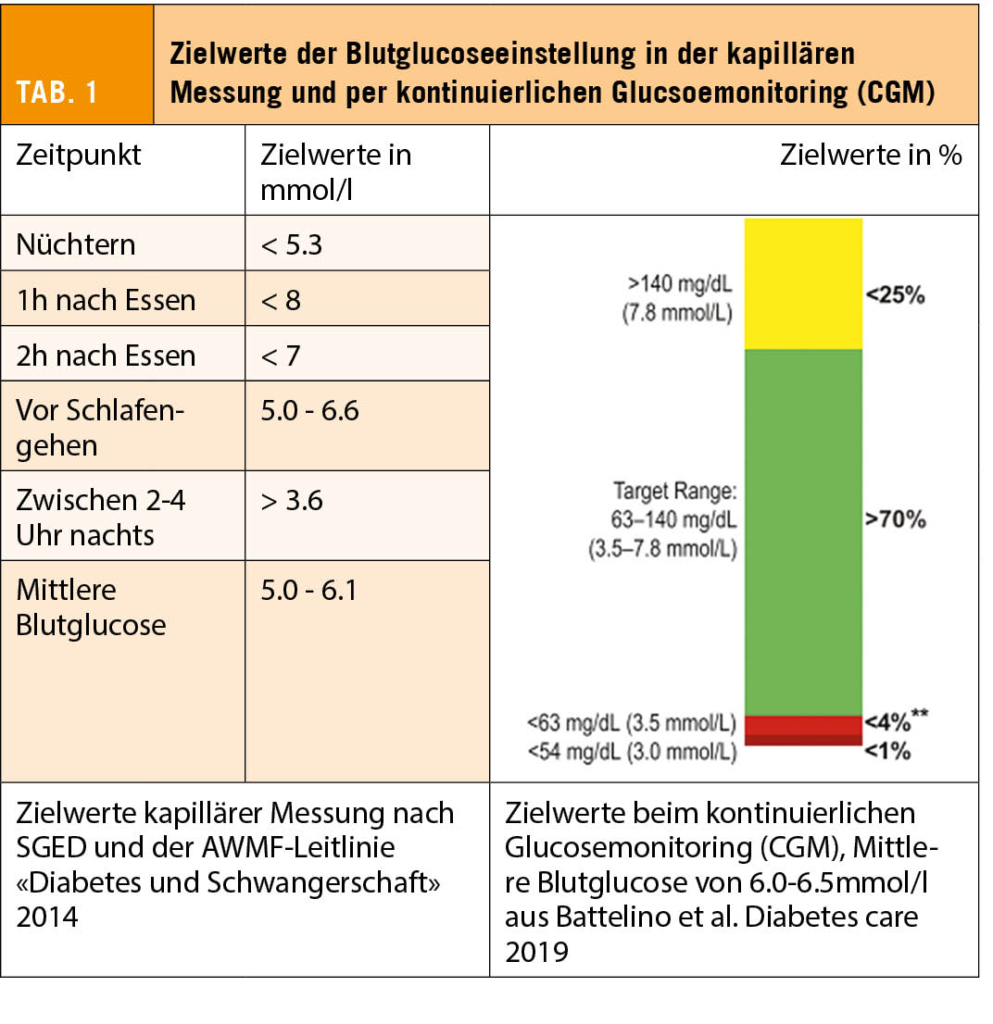
Aktuell gewinnen zunehmend Closed-Loop-Systeme, welche anhand von Sensordaten (CGM) automatisch die Insulinabgabe über die Pumpe steuern, an Bedeutung. Diese Systeme, welche Hypoglykämien und Blutzuckervariabilität reduzieren sowie die «Time-in-range» erhöhen, gelten auch in der Schwangerschaft als sicher. Der Benefit hinsichtlich maternalem und fetalem Outcome wird zurzeit noch im Rahmen von Studien geprüft. Blutzuckerziele während der Schwangerschaft werden je nach Quelle unterschiedlich definiert. Die Leitlinien der Schweizerischen Gesellschaft für Endokrinologie und Diabetologie (SGED) empfehlen als Grenzwerte einen nüchternen Blutzucker < 5.3 mmol/l und einen 1h postprandialen Wert von < 8 mmol/l, resp. 2h postprandial < 7 mmol/l (siehe Tab. 1). Diese Grenzwerte stellen eine optimale Blutzuckereinstellung dar und sollten angestrebt werden, solange darunter keine vermehrten Hypoglykämien auftreten. Für die CGM-Messung wird in aktuellen Studien eine Time-in-range von > 50% im Zielbereich (3.8 – 7.8 mmol/l) für das 1. Trimenon und > 60% im 2. und 3. Trimenon als realistisch angesehen, nur ein Drittel der Schwangeren mit T1DM schaffen die empfohlenen 70% (16).
Insbesondere bei Frauen mit eingeschränkter Hypoglykämiewahrnehmung müssen Grenzwerte individuell angepasst werden. Verschiedene Patientenfaktoren sind bei der Beratung zur Blutzuckeroptimierung mit einzubeziehen, so können z.B. der Verzehr von Zwischenmahlzeiten die Blutzuckerwerte beeinflussen und müssen bei der Anpassung der Insulintherapie berücksichtig werden. Der HbA1c Wert kann alle 4-6 Wochen bestimmt werden, wobei zu beachten gilt, dass die HbA1c-Werte aufgrund des erhöhten Erythrozyten-Turnovers in der Schwangerschaft tiefer ausfallen und somit vor allem ab 2. Trimenon nur eingeschränkt beurteilbar sind.
Diabetologische Notfälle in der Schwangerschaft
Das Risiko für Hypoglykämien besteht vor allem im ersten Trimenon. Schwere Hypoglykämien können zu Grand-mal-Krampfanfällen, Hirnödem und Unfällen führen. Um solche zu verhindern, gilt es Hypoglykämiewahrnehmungsstörungen frühzeitig zu erkennen. Vor allem diese Frauen profitieren von CGM Systemen mit Alarmfunktion. Zudem sollten sie, unter Einbezug der Angehörigen, über Notfallmassnahmen, wie z.B. die Applikation von Glukagon, geschult werden.
Die diabetische Ketoazidose tritt bei 1-3% der Schwangeren mit T1DM auf, geht mit Übelkeit und Erbrechen, unbehandelt mit Coma Diabeticum sowie einer akuten kindlichen Gefährdung einher. Risikofaktoren stellen die erhöhte Insulinresistenz in der Schwangerschaft, Infekte, Spritzfehler, Pumpentherapie, Steroide zB. im Rahmen der Lungenreifung oder Tokolyse mit Betamimetika dar. Die Ketoazidose ist charakterisiert durch erhöhte Blutzuckerwerte (ausserhalb einer Schwangerschaft definiert> 13.9mmol/l und Ketonämie und/oder Ketonurie (Ketonkörper müssen im klinischen Alltag nicht zwingend gemessen werden), art.pH < 7.35 oder venöser pH < 7.3 und Serum-Bikarbonat < 15mmol/l. Die diabetische Ketoazidose bedarf einer raschen Spitaleinweisung mit entsprechender Flüssigkeit-, Elektrolyt- und Insulinzufuhr. Ein aktives Geburtsmanagement ist kontraindiziert.
Im letzten Trimenon sollte auf die Entwicklung einer Plazentainsuffizienz, welche sich durch einen abfallenden Insulinbedarf oder das vermehrte Auftreten von Hypoglykämien manifestieren kann, geachtet werden. Es bedarf dann einer raschen sonographischen Kontrolle mit Dopplermessungen und eines Kardiotokogramms (CTGs) mit Evaluation der Notwendigkeit einer baldigen Entbindung.
Falls eine Schwangere mit T1DM zur stationären Aufnahme wegen Wehentätigkeit und drohender Frühgeburt kommt, sollte keine Tokolyse mit ß-Sympathomimetika begonnen werden. Zu dem Tokolytikum der Wahl zählen an erster Stelle Atosiban i.v. und nachrangig als “off-label use” Nifedipin per os. Die Notwendigkeit einer Lungenreifeinduktion bedarf neben der Gabe von 2x12mg Bethametason über 24 Stunden, das Steigern der Insulindosis um 20-40% der aktuellen Dosierung über 3-5 Tage.
Peri- und postpartale Betreuung
Die Entbindung einer Schwangeren mit T1DM sollte in einem Zentrumsspital mit Verfügbarkeit eines interdisziplinären Teams, bestehend aus Gynäkologie, Neonatologie und Endokrinologie, erfolgen. Die Vorstellung sollte hier bis spätestens zur 36. Schwangerschaftswoche geplant werden. Ein T1DM ist keine Indikation für eine primäre Sectio caesarea. Eine ausführliche Abschätzung bestehender Risikofaktoren wie die Blutzuckereinstellung, metabolische Risiken und einer sonographischen Gewichtsschätzung in der 36.-38. Schwangerschaftswoche und/oder ein geschätzter Gewichtsverlauf in den letzten Wochen ist für eine Geburtsplanung hinsichtlich Geburtsmodus und optimalen Geburtszeitpunkts essentiell. Bei Verdacht auf Makrosomie (cave schlechte Sensitivität des Ultraschalls) sollte über eine Einleitung ab 37+/38+0 SSW nachgedacht werden. Aufgrund des erhöhten Risikos für intrauterinen Fruchttod (IUFT) sollte eine Schwangerschaftsbeendigung per Einleitung oder primärer Sectio caesarea spätestens am errechneten Termin erfolgen. Das Vorliegen eines Diabetes erhöht das Risiko einer Schulterdystokie. Individuell sollte hierüber aufgeklärt werden insbesondere bei einem Schätzgewicht über 4000g und/oder einer Kopf-Abdomen-Diskrepanz. Bei einem Schätzgewicht > 4500g sollte eine primäre Sectio caesarea angeboten werden (8).
Während der Geburt nimmt der Stoffwechselbedarf zu und führt zu einem tieferen Insulinbedarf. Eine gute Blutzuckerkontrolle während der Geburt reduziert Hypoglykämien beim Neugeborenen (17) und vermindert das Risiko einer fetalen Azidose und Hypoxämie. Hinsichtlich peripartaler Blutzucker-Zielwerte, Messfrequenz und Glukose-/Insulingabe gibt es keine prospektiven Daten. Wir schlagen ein individualisiertes, peripartales Insulinmanagement vor. Sobald die Geburt in Sicht ist, empfehlen wir, von subkutanem auf intravenöses Insulin zu wechseln. Bei Patientinnen mit Insulinpumpe kann diese während der Geburt mit Beginn der Wehen oder bei Beginn der Sectio mit einer entsprechenden Anpassung der Basalrate (häufig 50% Reduktion) alternativ eingesetzt werden. Die peripartale Insulindosis wird bei intensivierter Insulintherapie anhand der Gesamtinsulindosis in den letzten 24 Stunden berechnet. Retrospektive Daten zeigen, dass intrapartale Blutzuckerzielwerte zwischen 4 – 7 mmol/l sicher sind und ein oberer Grenzwerte von 8 mmol/l kein erhöhtes Risiko für neonatale Hypoglykämien zeigt (18–21). Die Glucosewerte sollten in der Latenzphase alle 2-4 Stunden, ab Eröffnungsphase alle 1-2 Stunden kontrolliert werden. Postpartal fällt der Insulinbedarf drastisch ab, weshalb die Insulindosis auf 25 – 50% reduziert werden sollte um postpartale mütterliche Hypoglykämien zu verhindern.
Eine Frau mit T1DM sollte zum Stillen motiviert werden, evtl. unter grosszügiger Einbeziehung einer Stillberatung. Nach der World Health Organisation, WHO, ist eine Stilldauer von 6-12 Monaten empfohlen. Stillen führt zu einem verminderten Insulinbedarf weshalb die Insulindosis bei stillenden Müttern oftmals wegen einem erhöhten Risiko für Hypoglykämien vor allem nachts weiter reduziert werden sollte. Stillen führt langfristig beim Kind zu einem deutlich niedrigeren Risiko für Übergewicht und zu einem verbesserten Glucosestoffwechsel.
Copyright bei Aerzteverlag medinfo AG
Abteilung für Endokrinologie, Diabetologie und Metabolismus,
Universitätsspital Basel
Spitalstrasse 21
4031 Basel
Abteilung für Endokrinologie, Diabetologie und Metabolismus
Universitätsspital Basel
Spitalstrasse 21
4031 Basel
Klinik für Geburtshilfe und Schwangerenmedizin, Universitätsspital Basel
Klinik für Geburtshilfe und Feto-maternaler Medizin, Universitätsklinik Hamburg-Eppendorf, Deutschland
evelyn.huhn@usb.ch
Die Autorinnen haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Bei 0,2 – 0,5 % der Schwangerschaften findet sich ein vorbestehender Diabetes mellitus (T1DM). Diese Schwangerschaften sind mit einem erhöhten mütterlichen und kindlichen Risiko behaftet.
◆ In der Frühschwangerschaft besteht ein enger Zusammenhang zwischen dem mütterlichen HbA1c-Wert und der Fehlbildungsrate und der kindlichen Mortalität. Präkonzeptionell wird ein HbA1c-Wert < 7% (optimal < 6.5%) über mindestens 3 Monate angestrebt.
◆ Die Optimierung des Blutzuckers bereits präkonzeptionell hilft, die kindliche Fehlbildungsrate und Mortalität zu vermindern. Ebenso wird empfohlen, bereits 2 -3 Monate vor einer Schwangerschaft mit der Folsäure-Supplementation (400 – 800 ug/Tg) zu beginnen. Das Screening nach assoziierten Autoimmunkrankheiten und das Erfassen von kardiovaskulären Risken sowie diabetischen Spätkomplikationen gehören ebenfalls zur präkonzeptionellen Betreuung.
◆ Die diabetische Retinopathie ist die häufigste Spätkomplikation bei diabetischen Schwangeren.
◆ Zur Überwachung der Blutzuckerwerte werden zunehmend
kontinuierliche Blutzucker-Mess-Systeme (CGM) eingesetzt.
◆ Ein T1DM wird mit Insulin therapiert, mittels Injektionen oder Pumpe. Zu beachten ist, dass ab Geburtsbeginn der Insulinbedarf sinkt. Die Entbindung sollte in einem Zentrumsspital erfolgen, wo eine interdisziplinäre Betreuung möglich ist.
Messages à retenir
◆ Dans env. 0,2 – 0,5 % des grossesses, la future mère souffre d’ un diabète pré-existant (T1DM). Ces grossesses portent un risque accru pour la mère et le fœtus.
◆ En début de grossesse, il existe un lien étroit entre le taux d’ HbA1c maternel et le taux de malformations et de mortalité infantile. En préconceptionnel, on vise un taux d’ HbA1c < 7 % (optimal < 6,5 %) pendant au moins 3 mois.
◆ L’optimisation de la glycémie déjà avant la conception aide à diminuer le taux de malformations et de mortalité fœtales, et le début d’ une supplémentation avec de l’ acide folique (400 – 800 ug/j) déjà 2-3 mois avant la conception doit être recommandée. Le dépistage des maladies auto-immunes associées ainsi que la détection des risques cardiovasculaires et des complications tardives du diabète font également partie du suivi préconceptionnel.
◆ La rétinopathie est la complication tardive la plus fréquente pour la femme diabétique enceinte.
◆ Pour la surveillance de la glycémie, on utilise de plus en plus des systèmes de mesure continue (CGM) percutanés.
◆ La thérapie du T1DM est l’ insuline, administrée par injections ou pompe. Dès le début de l’ accouchement, les besoins en insuline chutent. L’ accouchement devrait avoir lieu dans un centre hospitalier disposant d’ une prise en charge interdisciplinaire.
1. DiMeglio LA, Evans-Molina C, Oram RA. Type 1 diabetes. Lancet. 2018;391(10138):2449-2462. doi:10.1016/S0140-6736(18)31320-5
2. Rewers M, Ludvigsson J. Environmental risk factors for type 1 diabetes. Lancet. 2016;387(10035):2340-2348. doi:10.1016/S0140-6736(16)30507-4
3. Roberto Vargas JTRSHU. Type 1 diabetes mellitus and pregnancy. Rev Obs
Gynecol . 2010;3(3):92-100.
4. García-Patterson A, Gich I, Amini SB, Catalano PM, De Leiva A, Corcoy R.
Insulin requirements throughout pregnancy in women with type 1 diabetes mellitus: Three changes of direction. Diabetologia. 2010;53(3):446-451. doi:10.1007/s00125-009-1633-z
5. Feig DS, Donovan LE, Corcoy R, et al. Continuous glucose monitoring in
pregnant women with type 1 diabetes (CONCEPTT): a multicentre international randomised controlled trial. Lancet. 2017;390(10110):2347-2359. doi:10.1016/S0140-6736(17)32400-5
6. Bell R, Glinianaia S V., Tennant PWG, Bilous RW, Rankin J. Peri-conception hyperglycaemia and nephropathy are associated with risk of congenital anomaly in women with pre-existing diabetes: A population-based cohort study. Diabetologia. 2012;55(4):936-947. doi:10.1007/s00125-012-2455-y
7. Tennant PWG, Glinianaia S V., Bilous RW, Rankin J, Bell R. Pre-existing diabetes, maternal glycated haemoglobin, and the risks of fetal and infant death: A population-based study. Diabetologia. 2014;57(2):285-294. doi:10.1007/s00125-013-3108-5
8. Kleinwechter H, Schäfer-Graf U, Bührer C, et al. Diabetes and Pregnancy.
Exp Clin Endocrinol Diabetes. 2021. doi:10.1055/a-1284-5758
9. Correa PJ, Vargas JF, Sen S, Illanes SE. Prediction of Gestational Diabetes
Early in Pregnancy: Targeting the Long-Term Complications. Gynecol Obstet
Invest. 2014;77(3):145-149. doi:10.1159/000357616
10. Newham JJ, Glinianaia S V., Tennant PWG, Rankin J, Bell R. Improved antenatal detection of congenital anomalies in women with pre-gestational diabetes:
Population-based cohort study. Diabet Med. 2013;30(12):1442-1448. doi:10.1111/dme.12293
11. Spencer K, Cowans NJ, Spencer CE, Achillea N. A re-evaluation of the influence of maternal insulin-dependent diabetes on fetal nuchal translucency thickness and first-trimester maternal serum biochemical markers of aneuploidy. Prenat
Diagn. 2010;30(10):937-940. doi:10.1002/pd.2589
12. Huttly WJ, Bestwick JP, Wald NJ. Insulin dependent diabetes mellitus (IDDM) and first trimester markers in prenatal screening for Down syndrome. Prenat Diagn. 2016;36(2):192-193. doi:10.1002/pd.4722
13. Feig DS, Murphy HR. Continuous glucose monitoring in pregnant women with Type 1 diabetes: benefits for mothers, using pumps or pens, and their babies. Diabet Med. 2018;35(4):430-435. doi:10.1111/dme.13585
14. Blumer I, Hadar E, Hadden DR, et al. Diabetes and pregnancy: An endocrine society clinical practice guideline. J Clin Endocrinol Metab. 2013;98(11):4227-4249. doi:10.1210/jc.2013-2465
15. Pala L, Dicembrini I, Mannucci E. Continuous subcutaneous insulin infusion vs modern multiple injection regimens in type 1 diabetes: an updated meta-analysis of randomized clinical trials. Acta Diabetol. 2019;56(9):973-980. doi:10.1007/s00592-019-01326-5
16. Battelino T, Danne T, Bergenstal M et al.. Clinical Targets for Continuous Glucose Monitoring Data Interpretation: Recommendations From the International Consensus on Time in Range. Diabetes Care. 2019;42(8):1593-1603. doi:10.2337/DCI19-0028.
17. Feldman AZ, Brown FM. Management of Type 1 Diabetes in Pregnancy. Curr Diab Rep. 2016;16(8). doi:10.1007/s11892-016-0765-z
18. Carron Brown S, Kyne-Grzebalski D, Mwangi B, Taylor R. Effect of management policy upon 120 Type 1 diabetic pregnancies: Policy decisions in practice. Diabet Med. 1999;16(7):573-578. doi:10.1046/j.1464-5491.1999.00124.x
19. Barrett HL, Morris J, Mcelduff A. Watchful waiting: A management protocol for maternal glycaemia in the peripartum period. Aust New Zeal J Obstet Gynaecol. 2009;49(2):162-167. doi:10.1111/j.1479-828X.2009.00969.x
20. Taylor R, Lee C, Kyne-Grzebalski D, Marshall SM, Davison JM. Clinical outcomes of pregnancy in women with type 1 diabetes. Obstet Gynecol. 2002;99(4):537-541. doi:10.1016/S0029-7844(01)01790-2
21. Dude A, Niznik CM, Szmuilowicz ED, Peaceman AM, Yee LM. Management of Diabetes in the Intrapartum and Postpartum Patient. Am J Perinatol. 2018;35(11):1119-1126. doi:10.1055/s-0038-1629903
info@gynäkologie
- Vol. 12
- Ausgabe 1
- Februar 2022