- Diagnostische Punktionen im Zeitalter von ETT und NIPT
Die Anzahl durchgeführter Amniocentesen und Chorionzottenbiopsien hat in den letzten 20 Jahren weltweit deutlich abgenommen. Neu entwickelte Screeningverfahren auf Trisomie 21,13 und 18 wie der ETT und die Einführung des NIPT in die Routine haben frühere Indikationen zur invasiven Pränataldiagnostik relativiert. Der NIPT hat sich als Screeninginstrument etabliert und geniesst aufgrund des fehlenden assoziierten Abortrisikos eine hohe Akzeptanz bei den Schwangeren. Dennoch sind die Punktionen unverändert das einzige «echte» diagnostische Verfahren und bieten das grösste Spektrum der pränatalen genetischen Diagnostik.
The number of amniocenteses and chorionic villus sampling performed worldwide has decreased significantly over the last 20 years. Newly developed screening procedures for trisomy 21, 13 and 18 such as combined first trimester screening and the introduction of non-invasive prenatal testing (NIPT) into routine practice have put earlier indications for invasive prenatal diagnostics into perspective. NIPT has established itself as a screening instrument and is widely accepted by pregnant women due to the lack of associated risk of miscarriage. Nevertheless, punctures remain the only «true» diagnostic procedure and offer the widest range of prenatal genetic diagnostics.
Keywords : NIPT, ETT, Amniocentese, Screening, Genetik
Rückgang invasiver Verfahren in der Pränataldiagnostik
Die Anzahl an Amniocentesen (AC) und Chorionzottenbiopsien (CVS) ist in den letzten beiden Jahrzehnten in der Schweiz und vielen Ländern sehr deutlich zurückgegangen. Differenzierte Risikokalkulationen wie der Erst-Trimester-Test (ETT) ersetzen die klassische «Altersindikation» beim Screening auf die häufigsten Trisomien 21, 18 und 13. Der nicht-invasive Pränataltest (NIPT) erfährt seit seiner Einführung in die Routine 2012 grossen Zuspruch und eine hohe Akzeptanz bei den Schwangeren. Gleichzeitig hat die bildgebende Pränataldiagnostik erhebliche Fortschritte gemacht und das Wissen um genetische Erkrankungen und deren pränatale Diagnose hat sich markant vergrössert. So ergibt sich eine interessante Konstellation, in der neue, nicht-invasive Tests trotz impliziter diagnostischer Limite eine starke Rolle erhalten haben, sich hingegen das Spektrum der Indikationen und Analysen für eine Punktion deutlich verändert und erweitert hat.
Die hauptsächliche Indikation für AC und CVS ist die genetische Analyse des Feten. Ältere Indikationen wie die AC zur Bestimmung der fetalen Lungenreife oder beim M. haemolyticus haben an Geltung verloren und Punktionen zur Erregerdiagnostik (PCR auf CMV und T. gondi), Nabelschnurpunktionen und therapeutische Prozeduren stellen weiter einen sehr geringen Anteil der Eingriffe dar.
Seitens der genetischen Indikation stand historisch die Trisomie 21 stark im Vordergrund. Daraus resultierte seit den 70er/80er Jahren die «klassische» Altersindikation, nach der Schwangeren ab 35 Jahren eine diagnostische Punktion angeboten wurde. Die implizite Rationale dafür war die pragmatische Abschätzung, dass das eingriffsassoziierte Komplikationsrisiko tiefer wäre als die Wahrscheinlichkeit einer Trisomie 21, die für eine 36-jährige Schwangere bei 12 SSW etwa 1 : 196 beträgt (1). Da das maternale Alter allein aber keine zufriedenstellende Performance im Screening zeigt, wurde früh nach zusätzlichen unabhängigen Risikofaktoren gesucht. Dies führte zur Implikation diverser Serummarker, beginnend mit alpha-Fetoprotein (2, 3) und später sonographischen Markern wie Nackentransparenz, Nasenbein, Trikuspidalinsuffizienz oder D. venosus-Flussmuster. Das international wohl verbreitetste Verfahren zur Risikokalkulation ist der ETT nach dem Algorithmus der Fetal Medicine Foundation mit einer Detektionsrate der Trisomie 21 von 90 % bei einer Falsch-Positiv-Rate (FPR) von 3 % bei einem cutoff von 1 : 300 zum Untersuchungszeitpunkt (analog einem Risiko von 1 : 380 am Geburtstermin, (4)). Bei einem in der Schweiz definierten cutoff von 1 : 1000 ist die Detektionsrate bei steigender FPR nochmals höher anzusetzen und wertet den ETT zusätzlich auf, was der Expertenbrief No. 52 der SGGG entsprechend berücksichtigt und somit einen auffälligen ETT als Voraussetzung für eine Übernahme der Kosten des Basis-NIPT durch die Grundversicherung definiert (10). Der Wandel in der Indikationsstellung einer diagnostischen Punktion kann durch eine einfache Beobachtung veranschaulicht werden : Der Anteil an Schwangeren von 35 Jahren oder darüber in der Schweiz ist von 11.5 % im Jahr 1990 auf 36 % im Jahr 2020 gestiegen (5). Abgesehen davon, dass natürlich beileibe nicht alle Schwangeren eine genetische Abklärung des Kindes wünschen, ist klar, dass die Punktionszahlen ohne differenzierte Alternativen wie ETT und NIPT markant hätten steigen müssen.
Entwicklung von Screeningmethoden
Im Gegenteil hat aber die Zahl der diagnostischen Punktionen in den letzten 20 Jahren in vielen Ländern stark abgenommen. Zahlen der Kassenärztlichen Bundesvereinigung in Deutschland zeigen, dass bezogen auf 100 Geburten im Jahr 2003 8.3 Punktionen (AC und CVS) durchgeführt wurden, 2013 waren dies noch 3.3 und 2020 nur noch 1.5 (6). Da der NIPT erst ab 2011/2012 in der Routine Anwendung fand, ist anzunehmen, dass die Verbreitung von Screeningverfahren wie dem ETT für den ersten und grössten Anteil dieser Reduktion verantwortlich sein dürfte. Auch im Hinblick auf die Konsequenzen eines auffälligen ETTs finden sich neue Tendenzen: Eine Studie aus Queensland verglich die Punktionszahlen in den Jahren 2014–2015 mit einer «historischen» Kohorte von 2002–2004 und zeigte, dass die Rate an diagnostischen Punktionen bei einem ETT-Risiko > 1 : 300 von 74.1 % auf 39.3 % gefallen war, was die Autoren auf das Aufkommen des NIPT und die Implikation erweiterter Marker wie z.B. das Nasenbein in den ETT zurückführten (7).
Was die Schwangeren selber bevorzugen, ist in der Praxis offensichtlich : Der NIPT wird wegen des primär nicht existenten Abortrisikos von vielen Schwangeren gegenüber den bereits durch die Bezeichnung «invasiv» unglücklich negativ konnotierten Punktionen favorisiert und ermöglicht ihnen einen Kompromiss zwischen Wunsch nach hoher diagnostischer Sicherheit und der Furcht vor den Komplikationen einer Punktion (8).
Mit dem offiziellen Aufklärungsformular der SGGG wird die Schwangere über ein Fehl- oder Frühgeburtsrisiko von 0.1–1 % aufgeklärt, was den neueren Metaanalysen entspricht. Salomon et al. (9) beschreiben z.B. die Abortrate vor 24 SSW durch eine Punktion für AC resp. CVS von 0.30 % bzw. 0.20 %. Bei Berücksichtigung von Kontrollgruppen mit vergleichbarem Risikoprofil liegt die Rate dabei nur noch bei 0.12 % resp. 0.11 %. Diese Datenlage erlaubt ein sehr differenziertes Eingehen auf die Sorgen der Schwangeren und sollte bei geeigneter Indikation nicht zu einem Verzicht auf eine diagnostische Punktion führen.
Bedeutung diagnostischer Punktionen im Vergleich zu NIPT
Wenn auch der NIPT als «bestes nichtinvasive(s) Verfahren, um die häufigsten Trisomien (…) zu erfassen» (10) gilt und Punktionen erübrigt, so generiert er andererseits selbst Punktionen. Zum einen sollen alle auffälligen NIPT-Resultate aufgrund des Screeningcharakters der NIPT durch eine diagnostische Punktion bestätigt werden. Zum anderen reicht das mögliche diagnostische Spektrum weit darüber hinaus. So wird auch der erweiterte, «genome-wide» NIPT mit Testung der Geschlechtschromosomen, seltener autosomaler Trisomien und der Deletionen/Duplikationen rege angewendet. Häufig geschieht das auch als «first-tier» Screening bei Wunsch der Schwangeren nach weitestmöglicher Abklärung und «Sicherheit». Das Screening auf seltene Chromosomenanomalien führt jedoch häufiger zu falsch positiven Testresultaten und damit tieferen positiv prädiktiven Werten (PPV)von nur ca. 6–50 % (11, Tab. 1). Genaue Daten über die Anzahl durchgeführter erweiterter NIPTs und deren Effekt auf Punktionszahlen in der Schweiz sind nicht veröffentlicht. Der Expertenbrief der SGGG empfiehlt aufgrund niedriger PPVs von gemittelt 18 % das Screening auf strukturelle Chromosomenanomalien explizit nicht. Weitere internationale Fachgesellschaften diskutieren den erweiterten NIPT wenn dann kritisch (12, 13, 14, 20). Allein das American College of Medical Genetics and Genomics (ACMG) erweitert die Empfehlung, allen Schwangeren einen NIPT für die Trisomien 21, 13, 18, gonosomale Aneuploidien (SCA) und die Mikrodeletion 22q11 anzubieten (15).
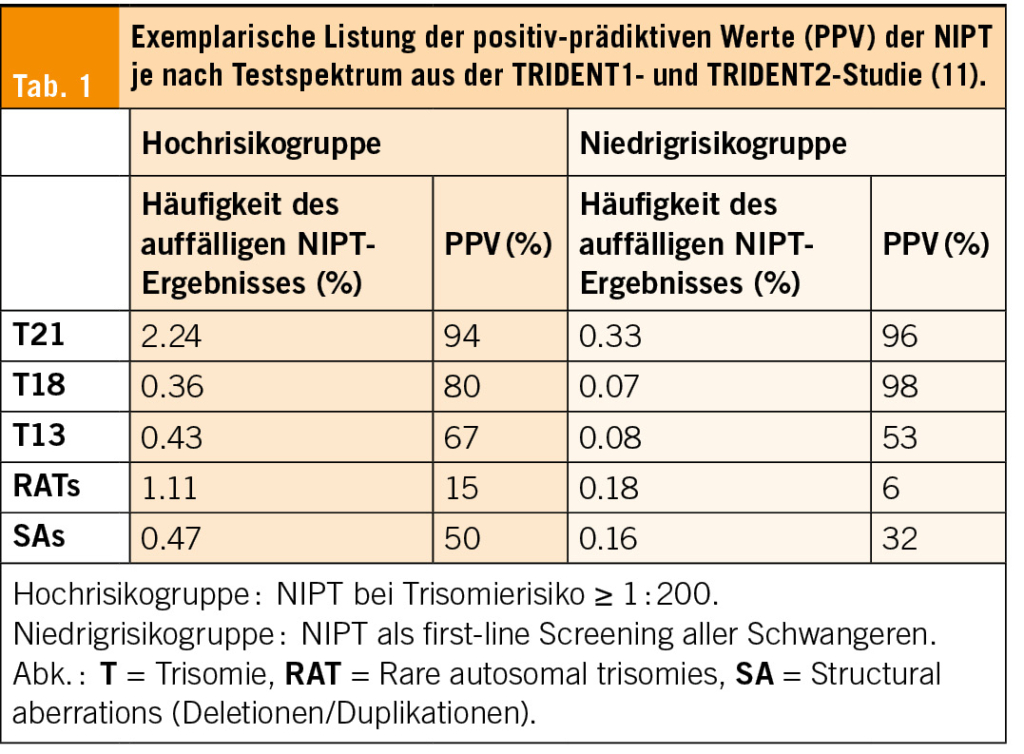
Insbesondere bei fetalen Auffälligkeiten wie einer Nackentransparenz über der 95. bzw. 99. Perzentile oder bei sonographischen Auffälligkeiten, früher intrauteriner Wachstumsretardierung und Fehlbildungen sollte nicht zu einem NIPT, sondern zu einer Punktion geraten werden. Schon bei einem ETT mit einem Risiko über dem international gebräuchlichen cutoff von >1 : 300 für Trisomie 21 und > 1 : 150 für Trisomie 13/18 könnte ein NIPT bereits mit Vorsicht bewertet werden. Sicher sind die Spezifitäten und Sensitivitäten beim Screening auf die häufigsten Trisomien 21,18 resp. 13 speziell in der Risikogruppe exzellent mit einer Detektionsrate (in %) von 99.7, 97.9 resp. 99.0 bei einer FPR von jeweils 0.04 % (13, 16). Ganz aktuelle Daten der Danish Fetal Medicine Database aus den Jahren 2008 bis 2018 zeigen aber beispielsweise, dass im Risikokollektiv mit ETT > 1 : 300 per Basis-NIPT (T21,13,18 und Monosomie X) nur 76 % der relevanten Pathologien detektiert worden wären, 24 % wären «übersehen» worden (17). Pathogene CNVs stellten dabei ca. 9 % der auffälligen Resultate, wobei 79 % der CNV kleiner als 5 Mb (Megabasen) waren und somit selbst ein erweiterter NIPT mit einer Auflösungsgrenze von ca. 7–10 Mb nur den geringsten Anteil dieser Pathologien detektiert hätte.
Parallel zu den positiven Entwicklungen der nicht-invasiven Screeningverfahren gab es erhebliche Fortschritte in der Ultraschalldiagnostik und im Verständnis genetischer Erkrankungen. Fetale Fehlbildungen und Marker als mögliche Anzeichen einer genetischen Anomalie werden an besser auflösenden Geräten häufiger und früher diagnostiziert. Bei fetalen Auffälligkeiten gehört mittlerweile der hochauflösende CGH-Array und das Whole-Exome-Screening (WES) zur Routine. Zwar bietet sich auch per NIPT die Möglichkeit einer Deletions-/Duplikationsanalyse bis zu einer Auflösung von ca. 7–10 Mb, was etwa der konventionellen mikroskopischen Analysemöglichkeit entspricht, und einzelne Tests erreichen bei hoher fetaler Fraktion Auflösungen von 3 Mb. Einzelne kommerzielle Tests ermöglichen einen NIPT auf ausgewählte Monogen-Erkrankungen und jüngst wurden vielversprechende Machbarkeitsstudien eines WES per NIPT publiziert (18, 19) Abgesehen vom Screeningcharakter und fehlenden grossen Validierungsstudien dieser NIPTs erreicht aber ein CGH-Array an DNA Amniozyten oder Chorionzotten eine deutlich höhere Auflösung von 70 bis 100 Kilobasen (kB) und Punktionen ermöglichen Analysen per Genpanel oder WES, die die Möglichkeiten der NIPT sehr deutlich übersteigen.

Copyright
Aerzteverlag medinfo AG
Leitender Arzt Frauenklinik Luzern
Frauenklinik Luzerner Kantonsspital
Spitalstrasse
6000 Luzern 16
joachim.kohl@luks.ch
Luzerner Kantonsspital
Frauenklinik
Spitalstrasse
6000 Luzern 16
Die Autorenschaft hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
- Trotz der Relativierung der klassischen Altersindikation durch differenzierte Screenings wie den ETT und der Verbreitung des NIPT als «bestem» nicht-invasiven Screeningtest bleiben die diagnostischen Punktionen das wegweisende diagnostische Verfahren für genetische Untersuchungen der Feten.
- Eine Beratung der Schwangeren über die Vor- und Nachteile und das diagnostische Spektrum von NIPT und Punktion ist wichtig.
- Im Falle von fetalen Auffälligkeiten (Fehlbildungen, Marker, IUGR) ist ein NIPT aufgrund seines limitierten diagnostischen Spektrums nicht empfohlen.
- Diagnostische Punktionen (AC und CVS) bleiben der Goldstandard in der pränatalen genetischen Diagnostik (mögliche Indikationen siehe Tab. 2) und bieten das mit Abstand weiteste diagnostische Spektrum bei sehr tiefem Abortrisiko.
1. Snijders RJ, Sundberg K, Holzgreve W, Henry G, Nicolaides KH. Maternal age- and gesta-tion-specific risk for trisomy 21. Ultrasound Obstet Gynecol. 1999;13(3) : 167-170.
2. Cuckle HS, Wald NJ, Lindenbaum RH. Maternal serum alpha-fetoprotein measurement : a screening test for Down syndrome. Lancet. 1984;1(8383) : 926-929.
3. Haddow JE, Palomaki GE, Knight GJ, Cunningham GC, Lustig LS, Boyd PA. Reducing the need for amniocentesis in women 35 years of age or older with serum markers for screen-ing. N Engl J Med. 1994;330(16) : 1114-1118.
4. Kagan KO, Etchegaray A, Zhou Y, Wright D, Nicolaides KH. Prospective validation of first-trimester combined screening for trisomy 21. Ultrasound Obstet Gynecol. 2009;34(1) : 14-18.
5. www.bfs.admin.ch/bfs/de/home/statistiken/bevoelkerung/geburten-todesfaelle/geburten.html
6. Kähler C, Faber R, Geipel A, et al. DEGUM Recommendations on Diagnostic Puncture in Prenatal Medicine. Empfehlungen der DEGUM zu diagnostischen Punktionen in der Präna-talmedizin. Ultraschall Med. 2023;44(3) : 269-279.
7. Lindquist A, Poulton A, Halliday J, Hui L. Prenatal diagnostic testing and atypical chromo-some abnormalities following combined first-trimester screening : implications for contingent models of non-invasive prenatal testing. Ultrasound Obstet Gynecol. 2018;51(4) : 487-492.
8. Sahlin E, Nordenskjöld M, Gustavsson P, Wincent J, Georgsson S, Iwarsson E. Positive Atti-tudes towards Non-Invasive Prenatal Testing (NIPT) in a Swedish Cohort of 1,003 Pregnant Women. PLoS One. 2016;11(5) : e0156088. Published 2016 May 19.
9. Salomon LJ, Sotiriadis A, Wulff CB, Odibo A, Akolekar R. Risk of miscarriage following amniocentesis or chorionic villus sampling : systematic review of literature and updated me-ta-analysis. Ultrasound Obstet Gynecol. 2019;54(4) : 442-451.
10. Ochsenbein N. et al., Expertenbrief No. 52 der SGGG «Pränatale nicht-invasive Risikoab-schätzung fetaler Aneuploidien» vom 01.07.2017 unter www.sggg.ch/fileadmin/user_upload/Formulardaten/52_def_Praenatale_nicht-invasive_Risikoabschaetzung_fetaler_Aneuploidien.pdf
11. van der Meij KRM, Sistermans EA, Macville MVE, et al. TRIDENT-2 : National Implementa-tion of Genome-wide Non-invasive Prenatal Testing as a First-Tier Screening Test in the Netherlands. Am J Hum Genet. 2019;105(6) : 1091-1101.
12. American College of Obstetricians and Gynecologists’ Committee on Practice Bulletins—Obstetrics; Committee on Genetics; Society for Maternal-Fetal Medicine. Screening for Fe-tal Chromosomal Abnormalities : ACOG Practice Bulletin, Number 226. Obstet Gynecol. 2020;136(4) : e48-e69.
13. Kozlowski P, Burkhardt T, Gembruch U, et al. DEGUM, ÖGUM, SGUM and FMF Germany Recommendations for the Implementation of First-Trimester Screening, Detailed Ultra-sound, Cell-Free DNA Screening and Diagnostic Procedures. Empfehlungen der DEGUM, der ÖGUM, der SGUM und der FMF Deutschland zum Einsatz von Ersttrimester-Screening, früher Fehlbildungsdiagnostik, Screening an zellfreier DNA (NIPT) und diagnos-tischen Punktionen. Ultraschall Med. 2019;40(2) : 176-193.
14. Salomon LJ, Alfirevic Z, Audibert F, et al. ISUOG updated consensus statement on the im-pact of cfDNA aneuploidy testing on screening policies and prenatal ultrasound prac-tice. Ultrasound Obstet Gynecol. 2017;49(6) : 815-816.
15. Dungan JS, Klugman S, Darilek S, et al. Noninvasive prenatal screening (NIPS) for fetal chromosome abnormalities in a general-risk population : An evidence-based clinical guide-line of the American College of Medical Genetics and Genomics (ACMG) [published cor-rection appears in Genet Med. 2023 Aug;25(8) : 100874.) Genet Med. 2023;25(2) : 100336
16. Gil MM, Quezada MS, Revello R, Akolekar R, Nicolaides KH. Analysis of cell-free DNA in maternal blood in screening for fetal aneuploidies : updated meta-analysis. Ultrasound Obs-tet Gynecol. 2015;45(3) : 249-266.
17. Gadsbøll K, Vogel I, Kristensen SE, et al. Combined first-trimester screening and invasive diagnostics for atypical chromosomal aberrations : Danish nationwide study of prenatal pro-files and detection compared with NIPT. Ultrasound Obstet Gynecol. 2024;64(4) : 470-479.
18. Brand H, Whelan CW, Duyzend M, et al. High-Resolution and Noninvasive Fetal Exome Screening. N Engl J Med. 2023;389(21) : 2014-2016.
19. Miceikaitė I, Hao Q, Brasch-Andersen C, et al. Comprehensive Noninvasive Fetal Screen-ing by Deep Trio-Exome Sequencing. N Engl J Med. 2023;389(21) : 2017-2019.
20. von Kaisenberg C, Kozlowski P, Kagan KO, Hoopmann M, Heling KS, Chaoui R, Klaritsch P, Pertl B, Burkhardt T, Tercanli S, Frenzel J, C. Mundlos. AWMF 085-002 S2e LL Ersttri-mester Diagnostik und Therapie @ 11-13+6 Schwangerschaftswochen
info@gynäkologie
- Vol. 15
- Ausgabe 1
- März 2025







