- Die Differentialdiagnose ist eine klinische Herausforderung
Ovarialbefunde sind immer wieder eine klinische Herausforderung. Kann der Befund beobachtet werden oder muss man eine Operation empfehlen? Falls operiert werden muss, stellt sich die Frage ob dies in einer allgemeinen gynäkologischen Abteilung erfolgen kann oder ob an einem gynäkologischen Tumorzentrum behandelt werden sollte. Zur Triagierung stehen hierzu verschiedene, evidenzbasierte Methoden zur Verfügung die im folgenden Artikel diskutiert werden.
La découverte d’ une masse ovarienne est chaque fois un important casse-tête pour le clinicien : Puis-je observer ou dois-je recommander l’ opération ? Pour le cas d’ opération, peut-on intervenir dans le service de gynécologie de l’ hôpital de proximité ou dois-je référer la patiente à un centre de chirurgie oncologique gynécologique ? Pour trouver la solution et faire un tri correct, nous disposons actuellement de diverses méthodes basées sur l’ évidence. Elles seront discutées dans le présent article.
Die Differentialdiagnose bei Raumforderungen im kleinen Becken ist immer wieder eine klinische Herausforderung. Insbesondere bei Patientinnen, die wenig Symptome haben werden diese Befunde immer wieder im Rahmen einer gynäkologischen Routinekontrolle im Ultraschall entdeckt und der betreuende Facharzt muss entscheiden ob weitere Abklärungen oder eine operative Therapie nötig sind oder ob man den Befund weiter beobachten kann. Bei Befunden mit unklarer Dignität stellt sich häufig die Frage, ob man die Patientin an ein gynäkologisches Tumorzentrum weiterleiten muss um das bestmögliche Outcome und Überleben für die Patientin sicherzustellen. Zur Triagierung stehen hierzu verschiedene, evidenzbasierte Methoden zur Verfügung. Hierzu gehört der seit den 1980-er Jahren verwendete Risk of Malignancy Index (RMI) und die Beurteilung von Befunden anhand der International Ovarian Tumor Analysis (IOTA)-Kriterien, die insbesondere bei Borderlinetumoren und bei prämenopausalen Patientinnen dem RMI überlegen ist. Es besteht weiterhin keine Empfehlung zum generellen Screening als Vorsorge für das Ovarialkarzinom. Die UK Collaborative Trial of Ovarian Cancer Screening (UKCTOCS) mit über 200 000 eingeschlossenen postmenopausalen Frauen konnte keine Reduktion der Mortalität beim Ovarialkarzinom durch ein Screening nachweisen (1).
Im folgenden Artikel werden die verschiedenen Optionen zur Beurteilung von Ovarialbefunden erläutert, und die aktuelle Datenlage zum konservativen Management nach den Ergebnissen der IOTA 5 Interimsanalyse diskutiert.
Risk of Malignancy Index (RMI)
Der seit den 1990-er Jahren verwendete RMI ist ein einfach zu ermittelnder Score, der den Menopausestatus der Patientin, den Tumormarker CA 125 und einfache, sonographische Befunde berücksichtigt. Er lässt sich nach der folgenden Formel einfach im Kopf berechnen: RMI = Menopausaler-Score (M) x Ultraschall-Score (U) x absoluter CA125 Titer (in kU/l).
Der M-Score zählt einen Punkt für postmenopausale Patientinnen. Der Ultraschall-score berücksichtigt das Vorliegen der folgenden 5 Kriterien: Multilokulären Zysten, soliden Strukturen, Aszites, bilateralen Raumforderungen, intraabdominalen Metastasen. Die Raumforderung erhält einen Score U = 0 wenn kein sonographisches Merkmal, U = 1 wenn 1 sonographisches Merkmal und U = 3 wenn ≥ 2 Merkmale nachgewiesen werden. Multipliziert werden diese beiden Scores dann mit dem absoluten CA 125-Wert (2).
Bei einem RMI von > 200 sollte die Patientin an ein gynäkologisches Tumorzentrum überweisen werden. Für diesen Cut-off Wert von 200 für Malignität liegt die Sensitivität bei 80%, die Spezifität bei 92% und der positiv prädiktive Wert bei 83%. Der RMI hat eine höhere Sensitivität bei postmenopausalen Patientinnen im Vergleich zu prämenopausalen Patientinnen und ist stark vom CA-125 Wert abhängig. Aus diesem Grund ist die Detektion von Frühstadien des Ovarialkarzinoms manchmal erschwert, und bei Borderlinetumoren liegt die Sensitivität bei ungefähr schwachen 30%. Umgekehrt ist die Spezifität erniedrigt bei Patientinnen, die eine Endometriose oder eine Adnexitis haben. Hier kann das CA 125 im Rahmen der Grunderkrankung ebenfalls erhöht sein. Ungefähr 14% der Endometriosebefunde sowie knapp 30 & der Tuboovarialabszesse zeigen einen RMI über 200 (3). Bei einem sonographischen U-Score von 3 und einem RMI unter 200 ist in jedem Fall zusätzlich eine Beurteilung anhand der IOTA-Kriterien oder ein Expertenultraschall empfohlen. Patientinnen mit unverdächtigen zystischen Raumforderungen der Adnexe profitieren von einer Kontrolle nach 6 Monaten mit erneuter Entnahme von CA125. Neue Studien belegen den höheren diagnostischen Wert der wiederholten Tumormarker-Bestimmung, vor allem zur Früherkennung und bei postmenopausalen Patientinnen (4).
International Ovarian Tumor Analysis (IOTA)-Algorithmen
Die multinationale europäische IOTA-Gruppe beschäftigt sich seit der Gründung um die Jahrtausendwende mit der Dignitätseinschätzung von Ovarialbefunden mittels Ultraschall anhand einer standardisierten Nomenklatur zur Beschreibung von Adnexbefunden (5). Heute beteiligen sich über 40 Zentren in Europa an den Studien der IOTA. Durch die standardisierte Beschreibung der Befunde und deren histologisches Korrelat ist es heute möglich alleine anhand der Ultraschallkriterien die Befunde mit einer sehr hohen Zuverlässigkeit zu klassifizieren. Obwohl weiterhin die US-Untersuchung durch einen Experten anhand der Erkennung spezifischer Merkmale (pattern recognition) sich zur Unterscheidung von Malignität und Benignität und Einschätzung der Histologie am besten eignet können auch weniger geübte Untersucher mit der Beschreibung nach der IOTA-Nomenklatur Adnexbefunde zuverlässig einschätzen. Für die korrekte Beschreibung ist es allerdings unabdingbar die IOTA-Terminologie genau zu kennen. Sich darauf beziehende Algorithmen zu klinischer Anwendung haben nur Bestand, wenn die Nomenklatur sehr genau verwendet wird. Hierzu werden seit einigen Jahren Zertifizierungskurse weltweit und auch in der Schweiz regelmässig angeboten (www.iotagroup.org). Heute stehen für die Triagierung verschiedene klinische IOTA-Algorithmen zur Verfügung von denen wir hier exemplarisch 2 Modelle vorstellen möchten, die besonders praxistauglich sind:
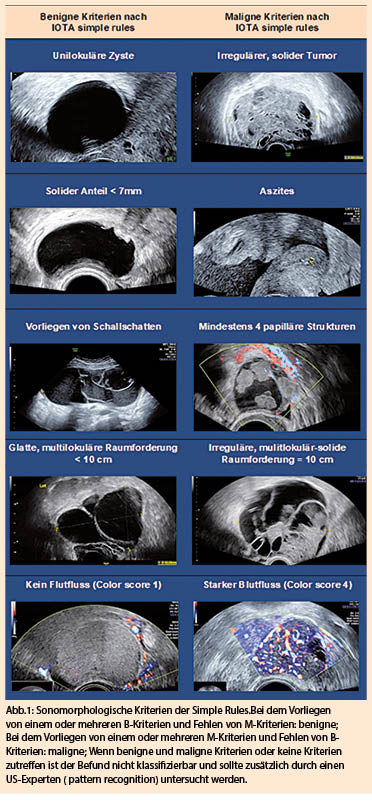
IOTA Simple Rules
Bei den IOTA Simple Rules werden jeweils 5 sonomorphologische Kriterien definiert, die für Benignität und Malignität sprechen (Abb. 1). Anhand der IOTA-Simple Rules lassen sich ca. 76% aller Adnexbefunde zuverlässig klassifizieren. Die übrigen 24% sind unklassifizierbar und benötigen die Einschätzung durch einen Experten. Ein Adnexbefund wird als Benigne eingestuft wenn mindestens ein B-Kriterium zutrifft und keine M-Kriterien vorhanden sind. Umgekehrt wird ein Befund als maligne eingestuft wenn mindestens ein M-Kriterium zutrifft aber kein B-Kriterium vorhanden ist. Falls kein Kriterium zutrifft oder M- und B-Kriterien vorliegen ist der Befund nicht klassifizierbar. Dies betrifft wie oben erwähnt knapp 25% aller Adnexbefunde. Bei Anwendung der Simple Rules liegt die Sensitivität für die klassifizierbaren Befunde bei 95% und die Spezifizität bei 91% (6). Wenn 2 B-Kriterien vorliegen liegt die Wahrscheinlichkeit für einen benignen Befund bei 99.4%. Die unilokuläre Zyste ist dabei das wichtigste B-Kriterium.
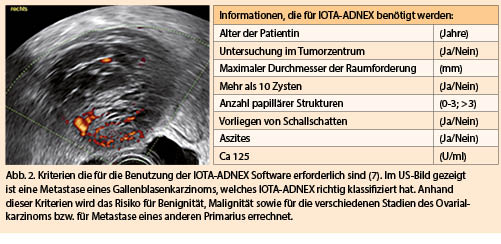
IOTA ADNEX-Algorithmus
Beim Modell ADNEX werden 6 Ultraschallkriterien und 3 klinische Kriterien zur Dignitätseinschätzung verwendet (Abb. 2). Der Algorithmus basiert auf Erfahrung aus 6000 prospektiv und systematisch erhobenen Adnexbefunden. Hier wurde bewusst auf die Werte der Dopplersonographie verzichtet, da die richtige Anwendung im klinischen Alltag häufig Probleme bereitet und mehr als die anderen Parameter von der subjektiven Einschätzung des Untersuchers anhängig ist. Zusätzlich wurden 3 klinische Parameter integriert: Das Alter der Patientin, der Ort der Untersuchung (gyn. Tumorzentrum versus andere Orte) und optional der Tumormarker CA 125. Da das Risiko für ein Malignom höher ist alleine durch die Tatsache, dass die Patientin in einem Tumorzentrum vorstellig wird, ist dieser Parameter für die Risikokalkulation nutzbar. Für die Risikokalkulation sind eine App (kostenpflichtig beim Erwerb) oder die kostenlose Web-Anwendung (https://www.iotagroup.org/iota-models-software/adnex-risk-model) nötig. Durch die Eingabe der 9 Parameter kann eine Risikoberechnung erfolgen. Basis ist auch für die Anwendung die richtige Anwendung der IOTA-Nomenklatur. Der Algorithmus liefert zum einen eine Risikoeinschätzung für Malignität bzw. für Benignität und macht zum anderen Angaben darüber ob es sich eher um einen Borderlinetumor, ein Ovarialkarzinom Stadium I-II, ein Ovarialkarzinom Stadium III-IV oder um die Metastase eines anderen Primarius handelt. Die zu erwartende Histologie ist diejenige, mit der stärksten Risikoerhöhung gegenüber dem statistischen Ausgangsrisiko (relative risk). Die Zahlen sind in der Triagierung zwischen einer allgemeinen Gynäkologie und einem Tumorzentrum hilfreich und können sogar in der präoperativen Abklärung, z. B. bei Verdacht auf eine Metastase für die richtige Therapie (eventuell primär nicht operativ) von Bedeutung sein (7). Der individuelle Cut-off für die Triagierung zu einem gyn. Tumorzentrum muss individuell gewählt werden und ist vom jeweiligen Setting und der Expertise vor Ort abhängig. Im Allgemeinen wird ein Cut-off zwischen 10-20 % Risiko für Malignität für die Zuweisung zu einem gyn. Tumorzentrum empfohlen. Die Sensitivität bei einem Cut-off von 10% Risiko für Malignität liegt bei 96.4% mit einer Spezifität von 73.2%. Die Sensitivität ist damit für prä- und postmenopausale Patientinnen höher als beim RMI bei einer akzeptablen Spezifität.
Konservatives Management von Adnexbefunden
In der prospektiven IOTA 5 Kohortenstudie werden über einen Zeitraum von 5 Jahren Adnexbefunde konservativ beobachtet
(3 Mo, 6 Monate, 12 Monate, danach jährlich), die sonographisch benigne imponieren. Dabei wird die Rate an Torsionen, Zystenrupturen und Spontanremissionen also auch die Rate an entdeckten Borderlinetumoren und invasiven Karzinomen aufgenommen. 36 Zentren in 14 Ländern haben an der Rekrutierung teilgenommen und das Follow-up läuft aktuell. In diesem Jahr wurden die Daten einer 2-Jahres Interimsanalyse hierzu publiziert. Die kumulative Inzidenz von den 1919 ausgewerteten Befunden lag für eine spontane Remission bei 20%. Die kumulative Inzidenz von Karzinomen und Borderlinetumoren lag bei 0,4%. Für Torsionen und Zystenrupturen lag diese bei 0,2%. Die Autoren folgern, dass das Risiko für Zystenrupturen und Malignität klein zu sein scheint, was für ein konservatives Management von benigne imponierenden Adnexbefunden sprechen würde. Die endgültigen Ergebnisse nach 5 Jahren müssen jedoch noch abgewartet werden (8).
Leiterin Frauenklinik & Gynäkologisches Tumorzentrum
Chefärztin Gynäkologie/Gyn. Onkologie
Frauenklinik
Universitätsspital Basel
Spitalstrasse 21
4031 Basel
viola.heinzelmann@usb.ch
Leiterin gyn. Sonographie und Pränataldiagnostik
Leitende ärztin
Frauenklinik
Universitätsspital Basel
Spitalstrasse 21
4031 Basel
gwendolin.manegold-brauer@usb.ch
Die Autorin hat keine Interessenskonflikte im Zusammenhang mit diesem Beitrag deklariert.
- Für die Dignitätseinschätzung von Adnexbefunden eignen sich die neben der Klinik die anamnestischen Risikofaktoren, der Tumormarker CA 125 sowie sonomorphologische Kriterien.
- Ein generelles Screening im Hinblick auf das Ovarialkarzinom ist nicht empfohlen.
- Zur Dignitätseinschätzung von Adnexbefunden sollte der Risk of Malignancy Index (RMI) sowie die IOTA-Nomenklatur verwendet werden.
- Die IOTA-Algorithmen sind dem RMI insbesondere bei prämenopausalen Frauen und bei Borderlinetumoren überlegen.
- Die Expertenmeinung des erfahrenen Untersuchers durch Wiedererkennungsmerkmale (pattern recognition) ist weiterhin die beste Methode zur Unterscheidung von malignen und benignen Adnexbefunden.
- Ein konservatives Management von benigne imponierenden Adnexbefunden mit regelmässigen Kontrollen scheint ein niedriges Risiko für Komplikationen und für Malignität zu haben.
Messages à retenir
- Plusieurs méthodes existent pour apprécier le potentiel infiltratif (allemand « Dignität ») d’ une masse ovarienne: L’ appréciation du clinicien expérimenté, les facteurs de risque anamnestiques, le marqueur tumoral CA 125 et des critères morphologiques à l’ échographie.
- Un screening de routine pour le cancer de l’ ovaire ne peut pas être recommandé
- Des outils particulièrement intéressants pour apprécier le potentiel infiltratif d’ une masse ovarienne sont le « Risk of Malignancy-Index » (RMI) ainsi que l’ évaluation par ultrason en appliquant les critères IOTA.
- Les algorithmes IOTA sont supérieurs au RMI en particulier chez la femme en préménopause et en cas de tumeur Borderline.
- L’ avis du clinicien ayant beaucoup d’ expérience avec l’ appréciation de masses annexielles représente la meilleure méthode pour distinguer des masses bénignes et malignes, et ceci grâce à la capacité de reconnaître des critères de malignité déjà observés par le passé (« pattern recognition »).
- L’ attitude expectative avec des contrôles réguliers en cas de masse apparaissant bénigne (à l’ échographie) semble comporter peu de risque (de se tromper ou de s’ exposer à des complications).
Literatur:
1. Jacobs IJ, Menon U, Ryan A, Gentry-Maharaj A, Burnell M, Kalsi JK, et al. Ovarian cancer screening and mortality in the UK Collaborative Trial of Ovarian Cancer Screening (UKCTOCS): a randomised controlled trial. Lancet. 2015 Dec 16;
2. Jacobs I, Oram D, Fairbanks J, Turner J, Frost C, Grudzinskas JG. A risk of malignancy index incorporating CA 125, ultrasound and menopausal status for the accurate preoperative diagnosis of ovarian cancer. Br J Obstet Gynaecol. 1990 Oct;97(10):922–9.
3. Manegold-Brauer G, Buechel J, Knipprath-Mészaros A, Schoetzau A, Hacker NF, Tercanli S, et al. Improved Detection Rate of Ovarian Cancer Using a 2-Step Triage Model of the Risk of Malignancy Index and Expert Sonography in an Outpatient Screening Setting. Int J Gynecol Cancer. 2016;26(6).
4. Menon U, Ryan A, Kalsi J, Gentry-Maharaj A, Dawnay A, Habib M, et al. Risk Algorithm Using Serial Biomarker Measurements Doubles the Number of Screen-Detected Cancers Compared With a Single-Threshold Rule in the United Kingdom Collaborative Trial of Ovarian Cancer Screening. J Clin Oncol. 2015 Jun 20;33(18):2062–71.
5. Timmerman D, Valentin L, Bourne TH, Collins WP, Verrelst H, Vergote I. Terms, definitions and measurements to describe the sonographic features of adnexal tumors: a consensus opinion from the International Ovarian Tumor Analysis (IOTA) Group. Vol. 16, Ultrasound in obstetrics & gynecology : the official journal of the International Society of Ultrasound in Obstetrics and Gynecology. 2000. p. 500–5.
6. Timmerman D, Testa AC, Bourne T, Ameye L, Jurkovic D, Van Holsbeke C, et al. Simple ultrasound-based rules for the diagnosis of ovarian cancer. Vol. 31, Ultrasound in obstetrics & gynecology : the official journal of the International Society of Ultrasound in Obstetrics and Gynecology. 2008. p. 681–90.
7. Van Calster B, Van Hoorde K, Valentin L, Testa AC, Fischerova D, Van Holsbeke C, et al. Evaluating the risk of ovarian cancer before surgery using the ADNEX model to differentiate between benign, borderline, early and advanced stage invasive, and secondary metastatic tumours: prospective multicentre diagnostic study. BMJ. 2014 Oct 15;349(oct07 3):g5920–g5920.
8. Froyman W, Landolfo C, De Cock B, Wynants L, Sladkevicius P, Testa AC, et al. Risk of complications in patients with conservatively managed ovarian tumours (IOTA5): a 2-year interim analysis of a multicentre, prospective, cohort study. Lancet Oncol. 2019 Mar;20(3):448–58.
info@gynäkologie
- Vol. 9
- Ausgabe 3
- Juni 2019