- Genitourinary syndrome of menopause (GSM)
Das Genitourinary Syndrome of Menopause (GSM) ist eine chronische, progressive Veränderung des urogenitalen Bereichs, welche durch Oestrogenmangel verursacht wird und im Alltag sehr belastend sein kann. Für die kompetente Behandlung ist eine gute Kenntnis der Pathophysiologie und evidenzbasierten Therapiemöglichkeiten essenziell, inklusive der neueren Alternativen, die zum Teil stark propagiert werden.
Le syndrome génito-urinaire de la ménopause (angl. GSM) est une affection chronique progrédiente dans la sphère uro-génitale. Elle est causée par le manque d’oestrogènes et peut devenir très gênante dans la vie de tous les jours. La bonne connaissance de la physiopathologie et des possibilités thérapeutiques basées sur des preuves sont essentielles pour une prise en charge compétente qui inclut la connaissance des traitements alternatifs plutôt récents, apparaissant souvent dans la publicité.
Das GSM betrifft ca. 50% der postmenopausalen Frauen in unterschiedlicher Ausprägung, die wahre Prävalenz ist schwierig zu eruieren (1, 2, 3, 4). Ältere Bezeichnungen (vulvovaginale Atrophie, atrophe Vaginitis, etc.) wurden dem Beschwerdebild in seiner Bandbreite nicht gerecht, so dass die International Society for the Study of Women’s Sexual Health (ISSWSH) und die North American Menopause Society (NAMS) sich 2013 auf den Begriff Genitourinary Syndrome of Menopause (GSM) einigten (1, 5).
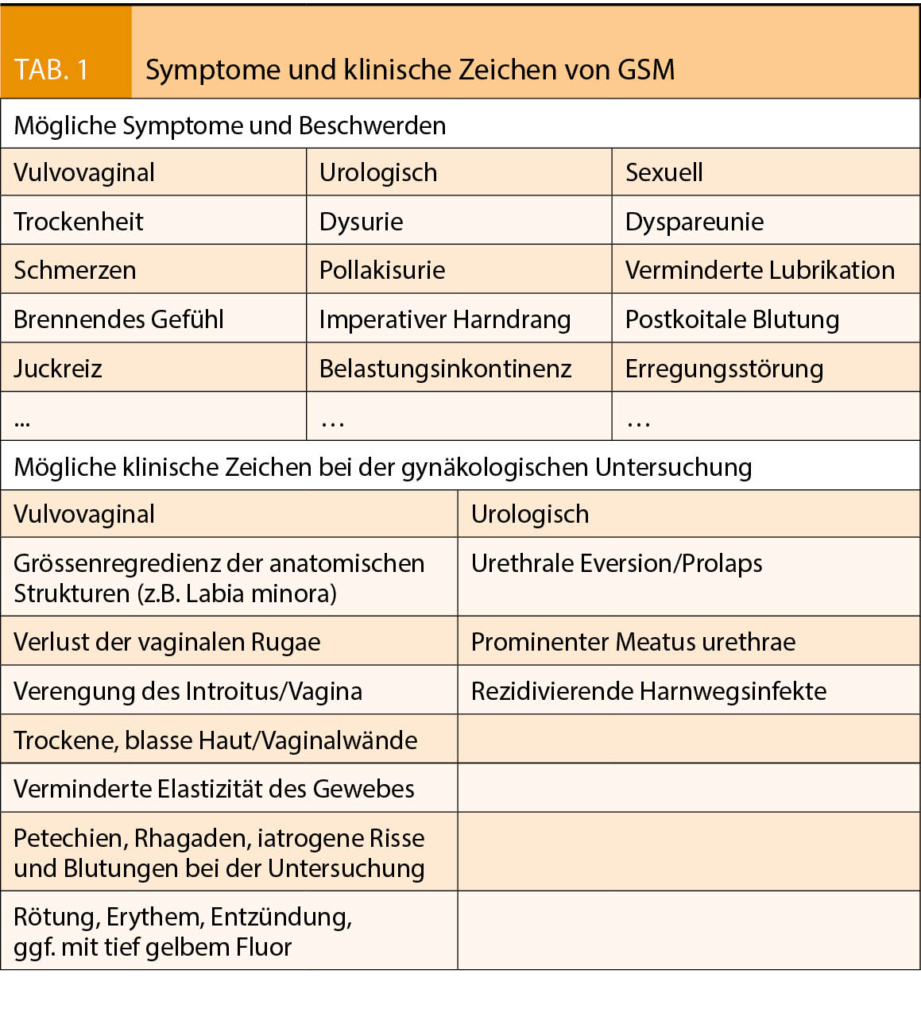
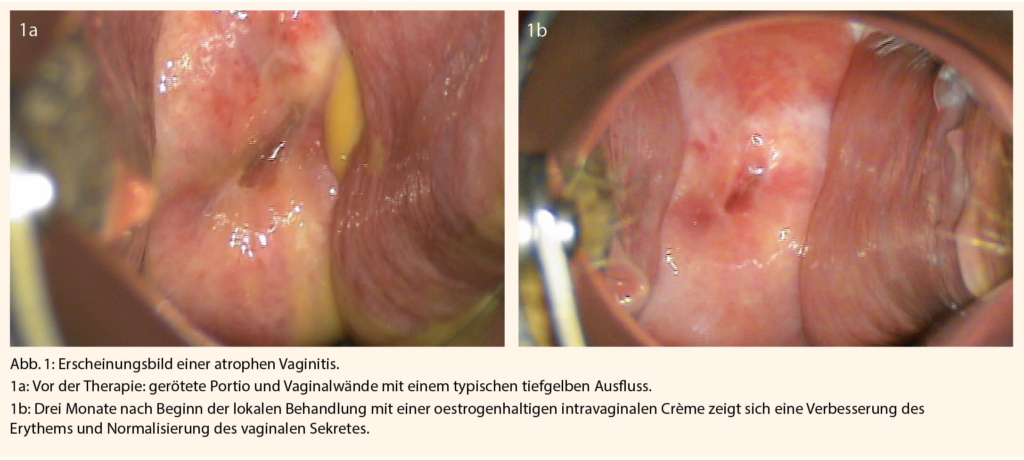
Das GSM verursacht eine Reihe von Beschwerden und Veränderungen im Urogenitalbereich (Tab. 1) (3). Der Oestrogenmangel führt zu progressiver Trockenheit und Ausdünnung der Vaginalwand, einer erhöhten Verletzlichkeit des Gewebes und auch einer höheren Rate an urogenitalen Infekten. Durch den Verlust von Zellschichten verringert sich die Produktion von Glykogen und somit die Produktion von Milchsäure durch die Laktobazillen, was zu einem höheren pH-Wert in der Vagina führt, was wiederum die Vermehrung von pathogenen Keimen fördert. In schweren Fällen kann es zu einer atrophiebedingten Kolpitis mit entzündlich veränderten Vaginalwänden und einem typischen tiefgelben Fluor kommen (Abb. 1a). Die Nativuntersuchung hier zeigt reichlich Parabasal- und Basalzellen, vermehrte Leukozyten und eine Prävalenz anderer Keime als Döderleinbakterien. Eine Behandlung mit lokalen Oestrogenen kann diese Befunde innert Wochen wieder normalisieren (Abb. 1b), sowie auch die Inzidenz an Harnwegsinfektrezidiven signifikant senken (6).
Ein einst vernachlässigtes Problem wird besser wahrgenommen
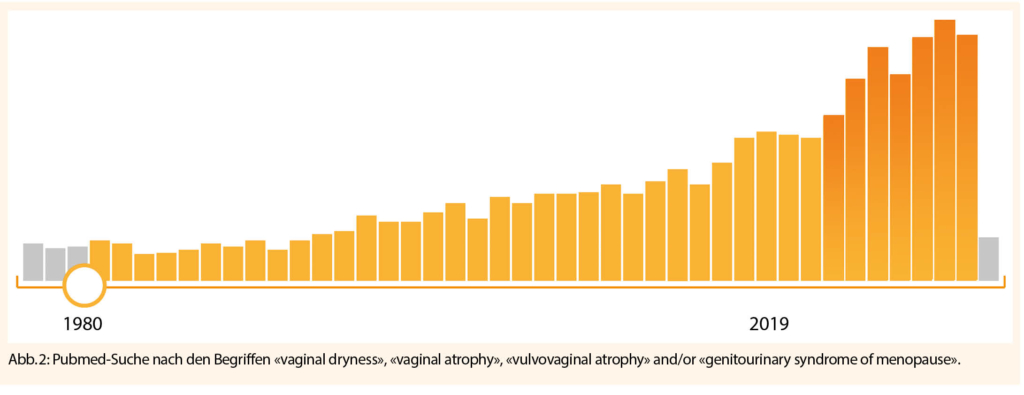
Das Interesse und Bewusstsein in Bezug auf das GSM hat zugenommen. Die PubMed Suche nach «vulvovaginal atrophy», und ähnlichen Begriffen zeigt einen deutlichen Anstieg an Publikationen in den letzten Jahren (Abb. 2).
Oftmals wird das Problem von den Betroffenen dem/der Arzt/Ärztin gegenüber aus diversen Gründen verschwiegen (2). Studien zeigen auch, dass Frauen die Symptome oft nicht erkennen oder falsch einstufen (7). Daher ist es wichtig, ein Bewusstsein für das GSM zu entwickeln, um betroffene Frauen adäquat zu behandeln. Fehlendes Wissen von behandelnder und betroffener Seite kann zu einer suboptimalen Behandlung bzw. einem frühzeitigen Sistieren der Behandlung führen.
Behandlungsmöglichkeiten
Da es sich um einen chronischen Zustand handelt wird eine langfristige Therapie benötigt, ansonsten rezidivieren die Beschwerden nach Sistieren der Therapie (1).
Lokale Oestrogenisierung
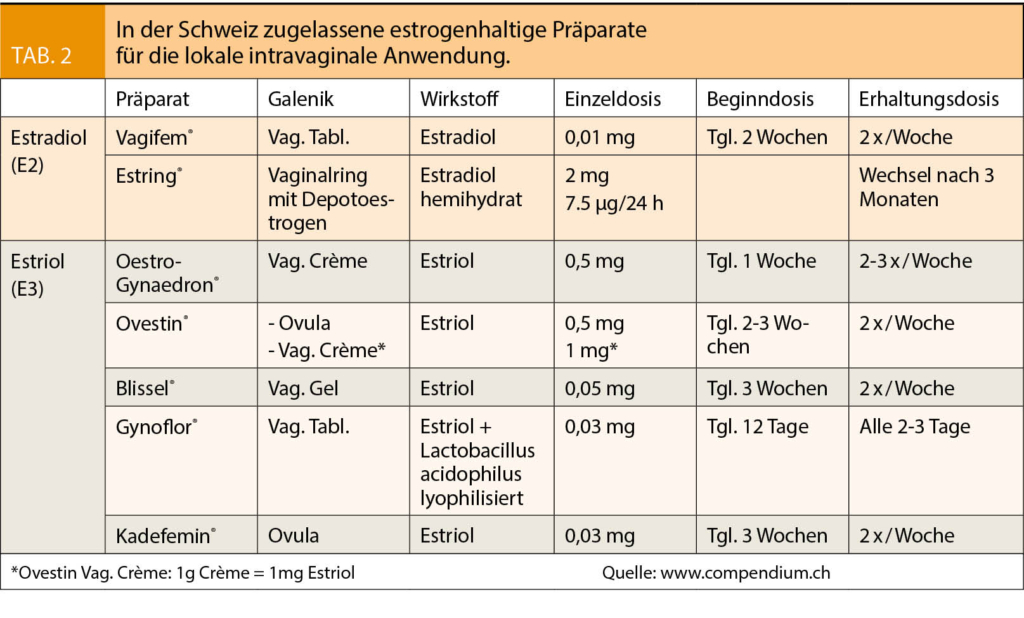
Die lokale Therapie mit Oestrogenen bleibt der Goldstandard (8, 9, 10). Alle in der Schweiz erhältlichen Präparate beinhalten niedrig bis sehr niedrig dosiertes Estradiol (E2) oder Estriol (E3) (Tab. 2). Die Oestrogenspiegel im Serum können je nach Dosierung variieren, scheinen aber nicht über die postmenopausalen Normwerte hinauszugehen (11, 12).
Um einen frühzeitigen Therapieabbruch zu vermeiden, sollte die Patientin darüber informiert sein, dass zu Beginn der Behandlung ein unangenehmes Gefühl in der Vagina zu erwarten ist, und dass es zu vermehrtem vaginalem Ausfluss kommen kann. Bei störenden Nebenwirkungen kann eine andere galenische Form probiert werden.
Bis zu 45% von Frauen unter systemischer HRT können persistierende vulvovaginale Beschwerden haben (10), so dass zusätzlich eine lokale Oestrogenisierung nötig ist. Deshalb ist bei Patientinnen mit GSM als Leitsymptom die vaginale niedrig dosierte Oestrogentherapie der systemischen menopausalen Hormotherapie überlegen und daher vorzuziehen (13).
Eine grosse Unsicherheit bei lokaler Oestrogenisierung besteht oft bei Frauen mit Karzinomen. Die aktuell in der Schweiz erhältlichen Präparate werden als sicher bei Frauen mit St. n. Mammakarzinom eingestuft, sollten aber nur eingesetzt werden, wenn der Leidensdruck unter den Symptomen des GSM ausgeprägt ist und die hormonfreien Therapien nicht den gewünschten Effekt erbracht haben. Dabei müssen die Nutzen und Risiken mit der Patientin ausführlich besprochen werden (13, 14, 15, 16, 17).
In einer Studie über 12 Monate mit Behandlung von postmenopausalen, nicht hysterektomierten Frauen mit 10 µg Oestradiol vaginal konnten keine Fälle von Endometriumhyperplasie oder -karzinom nachgewiesen werden (18). Die Daten betreffend lokale Oestrogenisierung bei Frauen mit Endometrium- oder Ovarialkarzinomen ist jedoch begrenzt und sollte nur überlegt werden, zusammen mit den behandelnden Onkologen, wenn der Leidensdruck sehr gross ist und alle andere Massnahmen keinen Effekt hatten (13, 19, 20). Die lokale Oestrogenisierung bei Frauen mit Zervix-, Vulva- oder Vaginalkarzinomen wird als unproblematisch betrachtet, weil diese Karzinome nicht als hormonempfindlich gelten.
Nicht hormonhaltige Lokaltherapeutika
Es gibt verschiedene Produkte in Form von wasserhaltigen Gels und ölhaltigen Crèmes und Salben. Grundsätzlich unterscheidet man zwischen Gleitmittel und Befeuchtungsmittel. Die Gleitmittel auf Wasser-, Öl oder Silikonbasis werden bei Bedarf angewendet, z.B. vor dem Geschlechtsverkehr. Glyzerin- und parabenhaltige Produkte können mukosale Reizungen auslösen, Vaseline und pflanzliche Öle können die Barrierefunktion von Kondomen verändern, teilweise auch zu allergischen Reaktionen führen (10). Befeuchtungsmittel haben die Eigenschaft, Wasser zu binden und somit den Feuchtigkeitsgehalt und auch die Elastizität der Vagina zu erhöhen. Einige dieser Produkte enthalten Hyaluronsäure und eine begrenzte Anzahl von Studien suggerieren, dass die Präparate mit Hyaluronsäure ähnlich effizient sind wie oestrogenhaltige Präparate (21, 22). Bei allen diesen Produkten spielt der Kostenfaktor eine signifikante Rolle, da sie nicht durch die Krankenversicherung rückerstattet werden und in der Regel täglich angewendet werden sollten, um die Besserung der Symptome aufrecht zu erhalten.
DHEA
Ein neuerer Ansatz ist die lokale Therapie mit Dehydroepiandosteron (DHEA) vaginal. Es gibt ein Produkt auf dem Markt (Prasteron), welches wahrscheinlich bald auch in der Schweiz zugelassen wird (23). DHEA wird in der Zelle in E2 und Testosteron umgewandelt (24), ohne den Serumspiegel beider Hormone signifikant zu verändern, und die Werte bleiben im normalen postmenopausalen Bereich (25, 26). Der Urogenitaltrakt ist nebst Oestrogenrezeptoren auch reich an Androgenrezeptoren (27). Einige Studien zeigen einen guten Effekt auf das GSM ohne systemische Nebenwirkungen (25, 28, 29, 30). DHEA scheint ebenfalls sicher in Bezug auf das Endometrium (31, 32, 33, 34).
Ospemifen
Ospemifen ist ein selektiver Oestrogenrezeptormodu-lator (SERM), welcher in der EU zugelassen ist für die Behandlung von Dyspareunie und vaginaler Trockenheit im Rahmen des GSM (4). Ospemifen und seine Hauptmetaboliten binden an die Oestrogenrezeptoren und haben an der vaginalen Mukosa einen agonistischen, estrogenähnlichen Effekt, im Uterus eine schwache partiell agonistische/antagonistische Wirkung und am Brustgewebe eine vorwiegend antagonistische Wirkung. Ospemifen ist in der Schweiz nicht zugelassen.
Laser- und Radiofrequenztherapie
Die vaginale Behandlung mittels Laser (fraktionierter CO2 Laser/ erbium: YAG Laser) wird als alternative Therapie des GSMs eingesetzt, um die Vaskularisierung der Vaginalwand zu verbessern, die Synthese von Kollagen und anderen Grundsubstanzen der Matrix zu stimulieren, und die Dicke der Vaginalwände wieder aufzubauen (35). Bei der Radiofrequenztherapie wird das Gewebe auf 40-45°C aufgeheizt, was die Fibroblasten dazu stimuliert, Kollagen zu bilden durch Aktivierung von heat shock Proteinen und Initiierung der inflammatorischen Kaskade (36). Die Studienlage über Sicherheit und Nebenwirkungen, wie Narben, Dyspareunie und chronische Schmerzen, insbesondere in Bezug auf Langzeitwirkungen ist für beide Methoden nach wie vor ungenügend (4, 36, 37, 38) und sowohl die FDA (39), als auch die Fachgesellschaften (40, 41) mahnen zur Vorsicht. Die Behandlung führt aktuell auch zu hohen Eigenkosten für die Patientinnen.
Vaginale Probiotika
Es gibt zunehmend Evidenz, dass das vaginale Mikrobiom eine wichtige Rolle für die vaginale Homöostase spielt, und dass es sich bei jungen Frauen im Vergleich zu postmenopausalen Frauen signifikant unterscheidet (42). Eine lokale Oestrogentherapie führt zu einer Re-Kolonisation mit Laktobazillen (43, 44). Eine Studie zeigt, dass Frauen, die ultraniedrig dosiertes E3 zusammen mit Laktobazillen angewendet haben, eine signifikant höhere Verbesserung der urogenitalen Symptomatik haben im Vergleich zu Frauen, die E3 ohne Laktobazillen appliziert hatten (45). Eine vaginale Gabe von Oestrogenen und gleichzeitig Laktobazillen könnte einen synergistischen Effekt haben, aber die Datenlage ist hier begrenzt. Die alleinige Gabe von oralen oder vaginalen Probiotika ist aktuell im Trend aber die Daten zu dauerhafter Wirksamkeit sind noch ungenügend.
Wichtige Zusatzmassnahmen für die erfolgreiche GSM Behandlung
Die (äussere) Vulva hat kaum Oestrogenrezeptoren, somit hat in diesem Bereich eine lokale Oestrogenisierung keinen Effekt auf die vulväre Trockenheit. Hier wäre die Anwendung einer fettreichen Salbe sinnvoll. Mit Ausnahme von Linola® fett Emuls werden diese Präparate in der Schweiz nicht rückerstattet. Deshalb sollten die Kosten für die Patientinnen immer berücksichtigt werden.
Die korrekte, hautschonende Genitalhygiene muss ebenfalls beachtet werden. Übermässiges Waschen sollte vermieden werden. Ebenfalls sollte man auch auf hautfreundliche Unterwäsche und Kleidung achten.
Urin- und/oder Stuhlinkontinenz können die Symptome verstärken und sollten erfragt werden. In diesem Fall ist eine Behandlung mit einer Fettsalbe ebenfalls sinnvoll um den natürlichen Säure-Talg-Film auf der Haut nicht zu zerstören und die Haut mittels Rückfettung abwehrfähig zu halten (46).
Digitale Quellen
Im digitalen Zeitalter greifen Frauen zunehmend auf online Quellen als erste Anlaufstelle für Informationen zurück. Es gibt eine grosse Anzahl an Plattformen und Foren um Fragen zu stellen und Antworten zu suchen. Die NAMS bietet selbst eine eigene kostenlose App «MenoPro».
Diese digitalen Quellen sind für viele Frauen wichtig und können eine Ergänzung zur ärztlichen Information darstellen. Wie immer finden sich aber auch beim GSM im Internet verwirrende oder irreführende Informationen und die Grenze zwischen Werbung und Wissenschaft ist nicht immer ersichtlich. Deshalb ist es umso wichtiger, dass medizinisches Fachpersonal gut über das aktuelle Wissen mit den effizienten Therapieformen informiert ist, da dies die Basis für eine erfolgreiche Behandlung darstellt.
Copyright bei Aerzteverlag medinfo AG
Frauenklinik
Universitätsspital Basel
Spitalstrasse 21
4031 Basel
jeanjacques.ries@usb.ch
Frauenklinik
Universitätsspital Basel
Spitalstrasse 21
4031 Basel
dorothy.huang@usb.ch
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel.
- Das GSM kann zum Teil sehr ausgeprägte Veränderungen und Symptome im ganzen Urogenitalbereich auslösen. Ein gutes Verständnis über die Symptomatik und Pathophysiologie des GSM ist die Basis für eine erfolgreiche Therapie.
- Die lokale Oestrogenisierung bleibt die wirksamste Therapie des GSM. Alle in der Schweiz erhältlichen Präparate sind niedrig dosiert und stellen gemäss aktueller Datenlage keine Gefahr für Frauen mit St. n. Mammakarzinom dar. Dabei sollten allerdings alle nicht-hormonelle Therapieoptionen ausgeschöpft worden sein. Nutzen und Risiken müssen mit der Patientin klar besprochen werden.
- Bei Wunsch nach nicht-hormonellen Therapien gibt es zahlreiche Produkte. Viele müssen allerdings täglich angewendet und die Kosten müssen selbst getragen werden.
- Laser- und Radiofrequenztherapie werden zum Teil stark propagiert. Die Datenlage insbesondere zur Sicherheit ist spärlich, und das Potenzial für Nebenwirkungen sowie hohe Selbstkosten sind immer zu berücksichtigen.
- Lokales DHEA scheint eine vielversprechende Behandlungsoption zu sein.
Messages à retenir
- Le syndrome génito-urinaire de la ménopause peut provoquer des symptômes et altérations parfois marqués dans toute la sphère uro-
génitale. De bonnes connaissances de la symptomatologie et la physiopathologie sont la base pour un traitement réussi. - L’oestrogénisation locale reste la meilleure thérapie de ce syndrome. Toutes les préparations disponibles en Suisse sont faiblement dosées et ne portent – d’après les données actuellement disponibles – aucun danger pour la santé de la femme, aussi après cancer du sein. Dans ce cas de figure néanmoins, toutes les options thérapeutiques non-hormonales devraient avoir été essayées. Les bénéfices et les risques doivent être discutés en détail avec la patiente.
- Pour la femme désirant un traitement non-hormonal, un grand nombre de produits est à disposition. Mais beaucoup doivent être appliqués quotidiennement et les caisses-maladies ne les remboursent pas.
- Les traitements au Laser et par radiofréquence font souvent l’objet de publicités poussées. Les données, en particulier sur la sécurité, sont toutefois peu nombreuses. En plus, les effets secondaires potentiels et le coût important à la charge de la patiente sont toujours à considérer.
- L’ application locale de DHEA semble être une option thérapeutique prometteuse.
1. Palacios S, Castelo-Branco C, Currie H, Mijatovic V, Nappi RE, Simon J, & Rees M. Update on management of genitourinary syndrome of menopause: A practical guide. Maturitas 2015 82 307–312. (doi:10.1016/j.maturitas.2015.07.020)
2. Parish SJ, Nappi R, Krychman ML, Kellogg-Spadt S, Simon JA, Goldstein JA, & Kingsberg S. Impact of vulvovaginal health on postmenopausal women: a review of surveys on symptoms of vulvovaginal atrophy. International Journal of Women’s Health 2013 5 437. (doi:10.2147/IJWH.S44579)
3. Gandhi J, Chen A, Dagur G, Suh Y, Smith N, Cali B, & Khan SA. Genitourinary syndrome of menopause: an overview of clinical manifestations, pathophysiology, etiology, evaluation, and management. American Journal of Obstetrics and Gynecology 2016 215 704–711. (doi:10.1016/j.ajog.2016.07.045)
4. Kagan R, Kellogg-Spadt S, & Parish SJ. Practical Treatment Considerations in the Management of Genitourinary Syndrome of Menopause. Drugs and Aging 2019 36 897–908. (doi:10.1007/s40266-019-00700-w)
5. Portman DJ, Gass MLS, Kingsberg S, Archer D, Bachmann G, Burrows L, Freedman M, Goldstein A, Goldstein I, Heller D, Iglesia CB, Kagan R, Spadt SK, Krychman M, Nachtigall L, Nappi RE, Pinkerton J V., Shifren J, Simon J, & Stuenkel C. Genitourinary syndrome of menopause: New terminology for vulvovaginal atrophy from the international society for the study of women’s sexual health and the North American Menopause Society. Menopause 2014 21 1063–1068. (doi:10.1097/gme.0000000000000329)
6. Raz R & Stamm WE. A Controlled Trial of Intravaginal Estriol in Postmenopausal Women with Recurrent Urinary Tract Infections. New England Journal of Medicine 1993 . (doi:10.1056/NEJM199309093291102)
7. Krychman M, Graham S, Bernick B, Mirkin S, & Kingsberg SA. The Women’s EMPOWER Survey: Women’s Knowledge and Awareness of Treatment Options for Vulvar and Vaginal Atrophy Remains Inadequate. Journal of Sexual Medicine 2017 14 425–433. (doi:10.1016/j.jsxm.2017.01.011)
8. Management of symptomatic vulvovaginal atrophy. Menopause: The Journal of The North American Menopause Society 2013 20 888–902. (doi:10.1097/GME.0b013e3182a122c2)
9. Baber RJ, Panay N, & Fenton A. 2016 IMS Recommendations on womens midlife health and menopause hormone therapy. Climacteric 2016 19 109–150. (doi:10.3109/13697137.2015.1129166)
10. Wuest A & Stute P. Vulvovaginale Beschwerden in der Menopause, Update 2018. Gynäkologie 2018 12–17.
11. Rees M, Pérez-López FR, Ceasu I, Depypere H, Erel T, Lambrinoudaki I, Schenck-Gustafsson K, Simoncini T, Schouw YT Van Der, & Tremollieres F. EMAS clinical guide: Low-dose vaginal estrogens for postmenopausal vaginal atrophy. Maturitas 2012 73 171–174. (doi:10.1016/j.maturitas.2012.06.009)
12. Eugster-Hausmann M, Waitzinger J, & Lehnick D. Minimized estradiol absorption with ultra-low-dose 10 μg 17 β-estradiol vaginal tablets. Climacteric 2010 13 219–227. (doi:10.3109/13697137.2010.483297)
13. Birkhäuser M, Bürki R, Geyter C De, Imthurn B, Schiessl K, Streuli I, Stute P, & Wunder D. Aktuelle Empfehlungen zur Menopausalen Hormon-Therapie ( MHT ) Allgemeine Grundsätze Empfehlungen zur Anwendung einer MHT bei Frauen mit zeitgerechter Menopause (SGGG Expertenbrief No 42). 2015.
14. Buchholz S, Mögele M, Lintermans A, Bellen G, Prasauskas V, Ortmann O, Grob P, Neven P, & Donders G. Vaginal estriol-lactobacilli combination and quality of life in endocrine-treated breast cancer. Climacteric 2015 18 252–259. (doi:10.3109/13697137.2014.991301)
15. Donders G, Neven P, Moegele M, Lintermans A, Bellen G, Prasauskas V, Grob P, Ortmann O, & Buchholz S. Ultra-low-dose estriol and Lactobacillus acidophilus vaginal tablets (Gynoflor®) for vaginal atrophy in postmenopausal breast cancer patients on aromatase inhibitors: Pharmacokinetic, safety, and efficacy phase i clinical study. Breast Cancer Research and Treatment 2014 145 371–379. (doi:10.1007/s10549-014-2930-x)
16. ACOG committee Opinion. The Use of Vaginal Estrogen in Women With a History of Estrogen-Dependent Breast Cancer. Obstetrics & Gynecology 2016 127 93–96.
17. Crandall CJ, Hovey KM, Andrews CA, Chlebowski RT, Stefanick ML, Lane DS, Shifren J, Chen C, Kaunitz AM, Cauley JA, & Manson JE. Breast cancer, endometrial cancer, and cardiovascular events in participants who used vaginal estrogen in the Women’s Health Initiative Observational Study. Menopause 2018 25 11–20. (doi:10.1097/GME.0000000000000956)
18. Ulrich LSG, Naessen T, Elia D, Goldstein JA, & Eugster-Hausmann M. Endometrial safety of ultra-low-dose Vagifem 10 μg in postmenopausal women with vaginal atrophy. Climacteric 2010 13 228–237. (doi:10.3109/13697137.2010.481058)
19. Guidozzi F. Estrogen therapy in gynecological cancer survivors. Climacteric 2013 16 611–617. (doi:10.3109/13697137.2013.806471)
20.Crean-Tate KK, Faubion SS, Pederson HJ, Vencill JA, & Batur P. Management of genitourinary syndrome of menopause in female cancer patients: a focus on vaginal hormonal therapy. American Journal of Obstetrics and Gynecology 2020 222 103–113. (doi:10.1016/j.ajog.2019.08.043)
21. Stute P. Is vaginal hyaluronic acid as effective as vaginal estriol for vaginal dryness relief? Archives of Gynecology and Obstetrics2013. (doi:10.1007/s00404-013-3068-5)
22. Chen J, Geng L, Song X, Li H, Giordan N, & Liao Q. Evaluation of the efficacy and safety of hyaluronic acid vaginal gel to ease vaginal dryness: A multicenter, randomized, controlled, open-label, parallel-group, clinical trial. Journal of Sexual Medicine 2013 . (doi:10.1111/jsm.12125)
23. European Medicines Agency. Intrarosa: summary of product characteristics. 2019.
24. Labrie F, Bélanger A, Pelletier G, Martel C, Archer DF, & Utian WH. Science of intracrinology in postmenopausal women. Menopause 2017 24 702–712. (doi:10.1097/GME.0000000000000808)
25. Heo YA. Prasterone: A Review in Vulvovaginal Atrophy. Drugs and Aging 2019 36 781–788. (doi:10.1007/s40266-019-00693-6)
26. Martel C, Labrie F, Archer DF, Ke Y, Gonthier R, Simard JN, Lavoie L, Vaillancourt M, Montesino M, Balser J, & Moyneur É. Serum steroid concentrations remain within normal postmenopausal values in women receiving daily 6.5 mg intravaginal prasterone for 12 weeks. Journal of Steroid Biochemistry and Molecular Biology 2016 . (doi:10.1016/j.jsbmb.2016.03.016)
27. Simon JA, Goldstein I, Kim NN, Davis SR, Kellogg-Spadt S, Lowenstein L, Pinkerton J V., Stuenkel CA, Traish AM, Archer DF, Bachmann G, Goldstein AT, Nappi RE, & Vignozzi L. The role of androgens in the treatment of genitourinary syndrome of menopause (GSM): International Society for the Study of Women’s Sexual Health (ISSWSH) expert consensus panel review. Menopause 2018 25 837–847. (doi:10.1097/GME.0000000000001138)
28 Barton DL, Shuster LT, Dockter T, Atherton PJ, Thielen J, Birrell SN, Sood R, Griffin P, Terstriep SA, Mattar B, Lafky JM, & Loprinzi CL. Systemic and local effects of vaginal dehydroepiandrosterone (DHEA): NCCTG N10C1 (Alliance). Supportive Care in Cancer 2018 26 1335–1343. (doi:10.1007/s00520-017-3960-9)
29. Labrie F, Archer DF, Martel C, Vaillancourt M, & Montesino M. Combined data of intravaginal prasterone against vulvovaginal atrophy of menopause. Menopause 2017 24 1246–1256. (doi:10.1097/GME.0000000000000910)
30. Labrie F, Archer DF, Koltun W, Vachon A, Young D, Frenette L, Portman D, Montesino M, Côté I, Parent J, Lavoie L, BSc AB, Martel C, Vaillancourt M, Balser J, & Moyneur É. Efficacy of intravaginal dehydroepiandrosterone (DHEA) on moderate to severe dyspareunia and vaginal dryness, symptoms of vulvovaginal atrophy, and of the genitourinary syndrome of menopause. Menopause (New York, N.Y.) 2018 25 1339–1353. (doi:10.1097/GME.0000000000001238)
31. Archer DF, Labrie F, Bouchard C, Portman DJ, Koltun W, Cusan L, Labrie C, Côté I, Lavoie L, Martel C, & Balser J. Treatment of pain at sexual activity (dyspareunia) with intravaginal dehydroepiandrosterone (prasterone). Menopause 2015 22 950–963. (doi:10.1097/GME.0000000000000428)
32. Archer DF, Labrie F, Montesino M, & Martel C. Comparison of intravaginal 6.5 mg (0.50%) prasterone, 0.3 mg conjugated estrogens and 10 μg estradiol on symptoms of vulvovaginal atrophy. Journal of Steroid Biochemistry and Molecular Biology 2017 174 1–8. (doi:10.1016/j.jsbmb.2017.03.014)
33. Labrie F, Archer DF, Koltun W, Vachon A, Young D, Frenette L, Portman D, Montesino M, Côte I, Parent J, Lavoie L, Beauregard A, Martel C, Vaillancourt M, Balser J, & Moyneur E. Efficacy of intravaginal dehydroepiandrosterone (DHEA) on moderate to severe dyspareunia and vaginal dryness, symptoms of vulvovaginal atrophy, and of the genitourinary syndrome of menopause. Menopause 2016 23 243–256. (doi:10.1097/GME.0000000000000571)
34. Portman DJ & Gass MLS. Genitourinary syndrome of menopause. Menopause 2014 21 1063–1068. (doi:10.1097/GME.0000000000000329)
35. Wańczyk-Baszak J, Woźniak S, Milejski B, & Paszkowski T. Genitourinary syndrome of menopause treatment using lasers and temperature-controlled radiofrequency. Menopause Review/Przeglad Menopauzalny 2018 17 180–184. (doi:10.5114/pm.2018.81743)
36. Qureshi AA, Tenenbaum MM, & Myckatyn TM. Nonsurgical Vulvovaginal Rejuvenation with Radiofrequency and Laser Devices: A Literature Review and Comprehensive Update for Aesthetic Surgeons. Aesthetic Surgery Journal 2018 38 302–311. (doi:10.1093/asj/sjx138)
37. Pitsouni E, Grigoriadis T, Falagas ME, Salvatore S, & Athanasiou S. Laser therapy for the genitourinary syndrome of menopause. A systematic review and meta-analysis. Maturitas 2017 103 78–88. (doi:10.1016/j.maturitas.2017.06.029)
38. Arunkalaivanan A, Kaur H, & Onuma O. Laser therapy as a treatment modality for genitourinary syndrome of menopause: a critical appraisal of evidence. International Urogynecology Journal 2017 28 681–685. (doi:10.1007/s00192-017-3282-y)
39. FDA. FDA Warns Against Use of Energy-Based Devices to Perform Vaginal ‘Rejuvenation’ or Vaginal Cosmetic Procedures: FDA Safety Communication.
40. Shobeiri SA, Kerkhof MH, Minassian VA, & Bazi T. IUGA committee opinion : laser-based vaginal devices for treatment of stress urinary incontinence , genitourinary syndrome of menopause , and vaginal laxity. Int Urogynecol J 2019 371–376.
41. Preti M, Vieira-Baptista P, Digesu GA, Bretschneider CE, Damaser M, Demirkesen O, Heller DS, Mangir N, Marchitelli C, Mourad S, Moyal-Barracco M, Peremateu S, Tailor V, Tarcan T, De EJB, & Stockdale CK. The clinical role of LASER for vulvar and vaginal treatments in gynecology and female urology: An ICS/ISSVD best practice consensus document. Neurourology and Urodynamics 2019 38 1009–1023. (doi:10.1002/nau.23931)
42. Brotman RM, Shardell MD, Gajer P, Fadrosh D, Chang K, Silver MI, Viscidi RP, Burke AE, Ravel J, & Gravitt PE. Association between the vaginal microbiota, menopause status, and signs of vulvovaginal atrophy. Menopause 2018 25 1321–1330. (doi:10.1097/gme.0b013e3182a4690b)
43. Gliniewicz K, Schneider GM, Ridenhour BJ, Williams CJ, Song Y, Farage MA, Miller K, & Forney LJ. Comparison of the vaginal microbiomes of premenopausal and postmenopausal women. Frontiers in Microbiology 2019 10 1–9. (doi:10.3389/fmicb.2019.00193)
44. Muhleisen AL & Herbst-Kralovetz MM. Menopause and the vaginal microbiome. Maturitas 2016 91 42–50. (doi:10.1016/j.maturitas.2016.05.015)
45. Capobianco G, Wenger JM, Meloni GB, Dessole M, Cherchi PL, & Dessole S. Triple therapy with Lactobacilli acidophili, estriol plus pelvic floor rehabilitation for symptoms of urogenital aging in postmenopausal women. Archives of Gynecology and Obstetrics 2014 289 601–608. (doi:10.1007/s00404-013-3030-6)
46. Ryu GSG. Rezidivierende Harnwegsinfektionen. info@gynäkologie 2017 7–10.
info@gynäkologie
- Vol. 10
- Ausgabe 4
- August 2020