- Highlights vom SABCS 2019
Zum 42. Mal fand Anfang Dezember das San Antonio Breast Cancer Symposium (SABCS), wahrscheinlich einer der wichtigsten Brustkrebs-Kongresse, statt. Über 7500 Teilnehmer aus mehr als 90 Ländern nahmen am Kongress teil.
Während 4.5 Tagen wurde bei vorweihnächtlicher Stimmung eine eindrückliche Menge an neuen Daten präsentiert und diskutiert. In der folgenden Zusammenfassung wurden Präsentationen zusammengefasst, die für praktizierende Gynäkologinnen und Gynäkologen am relevantesten sein könnten.
Endokrine Therapie
IBIS-II-Studie
Kann eine medikamentöse Brustkrebsprävention das Risiko von Brustkrebs bei Patientinnen mit erhöhtem Risiko reduzieren? In der randomisierten IBIS-II Studie konnte gezeigt werden, dass die Einnahme von Anastrozol über fünf Jahre bei Hochrisikopatientinnen das Brustkrebsrisiko signifikant reduziert und die präventive Wirkung über bis zu zwölf Jahren anhält.
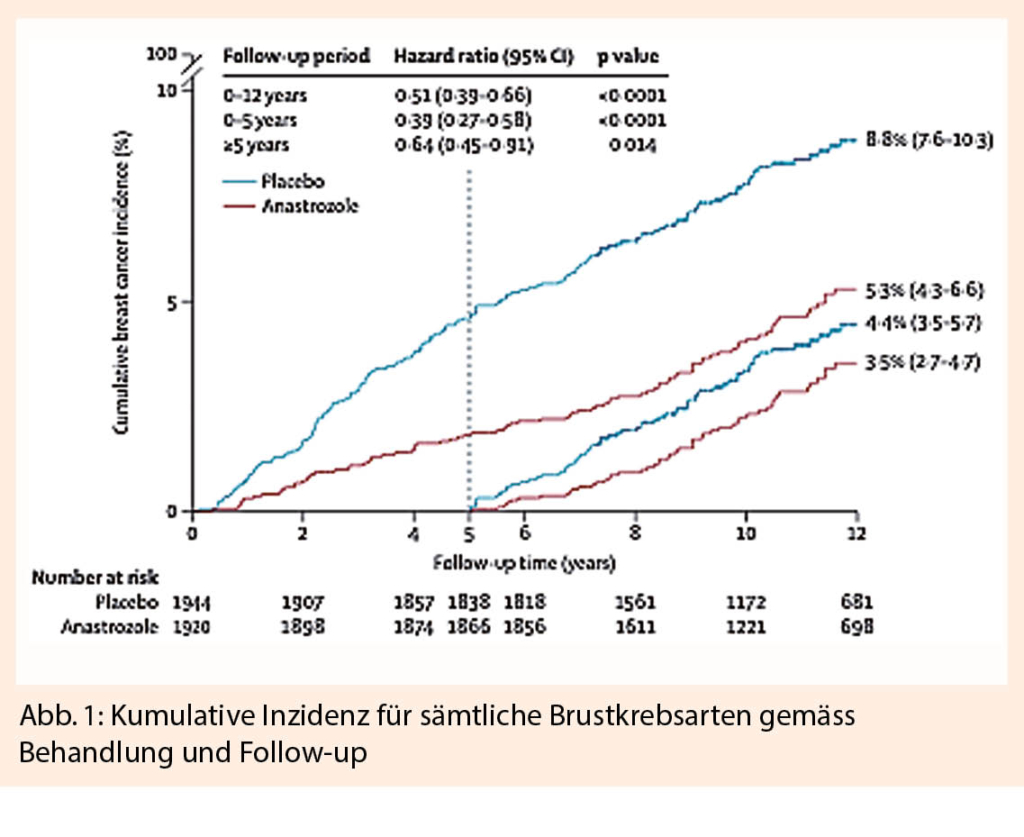
Jack Cuzick präsentierte mit der IBIS-II Studie die Langzeit Resultate der Einnahme einer prophylaktischen antihormonellen Therapie mit Anastrozol über 5 Jahre im Follow-up (1). In der Studie wurden Patientinnen zwischen 40-70 Jahren eingeschlossen, welche ein erhöhtes Risiko für Brustkrebs hatten (Familienanamnese, Atypie/LCIS, hohe Brustdichte) und keine Hormontherapie einnahmen. Es wurden 3864 Patientinnen eingeschlossen, davon 1920 Patientinnen in den Anastrozol Arm (1 mg/die), 1944 Patientinnen wurden in den Placebo Arm eingeschlossen. Nach 10.9 Jahren Follow-up wurde bei insgesamt 241 Patientinnen Brustkrebs diagnostiziert. Obwohl die Brustkrebsinzidenz in den ersten 5 Jahren mit 4.6% in der Placebo Gruppe versus 1.8% in der Anastrozol Gruppe (HR = 0.39 (0.27-2.58), P < 0.0001) deutlich besser war, zeigte sich nach 10.9 Jahren Follow-up immer noch eine signifikante Senkung der Brustkrebsinzidenz von 3.5% in der Anastrozol Gruppe versus 4.4% in der Placebo Gruppe (HR = 0.64 (0.45-0.91), P = 0.014). Gesamthaft zeigt sich somit ein Vorteil in der Anastrozol Gruppe mit 5.3% versus 8.8% in der Placebo Gruppe (HR 0.51 (0.39-0.66), p-Value < 0.0001) mit einer Number Needed to Treat (NTT) von 29. (Abb. 1).
ER-positive, invasive Mammakarzinome wurden mit 54% in der Anastrozol Gruppe vermindert gesehen (HR=0.46 (0.33-0.65), P<0.0001), jedoch zeigte sich kein signifikanter Effekt bei den ER-negativen Mammakarzinomen (HR = 0.77 (0.41-1.44), P = 0.4). Ebenfalls ergab sich eine gesamthafte Senkung der DCIS, vor allem bei ER-positivem DCIS (HR = 0.22 (0.07-0.65), p < 0.0001). Ferner wurde eine Reduktion der Inzidenz des Endometriumkarzinoms (5 vs. 7), Ovarialkarzinoms (7 vs. 10), Kolonkarzinoms (11 vs. 16) sowie Melanoms (9 vs. 12) festgestellt.
Zu Beginn der Therapie wurde bei jeder Frau eine Osteodensitometrie durchgeführt. Je nach Knochendichte erhielten die Patientinnen Bisphosphonate sowie Vitamin D. Es zeigte sich kein signifikanter Unterschied nach 10.9 Monaten Follow-up in Knochenbrüchen, Herzinfarkten, tiefe Beinvenenthrombosen, transitorische ischämische Attacken (TIA) oder Schlaganfällen. Die Adhärenz zur Therapie war bei der Placebo Gruppe 77% und bei der Anastrozol Gruppe 74%. Als Schlussfolgerung kann man aus diesen Resultaten ziehen, dass die Anastrozol Einnahme über 5 Jahre bei Patientinnen mit erhöhtem Risiko, das Risiko für Brustkrebs um ca. 49% reduziert (ER positive Mammakarzinome (54%) vs. ER negative Mammakarzinome (27%)). Diese Daten unterstützen die Empfehlung zur Einnahme von Anastrozol bei postmenopausalen Hochrisikopatientinnen zur Prävention von Brustkrebs.
Verursacht die postmenopausale Hormontherapie Brustkrebs?
Interessant waren die Daten von Rowan Chlebowski von der Woman’s Health Initiative. Er präsentierte Langzeitdaten von über 19 Jahren Follow-up (2). Die Daten wurden von den vier WHI randomisierten Kohorten Studien aus zwei randomisierten Studien ausgewählt und analysiert. Insgesamt wurden 27’347 Patientinnen zwischen 50-79 Jahren ohne Brustkrebs in der Vorgeschichte und in der Mammographie bei Einschluss in die zwei randomisierten Studien, welche in 40 US Kliniken zwischen 1993-1998 durchgeführt wurden, eingeschlossen. Ein Follow-up erfolgte bis September 2016. Alle Patientinnen stoppten die Studienmedikamenteneinnahme in 2002 resp. 2004. 10 739 postmenopausale Patientinnen mit Hysterektomie wurden in eine Placebo Gruppe versus CEE (conjugated equine estrogen 0.625 mg/d) Gruppe randomisiert. Als Vergleich wurden 16’608 Patientinnen ohne Hysterektomie in Placebo versus CEE und MPA (Medroxyprogesteronacetat 2.5mg/d) eingeschlossen. Jährlich erfolgte eine Mammographie. Neudiagnosen von Mammakarzinom sowie Mammakarzinom assoziierte Mortalität wurden erfasst. CEE zeigte nach 16.2 Jahren Follow-up im Vergleich zur Placebo Gruppe eine reduzierte Brustkrebsinzidenz (HR = 0.77 95% CI (0.65-0.92), P = 0.005). Nach 18.3 Jahren Follow-up, zeigte die Gruppe mit der Einnahme von CEE und MPA hingegen eine signifikant erhöhte Brustkrebsinzidenz (HR = 1.29 (1.14-.1.47) P < 0.001) im Vergleich zu Placebo.
Erst kürzlich wurde durch die Collaborative Group on Hormonal Factors in Breast cancer eine Publikation veröffentlicht (3), welche eine Meta-Analyse mit Daten von 58 Studien und 143 887 postmenopausalen Patientinnen mit Brustkrebs sowie 424 972 Patientinnen in der Kontrollgruppe ohne Brustkrebs verglich. Im Vergleich zu Chlebowski et al., postulierte diese Gruppe das Gegenteil, nämlich dass die Einnahme von Östrogenen alleine das Brustkrebsrisiko leicht erhöht um ca. 6.8% (absolut 0.5 per 100 Frauen). In der Schweiz werden konjugierte Östrogene kaum mehr verschrieben. Diese kontroversen Resultate der Brustkrebsrisiken einer postmenopausalen Hormontherapie mit Östrogenen, werden sicher Anlass zu vielen weiteren Diskussionen geben und sollten in der Hormontherapie-Beratung einer postmenopausalen miteinbezogen werden.
Minimal invasive Diagnostik nach neoadjuvanter Chemotherapie. Vakuumbiopsie anstatt Operation?

Zu Diskussionen führten auch vier Vorträge und ein Poster, die eine Validierung der minimal invasiven Diagnostik nach neoadjuvanter Chemotherapie untersuchten. Jörg Heil aus Heidelberg präsentierte die Daten der RESPONDER Studie (4), in der die Diagnose der pathologischen Komplettremission (pCR) durch Vakuum-assistierte Biopsie nach neoadjuvanter Chemotherapie bei Brustkrebs validiert wurde.
Eine neoadjuvante Chemotherapie wird immer häufiger indiziert und bis zu 60% kann eine pCR je nach Subtyp erreicht werden. Ein ypT0 Stadium nach operativer Therapie (brusterhaltender Therapie resp. Mastektomie) könnte als Überbehandlung angesehen werden. Durch Bildgebung kann eine pCR nicht korrekt ermittelt werden. In 21 Zentren in Deutschland zwischen März 2017 bis Mai 2019 konnten 451 Patientinnen in die Studie eingeschlossen werden. Einschlusskriterien waren c/iT1-c/iT3, alle biologischen Subtypen, Patientinnen mit partieller oder kompletter Remission in der Bildgebung, Tumor mit Clip sichtbar sonographisch oder mittels Mammographie. Ziel der Studie war es eine falsch-negative Rate (FNR) für Vakuum-assistierte Biopsien unter 10% zu erreichen. Die Studie wurde nach einer Interimsanalyse frühzeitig wegen nicht Erreichen des vorgegebenen Ziels gestoppt. In der Studie wurden 79% der Biopsien mittels sonographischer Vakuumbiopsie gemacht und 21% mittels stereotaktischer Vakuumbiopsie. Bei 31% wurden eine 10G Nadel verwendet, bei 6% eine 9G Nadel, bei 50% eine 8G Nadel und bei 13% eine 7G Nadel. Die falsch negative Rate an minimal invasiver Vakuumbiopsie war bei 17.8%. Bei 37 von 208 Frauen wurde der Tumor also verfehlt. Bei Marios Tasoulis et al. (5) wurden 166 Patientinnen eingeschlossen, 86% davon hatten eine Vakuumbiospie, 14% sogar eine Stanzbiopsie mit einer FNR von 18.7%. Mark Basik et al. (6) schlossen 98 Patientinnen in ihre Studie ein. Bei dieser Studie wurden mittels Stanzbiopsien eine FNR von 22.5% erzielt. Die Holländerin Marie Vrancken Peeters (7) und ihre Studiengruppe schlossen in Ihrer Studie insgesamt 167 Patientinnen ein. Mittels sonographischer Vakuumbiopsie hatte diese Studie eine FNR von 37%. Auch die Studie von Regina Grosse et al.(8), bei der Biopsie mittels stereotaktischer Vakuumbiopsie erzielt wurde, zeigte eine FNR von 19% bei 117 Patientinnen. Die meisten der Studien schlossen Patientinnen mit T3 Tumor, multifokale-multizentrische Tumore sowie lobuläre und ER pos. Karzinome mit in die Studie ein. Es wird sich zeigen, ob die in der Schweiz geplante SAKK 23/18 (VISION 1) Studie, mit nun angepassten Einschlusskriterien (Subtypen, Grösse der Biopsie Nadel etc.), eine tolerable FNR erreicht, damit bei ausgewählten Patientinnen ggf. eine weitere operative Therapie vermieden werden kann.
Follow-up Daten der Aphinity Studie
Viel Beachtung fand auch die vier Jahre Follow-up Interims-Überlebensanalyse der Aphinity Studie präsentiert von Martine Piccart et al.(9). In der Aphinity Studie wurden insgesamt 4802 Patientinnen mit HER2 Status nach Operation randomisiert in Chemotherapie plus Trastuzumab plus Pertuzumab (N = 2400) versus Chemotherapie plus Trastuzumab plus Placebo (N = 2405). Nach 74.1 Monaten median Follow-up, konnte sie zeigen, dass das 6-Jahre overal survival mit 94.8% (Pertuzumab Arm) versus 93.9% (Placebo Arm) (95% Cl (-0.5,2.29; HR = 0.85 (0.67, 1.07) bei der mit Doppelblockade behandelten Patientinnen besser ist. Ein klinischer Vorteil zeigte sich vor allem bei den nodal-positiven Patientinnen HR=0.72 (0.59-0.87); 6 –Jahres Follow-up invasiv disease-free survival von 87.7% (Pertuzumab Arm) versus 83.4% (Placebo Arm). In der nodal-negativen Gruppe zeigte sich kein Vorteil. Der Hormonrezeptor Status hatte keinen Einfluss. Des Weiteren zeigten sich keine weiteren kardialen Ereignisse.
Das HER2 positive Mammakarzinom (N+, > 2 cm) wird in der Regel neoadjuvant mittels Doppelblockade Herceptin/Pertuzumab behandelt (10). Bei nicht kompletter pathologischer Remission (pCR) werden nun seit dem Erscheinen der CATHERINE Studie die Patientinnen mit TDM-1 (Kadcyla®) adjuvant behandelt (11). Auch Dank diesen positiven Follow-up Daten, ist die Kassenzulässigkeit der adjuvanten Therapie mit Perjeta/Trastuzumab bei HER2-positiven Patientinnen im Frühstadium mit hohem Rezidivrisiko nun auch offiziell gewährleistet. Ob der Einsatz einer adjuvanten Doppelblockade vor allem bei nodal-positiven, high risk Patientinnen mit pCR angewendet wird, steht sicher noch zur Diskussion.
Pembrolizumab als Ad-on bei der neoadjuvanten Chemotherapie bei triple negativem Mammakarzinom
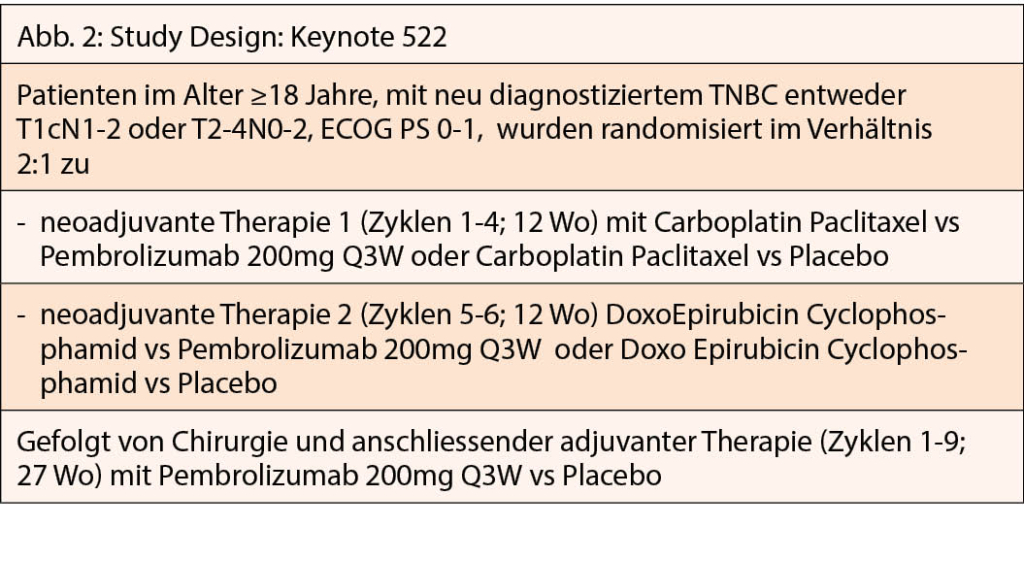
Immun-Checkpoint-Inhibitoren zählen seit einigen Jahren zur Behandlung verschiedener Tumoren. Viel Beachtung fand auch die KEYNOTE 522 Studie, eine randomisierte, Phase III Studie, die von Peter Schmid präsentiert wurde (12). Von März 2017 bis September 2018 wurden insgesamt 1174 Patientinnen aus 21 verschiedenen Ländern mit triple negativem Mammakarzinom, nicht metastasiert, naiv in die Studie eingeschlossen. Das Design der Studie zeigt (Abb 2).
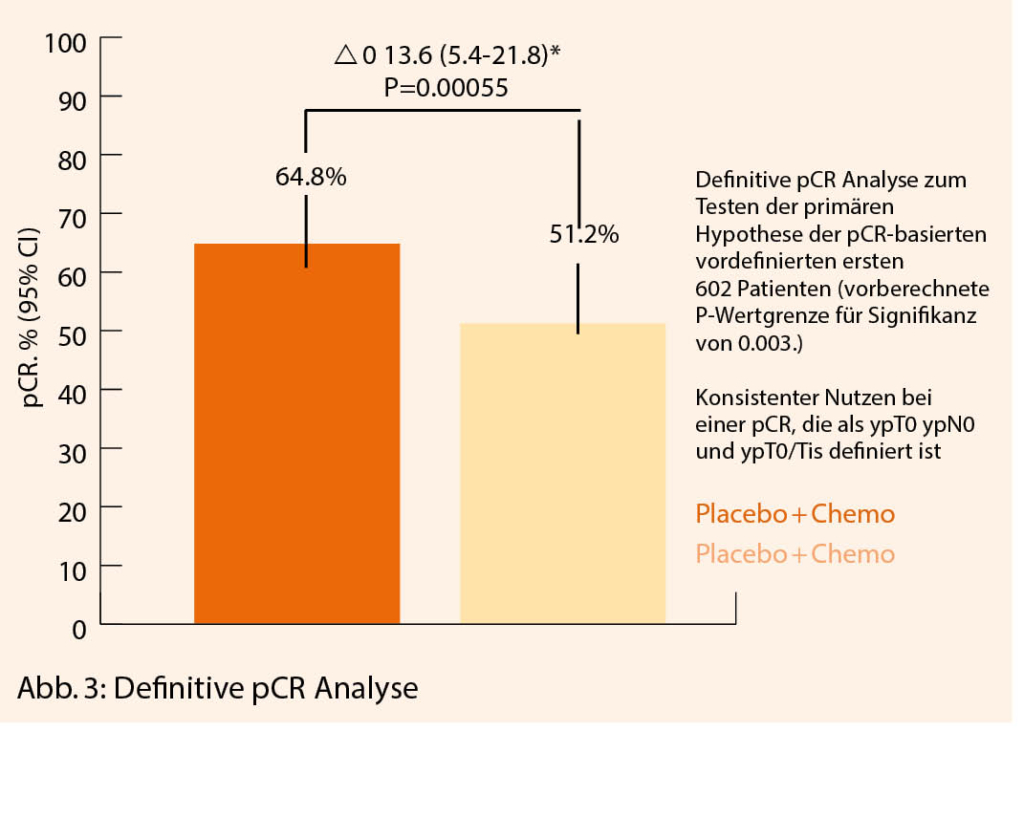
Er zeigte die erste Interimsanalyse für das Event-freie Überleben. Er konnte zeigen, dass die Gruppe mit Pembrolizumab bei einem Follow up von 15.5 Monaten 7.4 % Events hatte im Vergleich zu 11.8% der Gruppe mit Placebo (HR = 0.63, (0.43-0.93)). Ebenfalls war die pCR Rate bei der Gruppe mit Pembrolizumab bei 64.8% versus 51.2% signifikant (Figur 3). Auch bei Patientinnen, die nicht die volle Chemotherapie erhielten, war die pCR Rate besser als in der Placebo Gruppe. Patientinnen mit PD-L1 Expression zeigten eine höhere pCR Rate (68.9% bis zu 81.7% je nach Expression) als ohne Expression (45.3%) und in allen Subgruppen höhere pCR als zur Placebo-Gruppe. Follow-up Daten müssen diese Ergebnisse bestätigen und weitere Subgruppen Analysen sind abzuwarten. Diese Daten sind jedoch erfreulich und vielversprechend zur Behandlung des frühen triple-negativen Mammakarzinoms.
Metastasen – Zirkulierende Tumorzellen als wegweisend?
Einen spannenden Vortrag hielt Nicola Aceto von der Universität Basel, der mit seinem Vortrag auch die Schweiz in San Antonio repräsentierte (13). Es konnte bereits in mehreren Studien gezeigt werden, dass Patient/innen mit viel zirkulierenden Tumor Zellen (CTC) im Blut eine schlechtere Prognose haben. Aus diesem Grund setzt Aceto seine Akzente in der Erforschung von CTC. Er präsentiert seine Forschungsergebnisse, welche er in Cell (14) (1/2019) und Nature (15) (2/2019) publiziert hat. Aceto und seine Studiengruppe haben herausgefunden, dass zirkulierende Tumorzellverbände die Bildung von Metastasen beschleunigen.

Nicola Aceto und sein Team haben auch herausgefunden, dass sogenannte Na + /K + -ATPase-Inhibitoren Tumorzellverbände im Blut dissoziieren, also die Zellverbände in einzelne Zellen trennen und so das metastatische Potential von CTC reduzieren. Sein Ziel ist es nicht nur die Krebszellen abzutöten, sondern Wirkstoffe zu suchen, mit denen die Tumorzellverbände unwirksam gemacht werden können.
Des Weiteren hat er herausgefunden, dass sich Tumorzellverbände mit Immunozellen v.a Neutrophilen verbinden und so zu einer schnelleren Tumorprogression führen.
Universitäts-Frauenklinik
Basel
1. Cuzick J et al. Ten year results oft he international breast cancer intervention study II. San Antonio Breast Cancer Symposium 2019; Abstract GS4-04
2. Chlebowski R et al San Antonio Breast Cancer Symposium 2019; Abstract GS5-00
3. Collaborative Group on Hormonal Factors in Breast Cancer. Type and timing of menopausal hormone therapy and breast cancer risk: individual participant meta-analysis oft he worldwide epidemiological evidence. Lancet 2019;384:1159-1168
4. Heil J. et al. Image-guided vacuum-assisted breast biopsy. SABCS 2019, Abstract GS5-03
5. Tasoulis MK et al. Accuracy of post-neoadjuvant chemotherapy image-guided breast biopsy to predict residual cancer: a multi-institutional pooled analysis , SABCS 2019; Abstract GS5-04.
6. Basik M et al. Primary analysis of NRG-BR005, a phase II trial assessing accuracy of tumor bed biopsoes in predicting pathologic complete response (pCR) in patients with clinical/radiological complete response after neoadjuvant chemotheraüy (NCT) to explore the feasibility of breast-conserving treatment without surgery. SABCS 2019 Abstract GS5-05
7. Vrancken Peeters M-J et al. Towards omitting breast surgery in patients with a pathologic complete response after beoadjuvant systemic treatment: interim analysis oft he MICRA trial (Minimally Invasive Complete Assessment). SABCS 2019, Abstract GS5-06.
8. Grosse R et al. Vacuum assisted core-meedle niopsy after neoadjuvant therapy in breast cancer tp predict the status of pathologic response. SABCS 2019, Abstract P4-03-01
9. Piccart M. et al. Updated APHINITY trial data show addition of pertuzumab to trastuzumab plus chemotherapy continues to yield clinical benefit in patients with operable HER2-poisitive early breast cancer. SABCS 2019, Abstract GS1-04
10. Gianni L et al. Neoadjuvant pertuzuman and trastuzumab: Biomarker analyses of a 4-arm randomized phase II study (NeoDpher) in patients with HER2-positive breast cancer . SABCS 2019, Abstract GS5-01
11. Geyer CE et al. Phase III study of trastuzumab emtasine (T-DM1) vs trastuzumab as adjuvant therapy in patients with HER2-positive early breast cancer with residual imvasive disease after neoadjuvant chemotherapy and HER2-targeted therapy including trastuzumab: primary results from Katherine. SABCS 2019, Abstract GS1-10.
12. Schmid P- et al .Neoadjuvant and adjuvant treatment with pembrolizumab improves pathologic completes response rates for patients with triple-negative breast cancer with lymph node involvement. KEYNOTE 522. SABCS 2019, Abstract GS3-03
13 Aceta N . Biology, vulnerability and clinical implications of CTC clusters. SABCS 2019, Abstract TS2-2.
14. Gkountela S et al. Circulating tumor cell clustering shapes DANN methylation to enable metastasis seeding. Cell 2019;176:98-112.
15. Szczenta BM et al. Neutrophils escort circulating tumour cells to enable cell cycle progression. Nature 2019;566:553-557
info@gynäkologie
- Vol. 10
- Ausgabe 1
- Februar 2020