- Management beim frühen vorzeitigen Blasensprung
Der frühe vorzeitige Blasensprung oder PPROM (Preterm prelabor rupture of membranes) vor der abgeschlossenen 37. Schwangerschaftswoche ist einer der wesentlichen Risikofaktoren für Frühgeburtlichkeit und neonatale Morbidität und Mortalität. Eine Verlängerung der Schwangerschaft mit dem Ziel des Erreichens der 34+0 SSW und darüber hinaus verringert nachweislich die kindliche Morbidität und Mortalität. Gleichzeitig nimmt man durch Zuwarten maternale und fetale Risiken in Kauf wie Triple I (Inflammation und Infektion, Amnioninfektsyndrom), maternale Sepsis, vorzeitige Plazentalösung und fetale bzw. neonatale Infektionen. Das Management beinhaltet die Sicherung der Diagnose, die stationäre Überwachung im Geburtszentrum, die Organreifeinduktion mit Glukokortikoiden, eine auf den Zeitraum der Lungenreifung limitierte Tokolyse und eine prophylaktische Antibiose. Gerade bei drohender sehr früher Frühgeburt ist der Konflikt zwischen Verlängerung der Schwangerschaft und Vermeidung eines kindlichen Infektes eine grosse Herausforderung für den Kliniker. Ein drohendes oder manifestes Triple I wird am besten durch Beurteilung mehrerer mütterlicher (C-reaktives Protein, Leukozytose, Fieber, purulenter vaginaler Ausfluss) und kindlicher Parameter (Tachykardie) diagnostiziert.
Preterm prelabor rupture of membranes (PPROM) before the completed 37th week of pregnancy is one of the main risk factors for preterm birth and neonatal morbidity and mortality. Prolonging the pregnancy with the goal of reaching 34+0 weeks of gestation and beyond reduces infant morbidity and mortality. Expectant management however also implies acceptance of maternal and fetal risks such as Triple I (ascending infection, “amniotic infection syndrome”), maternal sepsis, premature placental abruption and fetal or neonatal infections. Management of PPROM includes securing the diagnosis, monitoring in a stationary setting, corticosteroids for pulmonary maturation, tocolysis limited to the period of lung maturation and prophylactic administration of antibiotics. The conflict between prolonging the pregnancy and avoiding an infection poses a major challenge for the clinician, especially in very early PPROM. Impending Triple I is best diagnosed by a combination of maternal (C-reactive protein, leukocytosis, fever, purulent discharge) and fetal parameters (tachycardia).
Key Words: Preterm prelabor rupture of membranes, PPROM, preterm delivery, Triple-I, amniotic infection syndrome
Ein früher vorzeitiger Blasensprung (Preterm prelabor rupture of membranes, PPROM) betrifft ca. 3% aller Schwangerschaften und insgesamt 0,5% der Schwangerschaften vor der abgeschlossenen 27. Schwangerschaftswoche (SSW) (4). Die Risikofaktoren für einen PPROM sind dabei im Wesentlichen die gleichen wie für eine Frühgeburt im Allgemeinen. Ein PPROM in der Eigenanamnese ist mit einem relativen Risiko von 3.3 ein zusätzlicher relevanter Faktor für einen erneuten PPROM (5). Der PPROM selbst ist wiederum ein signifikanter Risikofaktor für eine bald folgende Frühgeburt. Die kumulative Entbindungsrate betrug in einer Studie 27% nach 48h, 56% nach 7 Tagen und 76% nach 14 Tagen (7).
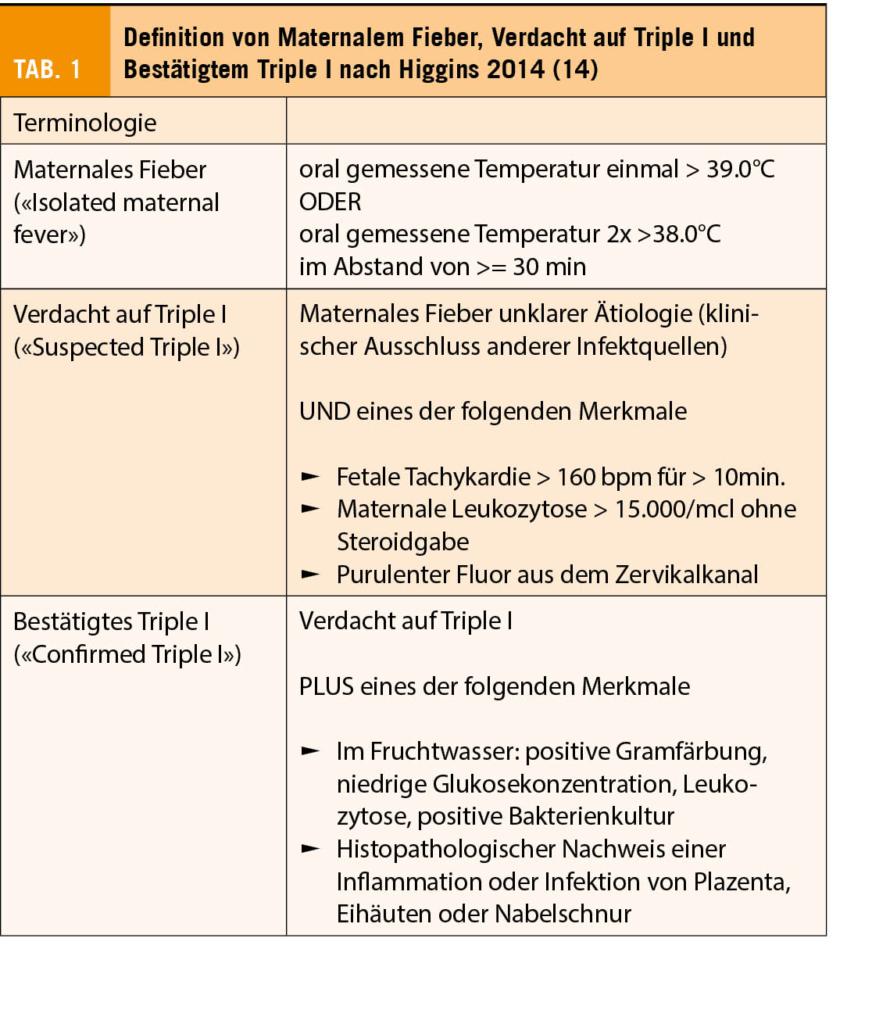
Das primäre Konzept des Managements eines PPROM besteht aus dem konservativen Vorgehen zur Verlängerung der Schwangerschaft bei gleichzeitiger Minimierung fetaler oder maternaler Komplikationen. Die Balance zwischen Risiko und Chance ist dabei die eigentliche Herausforderung in dieser Hochrisikosituation. Für die Mutter liegt das Risiko für eine Chorioamnionitis oder eine postpartale Infektion bei 15-20% (6, 8). Besonders bei Quer- oder Beckenendlage besteht die Gefahr eines Nabelschnurvorfalls. Eine vorzeitige Plazentalösung tritt in 2-5% der Fälle auf, im Falle rezidivierender Blutungen oder eines schweren Oligohydramnions deutlich häufiger (8, 9). Keimaszension und Chorioamnionitis, aber auch sterile inflammatorische Reize bedeuten für den Feten die Gefahr einer systemischen inflammatorischen Reaktion (fetal inflammatory response syndrome, FIRS) bis hin zur neonatalen Sepsis (3, 28). Für das sog. Amnioninfektionssyndrom hat sich international die Bezeichnung Triple I eingebürgert (Intrauterine Inflammation oder Infektion oder beides), welche die unterschiedlichen Stadien einer intrauterinen Infektion berücksichtigt (Tab. 1, 14). Diese Definition zentriert stark auf dem Vorhandensein von maternalem Fieber und hat sich in der Schweiz in der geburtshilflichen Terminologie noch nicht durchgesetzt, kann aber evidenzbasiert Hilfe bei der Diagnosestellung geben.
Vor Erreichen der Lebensfähigkeit bzw. vor dem interdisziplinären Entschluss zur neonatalen Maximalversorgung liegt der Fokus auf der Überwachung der mütterlichen Gesundheit. Mit Erreichen dieser Grenze wird auch das Kind engmaschig überwacht und wenn nötig aus kindlicher Indikation entbunden.
Die Grenze der Lebensfähigkeit wird international sehr unterschiedlich zwischen 22+0 und 26+0 SSW interpretiert. Ein sehr früher PPROM vor 22+0 SSW stellt trotz schlechterer Prognose keinen Grund für einen Abbruch dar, jedoch ist eine sehr frühzeitige interdisziplinäre Information der Eltern zwingend. Die Grenzen des neonatologisch Machbaren, aber auch des ärztlicherseits Versuchten haben sich im Trend der letzten Jahrzehnte nach vorne verschoben. In der Schweiz äussert sich dazu der Expertenbrief der SGGG No. 56 (24) unter Berücksichtigung der Empfehlungen der AG Limit of Viability (1, 2). Dieser Expertenbrief weist darauf hin, dass die Lungenreifung – mit dem Zwecke einer Maximalversorgung des Kindes bei Geburt – vor 23+0 SSW keinen neonatalen Benefit gezeigt hat. Ab 23+0 SSW kann demnach aber unter günstigen Rahmenbedingungen (kein Verdacht auf fetale Infektion, zeitgerecht entwickelter Fetus ohne schwere Fehlbildung, abgeschlossene LRI) bei entsprechendem Elternwunsch eine Maximalversorgung des Kindes erwogen werden. Sobald eine Maximalversorgung des Kindes geplant ist, ändert sich auch das geburtshilfliche Vorgehen mit fetaler Überwachung per CTG und Entbindung bei fetaler Indikation. Essenziell ist in diesen sehr frühen Wochen eine vorgängige interdisziplinäre Beratung der Eltern durch Neonatologen und Geburtshelfer, in der mütterliche wie fetale Risiken und Chancen erörtert werden (1). Ab 24+0 SSW dürften die allermeisten zur Maximalversorgung ausgestatteten Geburtszentren internationaleine kindliche Überwachung und die Versorgung quo ad vitam für das Kind anbieten und empfehlen. Ab der 25+0 SSW würde nur in Fällen mit mehreren prognostisch ungünstigen Zusatzfaktoren im Einzelfall von einer intensivmedizinischen Versorgung eines Kindes Abstand genommen werden (1).
Diagnose
Die Diagnose des PPROM stellt sich häufig schon aus der Klinik. Selbst bei klinisch eindeutigem Bild muss aber per steriler Speculumeinstellung ein Status erhoben und ein vaginaler mikrobiologischer Abstrich sowie ein vaginal-rektaler Abstrich auf Streptokokken der Gruppe B abgenommen werden. Typisch ist die Ansammlung von Fruchtwasser im hinteren Scheidengewölbe (pooling), welche durch einen Hustentest provoziert werden kann. Ist klinisch der Blasensprung bereits als absolut sicher anzunehmen, muss kein weiterer Test durchgeführt werden. Bei Unklarheiten sollte ein biochemischer Test zum Einsatz kommen. Dabei werden entweder IGFP-1, PAMG-1 oder eine Kombination aus AFP und IGFP-1 nachgewiesen, die Sensitivität und Spezifität liegt bei weit über 90% (11, 12). Bei starker Kontamination mit Blut ist die Aussagekraft der Tests dagegen eingeschränkt.
Eine sonographisch reduzierte Fruchtwassermenge oder eine chorioamniale Separation alleine sind suggestiv, aber nicht beweisend für einen PPROM. In einer prospektiven Studie hatten nur 67% der Patientinnen bei Diagnose einen AFI <5cm (10). Andersherum würde eine «normale» Fruchtwassermenge ebenso wenig einen PPROM ausschliessen.
Eine vaginale pH-Testung zur Diagnose eines PPROM kann ergänzend durchgeführt werden, hat aber eine relevante Rate an falsch-positiven wie falsch-negativen Resultaten und ist als einziges diagnostisches Kriterium nicht ausreichend (16, 20). Der mikroskopische Test auf ein Farnkrautphänomen ist den biochemischen Tests ebenso klar unterlegen und dürfte kaum noch Anwendung finden. Die diagnostische Indigocarmininstillation per Amniocentese und vaginale Tupfereinlage («Blauprobe») dürfte nur noch absoluten Einzelfällen vorbehalten sein.
Nicht oft genug wiederholt werden kann, dass auf eine digitale vaginale Untersuchung verzichtet werden soll, solange keine direkten Geburtsbestrebungen bestehen, da durch Einbringen von Bakterien die weitere Dauer der Schwangerschaft verkürzt wird (13). Es gibt keine ausreichende Datenlage zu Sicherheit und Risiken des transvaginalen Ultraschalls, ideal sollte die Cervix uteri nur per Speculum und per transabdominalem Ultraschall beurteilt werden.
Management
Ist der PPROM gesichert, soll die Patientin unbedingt spätestens in der 23+0 SSW, unabhängig von drohenden Geburtsbestrebungen, in ein dafür geeignetes Geburtszentrum mit angeschlossener neonatologischer Intensivstation verlegt werden (1, 2). Die weitere Betreuung erfolgt primär stationär. Einzelne Zentren, darunter auch Luzern, setzen beim klinisch stabilen PPROM in stabiler Situation alternativ auf ein ambulantes Management. Die Kriterien für ein homecare-Vorgehen wurden von der Gruppe um Céline Petit in Lille 2018 gut zusammengefasst (31).
Die antenatale Applikation von Steroiden zur Lungenreifungsinduktion (LRI) ist bei PPROM zwischen 24+0 SSW und 33+6 SSW klar indiziert und reduziert die kindliche Morbidität wie Mortalität signifikant (24). Auch vor 24+0 SSW kann eine LRI durchgeführt werden, wenn eine Maximaltherapie für das Kind besprochen wurde. Zwischen 22+0 und 23+6 SSW würde jedoch nur die neonatale Mortalität reduziert, einen signifikanten positiven Einfluss auf die Morbidität beweist die Datenlage in diesem Gestationsalter nicht (6, 15). Der Expertenbrief der SGGG hält entsprechend so auch fest, dass eine LRI vor 23+0 SSW nicht mit gesichertem kindlichen Benefit einhergeht (24).
Für den Zeitraum der LRI darf und sollte eine Tokolyse gegeben werden. Nach Ablauf dieser 48h sollte die Tokolyse gestoppt werden (6). Eine evidenzbasierte Empfehlung zum Einsatz eines favorisierten Medikaments ist nicht möglich, die Auswahl richtet sich nach den üblichen Kriterien bei drohender Frühgeburtlichkeit. Bei klinischem Bild eines Triple I oder in bereits fortgeschrittener Eröffnungsperiode ist jeder Versuch, eine Geburt tokolytisch «verhindern» zu wollen, entweder mit einem erhöhten Risiko eines neonatalen Infekts assoziiert oder schlicht frustran und soll unterbleiben. Interessant ist dabei die Datenlage zum Einsatz der Tokolyse bei PPROM: gemäss Cochrane-Analyse lässt sich bei eher tiefer Studienqualität zwar die Rate an Geburten innert der ersten 48h um 45% senken, jedoch fanden die Autoren keine signifkante Verbesserung der kindlichen Mortalität und Morbidität (19).
In allen Situationen, in denen eine Maximaltherapie gewünscht wird, soll nach Diagnose des PPROM ein einmaliger Antibiosezyklus von 5-10 Tagen gegeben werden (6). Die signifikanten Vorteile für Mutter und Kind sind klar evidenzbasiert. Sowohl das Risiko einer Chorioamnionitis (RR= 0,66), als auch einer Geburt binnen 48h (RR= 0,71) und für eine neonatale Infektion (RR= 0,67) kann hierdurch reduziert werden (21). Schwieriger ist die Frage nach dem optimalen Antbiotikum, da die Studienlage kein favorisiertes Antibioseschema ermitteln konnte (23). Gute Daten gibt es für den Einsatz von u.a. Ampicillin gefolgt von Amoxicillin, Pencillin G, Erythromycin, Cefuroxim oder der Kombination aus Clindamycin und Gentamicin. Die Kombination aus Amoxicillin und Clavulansäure wird bei PPROM wegen erhöhter Raten an Nekrotisierender Enterocolitis in der ORACLE-I-Studie nicht mehr empfohlen (21, 22). Eine Einmalgabe eines Makrolids (z.B. 1g Azithromycin) erweitert das Spektrum auf Chlamydien und Mykoplasmen.
Eine Neuroprotektion mit intravenösem Magnesium ist erst dann indiziert, wenn zwischen 24+0 und 32+0 SSW eine Geburt unmittelbar bevorsteht und damit nicht obligater Bestandteil der Initialtherapie.
Vaginales oder rektales Progesteron und 17-Hydroxyprogesteroncaproat i.m. verlängern die Latenzzeit nach PPROM nicht (18). Eine bereits begonnene vaginale Progesterongabe sollte bei PPROM beendet werden. Eine therapeutische serielle Amnioninfusion ist nicht empfohlen (6, 25). Genauso wenig ist die diagnostische Amniocentese zur Diagnostik auf Triple I mit z.B. Bestimmung des Interleukin-6 (IL-6) derzeit für die Routine geeignet. Auch der interessante Ansatz der Messung der IL-6-Konzentration im Vaginal-sekret bedarf weiterer Untersuchungen in Studien (26).
Die maternale und fetale Überwachung variiert sicher nach «Hausstandard». Empfehlenswert sind engmaschige Kontrollen des CTG (1-2x/d mit Fokus auf Anstieg der baseline über 160 bpm oder um mehr als 15%), der mütterlichen Temperatur und von mütterlichen Symptomen (Wehen, uterine Druckdolenz, Beschaffenheit der Fruchtwasserabgänge) und Laborkontrollen (Blutbild, CRP). Die Wertigkeit des CRP ist dabei kritisch zu diskutieren, ein isolierter CRP-Anstieg sollte nicht zur Entbindungsindikation führen (28).
Entbindungszeitpunkt
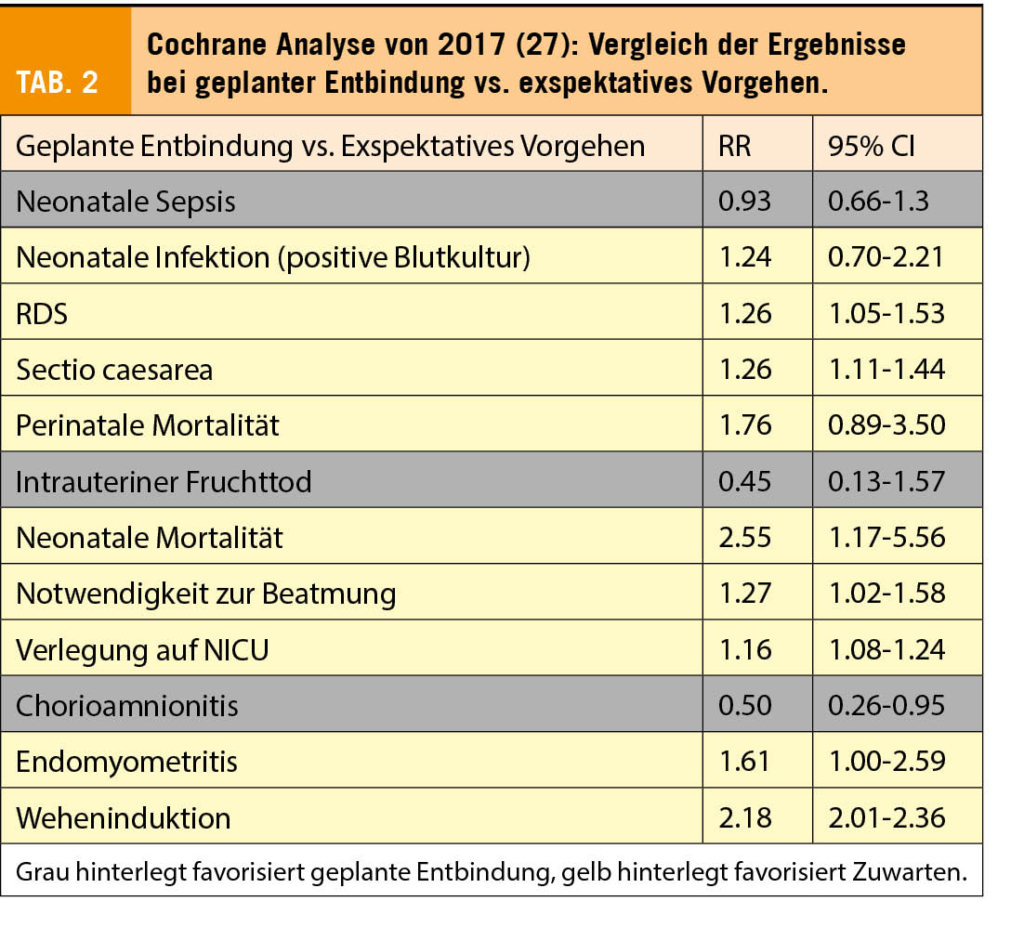
Generell ist bei PPROM bis 33+6 SSW ein exspektatives Vorgehen der internationale Standard (6, 16, 17). Tabelle 2 zeigt die Ergebnisse einer Metaanalyse, welche die Resultate einer geplanten frühen Entbindung mit dem abwartenden Vorgehen verglichen hat. Zuwarten trägt demnach – wie der klinischen Erfahrung entsprechend – ein höheres Risiko einer neonatalen Sepsis, reduziert aber die kindliche Mortalität und die Beatmungsnotwendigkeit (27).
Bei Anzeichen auf ein Triple I, fetalen distress, vorzeitige Plazentalösung oder drohenden Nabelschnurvorfall besteht die Indikation zur sofortigen Entbindung. Die grösste klinische Herausforderung besteht bei der sehr frühen Frühgeburtlichkeit im rechtzeitigen Erkennen eines drohenden Amnioninfekts. Hier sollte nicht aufgrund eines einzelnen Parameters entbunden werden, sondern aufgrund einer Kombination maternaler (CRP, Fieber, Leukozytose, purulenter Fluor) und fetaler (Tachykardie) Faktoren. Kommt es weder zu einer unmittelbaren fetalen oder maternalen Gefährdung noch zu einem spontanen Wehenbeginn, darf zugewartet werden. Ab der 34+0 SSW kann entbunden werden. Die Cochrane-Analyse von 2017 hat hierzu gezeigt, dass die Ergebnisse eines exspektativen Vorgehens unabhängig sind vom Zeitpunkt des Blasensprungs vor oder nach 34 SSW (27). Daher dürfte prinzipiell bei Blasensprung vor 34 SSW – ähnlich wie beim PPROM >34+0 SSW unter der Voraussetzung eines negativen GBS-Abstrichs – weiter zugewartet werden bis maximal 37 SSW, um die Folgen der late-preterm-Geburt für das Kind zu minimieren (27, 29, 30).
Copyright bei Aerzteverlag medinfo AG
Leitender Arzt Frauenklinik Luzern
Frauenklinik Luzerner Kantonsspital
Spitalstrasse
6000 Luzern 16
joachim.kohl@luks.ch
Chefarzt Geburtshilfe und Fetomaternale Medizin
Co-Leitung Perinatalzentrum Luzern
Frauenklinik Luzerner Kantonsspital
Spitalstrasse
6000 Luzern 16
markus.hodel@luks.ch
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Beim frühen vorzeitigen Blasensprung (SSW) ist das primäre Ziel die Fortsetzung der Schwangerschaft unter engmaschiger maternaler und fetaler Überwachung an einem Zentrum mit entsprechend ausgestatteter Neonatologie.
◆ Pfeiler des Managements sind ein an die Schwangerschaftswoche angepasstes Vorgehen, in sehr frühen Wochen der Einbezug des Elternwunsches per informed consent und die Minimierung maternaler und fetaler Risiken durch intensive maternale und fetale Überwachung, Lungenreifungsinduktion und Antibiose.
◆ Tokolyse sollte nur für den Zeitraum der Lungenreifung gegeben werden.
◆ Der Entscheid zur Entbindung bei V.a. Chorioamnionitis/Triple I sollte nicht aufgrund einzelner, sondern aufgrund einer Kombination maternaler und fetaler Faktoren erfolgen (CRP, Leukozytose, purulenter
Fluor, Fieber, fetale Tachykardie).
1. Berger TM et al. Perinatale Betreuung an der Grenze der Lebensfähigkeit zwi-schen 22 und 26 vollendeten Schwangerschaftswochen. Schweizerische Ärzte-zeitung 2012; 93:4.
2. Berger TM et al. Perinatal care at the limit of viability between 22 and 26 completed weeks of gestation in Switzerland. Swiss Med Wkly. 2011;141:w13280.
3. Romero R. Prevalence and clinical significance of sterile intraamniotic inflamma-tion in patients with preterm labor and intact membranes. Am J Reprod Immunol 2014;72:458–474.
4. Mercer BM. Preterm premature rupture of the membranes: current approaches to evaluation and management. Obstet Gynecol Clin North Am. 2005 Sep;32(3):411-28.
5. Mercer BM. The preterm prediction study: effect of gestational age and cause of preterm birth on subsequent obstetric outcome. National Institute of Child Health and Human Development Maternal-Fetal Medicine Units Network. Am J Obstet Gynecol. 1999 Nov;181(5 Pt 1):1216-21.
6. Prevention and therapy of preterm labour. Guideline of the DGGG, OEGG and SGGG (S2k-Level, AWMF registry No.015/025, February 2019)
7. Mercer BM et al. Antibiotic therapy for reduction of infant morbidity after preterm premature rupture of the membranes. A randomized controlled trial. National Insti-tute of Child Health and Human Development Maternal-Fetal Medicine Units Net-work. JAMA. 1997 Sep 24;278(12):989-95.
8. Berger R, Kiss H, Reisenberger K. Der frühe vorzeitige Blasensprung. In: Die Ge-burtshilfe. Hsg.: von Kaisenberg C, Klaritsch P, Hösli I. Springer, 6. Auflage 2022, Springer Verlag Heidelberg
9. Ananth CV, Oyelese Y, Srinivas N, Yeo L, Vintzileos AM. Preterm premature rup-ture of membranes, intrauterine infection, and oligohydramnios: risk factors for placental abruption. Obstet Gynecol. 2004 Jul;104(1):71-7.
10. Mercer BM, Rabello YA, Thurnau GR, Miodovnik M, Goldenberg RL, Das AF, Meis PJ, Moawad AH, Iams JD, Van Dorsten JP, Dombrowski MP, Roberts JM, McNellis D; NICHD-MFMU Network. The NICHD-MFMU antibiotic treatment of pre-term PROM study: impact of initial amniotic fluid volume on pregnancy outcome. Am J Obstet Gynecol. 2006 Feb;194(2):438-45.
11. Ramsauer B, Vidaeff AC, Hösli I, Park JS, Strauss A, Khodjaeva Z, de la Cruz ÁA, Martínez-Astorquiza T, Horovitz J, Coatleven F, Helmer H. The diagnosis of rupture of fetal membranes (ROM): a meta-analysis. J Perinat Med. 2013 May;41(3):233-40.
12. Liang DK, Qi HB, Luo X, Xiao XQ, Jia XY. Comparative study of placental α-microglobulin-1, insulin-like growth factor binding protein-1 and nitrazine test to diagnose premature rupture of membranes: a randomized controlled trial. J Obstet Gynaecol Res. 2014 Jun;40(6):1555-60.
13. Alexander JM, Mercer BM, Miodovnik M, Thurnau GR, Goldenberg RL, Das AF, Meis PJ, Moawad AH, Iams JD, Vandorsten JP, Paul RH, Dombrowski MP, Roberts JM, McNellis D. The impact of digital cervical examination on expectantly managed preterm rupture of membranes. Am J Obstet Gynecol. 2000 Oct;183(4):1003-7.
14. Higgins RD, Saade G, Polin RA, Grobman WA, Buhimschi IA, Watterberg K, Sil-ver RM, Raju TNK; Chorioamnionitis Workshop Participants. Evaluation and Man-agement of Women and Newborns With a Maternal Diagnosis of Chorioamni-onitis: Summary of a Workshop. Obstet Gynecol. 2016 Mar;127(3):426-436.
15. Deshmukh M, Patole S. Antenatal corticosteroids for neonates born before 25 Weeks – a systematic review and meta-analysis. PLoS One. 2017 May 9;12(5):e0176090.
16. Thomson AJ; Royal College of Obstetricians and Gynaecologists. Care of Women Presenting with Suspected Preterm Prelabour Rupture of Membranes from 24+0 Weeks of Gestation: Green-top Guideline No. 73. BJOG. 2019 Aug;126(9):e152-e166.
17. American College of Obstetricians and Gynecologists’ Committee on Practice Bulletins—Obstetrics. Prediction and Prevention of Spontaneous Preterm Birth: ACOG Practice Bulletin, Number 234. Obstet Gynecol. 2021 Aug 1;138(2):e65-e90.
18. Quist-Nelson J, Parker P, Mokhtari N, Di Sarno R, Saccone G, Berghella V. Pro-gestogens in singleton gestations with preterm prelabor rupture of membranes: a systematic review and metaanalysis of randomized controlled trials. Am J Obstet Gynecol. 2018 Oct;219(4):346-355.e2.
19. Mackeen AD, Seibel-Seamon J, Muhammad J, Baxter JK, Berghella V. Tocolytics for preterm premature rupture of membranes. Cochrane Database Syst Rev. 2014 Feb 27;(2):CD007062.
20. Davidson KM. Detection of premature rupture of the membranes. Clin Obstet Gy-necol. 1991 Dec;34(4):715-22.
21. Kenyon S, Boulvain M, Neilson JP. Antibiotics for preterm rupture of membranes. Cochrane Database Syst Rev. 2013 Dec 2;(12):CD001058.
22. Kenyon SL, Taylor DJ, Tarnow-Mordi W; ORACLE Collaborative Group. Broad-spectrum antibiotics for preterm, prelabour rupture of fetal membranes: the ORA-CLE I randomised trial. ORACLE Collaborative Group. Lancet. 2001 Mar 31;357(9261):979-88. Erratum in: Lancet 2001 Jul 14;358(9276):156.
23. Chatzakis C, Papatheodorou S, Sarafidis K, Dinas K, Makrydimas G, Sotiriadis A. Effect on perinatal outcome of prophylactic antibiotics in preterm prelabor rupture of membranes: network meta-analysis of randomized controlled trials. Ultrasound Obstet Gynecol. 2020 Jan;55(1):20-31.
24. D. Surbek, T. Roos, M. Hodel, R. Pfister, I. Hösli. Glucocorticoidtherapie zur an-tenatalen Lungenreifung bei drohender Frühgeburt: Indikationen und Dosierung. Expertenbrief der SGGG No. 56, 14.01.2019
25. Hofmeyr GJ, Eke AC, Lawrie TA. Amnioinfusion for third trimester preterm prema-ture rupture of membranes. Cochrane Database Syst Rev. 2014 Mar 30;2014(3):CD000942.
26. Musilova I, Andrys C, Drahosova M, Soucek O, Pliskova L, Jacobsson B, Kacer-ovsky M. Cervical fluid interleukin 6 and intra-amniotic complications of preterm prelabor rupture of membranes. J Matern Fetal Neonatal Med. 2018 Apr;31(7):827-836.
27. Bond DM, Middleton P, Levett KM, van der Ham DP, Crowther CA, Buchanan SL, Morris J. Planned early birth versus expectant management for women with pre-term prelabour rupture of membranes prior to 37 weeks’ gestation for improving pregnancy outcome. Cochrane Database Syst Rev. 2017 Mar 3;3(3):CD004735.
28. Maul H, Kunze M, Berger R. Aktuelles Vorgehen bei frühem vorzeitigem Blasen-sprung: neue Definitionen? Ist die CRP-Bestimmung sinnvoll? Sind Alternativen in Sicht? [Current approach in preterm prelabor rupture of membranes: new defini-tions? Is CRP determination useful? Are alternatives in sight?]. Gynakologe. 2021;54(3):186-194. German.
29. Morris JM, Roberts CL, Bowen JR, Patterson JA, Bond DM, Algert CS, Thornton JG, Crowther CA; PPROMT Collaboration. Immediate delivery compared with ex-pectant management after preterm pre-labour rupture of the membranes close to term (PPROMT trial): a randomised controlled trial. Lancet. 2016 Jan 30;387(10017):444-52.
30. van der Ham DP, van der Heyden JL, Opmeer BC, Mulder AL, Moonen RM, van Beek JH, Franssen MT, Bloemenkamp KW, Sikkema JM, de Groot CJ, Porath M, Kwee A, Woiski MD, Duvekot JH, Akerboom BM, van Loon AJ, de Leeuw JW, Wil-lekes C, Mol BW, Nijhuis JG. Management of late-preterm premature rupture of membranes: the PPROMEXIL-2 trial. Am J Obstet Gynecol. 2012 Oct;207(4):276.e1-10.
31. Petit C, Deruelle P, Behal H, Rakza T, Balagny S, Subtil D, Clouqueur E,
Gara-bedian C. Preterm premature rupture of membranes: Which criteria contraindicate home care management? Acta Obstet Gynecol Scand. 2018 Dec;97(12):1499-1507.
info@gynäkologie
- Vol. 12
- Ausgabe 6
- Dezember 2022