- Metastasierendes Endometriumkarzinom
Das Endometriumkarzinom ist der häufigste gynäkologische Tumor in der westlichen Welt, mit zunehmender Inzidenz. Dies ist hauptsächlich dem zunehmenden Übergewicht und Alter geschuldet (1). Die meisten Endometriumkarzinome treten bei postmenopausalen Frauen auf und führen durch eine Postmenopausenblutung zu früher Diagnostik, was die günstige Prognose erklärt. Das relative 5-Jahres-Überleben ist über 80% (2). Kommt es zu einem Rezidiv, ist die Prognose ungünstig. Es stellt sich die Frage: Können wir Patientinnen identifizieren, die trotz niedrigem Initial-Stadium und biologisch günstigen Eigenschaften rezidivieren werden?
Endometrial cancer is the most common gynecologic tumor in the Western world, with increasing incidence. This is mainly due to increasing obesity and age (1). Most endometrial carcinomas occur in postmenopausal women and lead to early diagnosis due to postmenopausal bleeding, which explains the favorable prognosis. The 5-year relative survival is over 80% (2). If recurrence occurs, the prognosis is unfavorable. The question is: Can we identify patients who will recur despite low initial stage and biologically favorable characteristics?
Key Words: Endometrial carcinoma, postmenopausal bleeding, Cancer Genome Atlas.
Neue Definition der Risikogruppen
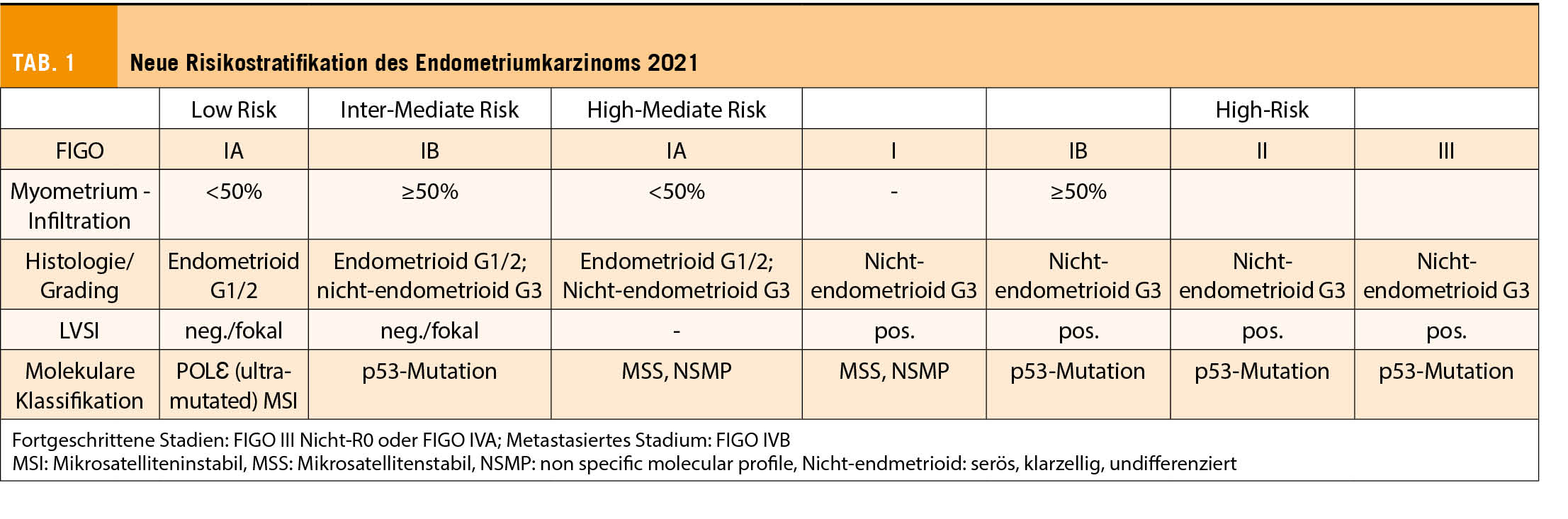
Die Einteilung aufgrund histologischer Subtypen (früher Typ 1: endometrioid, verbunden mit Übergewicht, Hormonrezeptor-Überexpression, günstiger Prognose, sowie Typ II: hauptsächlich seröse Histologie, schlechte Prognose) ist ungenügend, um das Rezidivrisiko akkurat abschätzen zu können (3). Das hat zur Weiterentwicklung der Bestimmung molekularer Eigenschaften des Endometriumkarzinoms geführt. Das Ziel ist, die Prognose dieser Patientinnen zu verbessern und die Therapien masszuschneidern. Im Sinne einer De-Eskalation werden möglicherweise sogenannte Standard-Therapien nicht (mehr) indiziert werden. Die Subgruppe der Patientinnen mit Polymerase epsilon (POLƐ)-Mutationen haben zum Beispiel eine exzellente Prognose und werden, wenn nicht als solche identifiziert, möglicherweise überbehandelt (Tab. 1). Ob die günstige Prognose allerdings aufgrund des sehr guten Therapie-Ansprechens oder der Verlauf tatsächlich auch spontan hervorragend wäre, ist zur Zeit unklar. Andererseits sind Tumoren mit p53-Dysfunktion prognostisch ungünstig mit genomischer Instabilität und rascher Tumorprogression (4).
Molekulare Subgruppen, Rezidivrisiko
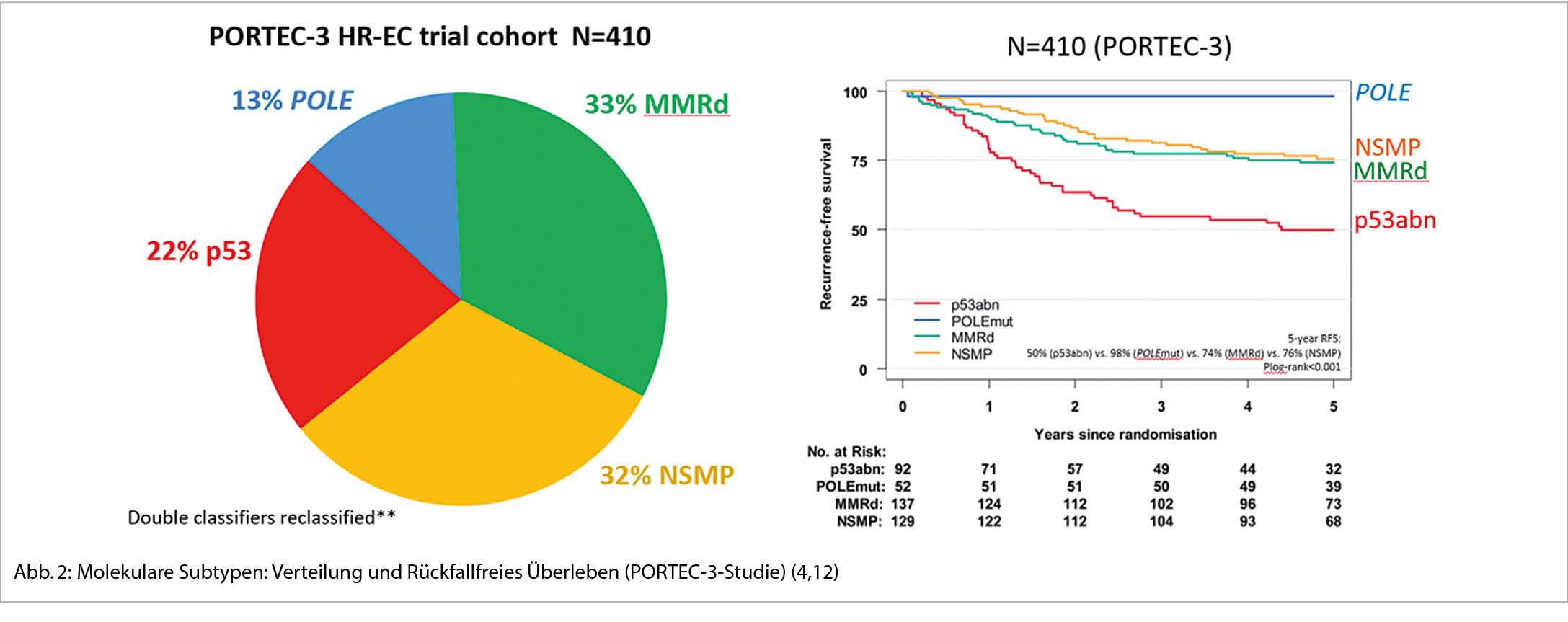
Im Jahr 2013 wurde der Cancer Genome Atlas (TCGA) zum Endometriumkarzinom publiziert, ein Durchbruch in der Klassifikation des Endometriumkarzinoms (5). Vier molekulare Subklassen mit unterschiedlicher Prognose wurden identifiziert. Retrospektive Untersuchungen an Adjuvant-Studien beim Endometriumkarzinom (Post-Operative Radiation Therapy in Endometrial Carcinoma PORTEC- 1, 2 und 3-Studien) entsprechend der molekularen Subtypsierung konnten zeigen, dass histologisch aggressive Tumore bei POLƐ-Mutation eine sehr gute Prognose mit geringem Rückfallrisiko aufweisen gegenüber anderen Subtypen mit gleicher Histologie (4). Betrachtet man ausschliesslich die G3-Tumoren, findet sich eine POLƐ-Mutation in 12%, eine MMMR-Defizienz in 40%, p53-Mutation in 18% und NSMP in 30% aller Karzinome (6).
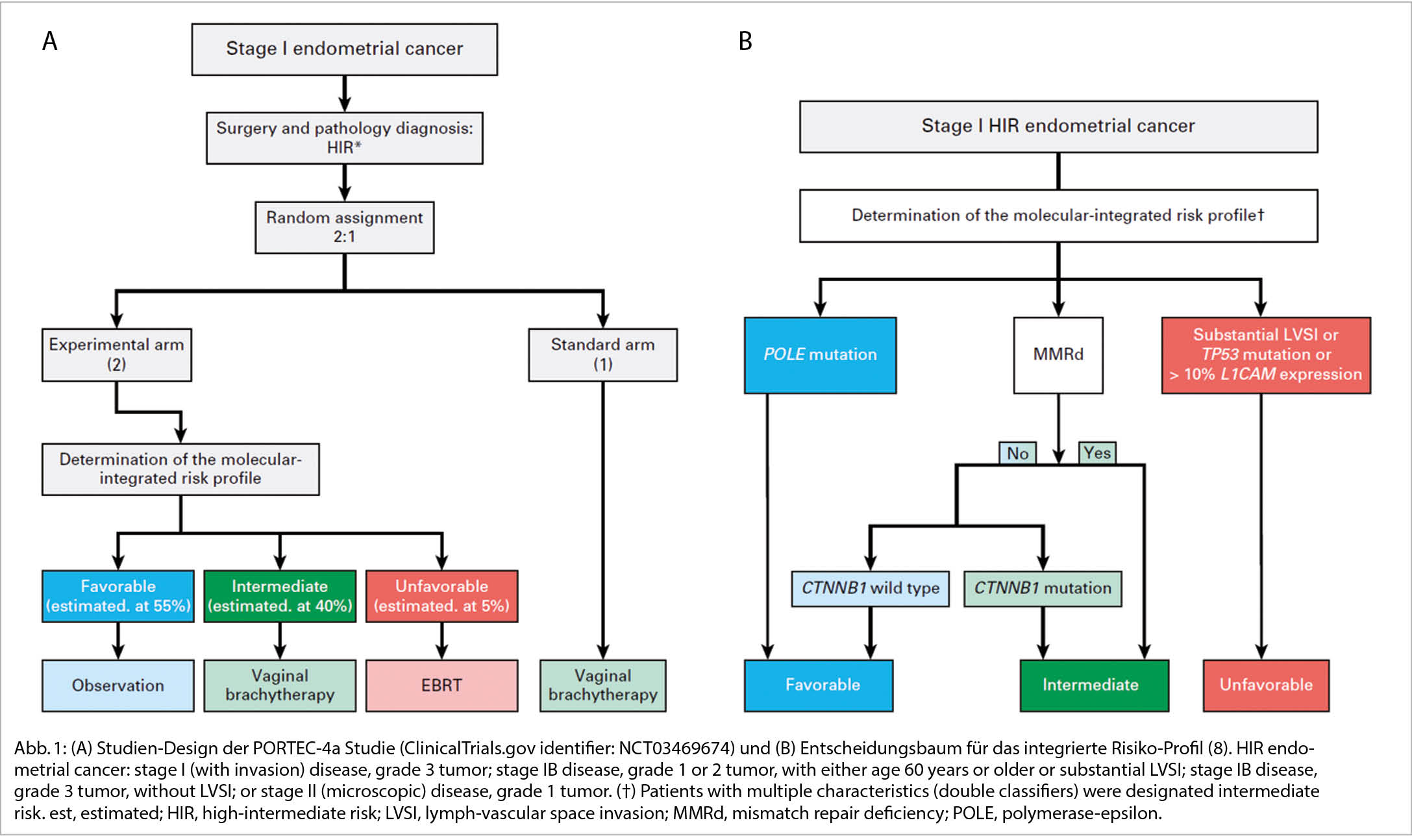
2021 wurden die aktualisierten ESGO-ESTRO-ESP – Guidelines zur Behandlung des Endometriumkarzinoms publiziert, worin die neuen Definitionen der Risikogruppen bereits aufgenommen wurden. Diese prognostischen Faktoren sind von grosser Bedeutung. Noch stehen uns keine robusten Daten zu prädiktiven Aussagen zur Verfügung. Die retrospektive Analyse der PORTEC3-Studie zeigte beispielsweise bei MMRd-Patientinnen mit adjuvanter Radiotherapie keine Prognoseverbesserung durch die Zugabe einer adjuvanten Chemotherapie. Diese Daten basieren jedoch auf der geringen Zahl von 2 x 70 Patientinnen. Diese wichtigen Daten werden zur Zeit in grossen Phase III-Studien erhoben, wie zum Beispiel in der PORTEC 4a-Studie (ClinicalTrials.gov Identifier: NCT03469674) (8). In dieser internationalen, prospektiven Studie werden Patientinnen mit high-intermediate Risiko-Endometriumkarzinomen randomisiert zu einer individuellen Behandlung, basierend auf molekularpathologischen Eigenschaften, versus der Standardbehandlung, welche auf herkömmlichen kliniko-pathologischen Empfehlungen beruht (s. Abb. 1). Die Patientinnen werden nach der Operation entweder weiter beobachtet ohne Therapie oder erhalten eine Brachytherapie oder eine perkutane Radiotherapie. Im weiteren sollen die molekularen Erkenntnisse aus der PORTEC 3-Studien-Population (TransPORTEC ) in einem komprehensiven internationalen Projekt bezüglich molekularer Risikostratifizierung unterschiedlichen, eben personalisierten adjuvanten Therapien zugeführt werden (Refining Adjuvant treatment IN endometrial cancer Based On molecular features (RAINBO Projekt), TransPORTEC platform trials). Die Planung und Finanzierung dieser grossen internationalen Studie läuft auf Hochtouren. Erste Patientinnen sollen 2022 eingeschlossen werden können. In der Schweiz wird dies im Rahmen unserer kooperativen Forschungsgruppe, der Schweizerische Arbeitsgruppe für Klinische Krebsforschung (SAKK), möglich sein. Alle diese Resultate werden mit Ungeduld erwartet und werden uns der Präzisionsmedizin grosse Schritte weiterbringen.
Histologische Subtypen des Endometriumkarzinoms
Die prognostisch ungünstigen serösen Endometriumkarzinome treten in ca 10% auf und sind häufig p53 mutiert. Die Wirksamkeit der Erstlinienchemotherapie ist gleich wie bei den übrigen Histologien, mit allerdings einem Trend zu geringerem Ansprechen. Hellzellige Histologie ist ein Prädiktor für schlechteres progressionsfreies Überleben (HR, 1,52) (9). Ungefähr 30% der Endometriumkarzinome zeigen eine HER2- Überexpression. In einer randomisierten Phase II-Studie konnte die Zugabe von Trastuzumab zu Paclitaxel und Carboplatin eine Verbesserung des medianen progressionsfreien Überlebens von 4.6 Monaten in der metastasierten Situation zeigen (10).
Karzinosarkome sind keine Sarkome. Gemäss der aktuellen WHO-Klassifikation (2020) sind sie, molekularpathologisch charakterisiert, eine aggressive Variante des Endometriumkarzinoms. In den Metastasen finden sich üblicherweise Karzinomanteile vorherrschend. Der Terminus «Maligner Müller’scher Mischtumor» wird nicht mehr verwendet.
Anforderungen an die Pathologie
Die Bestimmung der vier molekularen Subgruppen des Endometriumkarzinoms gemäss TCGA-Atlas ist kostspielig und aufwändig. Talhouk et al. entwickelten einen pragmatischen Algorithmus, den Proactive Molecular Risk Classifier for Endometrial Cancer (ProMisE). Hiermit lassen sich, validiert, molekular verschiedene Subgruppen ähnlich der TCGA-Klassifizierung identifizieren (11). Die vier Gruppen beinhalten:
- POLƐ Exonuclease Domain Mutationen (POLƐ EDMs)
- MMR-Defizienz (MMRd)
- p53 Abnormal / Wildtyp
- NSMP: kein spezifisches molekulares Profil
Ausser der POLƐ-Hotspot-Analyse (mittels NGS (next generation sequencing) / Sanger-Sequenzierung) werden diese Bestimmungen kostengünstig mittels Immunhistochemie durchgeführt. Sehr selten (ca 5%) finden sich bei Endometriumkarzinomen nicht nur p53 Mutationen, sondern auch POLƐ-Mutationen oder eine MMR-Defizienz.
Wie gehen wir praktisch vor?
Diese molekulare Klassifizierung wird bereits vielerorts routinemässig durchgeführt. Die Daten, welche uns leiten in der Auswahl der adjuvanten Systemtherapie nach molekularen Subgruppen, werden in prospektiven Studien allerdings erst generiert. Folgende Untersuchungen sind in der metastasierten Situation empfohlen:
- ER (Östrogen-) und PgR (Progesteronrezeptoren) bei allen Typen
- Immunhistochemische Biomarker wie Programmed death ligand-1 (PD-L1), MSI, evtl. tumor molecular burden (TMB)
- HER2-Status bei den serösen Endometriumkarzinomen
Etwa 3% aller Endometriumkarzinome und kolorektale Karzinome entstehen im Rahmen eines Lynch-Syndromes (HNPCC, hereditäres non-polyposis colorectal carcinoma). An unserem Zentrum testen wir alle Endometriumkarzinome immunhistochemisch bei Primärdiagnose auf Mismatch-Reparatur-Defizienz in den Genen MLH1, MSH2, MSH6, und PMS2. Falls ein Expressionsverlust vorliegt (MMRd) und zusätzlich in MLH1 eine sog. Promotor-Hypermethylierung ausgeschlossen werden konnte, werden diese Tumoren zusätzlich auf Mikrosatelliten-Instabilität untersucht. Bestehen anamnestisch Risikofaktoren auf ein Lynch-Syndrom, werden nach genetischer Beratung zusätzlich die MSI-Untersuchungen ergänzt auch bei den Patientinnen ohne MMR-Defizienz. Findet sich eine Mikrosatelliteninstabilität (MSI-H), werden molekulargenetische Untersuchungen an der Keimbahn angeschlossen zur Abklärung eines Lynch-Syndroms.
Wie wichtig das molekulare Profil der Endometriumkarzinome ist, sehen wir am gezielten und erfolgreichen Einsatz der Immuntherapie in der metastasierten Situation. Eine PD-L1-Überexpression qualifiziert für eine Checkpoint-Inhibitor-Therapie. Speziell MSI-H und hoher molecular tumor burden (TMB) sind hier prädiktiv (13).
Ein weiterer immunhistologisch bestimmbarer prognostischer Parameter ist das L1-cell adhesion molecule (L1-CAM). Seine Überexpression zeigt sich in zahlreichen Studien als wichtiger Prognose-Faktor (14). Es fehlen uns bis dato prädiktive Ansätze. Die Kombination von histopathologischen (lymphovaskuläre Invasion LVSI und L1-CAM) und neuen molekularen Faktoren werden wohl in Zukunft die die höchste prognostische Aussagekraft haben.
Erstlinienbehandlung des metastasierten Endometriumkarzinoms
Palliative endokrine Therapie
Eine antihormonelle Systemtherapie kann ein oft längeres Therapie-Ansprechen bei über der Hälfte der Patientinnen zeigen. Progestagene (Medroxyprogesteron-Azetat 200 (–300) mg und Megestrol-Azetat 160 mg tgl sind empfohlen (letzteres in der Schweiz nicht mehr erhältlich)). Den Nebenwirkungen wie gehäuft thrombo-embolischem Geschehen sowie relevanter Gewichtszunahme muss Rechnung getragen werden (15). Low grade Tumore mit langsamer Wachstumstendenz mit Hormonrezeptor-Positivität scheinen den grössten Nutzen einer endokrinen Therapie zu haben. Allerdings kann die endokrine Behandlung auch bei hormon-rezeptor-negativer Erkrankung indiziert werden (16).
Eine Steigerung der endokrinen Wirksamkeit konnte mit der Kombination von Aromatasehemmern und Everolimus erzielt werden. Auch hier gilt das spezifische (dosis-abhängige) Nebenwirkungsspektrum von Everolimus zu beachten (Mucositiden, interstitielle Pneumonitiden) (17). Am europäischen Onkologie-Kongress ESMO 2020 wurden Phase II- Daten präsentiert zu einer Kombination von Aromatasehemmern (Letrozol) und CDK4/6-Inhibitor (Palbociclib), wodurch eine klinisch bedeutsame Verbesserung des progressionsfreien Überlebens (PFS) erreicht wurde, mit den erwarteten Nebenwirkungen (18). Diese Resultate sollen in einer Phase III-Studie bestätigt werden. Palliative Chemotherapien in der ersten Therapie-Linie waren ursprünglich anthracyklin-basiert. Doxorubicin wurde allein versus Kombinationen mit Cyclophosphamid und auch Cisplatin untersucht (19). In der GOG-209- Studie konnte gezeigt werden, dass TAP (Paclitaxel, Doxorubicin, Cisplatin) vs Carboplatin/Paclitaxel bei fast 1400 Patientinnen mit fortgeschrittenen oder metastasierten Endometriumkarzinomen non-inferior war zu TAP mit gleichen Gesamtüberlebensraten (20). Carboplatin/Paclitaxel bleibt die Standardbehandlung in der ersten Linie.
Die Kombinationsbehandlungen mit Bevacizumab zeigten eine Verbesserung der Wirksamkeit, gering auch im Gesamtüberleben (21). Allerdings wurde von der FDA keine Zulassung für Bevacizumab erteilt.
Zweitlininenbehandlung
In der Auswahl der Zweitlinien-Therapie besteht kein Standard. Die Behandlung im Rahmen klinischer Studien ist deshalb immer zu prüfen. Vor der Einführung der Immuntherapie wurde im erneuten Rezidiv eine weitere platin-basierte Therapie versucht, wobei hier das Ansprechen > 60% betrug, allerdings nur nach längerem platin-freien Intervall (>24 Monate) (22). Platin- und taxanfreie Regimes zeigten geringe Aktivität.
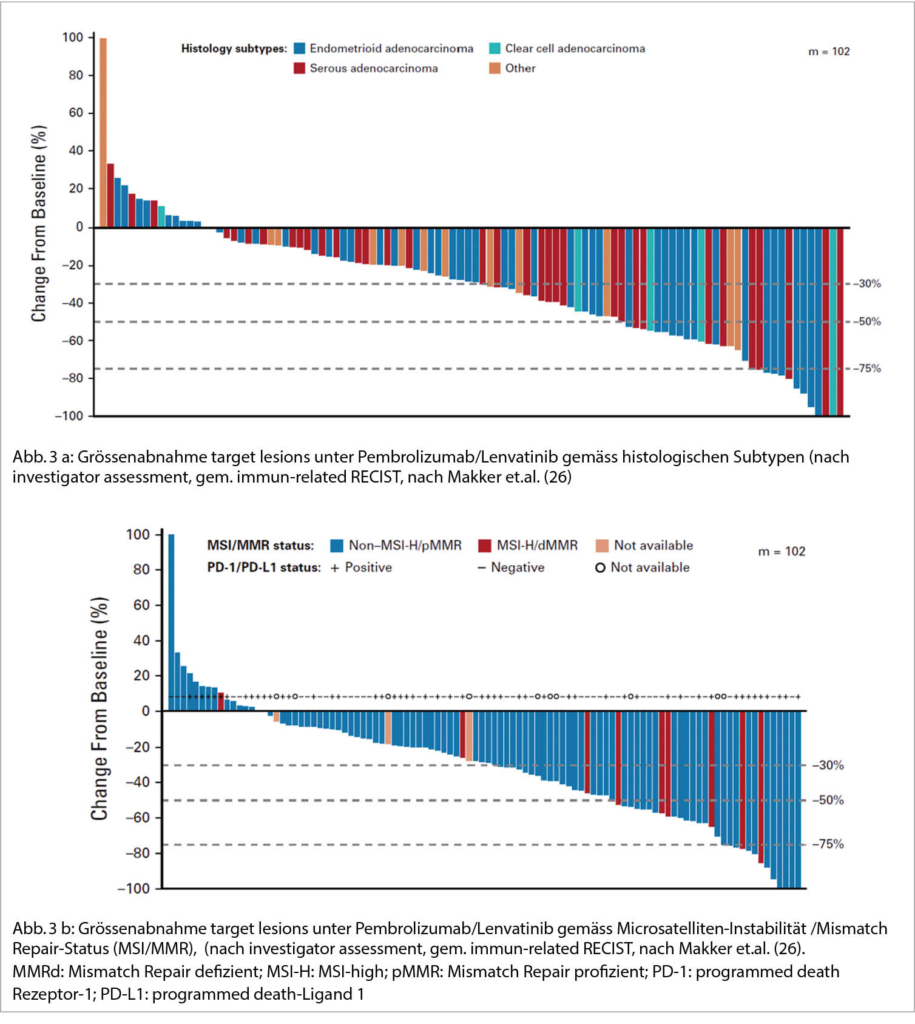
Verschiedene PD-1- und Anti PD-L1 Checkpoint-Inhibitoren wurden in den letzten wenigen Jahren beim metastasierten Endometriumkarzinom er-folgreich eingesetzt. Man kann von einem wahren Durchbruch in der Rezidiv-Behandlung sprechen, wo zuvor kaum wirksame Therapieoptionen bestanden. Programmed death-1 (PD-1) ist ein Immuncheckpoint Rezeptor, welcher von tumorinfiltrierenden T-Zellen exprimiert wird. Wird er durch PD-L1 aktiviert, ist die T-Zell Aktivität gehemmt und begünstigt dadurch eine Immun-Evasion. Liegt eine Defizienz in der Mismatch-Reparatur (MMRd) vor, kann dies den Tumor sensitiv auf Anti-PD-L1 – Therapien machen (23). Das Nebenwirkungsspektrum mit den immun-assoziierten Veränderungen muss hier beachtet werden, zumal ein Grossteil unserer Patientinnen älter und häufig ko-morbide ist. Die häufigsten unerwünschten Nebenwirkungen unter Pembrolizumab sind Fatigue, Pruritus, Diarrhoe, Übelkeit mit vermindertem Appetit, Hautausschlag, Fieber, Husten, Atemnot sowie muskulo-skelettale Schmerzen. Die immun-vermittelten Nebenwirkungen wie Pneumonitis, Colitis, Hepatitis, Endokrinopathien und Nephritis sind selten, aber potentiell fatal. Infusionsreaktionen werden öfters beobachtet. Es konnten langdauernde Remissionen beobachtet werden (24). 2017 wurde Pembrolizumab als erste Substanz tumor-agnostisch von der FDA (Food and Drug Administration) zugelassen. Dies erfolgte aufgrund Phase II-Daten bei soliden Tumoren mit Mikrosatelliten-Instabilität-high (MSI-H)/MMRd, nach Progression auf eine konventionelle Therapie. Es wurde eine signifikante Wirksamkeit gezeigt mit Gesamt-Ansprechraten (ORR) von 34% (25). 2019 wurde dann die Kombination von Pembrolizumab mit Lenvatinib, einem oralen VEGFR1-3 Hemmer, von Makker et al erfolgreich eingesetzt (26). Noch im selben Jahr wurde diese Behandlung von der FDA als breakthrough in der Zweitlininenbehandlung zugelassen, und zwar bei biomarker-unselektierten Patientinnen. 85% waren mikrosatelliten-stabil, nur 25% waren PD-L1-positiv. Es konnten hohe Ansprechraten (RR) von 36% in dieser vorbehandelten Population erzielt werden, insbesondere auch bei serösen Histologien. Fast 40% hatten ein langdauerndes Ansprechen. Die Nebenwirkungen waren leider beträchtlich, so litten fast 70% aller Patientinnen an einer G3/4-Toxizität (hpts. Nausea, Diarrhoe, art. Hypertonie, Fatigue). Dosis-Anpassungen waren in 70% notwendig.
Es ist bemerkenswert, dass diese Zulassungen ohne Daten aus randomisierten Phase III-Studien erfolgten. Ob die Krankenkassen unseren Patientinnen Kostengutsprache für diese Therapien erteilen, kommt mehr denn je einer Lotterie gleich. Zahlreiche Studien sind unterwegs mit weiteren Checkpoint-Inhibitoren, so zum Beispiel die italienische Phase III-Studie AtTEnd (NCT03603184), in der MMR-unabhängig Carboplatin/Taxol +/- Atezolizumab untersucht wird. Pembrolizumab/Lenvatinib wird in einer Phase III-Studie untersucht werden versus Doxorubicin oder Paclitaxel (ClinicalTrials.gov Identifier: NCT03517449).
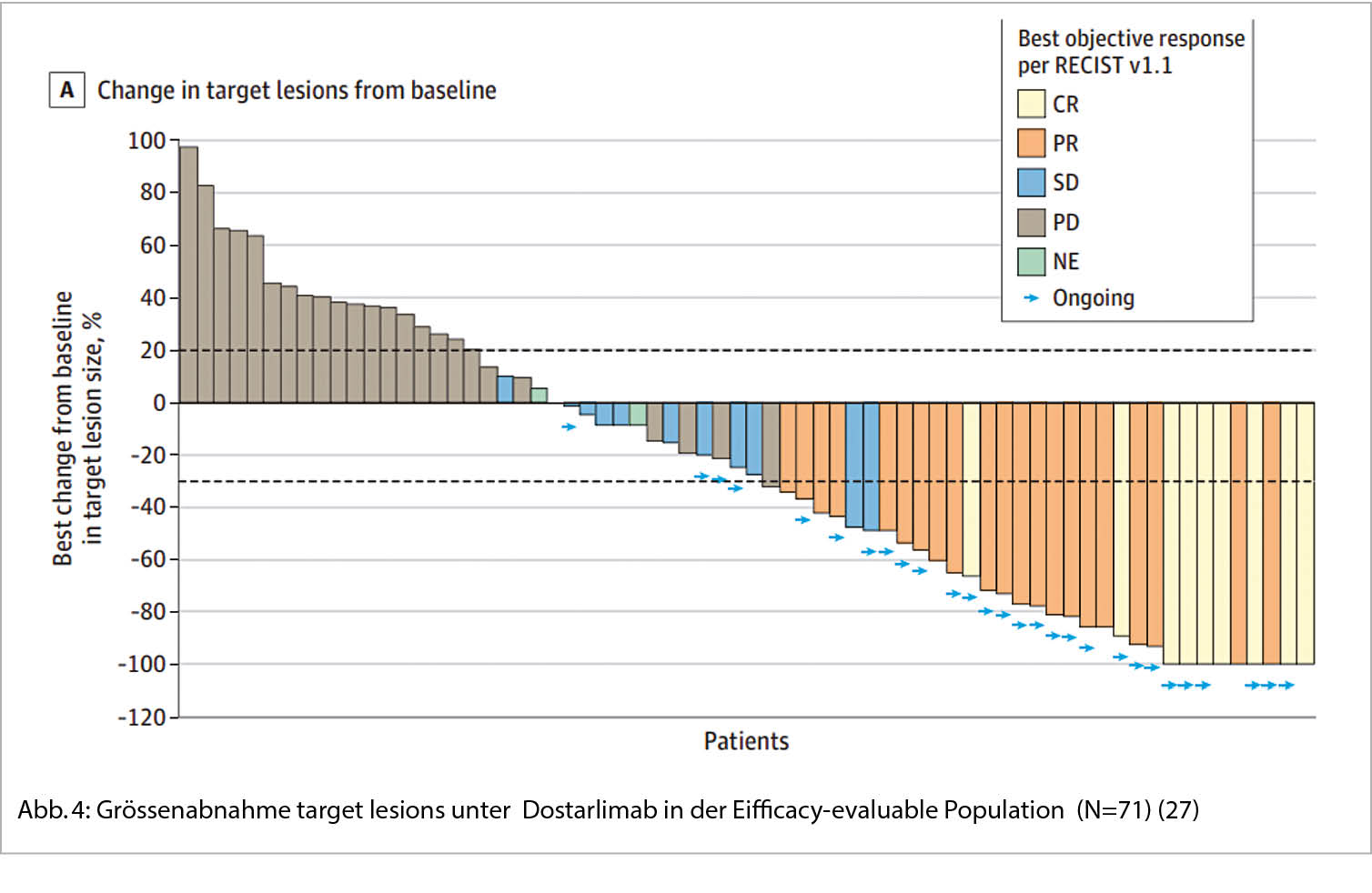
Dostarlimab (Jemperli®), ein weiterer Anti-PD-1-Antikörper, wurde in der GARNET-Studie (NCT02715284, multizenter, open-label Studie für Patienten mit fortgeschrittenen soliden Tumoren) bei Patientinnen mit MMRd rezidiviertem Endometriumkarzinomen untersucht. Bei den 71 eingeschlossenen Patientinnen waren die Resultate so beeindruckend, dass die Zulassung im April 2021 durch die FDA beschleunigt erfolgte für Patientinnen mit MMR-defizientem Endometriumkarzinom nach Progression auf eine platin-haltige Chemotherapie. Ebenso wurde der entsprechende diagnostische Test mittels VENTANA MMR RxDx Panel zugelassen. Dostarlimab wird weiter in einer Phase III-Studie untersucht in Kombination mit Carboplatin/Paclitaxel (NCT03981796, RUBY).
Jemperli® wurde in einer Dosierung von 500 mg iv alle 3 Wochen für 4 Dosen, gefolgt von 1000 mg iv alle 6 Wochen, verabreicht. Die overall response rate (ORR) war bei diesen vorbehandelten Patientinnen hoch mit 42.3% (95% CI: 30.6%, 54.6%), die mittlere Dauer des Ansprechens (duration of response DOR) war nicht erreicht; 93.3% der Patientinnen zeigten nämlich ein Ansprechen ≥ 6 Monate (Range: 2.6 – 22.4 Monate, es war ongoing beim letzten Assessment). Die Nebenwirkungen waren mit 34% SAE’s erheblich, in ≥ 20% wurde Müdigkeit, Asthenie, Nausea, Diarrhoe und Anämie rapportiert. Immun-assoziierte Reaktionen wurden im erwarteten Rahmen beobachtet.
Was bringt die Zukunft?
Wenn auch gerade in den letzten Jahren bedeutende Fortschritte in der Behandlung des metastasierten Endometriumkarzinoms erzielt werden konnten, muss unser Verständnis dieser heterogenen Krankheit stetig wachsen. Ein Fokus wird auf ihrer präzisen Klassifizierung bleiben sowie der weiteren aufwändigen Untersuchung in randomisierten klinischen Studien. Daten aus der PORTEC 4-a-Studie (NCT03469674) sowie Resultate der Phase III-Studie mit Paclitaxel, Carboplatin und Pembrolizumab (NCT02549209) werden unser Verständnis für diese Krankheit hoffentlich verbessern und uns die Therapie- Empfehlungen individuell gestalten lassen. Kombinationsbehandlungen mit Immuntherapie, Poly-ADP-Ribose-Polymerase (PARP)-Inhibitoren, anti-angiogenen Substanzen sowie mit Radiotherapie, werden untersucht.
Zweitabdruck aus info@onkologie_05-2021
Copyright bei Aerzteverlag medinfo AG
Stv. Leitende Ärztin Medizinische Onkologie
FMH Medizinische Onkologie
Kantonsspital Graubünden
Loestrasse 170
7000 Chur
ursula.hasler-strub@ksgr.ch
Die Autorin hat im Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
◆ Patientinnen mit metastasiertem Endometriumkarzinom haben eine ungünstige Prognose.
◆ Eine palliative endokrine Therapie (Megestat) ist oft langdauernd
wirksam und gut verträglich. Wenn die Krankheit nach einer palliativen Chemotherapie mit Carboplatin/Paclitaxel voranschreitet, bestehen neu Therapieansätze mit Immuntherapien: Pembrolizumab bei
PD-L1-positiven MMRd (Mismatch Repair defizienten) Patientinnen sowie Pembrolizumab/Lenvatinib bei PD-L1-negativen Patientinnen.
◆ Dostarlimab, ein weiterer PD-L1-Antikörper, wurde kürzlich von der FDA für MMRd rezidivierte Endometriumkarzinome zugelassen.
Hier muss eine sorgfältige Auswahl der Patientinnen erfolgen wegen potentiell schwerwiegender Nebenwirkungen.
◆ In Zukunft werden vielversprechende Weiterentwicklungen
(zB Immuntherapien in Kombination mit Radiotherapie) erwartet.
1. Noone AM, Howlader N, Krapcho M, et al (eds): SEER Cancer Statistics Review, 1975-2015, National Cancer Institute. https://seer.cancer.gov/csr/1975_2015
2. Sant M, Chirlaque Lopez MD, Agresti R, et al. Survival of women with cancers of breast and genital organs in Europe 1999–2007: results of the EUROCARE-5 study. Eur J Cancer 2015;51:2191–205
3. Bokhman JV.: Two pathogenetic types of endometrial carcinoma. Gynecol Oncol. 1983;15(1):10-17.).
4. Leon-Castillo A, de Boer SM, Powell ME, et al. Molecular classification of the PORTEC-3 trial for high-risk endometrial cancer: impact on prognosis and benefit from adjuvant therapy. JClin Oncol 2020;38:3388–97.
5. Kandoth C, Schultz N, et al, Cancer Genome Atlas Research Network. Integrated genomic characterization of endometrial carcinoma. Nature 2013;497:67–73.
6. Church DN, Stelloo E, Nout RA, et al: Prognostic significance of POLE proofreading mutations in endometrial cancer. J Natl Cancer Inst 107:402, 2014
7. Concin N et al.: ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma. Int J Gynecol Cancer. 2021;31(1):12-39.
8. Wortman BG, Bosse T, Nout RA, et al: Molecular-integrated risk profile to determine adjuvant radiotherapy in endometrial cancer: Evaluation of the pilot phase of the PORTEC-4a trial. Gynecol Oncol 151:69-75, 2018
9. McCluggage WG, Colgan T, Duggan M, et al. Data set for reporting of endometrial carcinomas: recommendations from the International Collaboration on Cancer Reporting (ICCR) between United Kingdom, United States, Canada, and Australasia. Int JGynecol Pathol 2013;32:45–65.
10. Fader AN, Roque DM, Siegel E, et al. Randomized phase II trial of carboplatin-paclitaxel versus carboplatin-paclitaxel-trastuzumab in uterine serous carcinomas that overexpress human epidermal growth factor receptor 2/neu. J Clin Oncol 2018;36:2044–51
11. Talhouk A, McConechy MK, Leung S, et al. Confirmation of ProMisE: a simple, genomics-based clinical classifier for endometrial cancer. Cancer 2017;123:802–13.
12. Stelloo E, Nout RA, Osse EM, et al. Improved risk assessment by integrating molecular and clinicopathological factors in early-stage endometrial cancer—combined analysis of the PORTEC cohorts. Clin Cancer Res 2016;22:4215–24.
13. Piulats JM, Matias-Guiu X: Immunotherapy in Endometrial Cancer: In the Nick of Time. Clin Cancer Res. 2016; 22(23): 5623–5.
14. Van Gool IC, Stelloo E, Nout RA, et al. Prognostic significance of L1CAM expression and its association with mutant p53 expression in high-risk endometrial cancer. Mod Pathol 2016;29:174–81.
15. van Weelden WJ, Massuger LFAG, et al, ENITEC. Anti-estrogen treatment in endometrial cancer: a systematic review. Front Oncol 2019;9:359.)
16. Ethier J-L, Desautels DN, Amir E, et al. Is hormonal therapy effective in advanced endometrial cancer? A systematic review and meta-analysis. Gynecol Oncol 2017;147:158–66.
17. Slomovitz BM, Jiang Y, Yates MS, et al. Phase II study of everolimus and letrozole in patients with recurrent endometrial carcinoma. JCO 2015;33:930–6.
18. A randomised double-blind placebo-controlled phase II trial of palbociclib combined with letrozole (L) in patients (pts) with oestrogen receptor-positive (ER+) advanced/recurrent endometrial cancer (EC): NSGO-PALEO / ENGOT-EN3 trial (LBA28 – ESMO 2020)
19. Thigpen JT, Brady MF, Homesley HD, et al: Phase III trial of doxorubicin with or without cisplatin in advanced endometrial carcinoma: A Gynecologic Oncology Group study. J Clin Oncol 22:3902-3908, 2004
20. Miller DFV, Filiaci V, Fleming G, et al. Randomized phase III non inferiority trial of first line chemotherapy for metastatic or recurrent endometrial carcinoma: a gynecologic oncology group study. Gynecol Oncol 2012;125S:771–3.
21. Aghajanian C, Sill MW, Darcy KM, et al.: Phase II trial of bevacizumab in recurrent or persistent endometrial cancer: a Gynecologic Oncology Group study. J Clin Oncol. 2011; 29(16): 2259–65.
22. Rubinstein M, Halpenny D, Makker V, et al. Retreatment with carboplatin and paclitaxel for recurrent endometrial cancer: a retrospective study of the Memorial Sloan Kettering Cancer Center experience. Gynecol Oncol Rep 2019;28:120–3.
23. Longoria TC, Eskander RN: Immunotherapy in endometrial cancer – an evolving therapeutic paradigm. Gynecol Oncol Res Pract. 2015; 2: 11.
24. Ott PA, Bang YJ, Berton-Rigaud D, et al.: Safety and Antitumor Activity of Pembrolizumab in Advanced Programmed Death Ligand 1-Positive Endometrial Cancer: Results From the KEYNOTE-028 Study. J Clin Oncol. 2017; 35(22): 2535–41.
25. Mittica G, Ghisoni E, Giannone G, et al. Checkpoint inhibitors in endometrial cancer: preclinical rationale and clinical activity. Oncotarget 2017;8:90532–44.
26. Makker V, Taylor MH, Aghajanian C, et al. Lenvatinib plus pembrolizumab in patients with advanced endometrial cancer. J Clin Oncol 2020;38:2981–92.
27. Oaknin A et al. Clinical Activity and Safety of the Anti–Programmed Death 1 Monoclonal Antibody Dostarlimab for Patients With Recurrent or Advanced Mismatch Repair–Deficient Endometrial Cancer JAMA Oncol. 2020;6(11):1766-1772.
info@gynäkologie
- Vol. 12
- Ausgabe 4
- August 2022