- Metformin in der Schwangerschaft und Stillzeit
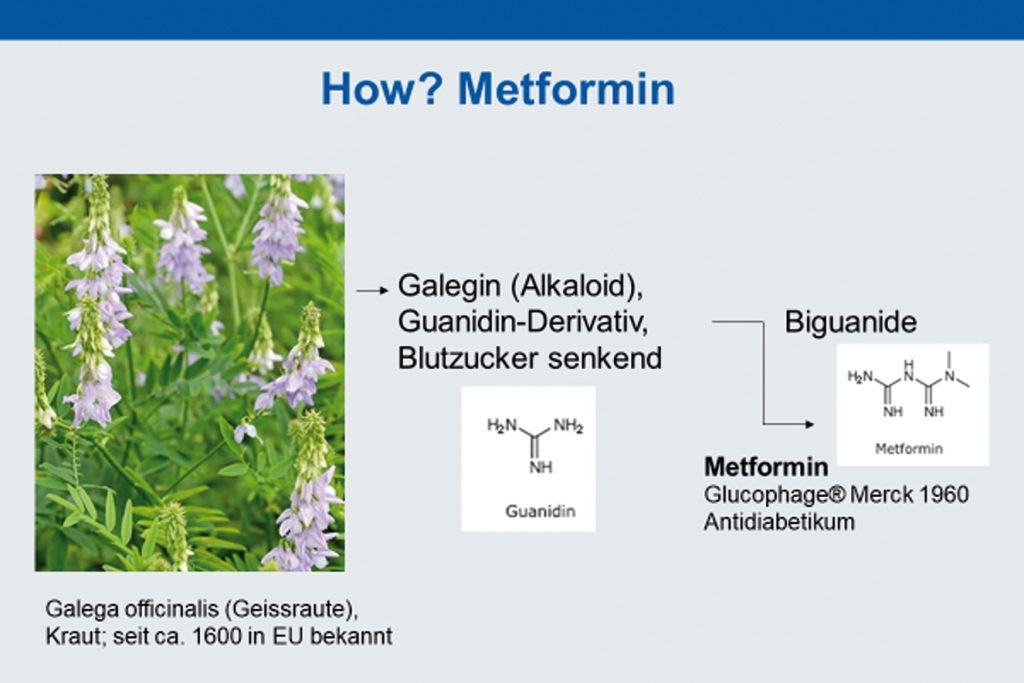
Metformin ist ein orales Antidiabetikum vom Guanidintyp, ein sogenanntes Biguanid. Biguanide sind chemisch verwandt mit dem Alkaloid Galegin, das in der Geissraute, der Galega officinalis, vorkommt (Abb. 1). Metformin hat also wie sehr viele Arzneistoffe pflanzlichen Ursprung. Metformin verringert die hepatische Glukoseproduktion, wodurch Nüchternblutzucker und Insulinspiegel gesenkt und die Insulinresistenz vermindert werden. Es erfolgt kein stimulierender Effekt auf die Insulinsekretion und somit bei alleiniger Anwendung auch keine Hypoglykämie (1).
La metformine est un antidiabétique de type biguanide. Les biguanides s’ apparentent chimiquement à l’ alcaloïde Galégine qui est présent dans la plante Galéga officinalis (rue-de-chèvre), (cf. fig. 1). Comme beaucoup de médicaments, la metformine est donc d’ origine végétale. La metformine diminue la production hépatique de glucose. De ce fait, la glycémie à jeun et le taux d’ insuline circulant baissent et la résistance à l’ insuline diminue. La substance n’ exerce aucun effet stimulant sur la sécrétion d‘insuline et de ce fait, en cas d’ utilisation seule, il n’ y a pas de risque d’ hypoglycémie (1).
Pharmakokinetik
Nichtschwangere
- Absorption: Die Bioverfügbarkeit beträgt 40-60% bei Dosen zwischen 0.5 g und 1 g und nimmt mit steigenden Dosen ab (2, 3).
- Distribution/Metabolismus: Metformin ist nicht proteingebunden und unterliegt keinem Metabolismus.
- Elimination: Die Ausscheidung erfolgt unverändert hauptsächlich renal; in den Faeces detektierbare Konzentrationen werden als intestinal nicht resorbierte Mengen interpretiert (2). Die renale Clearance von Metformin korreliert mit derjenigen von Kreatinin. Sie übersteigt die glomeruläre Filtrationsrate und spiegelt damit die aktive tubuläre Sekretion wider. Metformin ist Substrat des renalen «organic cation transports 2» (OCT2), der einem «single nucleotide polymorphism» unterliegt und je nach Genotyp und Herkunft mit einer OCT2 Aktivitätssteigerung oder -senkung verbunden ist (4).
Schwangerschaft und Stillzeit
In der Schwangerschaft nehmen die renale Clearance und die aktive Sekretion von Metformin zu. Ob eine Aktivitätssteigerung des OCT2 durch die in der Schwangerschaft vermehrt gebildeten Sexualsteroide ursächlich daran beteiligt ist, ist bisher nicht gezeigt. Am höchsten sind die Werte der renalen Clearance und der tubulären Sekretionsclearance in der Mitte der Schwangerschaft (22-26 SSW: Zunahme um knapp 50% bzw. 45% gegenüber Nichtschwangeren). Die renale Clearance korreliert besser mit der tubulären Sekretionsclearance (r = 0.97) als mit der Kreatininclearance (5). Die Halbwertzeit ist in der Mitte der Schwangerschaft erhöht (4.3 Std. vs. 3.8 Std. bei Nichtschwangeren), was eine Dosisanpassung nötig macht (5).
Metformin gelangt als kleines Molekül rasch in den fetalen Blutkreislauf: Es ist mit kindlichen Spiegeln zu rechnen, die denen im mütterlichen Blut entsprechen (90-1000 ng / ml) (5, 6). Erfolgt die letzte mütterliche Dosis < 10 Std. vor der Entbindung, sind im venösen/arteriellen Nabelschnurblut bei der Entbindung Konzentrationen detektierbar (5).
In der Muttermilch liegen die Konzentrationen unter Gleichgewichtsbedingungen bei einer Dosierung von 1 x 1500 mg täglich im Bereich von 200 ng / ml (5, 7, 8). Bei einem Trinkvolumen von 1 l pro Tag ergibt dies eine kindliche Dosis von 0.2 mg täglich. Ausführliche Kinetikdaten zur Muttermilch liegen nicht vor.
Anwendung
Metformin wird als Monotherapie zur oralen Behandlung des Typ 2 Diabetes eingesetzt. Zudem erfolgt bei Frauen präkonzeptionell die Behandlung des polycystischen Ovarsyndroms (9) mit Metformin und in der Schwangerschaft wird Metformin im off-label use bei Typ 2 Diabetes und Gestationsdiabetes eingesetzt. Es gibt bei der Therapie des Gestationsdiabetes noch keinerlei Expertenkonsens. Die Wirksamkeit und Sicherheit im Vergleich zu Insulin sprechen aber in vielen Untersuchungen für Metformin.
| Empfehlungen der SGED 2009 zum Screening des Gestationsdiabetes basierend auf den Ergebnissen der HAPO Studie (10, 11): Nüchternblutzucker (Plasma): Pathologisch ≥ 5.1 mmol/l Blutzucker (Plasma) 1 Stunde nach 75 g Glukose: Pathologisch ≥ 10.0 mmol/l Blutzucker (Plasma) 2 Stunden nach 75 g Glukose: Pathologisch ≥ 8.5 mmol/l |
Dosierung
Initialdosis oral 0.5 g -1 g / Tag; Steigerung auf max. 2.0 g (bis im Extremfall 3.0 g) / Tag, verteilt auf 3 Einzeldosen jeweils vor den Mahlzeiten. Anpassung aufgrund der veränderten Kinetik und grosser individueller Unterschiede nach oben im 2., evtl. im 3. Trimenon. Eine gute Kontrolle des Blutzuckers ist notwendig.
| Zielblutzuckerwerte bei Gestationsdiabetes (Plasma, gerundete Werte; Empfehlungen der SGED 2009 [11]: Präprandial/Nüchtern: ≤ 5.3 mmol / l 1 Std. postprandial*: ≤ 8.0 mmol / l 2 Std. postprandial*: ≤ 7.0 mmol / l *Zeit nach Ende der Mahlzeit |
Wirksamkeit und Sicherheit bei Gestationsdiabetes
Präventiv: Bei adipösen zu Studienbeginn noch nicht-diabetischen Schwangeren, scheint Metformin keine Vorteile zu bringen gegenüber Placebo (12).
Therapeutisch: In kontrollierten Untersuchungen zur Gestationsdiabetes-Behandlung mit Metformin vs. Insulin scheint Metformin bzgl. Sicherheit und Wirksamkeit (Glukoseblutspiegel, Schwangerschaftsverlauf (z.B. Abortrate) und -ausgang sowie Verträglichkeit nicht hinter Insulin zu stehen (13-19). In allen Studien kommt zum Ausdruck, dass ein Teil der Patientinnen nicht ohne zusätzliches Insulin auskommt. Folgende Befunde aus RCT’ s sprechen jedoch für eine überlegene Wirksamkeit von Metformin, weshalb die Therapie als wirksam und kostengünstig beurteilt wird (15-19):
• Bei der Schwangeren erfolgt unter Metformin eine geringere Gewichtszunahme bzw. postpartal ein rascherer bzw. grösserer Gewichtsverlust als unter Insulin (13, 15).
• Beim Neugeborenen kommt es weniger häufig zu neonatalen Hypoglykämien bzw. intensivmedizinischen Massnahmen (13, 15, 17) oder zu Makrosomien (19) als nach Insulin.
Unerwünschte Arzneimittelwirkungen (UAW)
Schwangerschaftsunspezifisch: Gastrointestinale Symptome, Vit. B12 Mangel (20).
Schwangere: In der australisch-neuseeländischen MIG Studie (RCT), in der 733 Patientinnen mit Gestationsdiabetes > 20 SSW zu Insulin vs. Metformin randomisiert waren, wurden in beiden Gruppen weder bei der Mutter noch beim Kind schwere Nebenwirkungen verzeichnet.
Embryo/Fetus: In Studien an Schwangeren im ersten Trimenon zur Metforminbehandlung bei polycystischem Ovarsyndrom (PCOS) oder bei Gestationsdiabetes im Vergleich zu Insulin wurde kein erhöhtes Risiko für Fehlbildungen gefunden (21-23).
Neugeborene: Viele Studien finden im Vergleich zu Insulin kein unterschiedliches oder sogar ein verbessertes neonatales Outcome wie z.B. die geringere Inzidenz an schweren Hypoglykämien (siehe oben). Allerdings zeigten die erwähnte MIG Studie (13) und eine RCT aus dem Jahre 2015 (14) neben diesem Vorteil auch Nachteile; die Anzahl frühgeborener bzw. small for date Kinder war in der Metformingruppe höher (13, 15).
Stillzeit: Die Anwendung in der Stillzeit wird für den gestillten Säugling als unproblematisch angesehen (24), u.a. aufgrund der niedrigen Konzentrationen in der Muttermilch (siehe Pharmakokinetik).
Kontraindikationen und Interaktionen
Bei Patientinnen mit erhöhtem Laktatazidose-Risiko (Niereninsuffizienz, Alkoholexzess) kontraindiziert (12, 20, 25).
Glukokortikoide (LRI): Stimulieren die Glukoneogenese. Cave: Lungenreifungsinduktion (LRI): Überwachung der Blutglukosekonzentration, um die antidiabetische Therapie ev. anzupassen (26, 27).
Salizylate: Höhere Salizylat-Dosen (> 2 g / Tag) wirken hypoglykämisch (20). In der Schwangerschaft ist das jedoch irrelevant (die Dosis zur Präeklampsie-Prophylaxe liegt bei 100-300 mg / Tag Acetylsalicylsäure).
Empfehlungen von Fachgesellschaften
CAN: Diabetes Canada: «First-line therapy conists of diet and physical activity. If glycemic targets are not met, insulin or metformin can then be used» (28).
CH: Schweizerische Gesellschaft für Endokrinologie und Diabetologie (SGED): «Falls die Instruktion bezüglich Insulininjektion nicht möglich ist, stellt Metformin eine Alternative zur Insulintherapie dar, wobei fast 50% der Frauen mit ungenügenden Blutzuckerwerten unter Metformin auf Insulin umgestellt werden müssen» (11).
D: Deutsche Diabetes Gesellschaft (DDG) und Deutsche Gesellschaft für Gynäkologie und Geburtshilfe (DGGG): «Bei Schwangeren mit GDM und nachgewiesener, ausgeprägter Insulinresistenz (Insulintagesdosis > 1,5–2,0 U / kg aktuellem KG) und nicht zielgerechter BZ-Einstellung sowie ggf. zusätzlicher asymmetrischer fetaler Makrosomie kann nach erneuter Prüfung aller Basismassnahmen und Bestätigung einer einwandfreien Anwendung der Insulinapplikation durch die betreuende Diabetes Schwerpunkteinrichtung ein individueller Heilversuch aus fetaler Indikation mit Metformin nach entsprechender Aufklärung der Schwangeren als off-label-use erwogen werden» (29).
UK: National Institute for Health and Clinical Excellence (NICE): «1.2.20 Offer metformin to women with gestational diabetes if blood glucose targets are not met using changes in diet and exercise within 1–2 weeks» (30).
UK: Royal College of Obstetricians and Gynaecologists (RCOG): Ein Scientific Impact Paper von 2011 deklariert Metformin während der Schwangerschaft als wirksam und sicher, die Langzeitauswirkungen auf die Kinder sind jedoch unklar (31).
USA: American Congress of Obstetricians and Gynecologists (ACOG): «In women who decline insulin therapy or who the obstetricians or other obstetric care providers believe will be unable to safely administer insulin, or for women who cannot afford insulin, metformin is a reasonable alternative choice» (Evidence Level B) (32).
International, FIGO: «Insulin, glyburide, and metformin are safe and effective therapies for GDM during the second and third trimesters…» (33).
Die Autoren haben keine Interessenskonflikte in Zusammenhang mit diesem Artikel.
Empfehlung der SAPP:
- Metformin kann präkonzeptionell und in der Schwangerschaft
verwendet werden - In der Schwangerschaft dient es der Therapie des Gestationsdiabetes (im 2. oder 3. Trimenon) oder des Diabetes Typ 2, v.a. wenn Gründe gegen eine (alleinige) Insulintherapie sprechen.
- Bei einer mütterlichen Metforminbehandlung ist beim gestillten Kind aufgrund der geringen Metforminmengen in der Muttermilch nicht
mit unerwünschten Wirkungen zu rechnen. - Es muss darauf hingewiesen werden, dass der Gebrauch von
Metformin in der Schwangerschaft einen «Off-label use» darstellt!
Messages à retenir
A la lumière de la littérature récente, les sociétés de spécialistes ont revu leurs recommandations (11, 28 - 33) ; ci-après celles de la SAPP / ASPP :
- La metformine peut être utilisée avant toute conception et pendant la grossesse et l’ allaitement.
- Pendant la grossesse, elle sert au traitement du diabète gestationnel (au 2me et 3me trimestre) ou du diabète de type 2, surtout s’ il existe des arguments parlant contre le traitement par Insuline seul.
- Une femme traitée pendant la grossesse peut allaiter. Les quantités de metformine passant dans le lait maternel sont faibles. Des effets non-désirés ne sont dès lors pas attendus.
- Il est à souligner que l’ utilisation de metformine pendant la grossesse représente un usage hors indication (« off label use »).
Pour les lecteurs de Suisse romande, la référence supplémentaire est recommandée :
Centre de référence sur les agents tératogènes de Paris (www.lecrat.org)
- Natali A, Ferrannini E.: Effects of metformin and thiazolidinediones on suppression of hepatic glucose production and stimulation of glucose uptake in type 2 diabetes: a systematic review. Diabetologia 2006;49:434-41.
- Tucker GT, Casey C, Phillips PJ, Connor H, Ward JD, Woods HF. Metformin kinetics in healthy subjects and in patients with diabetes mellitus. Br J Clin Pharmacol 1981;12:235-46.
- Scheen AJ. Clinical pharmacokinetics of metformin. Clin Pharmacokinet 1996;30:359-71.
- Chen Y, Li S, Brown C, Cheatham S, Castro PA, Leabman MK, Urban TJ, Chen I, Yee SW, Choi JH et al. Effect of genetic variation in the organic cation transporter 2 on the renal elimination of metformin. Pharmacogenet Genomics 2009;19:497-504.
- Eyal S, Easterling TR, Carr D, Umans JG, Miodovnik M, Hankins GD, Clark SM, Risler L, Wang J, Kelly EJ, Shen DD, Hebert MF. Pharmacokinetics of metformin during pregnancy. Drug Metab Dispos 2010;38:833-40.
- Vanky E, Zahlsen K, Spigset O and Carlsen SM. Placental passage of metformin in women with polycystic ovary. Fertil Steril 83:1575-8.
- Hale T, Kristensen J, Hackett L, Kohan R, Ilett K. Transfer of metformin into human milk. Adv Exp Med Biol 2004;554:435-6.
- Gardiner SJ, Kirkpatrick CM, Begg EJ, Zhang M, Moore MP, Saville DJ. Transfer of metformin into human milk. Clin Pharmacol Ther 2003;73:71-7.
- Lord MJ, Flight JHK, Norman JR. Metformin in polycystic ovary syndrome: systematic review and meta-analysis. BMJ 2003;327:951-3.
- The HAPO Study Cooperative Research Group: Hyperglycemia and adverse pregnancy outcomes. N Engl J Med 2008;358:1991-2002.
- SGED: Lehmann R, Troendle A, Brändle M. Neue Erkenntnisse zur Diagnostik und Management des Gestationsdiabetes. Ther Umsch 2009;;66:695-706.
- Chiswick C Reynolds RM, Denison F, Drake AJ, Forbes S, Newby DE, Walker BR, Quenby S, Wray S, Weeks A, Lashen H, Rodriguez A, Murray G, Whyte S, Norman JE. Effect of metformin on maternal and fetal outcomes in obese pregnant women (EMPOWaR): a randomised, double-blind, placebo-controlled trial. Lancet Diabetes Endocrinol 2015;pii: S2213-8587(15)00219-3.
- Rowan JA, Hague WM, Gao W, Battin, MR, Moore MP, the MiG Trial Investigators: Metformin versus insulin for the treatment of gestational diabetes. N Engl J Med 2008;358:2003-15.
- Zhao LP, Sheng XY, Zhou S, Yang T, Ma LY, Zhou Y, Cui YM. Metformin versus insulin for gestational diabetes mellitus: a meta-analysis. Br J Clin Pharmacol 2015 April 29.
- Ainuddin JA, Karim N, Zaheer S, Ali SS, Hasan AA. Metformin treatment in type 2 diabetes in pregnancy: an active controlled, parallel-group, randomized, open label study in patients with type 2diabetes in pregnancy. J Diabetes Res 2015;2015:325851.
- Niromanesh S, Alavi A, Sharbaf FR, Amjadi N, Moosavi S, Akbari S. Metformin compared with insulin in the management of gestational diabetes mellitus:
a randomized clinical trial. Diabetes Res Clin Pract 2012;98:422-9. - Spaulonci CP, Bernardes LS, Trindade TC, Zugaib M, Francisco RP.Randomized trial of metformin vs insulin in the management of gestational diabetes. Am J
Obstet Gynecol 2013;209:34.e1-7. - Beyuo T, Obed SA, Adjepong-Yamoah KK, Bugyei KA3 Oppong SA, Marfoh K. Metformin versus insulin in the management of pre-gestational diabetes mellitus in pregnancy and gestational diabetes mellitus, PLOS One 2015;10:e0125712
- Gandhi P, Bustani R, Madhuvrata P, Farrell T. Introduction of metformin for gestational diabetes mellitus in clinical practic has it an impact, Eur J Obstet Gynecol Repr Biol 2012;160:147-50.
- Arzneimittelinformation der Schweiz. https:// compendium.ch; www.swissmedicinfo.ch
- Gilbert C, Valois M, Koren G. Pregnancy outcome after first-trimester exposure to metformin: a meta-analysis. Fertil Steril 2006;86:658-63.[22] Lautatzis M, Efficacy safety of metformin during pregnancy with gestational diabetes or polycystic ovary syndrom systematic review, Metabolism 2013;62:1522-34.
- Nicholson W, Bolen S, Witkop CT, Neale D, Wilson L, Bass E. Benefits and risks of oral diabetes agents compared with insulin in women with gestational diabetes: A systematic review. Obstet Gynecol 2009;113:193-205.
- Hague WE. Metformin in pregnancy and lactation. Aust Prescr 2007;30:68–9.
- Tahrani AA, Varughese GI, Scarpello JH, Hanna FW. Metformin, heart failure, and lactic acidosis: is metformin absolutely contraindicated? BMJ 2007;335:508-12.
- Tappy L, Randin D, Vollenweider P, Vollenweider L, Paquot N, Scherrer U, Schneiter P, Nicod P, Jéquier E. Mechanisms of dexamethasone-induced insulin resistance in healthy humans. J Clin Endocrinol Metab 1994;79:1063-9.
- Bruno A, Pagano G, Benzi L, Di Ciani G, Spallone V, Calabrese G, Passeri A. Change in glucose metabolism after long-term treatment with deflazacort and
betamethasone. Eur J Clin Pharmacol 1992;43:47-50. - Diabetes Canada: Diabetes Canada Clinical Practice Guidelines Expert Committee. Feig S et al. Diabetes and pregnancy. Can J Diabetes 2018;42:S255-82.
- DDD, DGG-AGG: S3-Leitlinie Gestationsdiabetes mellitus (GDM), Diagnostik,
Therapie und Nachsorge 2. Auflage. https://www.deutsche-diabetes-gesellschaft.de/fileadmin/Redakteur/Leitlinien/Evidenzbasierte_Leitlinien/2018/057-008l_S3_Gestationsdiabetes-mellitus-GDM-Diagnostik-Therapie-Nachsorge_2018-03.pdf - NICE: NICE guideline NG3 (Last updates August 2015). Management of diabetes and its complications from pre-conception to the postnatal period. https://www.nice.org.uk/guidance/ng3
- RCOG: Diagnosis and treatment of gestational diabetes, Scientific Impact Paper 23 (2011). https://www.rcog.org.uk/globalassets/documents/guidelines/scientific-impact-papers/sip_23.pdf
- ACOG: Practice Bulletin No 190: Gestational diabetes. Obstet Gynecol 2018 Feb; 131 (2) :: e49-e64
- FIGO: The International Federation of Gynecology and Obstetrics (FIGO). Hod M et al. Initiative on gestational diabetes mellitus: A pragmatic guide to diagnosis, management, and care Int J Gynecol and Obstet 2015: 131; Suppl 3: S173-211.
info@gynäkologie
- Vol. 9
- Ausgabe 1
- Februar 2019






