- Orale Eisentherapie
Obwohl die orale Eisentherapie als First-Line-Behandlung für einen Eisenmangel und eine Eisenmangelanämie bei den meisten Frauen gilt (1), variieren die Richtlinien und Konsens über die empfohlene Dosierung und Häufigkeit der Einnahme. Orales Eisen ist bei einem Eisenmangel, bei einer leichten und mittelschweren Eisenmangelanämie (IDA) empfohlen, d. h. wenn das Hämoglobin ≥ 8,0 g/dl liegt, entsprechend der WHO- Empfehlungen (http://www.who.int/vmnis/indicators/haemoglobin/en). Bei einer schweren IDA (Hämoglobin < 8,0 g/dl), unabhängig von der Ursache, gibt es einen Konsens über den Einsatz neuer intravenöser Eisenpräparate als wirksame und rasche Erstlinientherapie (2, 3).
Bien que l’administration orale de fer représente le traitement de premier choix en cas de manque de fer et d’anémie ferriprive chez la plupart des femmes (1), les directives quant au dosage et le nombre de prises quotidiennes recommandes varient. Le fer par voie orale est indiqué en cas de manque de fer et d’anémie ferriprive (angl. IDA) légère à modérée, càd hémoglobine ≥ 8,0 g/dl, en accord avec les recommandations de l’OMS, (http://www.who.int/vmnis/indicators/haemoglobin/en). En cas d’IDA sévère (hémoglobine < 8,0 g/dl), de toute origine, il existe un consensus pour l’emploi déjà en première intention d’une des préparations de fer intraveineuses modernes, efficaces et rapides (2, 3).
Eisenpräparate
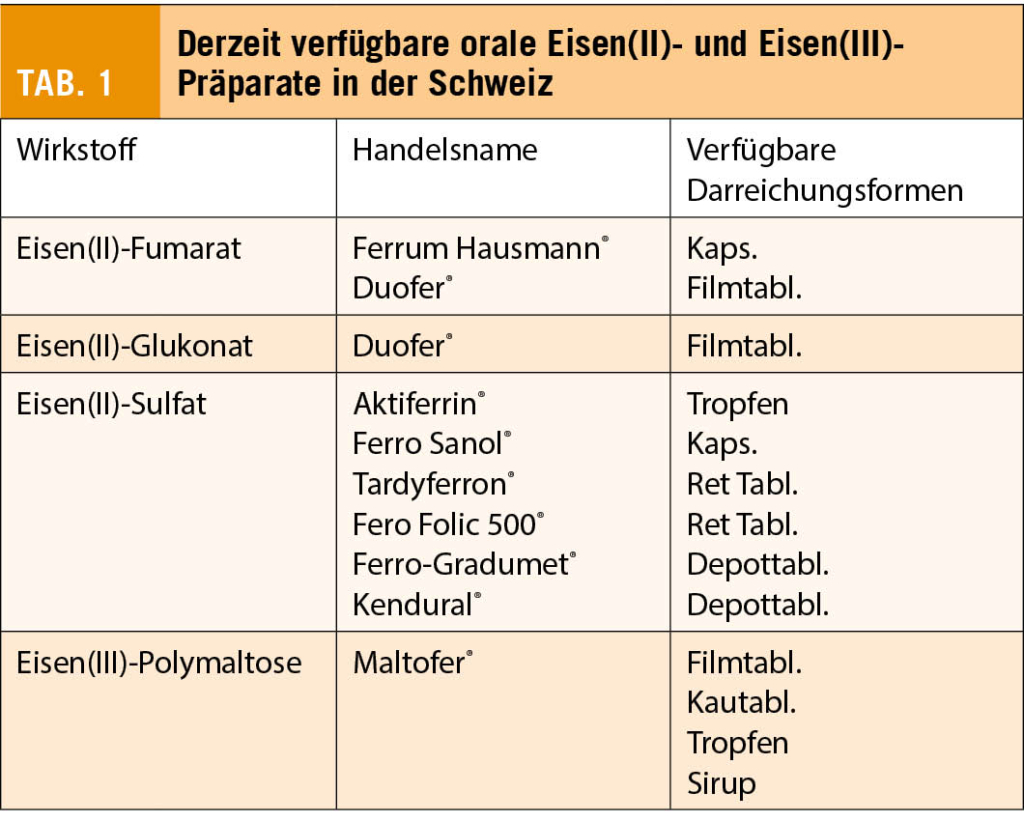
Die auf dem Markt erhältlichen Eisenpräparate unterscheiden sich stark in Dosierung, Zusammensetzung, Kosten und Bioverfügbarkeit. Ihre Chemie ist ebenfalls heterogen und enthält entweder dreiwertiges (Fe3+) oder zweiwertiges (Fe2+) Eisen, in Form von Eisensalzen oder Eisen-Polysaccharid-Komplexen (4). Pharmakologisches Eisen wird über denselben Weg absorbiert wie das in pflanzlichen Nahrungsmitteln enthaltene Nicht-Häm-Eisen, was weniger effizient ist als die Absorption von Häm-Eisen aus Fleisch (5, 6). Das dreiwertige Eisen hat eine sehr geringe Löslichkeit bei neutralem oder alkalischem pH-Wert und muss vor der Aufnahme durch Enterozyten zu zweiwertigem Eisen reduziert werden (7). Daher scheinen im Moment zweiwertige Eisensalze aufgrund ihrer besseren Bioverfügbarkeit die optimalere Form der oralen Eisentherapie zu sein. Zu den häufig verwendeten Eisensalzen gehören Eisen(II)-Fumarat, Eisen(II)-Sulfat und Eisen(II)-Gluconat (8) (Tabelle 1). Eisen(II)- Salze sind relativ gut und besser wasserlöslich als Eisen(III)- Salze; sie werden deshalb relativ rasch aufgenommen, wirken aber in höherer Dosis auch entsprechend toxisch und zwar sowohl lokal (irritierend) als auch systemisch, wenn die Ferritin-Bindungskapazität in den Zellen und die Transferrin- Bindungskapazität im Blut überschritten wird. Eisensulfat (in der Schweiz erhältlich als Aktiferrin®, Ferro Sanol®, Tardyferon®, Gyno-Tardyferon®, Fero Folic®, Ferro-Gradumet®, Kenderal®) wird von mehreren Leitlinien für eine orale Eisentherapie als erste Wahl empfohlen (9, 10), obwohl Eisensulfat deutlich toxischer ist als Eisenfumarat.
Die Wirksamkeit der oralen Eisentherapie wird durch gastrointestinale Nebenwirkungen und langer Behandlungsdauer beeinträchtigt, die zu einer verminderten Behandlungsadhärenz führen. Darum wurden als weitere Strategie stabilere Eisen(III)-Komplexe wie Eisen(III)-Polymaltose und Eisen(III)-Trimaltol entwickelt, die nur eine minimale parazelluläre Aufnahme zeigen und eine gute Resorption bei gleichzeitig deutlich besserer Verträglichkeit bieten (11). Sie sind jedoch deutlich teurer als herkömmliche Eisen(II)-Präparate.
Viele Multivitamin-/Mineralstoffpräparate enthalten in der Regel niedrige Eisendosen, die nicht ausreichen, um einen Eisenmangel zu beheben, und können andere Mineralstoffe (wie Zink) enthalten, die die Eisenabsorption stören (12). Die Resorption von oralem Eisen, insbesondere bei der Einnahme mit Mahlzeiten, wird durch die Zugabe von Ascorbinsäure mit einem molaren Verhältnis von ≥ 2:1 zu Eisen erhöht, d.h. etwa 6 mg Ascorbinsäure für 1 mg Eisen (13). Einige orale Eisenpräparate enthalten präbiotische Galacto-Oligosaccharide, die mit verabreichtem Eisenfumarat die Eisenabsorption erhöhen können (14). Es gibt jedoch keine Evidenz dafür, dass die Aufnahme anderer Nährstoffe, wie z. B. der B-Vitamine oder Vitamin A, die Bioverfügbarkeit von Eisen verbessert. Antazida und Protonenpumpenhemmer sollten nicht zusammen mit Eisen eingenommen werden, da ein erhöhter Magen-pH-Wert die Eisenauflösung und Eisenresorption verringert.
Verträglichkeit und Nebenwirkungen
Eisenpräparate unterscheiden sich in der Verträglichkeit, welche auch von Patientin zu Patientin verschieden ist. Eine gute Aufklärung über eventuelle Nebenwirkungen und auch genaue Einnahmeempfehlungen können hilfreich sein, die oft mässige Compliance zu verbessern. Die orale Eisenbehandlung ist kostengünstig und wirksam, wenn sie über ausreichend langen Zeitraum durchgeführt wird. Aber mehr als 90 % des verabreichten Eisens, welches nicht im Darm resorbiert wird, verbleibt im Dickdarm und führt dort zu ausgeprägten Veränderungen des Mikrobioms (15). Obwohl der genaue Mechanismus, sowie die Rolle von Eisen bei der Entstehung von Nebenwirkungen ungewiss ist, können grössere Eisendosen möglicherweise die Zusammensetzung des Darmmikrobioms beeinträchtigen, Dysbiose verursachen, das Wachstum von Enteropathogenen fördern und Entzündungen verstärken, wie durch fäkale Calprotectin-Werte gemessen wurde (15, 16). Bei grösseren Eisendosen nimmt der Anteil des resorbierten Eisens (sogenannte fraktionierte Eisenresorption) stark ab, und grosse Mengen nicht resorbierten Eisens können die Produktion von freien Radikalen und die Peroxidation in der Darmschleimhaut erhöhen (17, 18). Dies kann zu gastrointestinalen Nebenwirkungen führen, die häufig und typischerweise dosisabhängig sind (19) und meistens eine Stunde nach Einnahme auftreten. Darüber hinaus kann eine Erhöhung des Eisens im Darm die Abnahme von nützlichen kommensalen Darmbakterien (d.h. Bifidobakterien und Laktobazillen, die wenig oder kein Eisen benötigen) verursachen und die Abundanz von potenziellen Enteropathogenen erhöhen d.h. eine Zunahme von Enterobakterien, einschliesslich eisenbedürftiger enteropathogenen Escherichia coli- Stämme (15, 20).
Dosierung, Häufigkeit der Einnahme und Dauer der Therapie
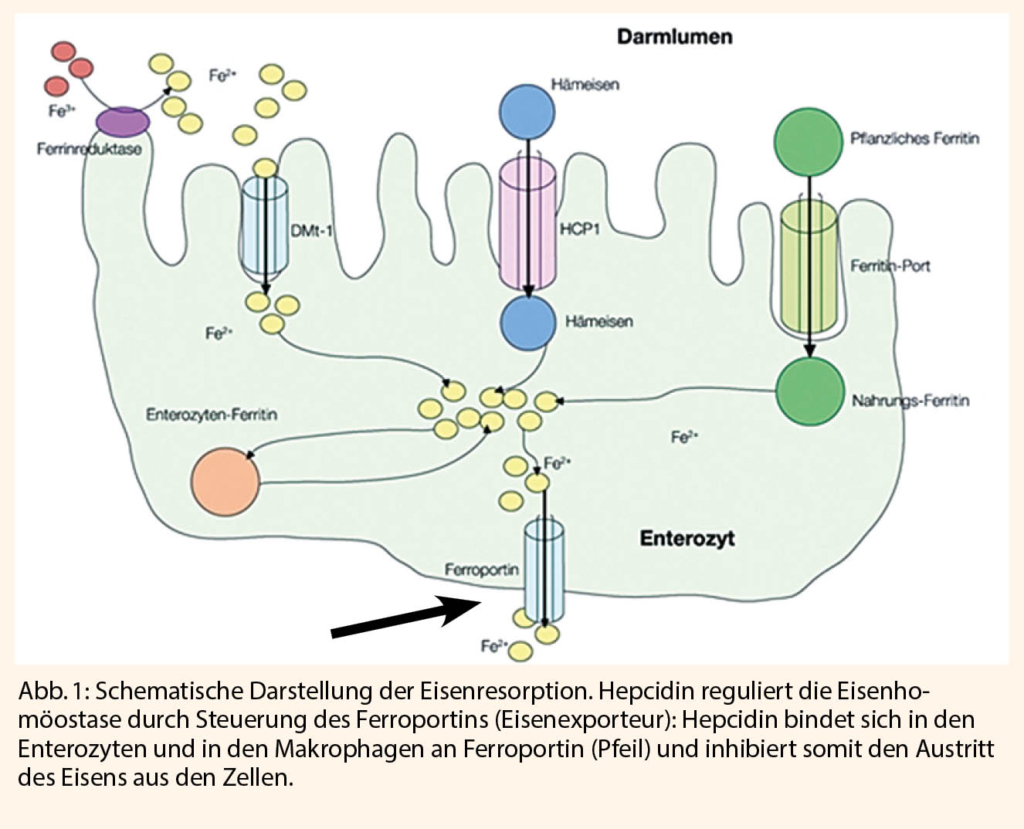
Früher wurde eine orale Dosis von 100-200 mg Eisen pro Tag empfohlen, die in geteilten Dosen von Eisensalzen verabreicht werden sollte (1, 21). Einige Expertengruppen haben 80-200 mg elementares Eisen pro Tag zur Behandlung von Eisenmangel und IDA empfohlen (9, 22), aber neuere Leitlinien deuten darauf hin, dass niedrigere Dosen wirksamer sind und weniger negativen Auswirkungen haben können (8, 23); zum Beispiel empfehlen neuere britische Leitlinien 40-80 mg Eisen Morgens als Eisensalz (24). Ein bereits etablierter grosser Fortschritt in der oralen Eisentherapie, der sich aus der Entdeckung von Hepcidin ergibt, bezieht sich auf das Verabreichungsschema. Hepcidin, das von der Leber produzierte Peptidhormon, ist ein wichtiger Regulator der Eisenhomöostase. Eine abnormale Hepcidin-Produktion hat sich als Ursache für diverse Eisenstörungen erwiesen. Hepcidin-Mangel führt zu einer Eisenüberladung und eisenhaltigen Anämien, während ein Hepcidin-Überschuss die Entwicklung einer Eisenmangelanämie bei entzündlichen Erkrankungen, Infektionen, einigen Neoplasien und chronischen Nierenerkrankungen verursacht. Obwohl die WHO eine intermittierende Eisensupplementierung empfohlen hat (25) und eine 5-6 Tage andauernde Schleimhautblockade in den Enterozyten durch die Erhöhung von Hepcidin vorgeschlagen hat (Abbildung 1), zeigen neue Daten (26, 27), dass 48 Stunden, nicht 5 oder 6 Tage, eine ausreichende Zeitspanne für die Eisenresorption sind, um den Ausgangswert von zirkulierendem Hepcidin zu erreichen. Hepcidin ist während der Schwangerschaft stark supprimiert insbesondere bei Frauen mit IDA.
Aber auch wenn bei einem Eisenmangel und einer IDA die hepatische Hepcidin-Expression durch Eisenmangel und Erythropoese stark unterdrückt wird, führt die Einnahme von oralen Eisenpräparaten von ≥ 60 mg Eisen zu einem akuten Hepcidin-Anstieg für 24 Stunden, der aber nach 48 Stunden abklingt (26, 27). Es scheint, dass orale Dosen ≤ 40 mg bei Frauen mit Eisenmangel keinen akuten Anstieg des zirkulierenden Hepcidins auslösen (26). Dies deutet darauf hin, dass das optimale Dosierungsschema zur Maximierung der fraktionierten Eisenabsorption bei Frauen mit Eisenmangel und milder IDA darin besteht, täglich entweder eine Dosis ≤ 40 mg oder abwechselnd – jeden zweiten Tag – eine Dosis ≥ 60 mg zu verabreichen (8, 26-28). Es gibt einen zirkadianen Anstieg des zirkulierenden Hepcidins über den Tag, der durch die morgendliche Dosis verstärkt wird (26). Aus diesem Grund sollten nach einer morgendlichen Dosis keine Dosen am Nachmittag oder Abend gegeben werden und generell sollte eine zweimal tägliche Verabreichung vermieden werden (26). Eine systematische Review hat gezeigt, dass eine intermittierende Supplementierung im Vergleich zur Tagessupplementierung ähnliche Vorteile für die Anämie bringt, jedoch mit wenigen Nebenwirkungen verbunden ist (29). Moretti et al. könnten (26, 27) kürzlich folgendes zeigen:
- bei Frauen mit einem Eisenmangel und einer IDA ist die Eisenabsorption bei niedrigeren Eisendosen (40 bis 80 mg) am höchsten
- eine intermittierende Eiseneinnahme (auch bei einer Tagesdosis von 100 bis 200 mg Eisen) – jeden zweiten Tag bei Frauen mit IDA – zeigt eine höhere fraktionelle Eisenresortption, einen besseren Hämoglobinanstieg und eine geringere Inzidenz von gastrointestinalen Nebenwirkungen im Vergleich zur täglichen Eiseneinnahme.
Der Hb-Wert spricht in der Regel schnell auf eine wirksame orale Eisentherapie an, und ein Hb-Anstieg von mindestens 2 g/dl nach 3 Wochen Therapie zeigt ein ausreichendes therapeutisches Ansprechen an. Nach der Normalisierung der Hämoglobinwerte muss die orale Eisentherapie mindestens drei Monate fortgesetzt werden, um die Eisenspeicher vollständig aufzufüllen. Die Wiederauffüllung der Eisenspeicher und die Normalisierung des Ferritins können jedoch 4-6 Monate Behandlung erfordern. Da selbst nach zwei Monaten Behandlung die Adhärenz auf nur 10 bis 32% geschätzt wurde, wird sich diese erwartungsgemäss bei längerer Behandlung wahrscheinlich noch weiter verringern (30).
In der Zukunft kann eine alternative Eisendosierung die Eisenresorption optimieren und Verträglichkeit verbessern, aber es sind noch grössere prospektive Studien erforderlich, um die Auswirkungen auf die Sättigung des Hämoglobins und das Serum Ferritin sowie die Nebenwirkungen auf den Magen-Darm-Trakt zu untersuchen.
Copyright bei Aerzteverlag medinfo AG
FMH Gynäkologie und Geburtshilfe
Oberärztin Frauenklinik
Universitätsspital Basel
Spitalstrasse 21
4031 Basel
gabriela.amstad@usb.ch
FMH Gynäkologie und Geburtshilfe
Universitätsspital Basel
Spitalstrasse 21
4031 Basel
Die Autoren haben keine Interessenkonflikte in Zusammenhang mit diesem Artikel.
◆ Hepcidin ist ein wichtiger Regulator der Eisenhomöostase.
◆ Ein zirkadianer Anstieg des zirkulierenden Hepcidins über den Tag wird durch die morgendliche Einnahme verstärkt; daher sollten nach einer morgendlichen Eiseneinnahme keine weiteren Dosen am Nachmittag oder Abend gegeben werden.
◆ Orale Eisendosen ≥ 60 mg lösen bei nicht-anämischen Frauen mit einem Eisenmangel und ≥ 100 mg bei Frauen mit einer IDA einen Anstieg des zirkulierenden Hepcidins aus, der 24 Stunden nach der Einnahme anhält, aber nach 48 Stunden wieder abklingt. Dies deutet darauf hin, dass das optimale Dosierungsschema bei Frauen mit Eisenmangel, leichter und mittelschweren IDA darin besteht, täglich eine Dosis von ≤ 40 mg zu verabreichen oder abwechselnd Dosen (jeden zweiten Tag) von ≥ 60 mg zu verabreichen.
◆ Da die fraktionierte Eisenresorption mit steigender Eisendosis stark abnimmt und nicht resorbiertes Eisen eine negative Auswirkung auf den Darm haben kann, können niedrigere Dosen besser vertragen werden und die Compliance verbessern.
◆ Die Resorption von oralem Eisen, insbesondere bei der Einnahme mit Mahlzeiten, wird erhöht, wenn es mit Ascorbinsäure in einem molaren Verhältnis von ≥ 2:1 zu Eisen verabreicht wird, d. h. etwa 6 mg Ascorbinsäure für 1 mg Eisen.
Messages à retenir
◆ L’hepcidine est un régulateur important de l’homéostase du fer.
◆ Une montée circadienne de l’hepcidine circulante est renforcée par une ingestion matinale de fer. Pour cette raison on devrait s’abstenir de redonner une autre dose de fer dans l’après-midi ou le soir.
◆ Une prise orale de fer ≥ 60 mg provoque chez les femmes qui manquent de fer mais qui ne sont pas anémiques une augmentation de l’hepcidine circulante qui persiste pendant 24 heures et disparaît après 48 heures. Le même phénomène s’observe avec une prise
de ≥ 100 mg de fer en présence d’une anémie ferriprive (IDA). Ceci suggère que le dosage optimal pour une femme avec manque de fer ou avec IDA légère ou modérée serait d’administrer chaque matin ≤ 40 mg de fer ou tous les deux jours ≥ 60 mg.
◆ Vu que la fraction résorbée du fer diminue fortement avec l’augmentation de la dose et que le fer non-résorbé peut exercer un effet négatif au niveau intestinal, de petites doses sont mieux tolérées et peuvent améliorer la compliance.
◆ La résorption de fer administré par voie orale, surtout en cas de prise pendant un repas, est améliorée par l’adjonction d’acide ascorbique (Vit C) dans un ratio de ≥ 2:1, soit env. 6 mg de Vit C pour 1 mg
de fer.
1. Camaschella C. Iron-Deficiency Anemia. N Engl J Med. 2015;373(5):485-6.
2. Muñoz M, Gómez-Ramírez S, Besser M, Pavía J, Gomollón F, Liumbruno GM, et al. Current misconceptions in diagnosis and management of iron deficiency. Blood Transfus. 2017;15(5):422-37.
3. Girelli D, Ugolini S, Busti F, Marchi G, Castagna A. Modern iron replacement therapy: clinical and pathophysiological insights. Int J Hematol. 2018;107(1):16-30.
4. Santiago P. Ferrous versus ferric oral iron formulations for the treatment of iron deficiency: a clinical overview. ScientificWorldJournal. 2012;2012:846824.
5. Bothwell TH, Pirzio-Biroli G, Finch CA. Iron absorption. I. Factors influencing absorption. J Lab Clin Med. 1958;51(1):24-36.
6. Gulec S, Anderson GJ, Collins JF. Mechanistic and regulatory aspects of intestinal iron absorption. Am J Physiol Gastrointest Liver Physiol. 2014;307(4):G397-409.
7. Sangkhae V, Nemeth E. Regulation of the Iron Homeostatic Hormone Hepcidin. Adv Nutr. 2017;8(1):126-36.
8. Stoffel NU, von Siebenthal HK, Moretti D, Zimmermann MB. Oral iron supplementation in iron-deficient women: How much and how often? Mol Aspects Med. 2020;75:100865.
9. Goddard AF, James MW, McIntyre AS, Scott BB. Guidelines for the management of iron deficiency anaemia. Gut. 2011;60(10):1309-16.
10. Peyrin-Biroulet L, Williet N, Cacoub P. Guidelines on the diagnosis and treatment of iron deficiency across indications: a systematic review. Am J Clin Nutr. 2015;102(6):1585-94.
11. Jacobs P, Wood L, Bird AR. Erythrocytes: Better Tolerance of Iron Polymaltose Complex Compared with Ferrous Sulphate in the Treatment of Anaemia. Hematology. 2000;5(1):77-83.
12. Olivares M, Pizarro F, Ruz M, de Romaña DL. Acute inhibition of iron bioavailability by zinc: studies in humans. Biometals. 2012;25(4):657-64.
13. Teucher B, Olivares M, Cori H. Enhancers of iron absorption: ascorbic acid and other organic acids. Int J Vitam Nutr Res. 2004;74(6):403-19.
14. Paganini D, Uyoga MA, Cercamondi CI, Moretti D, Mwasi E, Schwab C, et al. Consumption of galacto-oligosaccharides increases iron absorption from a micronutrient powder containing ferrous fumarate and sodium iron EDTA: a stable-isotope study in Kenyan infants. Am J Clin Nutr. 2017;106(4):1020-31.
15. Jaeggi T, Kortman GA, Moretti D, Chassard C, Holding P, Dostal A, et al. Iron fortification adversely affects the gut microbiome, increases pathogen abundance and induces intestinal inflammation in Kenyan infants. Gut. 2015;64(5):731-42.
16. Zimmermann MB, Chassard C, Rohner F, N’Goran E K, Nindjin C, Dostal A, et al. The effects of iron fortification on the gut microbiota in African children: a randomized controlled trial in Cote d’Ivoire. Am J Clin Nutr. 2010;92(6):1406-15.
17. Lund EK, Fairweather-Tait SJ, Wharf SG, Johnson IT. Chronic exposure to high levels of dietary iron fortification increases lipid peroxidation in the mucosa of the rat large intestine. J Nutr. 2001;131(11):2928-31.
18. Lund EK, Wharf SG, Fairweather-Tait SJ, Johnson IT. Oral ferrous sulfate supplements increase the free radical-generating capacity of feces from healthy volunteers. Am J Clin Nutr. 1999;69(2):250-5.
19. Rimon E, Kagansky N, Kagansky M, Mechnick L, Mashiah T, Namir M, et al. Are we giving too much iron? Low-dose iron therapy is effective in octogenarians. Am J Med. 2005;118(10):1142-7.
20. Paganini D, Uyoga MA, Kortman GAM, Cercamondi CI, Moretti D, Barth-Jaeggi T, et al. Prebiotic galacto-oligosaccharides mitigate the adverse effects of iron fortification on the gut microbiome: a randomised controlled study in Kenyan infants. Gut. 2017;66(11):1956-67.
21. Pasricha SR, Tye-Din J, Muckenthaler MU, Swinkels DW. Iron deficiency. Lancet. 2021;397(10270):233-48.
22. Pavord S, Myers B, Robinson S, Allard S, Strong J, Oppenheimer C. UK guidelines on the management of iron deficiency in pregnancy. Br J Haematol. 2012;156(5):588-600.
23. Camaschella C. Iron deficiency. Blood. 2019;133(1):30-9.
24. Pavord S, Daru J, Prasannan N, Robinson S, Stanworth S, Girling J. UK guidelines on the management of iron deficiency in pregnancy. Br J Haematol. 2020;188(6):819-30.
25. WHO. Intermittent Iron and Folic Acid Sopplementation in Menstruating Women. World Health Organization. 2011;Geneva.
26. Moretti D, Goede JS, Zeder C, Jiskra M, Chatzinakou V, Tjalsma H, et al. Oral iron supplements increase hepcidin and decrease iron absorption from daily or twice-daily doses in iron-depleted young women. Blood. 2015;126(17):1981-9.
27. Stoffel NU, Zeder C, Brittenham GM, Moretti D, Zimmermann MB. Iron absorption from supplements is greater with alternate day than with consecutive day dosing in iron-deficient anemic women. Haematologica. 2020;105(5):1232-9.
28. Stoffel NU, Cercamondi CI, Brittenham G, Zeder C, Geurts-Moespot AJ, Swinkels DW, et al. Iron absorption from oral iron supplements given on consecutive versus alternate days and as single morning doses versus twice-daily split dosing in iron-depleted women: two open-label, randomised controlled trials. Lancet Haematol. 2017;4(11):e524-e33.
29. Fernández-Gaxiola AC, De-Regil LM. Intermittent iron supplementation for reducing anaemia and its associated impairments in adolescent and adult menstruating women. Cochrane Database Syst Rev. 2019;1(1):Cd009218.
30. Ning S, Zeller MP. Management of iron deficiency. Hematology Am Soc Hematol Educ Program. 2019;2019(1):315-22.
info@gynäkologie
- Vol. 11
- Ausgabe 6
- Dezember 2021