- Osteoporose-Update für die Praxis
Osteoporose ist eine häufige Erkrankung mit einer hohen Morbidität und Mortalität. Deshalb sind Prophylaxe, rechtzeitige Diagnose und Therapie essentiell. Da viele Frauen ihre Gynäkologin als einzige Ärztin aufsuchen, sind die Evaluation der Risikofaktoren und Besprechung präventiver Massnahmen auch wichtige Punkte in der gynäkologischen Vorsorge. An einem exemplarischen Fall sollen in diesem Artikel Indikationen für eine Abklärung und Therapie sowie die präventiven und therapeutischen Möglichkeiten beleuchtet werden.
L’ ostéoporose est une maladie fréquente avec une morbidité et une mortalité élevées. Pour ces raisons, la prophylaxie, le diagnostic et le traitement précoces sont essentiels. Beaucoup de femmes ne vont pour des visites médicales que chez leur gynécologue. Dès lors, l’ évaluation des facteurs de risque et la discussion des mesures préventives doivent faire partie intégrante de la visite chez sa/son gynécologue. En suivant une casuistique exemplaire, le présent article développe les indications nécessaires pour proposer une investigation et une thérapie ciblées et présente les mesures préventives et thérapeutiques possibles.
Frau B., 54-jährig, meldet sich in der Sprechstunde mit der Frage, ob sie an Osteoporose leiden könnte. Kürzlich hat sie sich bei einem Sturz beim Langlaufen in langsamen Tempo eine Radiusfraktur zugezogen und ihre Mutter erlitt mit 75 Jahren eine Schenkelhalsfraktur. Frau B. ist sonst gesund, normalgewichtig und seit 3 Jahren in der Menopause.
Die Indikation für eine Abklärung wird aufgrund des Risikoprofils gestellt
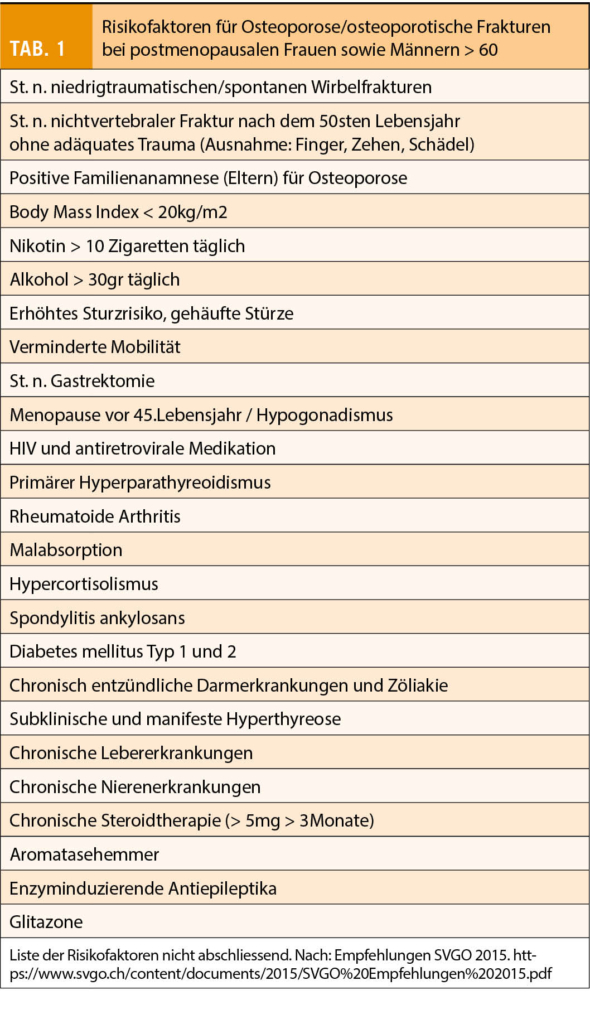
Eine Osteoporosebehandlung wurde lange rein aufgrund des DXA-Wertes (T-Score ≤ -2.5 = Osteoporose, > -2.5/ < 1.0 = Osteopenie und ≥-1.0 = normal) eingeleitet. Das Frakturrisiko hängt jedoch noch von vielen weiteren Faktoren ab, die z.T. unabhängig von der gemessenen Knochendichte die Knochenstabilität beeinträchtigen. Deshalb sollte zur Beurteilung, ob eine Abklärung überhaupt nötig ist, zuerst ein Risikoprofil erstellt werden. Die wichtigsten Risikofaktoren lassen sich leicht erfragen und geben einen Hinweis darauf, ob eine weiterführende Diagnostik angezeigt ist (Tab. 1). Grundsätzlich ist eine DXA-Messung bei spontanen oder niedrigtraumatischen Frakturen und/oder bei Vorliegen von Risikofaktoren sinnvoll.
Anamnestisch können bei Frau B. keine weiteren Risikofaktoren festgestellt werden. Wegen der positiven Familienanamnese und der Fraktur aufgrund eines fraglich adäquaten Traumas ist aber eine DXA-Messung indiziert. Diese zeigt eine Osteoporose der LWS (T-Score -3.0). Die Gesamthüfte und der Schenkelhals weisen beide einen T-Score von -2.0 auf.
Sekundäre Ursachen suchen
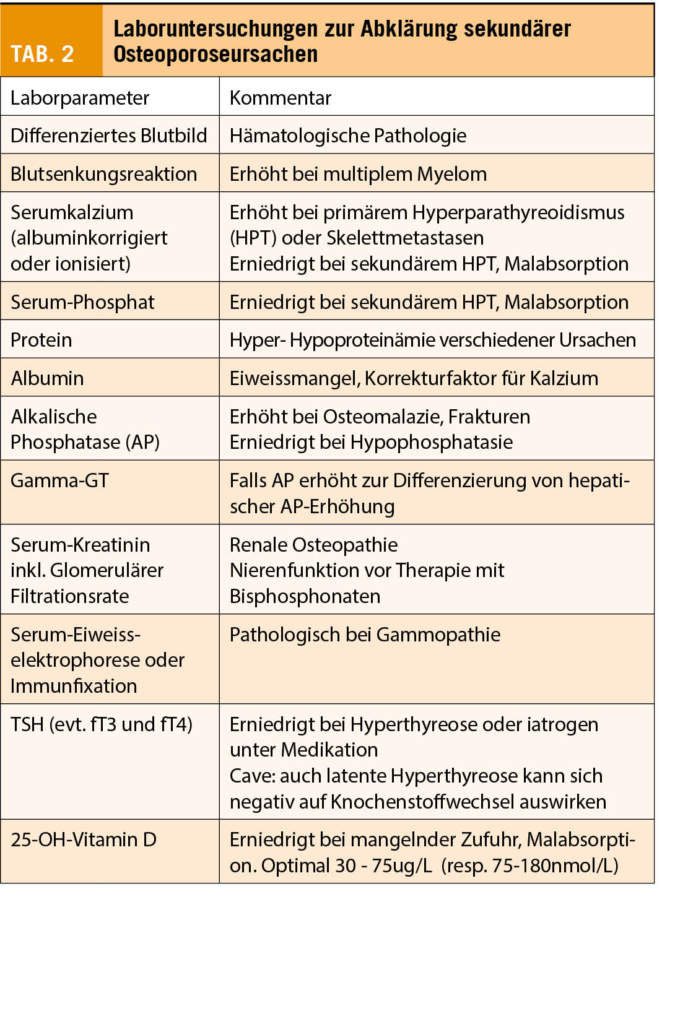
Obwohl oft bereits anamnestisch Gründe für eine Osteoporose ersichtlich sind, sollten bei jeder schweren Osteoporose andere sekundäre Ursachen klinisch und laborchemisch ausgeschlossen werden. Ein Screening umfasst insbesondere einen asymptomatischen Hyperparathyreoidismus, ein Malignom (Myelom) oder eine unerkannte Hyperthyreose. Weitere Screeningparameter finden sich in (Tab. 2). Eine klinische Untersuchung kann Hinweise auf ein erhöhtes Sturzrisiko oder bereits vorhandene Wirbelfrakturen geben. Zudem kann damit eine Hypermobilität als mögliches Zeichen einer Bindegewebsschwäche ausgeschlossen werden.
Die Laboruntersuchungen bei Frau B. sind bis auf einen erniedrigten Vitamin D – Spiegel von 15 ug/L unauffällig. Klinisch finden sich keine Hinweise auf Wirbelfrakturen oder andere wesentliche Erkrankungen.
Prävention für Alle
Die Therapie der Osteoporose stützt sich auf die drei Pfeiler Ernährung, Aktivität und Vermeiden schädlicher Einflüsse und wird, falls nötig, durch spezifische Osteoporose-Medikamente erweitert. Die Basismassnahmen gelten selbstverständlich auch präventiv für gesunde Personen (1-3).
Vitamin D
Nur etwa 10-20% des benötigten Vitamin D kann durch die Nahrung aufgenommen werden, etwa 80-90% werden endogen mittels UVB-Strahlung in der Haut aus 7-Dehydroxycholesterol synthetisiert. In der Schweiz (Mittelland) ist die Sonneneinstrahlung während der Wintermonate jedoch zu tief für eine genügende endogene Synthese. Dies bedeutet, dass im Sommer ein Depot angelegt oder die benötigte Vitamin D-Menge mittels Supplementen zugeführt werden muss. Letzteres ist insbesondere oft bei Menschen über 65 Jahren oder mit dunklem Teint, sowie bei Personen, die sich konsequent vor Sonne schützen müssen, notwendig (verminderte Synthese). Auch Patienten, die aus anderen Gründen für einen Vitamin D – Mangel prädestiniert sind (Malabsorption, enzyminduzierende Medikamente etc.) sollten Vitamin D als Supplement einnehmen. Der Vitamin-Spiegel im Blut kann gut zur Einstellung einer optimalen Versorgung benützt werden: Serumspiegel von 50-75 nmol/L werden empfohlen.
Proteine
Der Mensch benötigt nicht nur für den Aufbau der Muskulatur, sondern auch für viele andere Funktionen Proteine. Von den 21 bekannten Aminosäuren sind mehrere essentiell, d. h. müssen von aussen zugeführt werden. Proteine aus tierischen Quellen enthalten diese essentiellen Aminosäuren konzentrierter, weshalb tierische Proteine als hochwertiger anzusehen sind. Auch Vegetarier können durch Milchprodukte und Eier problemlos den Proteinbedarf decken. Schwieriger wird dies bei veganer Ernährung, da hier der ganze Proteinbedarf aus pflanzlichen Quellen kommt.
Der Eiweissbedarf beträgt ca. 1 gr/kg Körpergewicht, in der Schwangerschaft und Stillzeit sowie bei Jugendlichen und Sportlern eher etwas mehr.
Kalzium
Die Kalziumzufuhr pro Tag sollte zwischen 800-1200 mg betragen und vorzugsweise über die Nahrung erfolgen. Falls die erforderliche Menge nicht erreicht wird, können zusätzlich Kalzium-Supplemente (mit Vitamin D) gegeben werden. Nachdem vor einigen Jahren ein schädlicher Einfluss von Kalziumsupplementen auf das kardiovaskuläre System diskutiert wurde, scheint gemäss neueren Metaanalysen das Risiko nicht oder nur unwesentlich erhöht zu sein (4, 5). Trotzdem ist die nutritive Zufuhr sicher physiologischer als die Einnahme von Supplementen. Eine Schätzung der nutritiven Kalziumzufuhr kann beispielsweise mittels Online-Kalziumrechnern erfolgen.
Bewegung
Obwohl körperliche Aktivität nur einen kleinen Einfluss auf die Knochendichte hat, gehört regelmässige körperliche Bewegung zur Prävention. Training führt einerseits zu einer Sturzprävention, andererseits auch zur Haltungsstabilisierung, was insbesondere für die Wirbelsäule essentiell ist. Geeignete Sportarten sind achsenskelettbelastend (Hüpfen, Tanzen, Springseilen etc.), fördern Koordination und Gleichgewicht (Tanz, Spiele, gezielte Gymnastikübungen) und sollten möglichst regelmässig in den Alltag eingeplant werden können (6).
Vermeiden schädlicher Einflüsse
Wichtigste vermeidbare Noxen sind ein Nikotinabusus (gut belegt ist der schädliche Effekt von über 10 Zigaretten täglich) und ein erhöhter Alkoholkonsum (> 20-30 gr reinen Alkohol täglich). Vor allem bei jungen Frauen ist ein erniedrigter BMI (< 20 kg/m2) manchmal die Ursache einer erniedrigten Knochendichte und geht oft mit einer Amenorrhoe einher, was zusätzlich einen negativen Einfluss auf die Knochen hat. Bei knochentoxischen Medikamenten (Steroide, Aromatasehemmer, SSRI, Antiepileptika etc) ist es wichtig, die Indikation regelmässig zu überprüfen, resp. eine möglichst geringe Dosis einzusetzen.
Die Berechnung der nutritiven Kalziumaufnahme ergibt bei Frau B. ca. 650 mg täglich und eine etwa genügende Proteinzufuhr. Sie geht einmal wöchentlich schwimmen. Ein Nikotinabusus wird verneint, der Alkoholkonsum beträgt 1-2 Gläser Wein am Wochenende. Bei heller, sommersprossiger Haut trägt die Patientin konsequent Sonnenschutzcrème auf.
Aufgrund der geringen Kalziumzufuhr und des tiefen Vitamin D-Spiegels bei wahrscheinlich deutlich ungenügender endogener Synthese (Sonnencreme verhindert die Vitamin D-Synthese) wird der Patientin die Einnahme eines kombinierten Kalzium/Vitamin D-Präparates mit 500 mg Kalzium und 800 IU Vitamin D empfohlen. Die Eiweisszufuhr ist hingegen genügend. Ausserdem wird ihr zu einer zusätzlichen achsenskelettbelastenden Sportart geraten, da Schwimmen auf den Knochen keinen nennenswerten positiven Einfluss hat.
Spezifische Osteoporosetherapie bei hohem Risiko
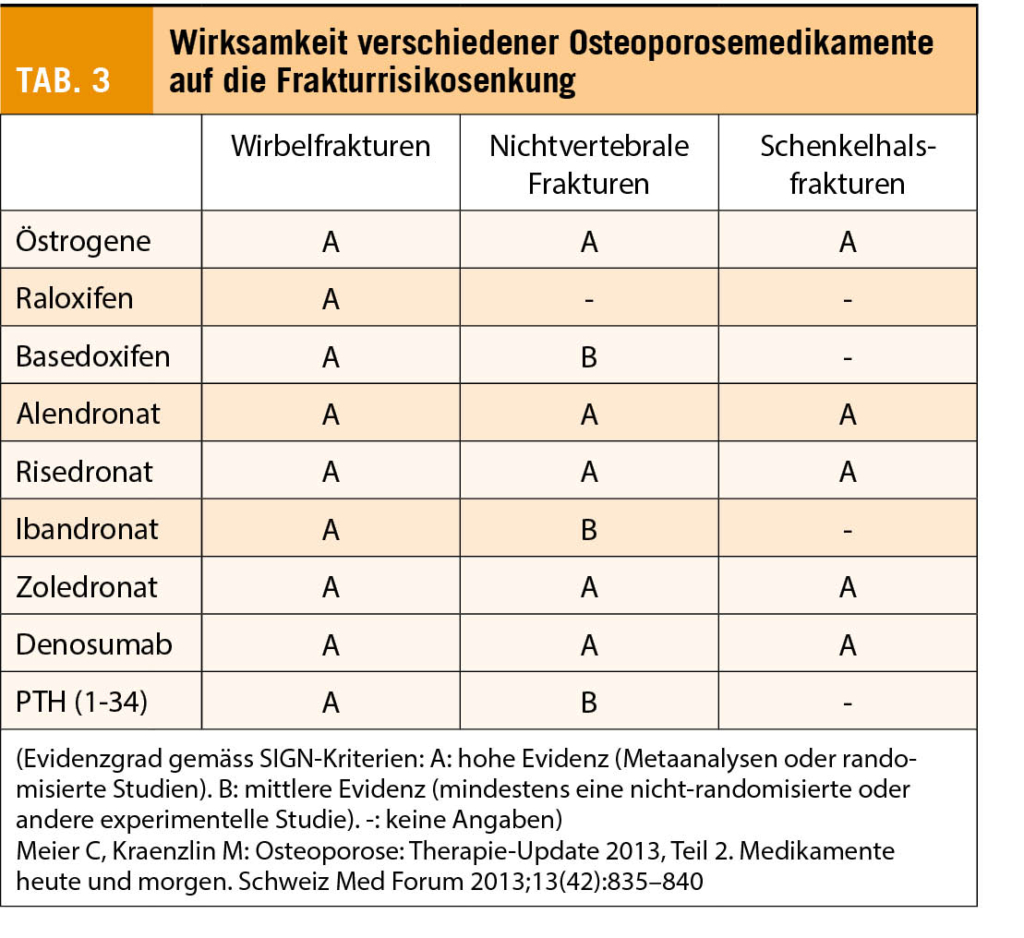
Bei hohem Frakturrisiko sollte zusätzlich zu den Basismassnahmen eine spezifische medikamentöse Therapie erfolgen. Ab welchem Risiko eine Therapie indiziert ist, wird unterschiedlich diskutiert. Die SVGO empfiehlt ein alters- und risikoadaptiertes Schema, die Schweizerische Gesellschaft für Rheumatologie setzt die Therapieschwelle fix bei einem 10-Jahres-Frakturrisiko von 25% an und in Deutschland hängt die Therapieindikation vom T-Score, Lebensalter, Geschlecht und Risikofaktoren ab (1, 3, 7). Therapeutisch wird zwischen antiresorptiv und osteoanabol wirkenden Substanzen unterschieden. Je nach Studienlage ist die Wirksamkeit der einzelnen Substanzen bezüglich Knochendichte, bzw. Reduktion des Frakturrisikos unterschiedlich gut belegt (Tab. 3).
Menopausale Hormontherapie (MHT)
Bei Frauen mit Osteoporose oder Osteopenie kurz nach der Menopause ist eine MHT eine gute Option, v.a. wenn gleichzeitig perimenopausale Symptome vorliegen. Die Hormontherapie ist bezüglich Frakturrisikoreduktion sehr gut belegt und kann – unter entsprechenden Kontrollen – mehrere Jahre eingesetzt werden. Im Gegensatz zu Bisphosphonaten und Denosumab besteht auch bei längerer Behandlung kein Risiko für Kieferknochennekrosen oder atypische Femurfrakturen.
Selektive Östrogenrezeptor-Antagonisten (SERM)
Bei Frauen einige Jahre nach der Menopause und mit vorwiegender Osteoporose des trabekulären Knochens (LWS) eignet sich als Einstiegstherapie ein SERM, was zusätzlich die Inzidenz Hormonrezeptor-positiver Mammakarzinome reduziert. Dies wird allerdings – wie bei der MHT – mit einem leicht erhöhten Thromboserisiko erkauft. Kieferknochennekrosen und atypische Femurfrakturen wurden hingegen unter SERM ebenfalls nicht beobachtet.
Bisphosphonate (BP)
BP haben den Vorteil, dass sie kostengünstig und in verschiedenen galenischen Formen erhältlich sind und in den meisten Fällen auch eine gut belegte Wirksamkeit auf das Frakturrisiko haben. Je nach Patientencharakteristika kann die Therapie angepasst werden. Perorale Formen sollten nur bei Patienten mit guter Compliance und ohne begleitende gastrointestinale Problematik eingesetzt werden, da auch bei korrekter Einnahme nur 1-2% der Substanz resorbiert werden. Bereits kleine Einnahmefehler, bzw. mangelnde Adhärenz vermindern die Wirksamkeit. Im Gegensatz dazu sind intravenöse Formen weniger Compliance-abhängig und haben eine hohe Bioverfügbarkeit. Bei allen Bisphosphonaten, aber insbesondere bei den intravenösen Formen können jedoch als Nebenwirkungen Kieferknochennekrosen (Osteonecrosis of the Jaw, ONJ) oder atypische Femurfrakturen (AFF) auftreten. Beide Nebenwirkungen sind allerdings äusserst selten. Trotzdem wird wegen des Anstiegs des Nebenwirkungsrisikos mit zunehmender Therapiedauer und wegen der möglichen Plateaubildung bezüglich Knochendichtezunahme eine Begrenzung der Behandlungsdauer auf 4-6 Jahre diskutiert. Allerdings sollte das Risiko der Nebenwirkungen gegenüber demjenigen von osteoporotischen Frakturen sorgfältig abgewogen und die Therapiedauer allenfalls verlängert werden. Als subjektiv störende Nebenwirkung kann es, insbesondere nach Verabreichung von Zoledronat, zu grippeartigen Symptomen kommen, die mehrere Tage anhalten können.
Denosumab
Die Wirksamkeit und Verträglichkeit des RANKL-Antikörpers Denosumab wurde in Studien gut dokumentiert, so dass sich das Medikament grundsätzlich für viele Patienten eignet. Allerdings kann es nach Absetzen von Denosumab innert weniger Wochen zu einem massiven Knochendichteverlust und (multiplen) Wirbelfrakturen kommen (Rebound-Effekt). Eine Verlängerung des Injektionsintervalls, resp. das Sistieren der Therapie mit Denosumab ohne Nachfolgebehandlung ist deshalb kontraindiziert.
Osteoanabole Substanzen
Aktuell ist in der Schweiz nur eine osteoanabole Substanz zugelassen: Teriparatid (PTH), ein in E. coli mittels rekombinanter DNA-Technologie hergestelltes und mit der 34-N-terminalen Aminosäurensequenz identisches humanes Parathormon.
Teriparatid (PTH)
PTH hat in der Schweiz eine strikte Limitation (neue Wirbelfrakturen unter adäquater antiresorptiver Therapie, steroidinduzierte Osteoporose bei mangelnder Wirksamkeit oder Unverträglichkeit von Antiresorptiva) und ist auf eine Behandlungsdauer von 2 Jahren beschränkt.
Das 10-Jahresrisiko beträgt bei Frau B. 25%, was gemäss allen Guidelines eine spezifische Osteoporosetherapie erfordert. Teriparatid kommt als erste Therapie ohne Vorbehandlung nicht in Frage. Denosumab erscheint bei noch junger Patientin aktuell eher ungeeignet, da die Therapie nicht lebenslang durchgeführt werden soll und die optimale Anschlussbehandlung noch nicht sicher ist. Alle anderen Therapieoptionen kämen grundsätzlich in Frage. Bei noch junger, sonst gesunder Patientin ohne Magenprobleme und mit reiner LWS-Osteoporose wird mit der Patientin ein SERM oder ein orales Bisphosphonat diskutiert. Die Patientin favorisiert schliesslich die Behandlung mit einem SERM. Eine DXA-Nachkontrolle wird in 2 Jahren vereinbart.
Copyright bei Aerzteverlag medinfo AG
Leiterin OsteoporoseZentrum
Klinik für Rheumatologie
UniversitätsSpital Zürich
Rämistrasse 100
8091 Zürich
diana.frey@usz.ch
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Beitrag deklariert.
- Das anamnestische Erfassen von Risikofaktoren für eine Osteoporose gehört zu jeder Vorsorge.
- Bei Vorhandensein klinischer Risikofaktoren sollte eine Knochendichtemessung erfolgen.
- Vor Beginn einer Osteoporosetherapie müssen sekundäre Ursachen der Osteoporose klinisch und mittels Laboruntersuchungen gesucht werden.
- Die Therapieindikation wird aufgrund der Knochendichte, weiterer Risikofaktoren und des absoluten Frakturrisikos gestellt.
- Die Wahl des geeigneten Therapeutikums hängt sowohl von den Patientencharakteristika wie von den Medikamenteneigenschaften ab und wird deshalb individuell mit jeder Patientin festgelegt.
Messages à retenir
- L’ anamnèse ciblée à la recherche de facteurs de risque pour l’ ostéoporose doit faire partie intégrante de chaque visite de dépistage.
- En présence de facteurs de risque cliniques, une densitométrie osseuse devrait se faire.
- Avant d’ initier un traitement spécifique, des causes d’ une ostéoporose secondaire doivent être recherchées par l’ examen clinique et des analyses de laboratoire.
- L’ indication pour le traitement est posée en fonction de la densité osseuse, de la présence de facteurs de risque supplémentaires et du risque fracturaire absolu.
- Le choix du traitement adapté dépend aussi bien des caractéristiques de la patiente que de celles des médicaments. Il est défini avec chaque patiente individuellement.
1. Leitlinien des Dachverbands Osteologie DVO 2017. https://dv-osteologie.org/osteoporose-leitlinien
2. Ernährungsempfehlungen des BLV https://www.blv.admin.ch/blv/de/home/lebensmittel-und-ernaehrung/ernaehrung/empfehlungen-informationen/naehrstoffe/hauptnaehrstoffe.html
3. Empfehlungen der SVGO 2015 http://www.svgo.ch
4. Harvey N, D’Angelo S, Paccou J et al: Calcium and Vitamin D Supplementation are not associated with risk of incident ischemic cardiac events or death: Findings from the UK Biobank Cohort. JBMR 2018 May. Vol 33, No. 5.803-811
5. Bolland M, Avenell A, Baron J et al: Effect of calcium supplements on risk of myocardial infarction and cardiovascular events: meta-analysis.
BMJ. 2010 Jul 29; 341:c3691
6. Howe TE, Shea B, Dawson LJ et al: Exercise for preventing and treating osteoporosis in postmenopausal women. Cochrane Database Syst Rev. 2011 Jul 6 (7)
7. Osteoporose Plattform der Schweizerischen Gesellschaft für Rheumatologie http://www.osteorheuma.ch
info@gynäkologie
- Vol. 10
- Ausgabe 5
- Oktober 2020