- Physiotherapie und Pessar als empfohlene Firstline-Therapie
Der folgende Artikel soll die komplexe Thematik der Deszensusbeschwerden näherbringen. Zu den aufgegriffenen Punkten gehören der Zusammenhang zwischen Geburt und Beckenboden, Risikofaktoren für die Entwicklung eines Genitaldeszensus und die heute vorhandenen therapeutischen Optionen, allen voran die Pessartherapie. Obschon das Augenmerk auf die konservativen Therapieformen gerichtet wird, soll auch kurz die Problematik der Deszensuschirurgie gestreift werden.
L’article présenté a pour but de faire mieux connaître au lecteur estimé la problématique complexe des troubles observés en cas de descente d’organes gynécologiques. Les répercussions de l’accouchement sur le plancher pelvien, les facteurs de risque pour le développement d‘une descente d’organe ainsi que les options thérapeutiques actuelles seront évoqués, en premier lieu le traitement par pessaire. Bien que l’accent soit mis sur les traitements conservateurs, la problématique liée aux procédés chirurgicaux du prolapsus sera également brièvement discutée.
Descensus genitalis in nuce
Sogar die Bibel hob die Problematik des Gebärens bei uns Menschen hervor: «mit Schmerzen sollst du Kinder gebären» (Genesis 3:16). Wir haben früh begriffen, dass sich unsere Geburt von derjenigen in der Tierwelt unterscheidet. Nur wir Menschen benötigen eine Hebamme zur Geburt. Zeuge der Konsequenzen der vaginalen Geburt auf den weiblichen Beckenboden aus der Antike ist das Viesenhäuser Tonpessar aus der vorrömischen Eisenzeit in Deutschland (1). Der Beckenboden bildet den anatomischen Abschluss des Bauchraumes und wird naturbedingt bei der Frau durch drei anatomische Lücken unterbrochen, nämlich für Urethra, Rektum und Vagina (sog. Hiatus urogenitalis). Damit sind die physiologischen Funktionen Miktion, Defäkation und Reproduktion gewährleistet.
Komplexe Geburtsmechanik
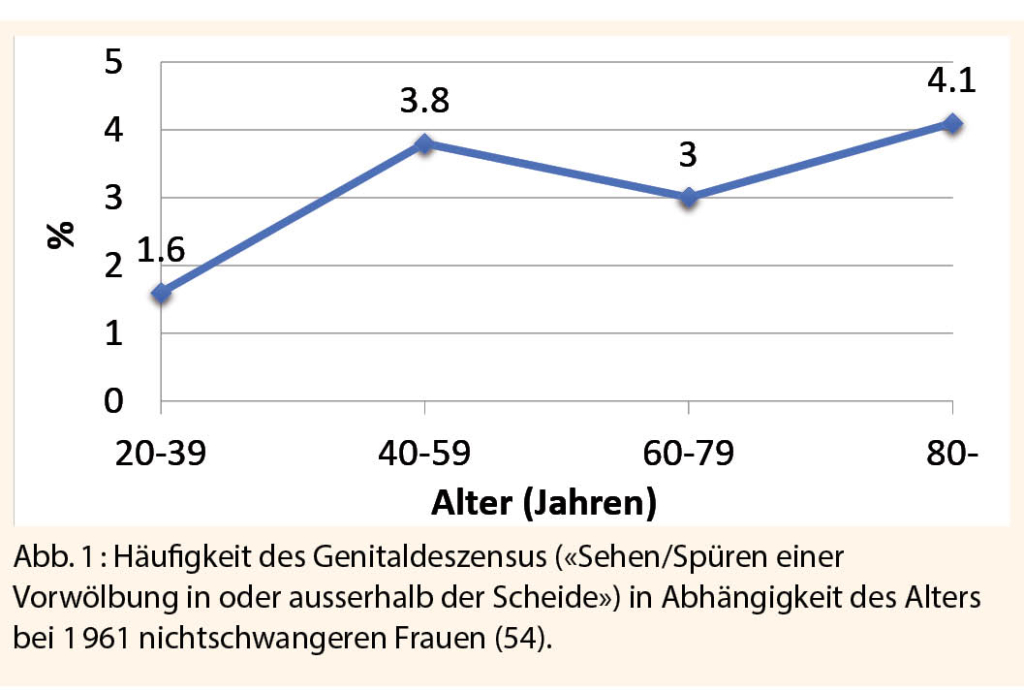
Heute verstehen wir, dass nicht die Einverleibung verbotener Früchte, sondern die komplexe Geburtsmechanik beim Menschen den Beckenboden akut überdehnt und Schmerzen auslöst. Das evolutiv eng gewordene mütterliche Becken ermöglichte den aufrechten Gang, führte aber bei gleichzeitig grösser gewordenem Gehirn und kindlichem Köpfchen zu einem ungünstigen Kopf-Becken-Verhältnis. Ein grosses Kind, enge mütterliche innerliche Beckenmasse, aber z. B. auch die geburtsmechanisch ungünstige hintere Hinterhauptslage erschweren den Geburtsvorgang, verlängern die Austreibungsphase und traumatisieren damit den mütterlichen Beckenboden zusätzlich. Auf seinem Weg durch den Geburtskanal überdehnt und komprimiert das kindliche Köpfchen Bindegewebe, Muskulatur und Nerven des Beckenbodens; Muskelabrisse und Nervenschäden sind akute Folgen (2-7). Höheres mütterliches Alter, Forzepsentbindung und Dammschnitt sind weitere geburtshilfliche Risikofaktoren (8, 9). Langfristig kommt es zur Belastungsinkontinenz in 25 bis 45%, Stuhlinkontinenz in 11 bis 15% und Genitaldeszensus in 5 bis 15% (Abb. 1) (10-14).
Isolierter oder kombinierter Genitaldeszensus
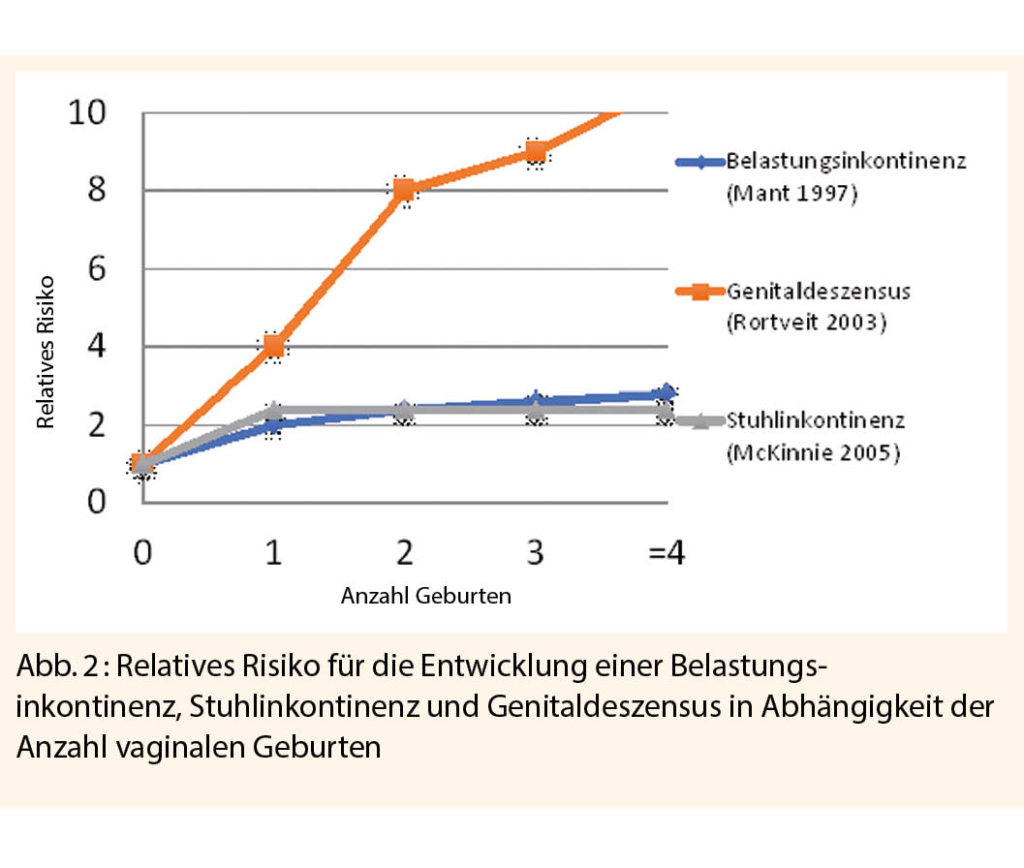
Von Genitaldeszensus sprechen wir bei einer Senkung der vorderen Vaginalwand mit Tiefertreten der Blase (Zystozele), der hinteren Vaginalwand mit dem Rektum (Rektozele) oder des Apex mit dem Uterus (Deszensus uteri) bzw. Vaginalstumpf bei Zustand nach Hysterektomie. Der Deszensus tritt isoliert oder häufiger kombiniert auf. Während das vaginale Gebären das Risiko für die Entwicklung einer Urin- oder Stuhlinkontinenz verdoppelt, erhöht sich das Risiko für einen Genitaldeszensus zusätzlich mit jeder weiteren vaginalen Geburt (Abb. 2). Das Lebenszeitrisiko für die Entwicklung eines Genitaldeszensus beträgt 30 bis 50% und für eine Operation wegen Beckenbodenschwäche 11 bis 19% (15-17). Mit steigender Lebenserwartung steigt die Inzidenz des Genitaldeszensus mit entsprechenden ökonomischen Folgen (18). Tatsächlich kann aber ein Genitaldeszensus auch bei nulliparen Frauen auftreten (19, 20). Chronische Belastung des Beckenbodens durch chronische Lungenerkrankungen oder Husten, chronische Obstipation, Adipositas oder Alltagsbelastungen in Beruf oder Haushalt wie Heben schwerer Lasten sowie eine genetische Prädisposition wurden als weitere Risikofaktoren ausgemacht (8).
Problematik der Deszensusbehandlung
Den kuriosen antiken und mittelalterlichen Therapiemodalitäten wie die Beräucherung oder das in Schrecken Versetzen des prolabierten Uterus mit glühenden Eisen zwecks Reposition desselben folgten nicht minder haarsträubende Massnahmen wie das Aufhängen der Betroffenen an den Beinen oder als Ultima Ratio die vaginale Hysterektomie, die erstmalig Soranus von Ephesus im 2. Jahrhundert zur Therapie eines gangränösen prolabierten Uterus durchgeführt hatte (21, 22). Der Leser erahnt, wie nutzlos die erstgenannten Verfahren sind, die Suspension nur im Moment wirkt und die vaginale Hysterektomie, sofern komplikationslos durchgeführt, den Deszensus unzureichend behandelt.
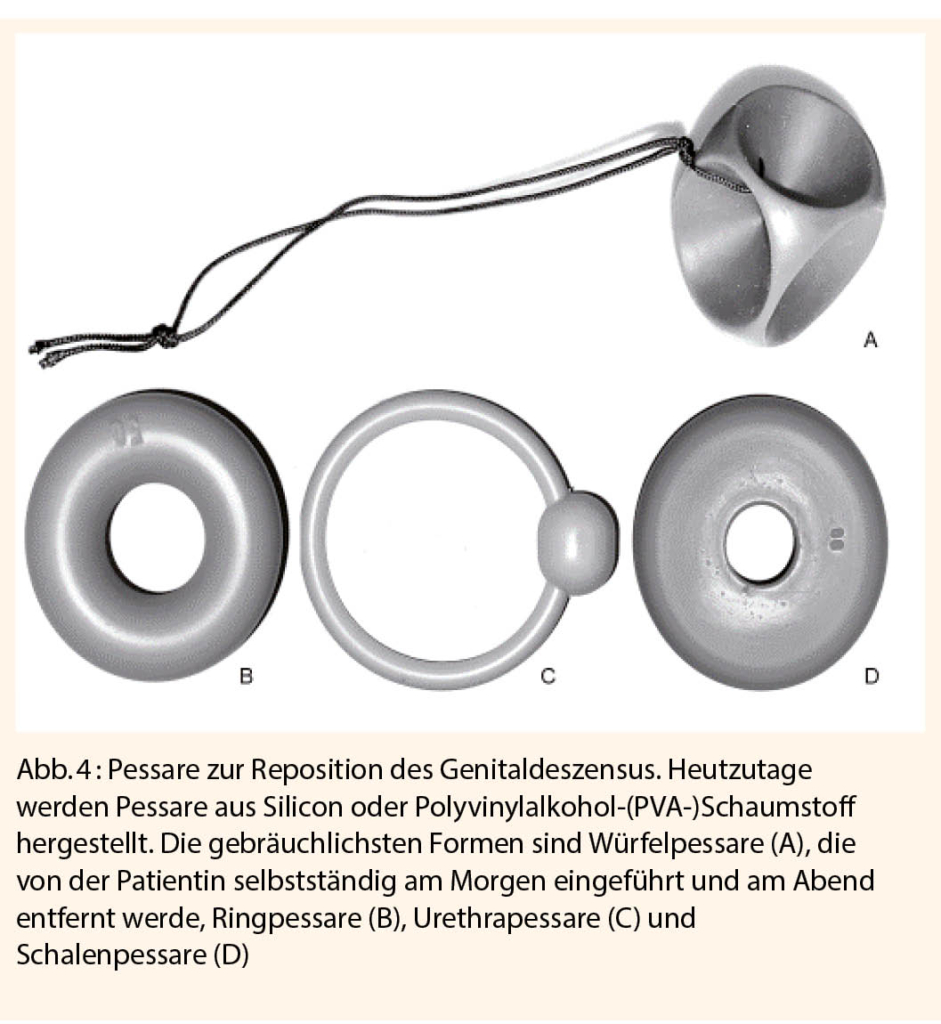
Vaginalpessar seit der Antike
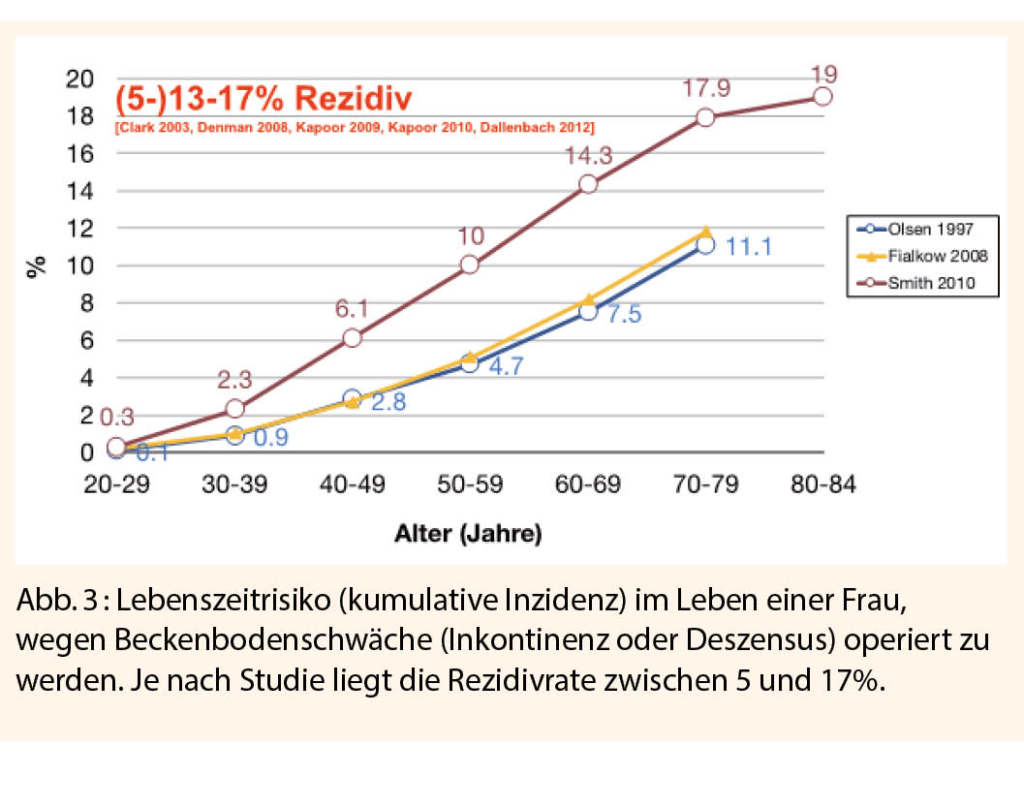
Doch eine Therapieform ist seit der Antike geblieben: Ob Hippokrates’ Granatapfel, in Honig getränkte oder von Wachs überzogene Wollknäuel, ob aus Keramik, Bronze, Gold, Porzellan, Glas, Kautschuk, Holz, Kork, Gips oder wie heutzutage als modernes Medizinprodukt aus dem weichen, gewebeverträglichen, haltbaren, gegen Gerüche resistenten und die vaginale Flüssigkeit abweisende Silicon oder Polyvinylalkohol-(PVA-)Schaumstoff, das Wirkprinzip des Vaginalpessars (griechisch πεσσόν für Stöpsel und lateinisch pessarium für Gebärmutterzapfen) bleibt dasselbe, nämlich die Elevation der tiefergetretenen, prolabierten Beckenorgane (Abb. 4) (21, 22). Allerdings muss dieses Hilfsmittel ständig getragen werden, um Abhilfe oder Linderung zu verschaffen und wird heutzutage weniger als dauerhafte Lösung angesehen. Seit 1892, als der Schweizer Gynäkologe Paul Zweifel die sakrotuberale Fixation durchführte, werden die chirurgischen Verfahren zur definitiven Behebung des Genitaldeszensus weiterentwickelt (23). Doch auch die moderne Chirurgie ist nicht frei von Komplikationen. Gerade die älteren Frauen sind nicht nur häufiger von Senkungen betroffen, sondern erleiden auch häufiger narkosebedingte kognitive Veränderungen (24, 25). Dazu kommt, dass die Deszensuschirurgie das Problem auch nicht immer vollumfänglich löst. Bei der klassischen Deszensuschirurgie ohne alloplastisches Netz sind Rezidive und Reoperationen je nach Kompartiment in 5 bis 17% beschrieben (Abb. 3) (26-30).
Netzunterstützte vaginale Operationstechniken
Die zur Senkung der Rezidivrate entwickelten und propagierten netzunterstützten vaginalen Operationstechniken erzielen zwar höhere objektive (aber nicht zwingend subjektive) Heilungsraten, dies jedoch zum Preis neuer operationswürdiger Komplikationen wie Blasenläsionen (3.5%), vaginale Netzerosionen (bis 17 %), operative Revisionen von Erosionen (bis 6%) und einer Dyspareunierate bis 17% (31-35). Der Lebensqualität der Betroffenen zuträglich ist dies bestimmt nicht. Es kam, wie es kommen musste: Patientinnen klagten, es kam zu Verurteilungen und Strafzahlungen horrender Summen in den angelsächsischen Ländern, die amerikanische Food and Drug Administration (FDA) warnte im Jahre 2011 vor den Netzen, im Verlauf zogen viele Hersteller ihre Netze vom Markt zurück, und viele angelsächsische Länder untersagten deren Einsatz (36, 37). In der Schweiz werden Netze weiterhin eingesetzt, die Indikation und Situation wird aber differenzierter als in den genannten Ländern betrachtet, zumal allein schon zwischen vaginalen, abdominalen bzw. laparoskopischen Netzen und Inkontinenzschlingen unterschieden wird (31).
Symptome, Schweregrad, Lebensqualität
Ein symptomatischer Genitaldeszensus reduziert die Lebensqualität (38). Die betroffenen Frauen schildern typischerweise ein vaginales Druck- oder Fremdkörpergefühl, das über den Tag zu- und über Nacht bzw. im Liegen abnimmt. Reicht der Deszensus über den Introitus vaginae hinaus, dann scheuern Vaginalwand und Portio an der Unterwäsche, und es treten Ulzerationen und blutiger Fluor auf. Blasenentleerungsstörungen, Restharnbildung, Drangbeschwerden oder Urininkontinenz können durch eine Zystozele bedingt sein, Defäkationsbeschwerden, Obstipation (stool outlet obstruction) oder rektale Schmerzen wiederum können bei Rektozelen auftreten. Der Genitaldeszensus wird mit dem Pelvic-Organ-Prolapse-Quantification-System (POP-Q) zentimetergenau für jedes einzelne Kompartiment (Zystozele, Rektozele und Uterus bzw. Vaginalstumpf) in die Grade 0 bis 4 eingeteilt (39): Grad 0 = kein Deszensus, Grad 1 = maximaler Deszensus bis >1 cm oberhalb des Hymenalsaums, Grad 2 = Deszensus ≤1 cm kranial bis 1 cm kaudal des Hymenalsaums, Grad 3 = Deszensus > 1 cm kaudal des Hymens des Introitus und Grad 4 = Totalprolaps von mindestens Vaginallänge minus 2 cm über Hymenalsaum hinaus. Zwar ist POP-Q ein gutes Instrument zur Quantifizierung eines Deszensus, korreliert aber nur schwach mit den subjektiven Beschwerden. Häufig bleibt ein geringer Deszensus stumm. Nimmt dieser mit der Zeit zu, so kann er schon bei den Graden 1 und 2 mit Blasen-, Darm- und Senkungsbeschwerden assoziiert sein, und die Betroffenen sehen oder spüren eine Vorwölbung (40). Letztlich ist aber der Hymenalsaum kein verlässlicher Grenzwert zur Identifikation von Frauen mit symptomatischem Genitaldeszensus (41).
Abklärung
Die gynäkologische Abklärung beim Genitaldeszensus umfasst die Inspektion des Introitus vaginae und die vaginale Spekulumeinstellung mit separater Beurteilung der vorderen (Zystozele) und hinteren Vaginalwand (Rektozele) sowie von Apex vaginae mit der Portio (Uterus) oder bei Zustand nach Hysterektomie des Vaginalstumpfs. Die genitale Trophik wird anhand des pH-Wertes und der vaginalen Rugierung eruiert: Ein pH-Wert unter 4.5 spricht für eine gute Trophik (z. B. prämenopausal), wohingegen in der Postmenopause bzw. bei Östrogenmangel der Wert auf über 6 ansteigt und die Rugae vaginales verstrichen sind. Mittels Rektalpalpation wird das Ausmass der Rektozele beurteilt und diese von einer Enterozele abgegrenzt. Restharn wird sonografisch anhand der Elipsoid-Formel berechnet: Die Blase wird in zwei Ebenen vermessen (Länge, Breite und Höhe in Zentimeter) und der Restharn durch Multiplikation dieser drei Strecken und den Faktor 0.6 in Milliliter ermittelt. Bei Vorliegen von Blasen- und Miktionsbeschwerden soll auch eine Urinanalyse erfolgen. Ebenfalls ist eine urodynamische Abklärung insbesondere bei Urininkontinenz oder Blasenbeschwerden zu diskutieren.
Konservative Therapieoptionen
Der Genitaldeszensus, der die Patientin weder stört noch Blasen-, Darmbeschwerden oder Ulzerationen verursacht, ist nicht behandlungsbedürftig. Als Folge des bisher Gesagten empfiehlt sich als erster Schritt und insbesondere beim Genitaldeszensus bis Grad 2 das konservative Vorgehen (42). Das «ideale» Vorgehen, ob konservativ oder chirurgisch, wird mit der Patientin individuell geplant. Dabei spielen ihr Alter, die Komorbiditäten, Sexualität und insbesondere ihre Wünsche und Vorstellungen die entscheidende Rolle.
Gewichtsabnahme, Stuhlregulation und Nikotinkarenz
Eine solche reduziert bei übergewichtigen Frauen deren Beschwerden bei Inkontinenz und Genitaldeszensus (43-45). Begleiterkrankungen, die sogar ursächlich für die Beckenbodenschwäche sein können, wie chronische Lungenerkrankungen, Husten oder Obstipation, sollen mittherapiert werden. Gerade die chronische Obstipation kann eine verstärkte Bauchpresse nötig machen und damit eine Rektozele verstärken. Hier sind Beckenbodentraining, ballaststoffreiche Ernährung und Stuhlregulation hilfreich. Eine körperliche chronische (Fehl-)Belastung, z. B. am Arbeitsplatz, ist ebenfalls anzugehen. Eine Nikotinkarenz ist dringend nahezulegen.
Beckenbodenrehabilitation mittels Physiotherapie
Die Beckenbodenrehabilitation mittels Physiotherapie ist eine der grossen Stützen der konservativen Behandlung. Die Patientin lernt, den Beckenboden wiederholt zu kontrahieren, womit dessen Stärke und Effizienz erhöht und der Tonus verbessert wird, was wiederum die Organe des kleinen Beckens besser trägt und stützt (46). Anatomische und subjektive Befunde werden verbessert und Beschwerden gelindert (47-49).
Pessare und Östrogenisierung
Während die bisher genannten Massnahmen – sofern korrekt und konsequent angewendet – langsam greifen, beheben Pessare den Deszensus umgehend, indem sie den Levatorenschenkeln aufsitzen und die Senkung reponieren. Sie können auch als langfristige therapeutische Lösung angewendet werden, sofern die Betroffenen das Pessar korrekt handhaben, diese Therapieform vertragen, keine Ulzerationen auftreten und die Beschwerden damit auch behoben werden. Tatsächlich ist die Compliance bezüglich kontinuierlicher Pessaranwendung – bei allerdings selektionierten Patientinnen – mit 50 bis 80% nach 1 Jahr, 48% nach 5.4 Jahren und 14% nach 7 Jahren gut (50, 51). Es sind die sexuell aktiven Frauen und die über 65-jährigen Frauen, die die Pessaranwendung länger fortsetzen (50).
Zu den Indikationen für die Pessartherapie zählen die fehlende Operabilität wegen relevanter Komorbiditäten, der Rezidivdeszensus, der positive Kinderwunsch oder eine bestehende Schwangerschaft, aber auch der Wunsch der Patientin nach nicht operativer Therapie. Dabei hängt die erfolgreiche Pessaranpassung und -behandlung weder vom betroffenen Kompartiment noch vom Schweregrad des Deszensus ab (50).
Pessare können auch als Überbrückungstherapie bis zur operativen Korrektur eingesetzt werden. Oder sie decken als Repositionsversuch diagnostisch eine allfällig durch den Deszensus larvierte Belastungsinkontinenz oder eine Blasenentleerungsstörung auf, indem sie die störende urethrale Kompression beheben. Umgekehrt kann das Pessar durch Kompression der Urethra eine Harninkontinenz behandeln. Bei Deszensus mit Inkontinenz sind Ring- oder Schalenpessare mit Oliven, welche den Urethrasupport bieten, indiziert. Letztlich zeigt sich der Outcome bei Pessaranwendung erst im Verlauf, wovon dann die Patientinnencompliance abhängt.
Die Pessartherapie soll idealerweise mit einer lokalen Östrogenisierung (Crème) kombiniert werden. Dies behandelt nicht nur die postmenopausale Genitalatrophie, sondern reduziert den vaginalen Ausfluss und erhöht die Compliance für das Tragen des Pessars (52, 53).
Zudem erleichtert die auf das Pessar aufgetragene Crème dessen Einführen. Die Pessare sind in verschiedenen Grössen, die den anatomischen Verhältnissen der Patientin Rechnung tragen, und Formen für die unterschiedlichen Indikationen erhältlich (Abb. 4).
Würfelpessare werden in der Regel nur tagsüber getragen und von der Patientin selbständig am Morgen eingeführt und am Abend entfernt, Ring- oder Siebschalenpessare können dagegen bis zu 6 Wochen belassen werden und eignen sich eher für betagte Patientinnen oder Patientinnen mit z. B. arthrotischen Beschwerden der Hand. Urethralpessare sind zusätzlich an einer Stelle mit einer olivenartigen Verstärkung ausgestattet, die suburethral zu liegen kommt und dadurch eine gleichzeitig bestehende Belastungsinkontinenz beheben kann.
Mitunter tritt ein durch Anaerobier verursachter Geruch auf, der dann mit einer Clindamycin-haltigen Crème angegangen werden kann. Daher sowie aufgrund der Gefahr von Erosionen und Ulzerationen bzw. Druckstellen bei zu langer Liegedauer sind regelmässige Spekulumeinstellungen und Pessarwechsel notwendig. Bei Ulzerationen muss die Pessartherapie für einige Tage ausgesetzt und solange mit Tupferpessaren und lokaler Östrogenisierung überbrückt werden. Risikofaktoren für einen Misserfolg sind eine kurze Scheide (< 6 cm), ein weiter (klaffender), für vier oder mehr Querfinger durchgängiger Introitus oder eine isolierte Rektozele, weshalb das Pessar wegen den auseinandergewichenen Levatorenschenkeln nicht ausreichendend gestützt wird.
Ideal ist die Kombination der konservativen Massnahmen mit angepasstem Verhalten, Östrogenisierung, Beckenbodenrehabilitation und Pessartherapie.
PD Dr. med. Daniele Perucchini
Dr. med. Gian-Piero Ghisu
Prof. Dr. med. Daniel Fink
PD Dr. med. Cornelia Betschart
Klinik für Gynäkologie, Universitätsspital Zürich
Frauenklinikstrasse 10
8091 Zürich
Klinik für Gynäkologie
Universitätsspital Zürich
Frauenklinikstrasse 10
8091 Zürich
david.scheiner@usz.ch
Für die Autoren besteht kein Interessenskonflikt in Verbindung mit dem vorgelegten Manuskript.
- Der Genitaldeszensus ist ein häufiges gynäkologisches Problem, welches die Lebensqualität der betroffenen Frauen beeinträchtigt.
- Hauptrisikofaktor ist die vaginale Geburt.
- Die konservative Therapie mittels Physiotherapie und Pessar gehört zur empfohlenen Firstline-Therapie.
Messages à retenir
- La descente d’organes est un problème fréquent en gynécologie et affecte la qualité de vie des femmes qui en sont atteintes.
- Le facteur de risque majeur est l’accouchement par voie vaginale.
- Les traitements conservateurs avec physiothérapie et application de pessaire représentent les thérapies à recommander en première intention.
1. Scherzler D. Der tönerne Ring vom Viesenhäuser Hof – Ein Hinweis auf medizinische Versorgung in der Vorrömischen Eisenzeit? Fundberichte aus Baden Württemberg. 1998;22(1):237-94.
2. Snooks SJ, Setchell M, Swash M, Henry MM. Injury to innervation of pelvic floor sphincter musculature in childbirth. Lancet. 1984;2(8402):546-50.
3. Lien KC, Morgan DM, Delancey JO, Ashton-Miller JA. Pudendal nerve stretch during vaginal birth: a 3D computer simulation. Am J Obstet Gynecol. 2005;192(5):1669-76.
4. Lien KC, Mooney B, DeLancey JO, Ashton-Miller JA. Levator ani muscle stretch induced by simulated vaginal birth. Obstet Gynecol. 2004;103(1):31-40.
5. Brooks SV, Zerba E, Faulkner JA. Injury to muscle fibres after single stretches of passive and maximally stimulated muscles in mice. J Physiol. 1995;488 ( Pt 2):459-69.
6. Kearney R, Miller JM, Ashton-Miller JA, DeLancey JO. Obstetric factors associated with levator ani muscle injury after vaginal birth. Obstet Gynecol. 2006;107(1):144-9.
7. Dietz HP, Lanzarone V. Levator trauma after vaginal delivery. Obstet Gynecol. 2005;106(4):707-12.
8. Delancey JO, Kane Low L, Miller JM, Patel DA, Tumbarello JA. Graphic integration of causal factors of pelvic floor disorders: an integrated life span model. Am J Obstet Gynecol. 2008;199(6):610 e1-5.
9. Handa VL, Blomquist JL, Knoepp LR, Hoskey KA, McDermott KC, Munoz A. Pelvic floor disorders 5-10 years after vaginal or cesarean childbirth. Obstet Gynecol. 2011;118(4):777-84.
10. Boyles SH, Weber AM, Meyn L. Procedures for urinary incontinence in the United States, 1979-1997. Am J Obstet Gynecol. 2003;189(1):70-5.
11. Boyles SH, Weber AM, Meyn L. Procedures for pelvic organ prolapse in the United States, 1979-1997. Am J Obstet Gynecol. 2003;188(1):108-15.
12. Rortveit G, Hannestad YS. Association between mode of delivery and pelvic floor dysfunction. Tidsskr Nor Laegeforen. 2014;134(19):1848-52.
13. Gyhagen M, Bullarbo M, Nielsen TF, Milsom I. Prevalence and risk factors for pelvic organ prolapse 20 years after childbirth: a national cohort study in singleton primiparae after vaginal or caesarean delivery. BJOG. 2013;120(2):152-60.
14. Gyhagen M, Bullarbo M, Nielsen TF, Milsom I. The prevalence of urinary incontinence 20 years after childbirth: a national cohort study in singleton primiparae after vaginal or caesarean delivery. BJOG. 2013;120(2):144-51.
15. Olsen AL, Smith VJ, Bergstrom JO, Colling JC, Clark AL. Epidemiology of surgically managed pelvic organ prolapse and urinary incontinence. Obstet Gynecol. 1997;89(4):501-6.
16. Fialkow MF, Newton KM, Lentz GM, Weiss NS. Lifetime risk of surgical management for pelvic organ prolapse or urinary incontinence. Int Urogynecol J Pelvic Floor Dysfunct. 2008;19(3):437-40.
17. Smith FJ, Holman CD, Moorin RE, Tsokos N. Lifetime risk of undergoing surgery for pelvic organ prolapse. Obstet Gynecol. 2010;116(5):1096-100.
18. Cheon C, Maher C. Economics of pelvic organ prolapse surgery. Int Urogynecol J. 2013;24(11):1873-6.
19. Buchsbaum GM, Duecy EE, Kerr LA, Huang L-S, Perevich M, Guzick DS. Pelvic organ prolapse in nulliparous women and their parous sisters. Obstetrics and gynecology. 2006;108(6):1388-93.
20. Gyhagen M, Al-Mukhtar Othman J, Akervall S, Nilsson I, Milsom I. The symptom of vaginal bulging in nulliparous women aged 25-64 years: a national cohort study. Int Urogynecol J. 2019;30(4):639-47.
21. Anders K. Devices for continence and prolapse. BJOG. 2004;111 Suppl 1:61-6.
22. Shah SM, Sultan AH, Thakar R. The history and evolution of pessaries for pelvic organ prolapse. Int Urogynecol J Pelvic Floor Dysfunct. 2006;17(2):170-5.
23. Zweifel P. Vorlesungen über klinische Gynäkologie. Berlin: Hirschwald; 1892.
24. de Tayrac R, Sentilhes L. Complications of pelvic organ prolapse surgery and methods of prevention. Int Urogynecol J. 2013;24(11):1859-72.
25. Brandner S, Aeberhard C, Mueller MD, Kuhn A. Cognitive changes in older women after urogynaecological surgery. Ginekol Pol. 2018;89(11):587-92.
26. Clark AL, Gregory T, Smith VJ, Edwards R. Epidemiologic evaluation of reoperation for surgically treated pelvic organ prolapse and urinary incontinence. American Journal of Obstetrics and Gynecology. 2003;189(5):1261-7.
27. Denman MA, Gregory WT, Boyles SH, Smith V, Edwards SR, Clark AL. Reoperation 10 years after surgically managed pelvic organ prolapse and urinary incontinence. Am J Obstet Gynecol. 2008;198(5):555 e1-5.
28. Kapoor DS, Freeman RM. Reoperation rate following prolapse surgery. Am J Obstet Gynecol. 2009;200(2):e15; author reply e.
29. Kapoor DS, Nemcova M, Pantazis K, Brockman P, Bombieri L, Freeman RM. Reoperation rate for traditional anterior vaginal repair: analysis of 207 cases with a median 4-year follow-up. Int Urogynecol J. 2010;21(1):27-31.
30. Dallenbach P, Jungo Nancoz C, Eperon I, Dubuisson JB, Boulvain M. Incidence and risk factors for reoperation of surgically treated pelvic organ prolapse. Int Urogynecol J. 2012;23(1):35-41.
31. Expertenbrief No 61. Der Einsatz von Netzen bei Senkungsoperationen, (2018).
32. Altman D, Vayrynen T, Engh ME, Axelsen S, Falconer C, Nordic Transvaginal Mesh G. Anterior colporrhaphy versus transvaginal mesh for pelvic-organ prolapse. N Engl J Med. 2011;364(19):1826-36.
33. Withagen MI, Milani AL, den Boon J, Vervest HA, Vierhout ME. Trocar-guided mesh compared with conventional vaginal repair in recurrent prolapse: a randomized controlled trial. Obstet Gynecol. 2011;117(2 Pt 1):242-50.
34. Nguyen JN, Burchette RJ. Outcome after anterior vaginal prolapse repair: a randomized controlled trial. Obstet Gynecol. 2008;111(4):891-8.
35. Menefee SA, Dyer KY, Lukacz ES, Simsiman AJ, Luber KM, Nguyen JN. Colporrhaphy compared with mesh or graft-reinforced vaginal paravaginal repair for anterior vaginal wall prolapse: a randomized controlled trial. Obstet Gynecol. 2011;118(6):1337-44.
36. FDA takes action to protect women’s health, orders manufacturers of surgical mesh intended for transvaginal repair of pelvic organ prolapse to stop selling all devices 2019 [Available from: https://www.fda.gov/news-events/press-announcements/fda-takes-action-protect-womens-health-orders-manufacturers-surgical-mesh-intended-transvaginal.
37. Food, Administration D. FDA safety communication: Urogynecologic surgical mesh: update on the safety and effectiveness of transvaginal placement for pelvic organ prolapse. Published July 2011. 2014.
38. Chan SS, Cheung RY, Yiu KW, Lee LL, Pang AW, Chung TK. Symptoms, quality of life, and factors affecting women’s treatment decisions regarding pelvic organ prolapse. Int Urogynecol J. 2012;23(8):1027-33.
39. Bump RC, Mattiasson A, Bo K, Brubaker LP, DeLancey JO, Klarskov P, et al. The standardization of terminology of female pelvic organ prolapse and pelvic floor dysfunction. Am J Obstet Gynecol. 1996;175(1):10-7.
40. Bradley CS, Zimmerman MB, Wang Q, Nygaard IE, Women’s Health I. Vaginal descent and pelvic floor symptoms in postmenopausal women: a longitudinal study. Obstet Gynecol. 2008;111(5):1148-53.
41. Wiegersma M, Panman CMCR, Kollen BJ, Berger MY, Lisman-Van Leeuwen Y, Dekker JH. Is the hymen a suitable cut-off point for clinically relevant pelvic organ prolapse? Maturitas. 2017;99:86-91.
42. Bo K. Pelvic floor muscle training in treatment of female stress urinary incontinence, pelvic organ prolapse and sexual dysfunction. World J Urol. 2012;30(4):437-43.
43. Myers DL, Sung VW, Richter HE, Creasman J, Subak LL. Prolapse symptoms in overweight and obese women before and after weight loss. Female Pelvic Med Reconstr Surg. 2012;18(1):55-9.
44. Greer WJ, Richter HE, Bartolucci AA, Burgio KL. Obesity and pelvic floor disorders: a systematic review. Obstet Gynecol. 2008;112(2 Pt 1):341-9.
45. ACOG Practice Bulletin No. 85: Pelvic organ prolapse. Obstet Gynecol. 2007;110(3):717-29.
46. Boyle R, Hay-Smith EJ, Cody JD, Morkved S. Pelvic floor muscle training for prevention and treatment of urinary and faecal incontinence in antenatal and postnatal women. Cochrane Database Syst Rev. 2012;10:CD007471.
47. Hagen S, Stark D. Conservative prevention and management of pelvic organ prolapse in women. Cochrane Database Syst Rev. 2011(12):CD003882.
48. Li C, Gong Y, Wang B. The efficacy of pelvic floor muscle training for pelvic organ prolapse: a systematic review and meta-analysis. Int Urogynecol J. 2016;27(7):981-92.
49. Culligan PJ. Nonsurgical management of pelvic organ prolapse. Obstet Gynecol. 2012;119(4):852-60.
50. Lamers BH, Broekman BM, Milani AL. Pessary treatment for pelvic organ prolapse and health-related quality of life: a review. Int Urogynecol J. 2011;22(6):637-44.
51. Clemons JL, Aguilar VC, Tillinghast TA, Jackson ND, Myers DL. Risk factors associated with an unsuccessful pessary fitting trial in women with pelvic organ prolapse. Am J Obstet Gynecol. 2004;190(2):345-50.
info@gynäkologie
- Vol. 10
- Ausgabe 2
- April 2020