- Plazentationsstörungen
Unter «Plazentationsstörungen» (im Englischen «Abnormally Invasive Placenta») werden Placenta accreta, Placenta increta und Placenta percreta zusammengefasst. Durch steigende Kaiserschnittraten sehen wir uns in Folgeschwangerschaften zunehmend mit diesem Problem konfrontiert. In dieser Übersicht sollen Risikofaktoren eruiert und Diagnosemöglichkeiten aufgezeigt werden. Nur so lässt sich das operative Vorgehen optimal planen und die Risiken für Mutter und Kind senken.
Dans les «anomalies de la placentation», le terme anglais «Abnormally Invasive Placenta» résume les placenta accreta, placenta increta et placenta percreta, soit les «placentas anormalement invasifs». En raison du taux de césariennes qui continue à augmenter, les AIP se rencontrent de plus en plus fréquemment : dans les grossesses qui suivent une grossesse s’étant terminée par césarienne. Cet article se promet de discuter les facteurs de risque et de présenter les possibilités diagnostiques. C’est la seule manière pour planifier de manière optimale la prise en charge opératoire et ainsi diminuer les risques pour la mère et l’enfant.
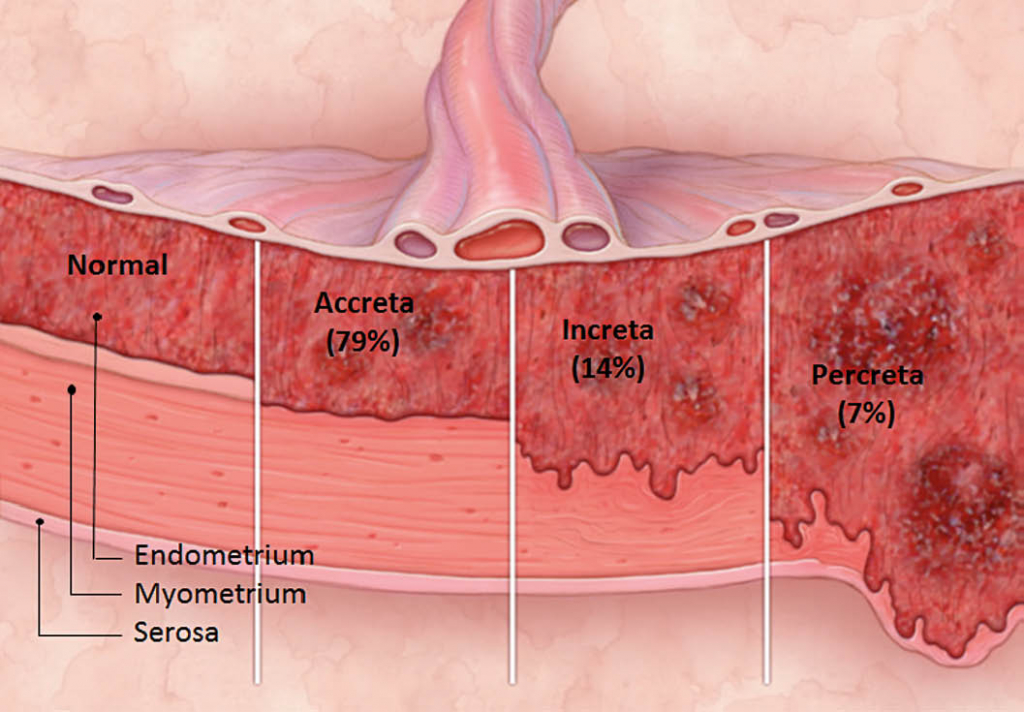
Abnormally invasive placenta »(AIP) is defined as impaired trophoblast attachment to the myometrium in the absence of decidua basalis. The most common form is placenta accreta (79%). The second most common form, placenta increta (14%), has trophoblastic performance in the myometrium. Placenta percreta (7%), the most severe variant, is a trophoblast invasion through the myometrium and beyond the serosa, possibly also to adjacent organs such as the maternal parametria and / or the bladder (Fig. 1) (1-4). Of clinical relevance are the placental disorders, in particular with regard to the delivery. Attempting to loosen the adherent placenta results in the opening of the vascular bed, thereby increasing often uncontrollable and life-threatening bleeding with disseminated consumption coagulopathy (DIC). Blood transfusions, hysterectomy and injury to adjacent organs (ureter, bladder, bowel, neurovascular structures) are complications and increase maternal mortality up to 7% (3, 5). Neonatal morbidity and mortality is increased by prematurity, as delivery is often planned or indicated before the 37th week of gestation. To reduce maternal and neonatal morbidity and mortality, prenatal diagnosis is of key importance as a planned delivery in a center with interdisciplinary expertise is associated with a significantly improved outcome for both mother and child (6). Intestine, neurovascular structures) are among the complications and increase maternal mortality up to 7% (3, 5). Neonatal morbidity and mortality is increased by prematurity, as delivery is often planned or indicated before the 37th week of gestation. To reduce maternal and neonatal morbidity and mortality, prenatal diagnosis is of key importance as a planned delivery in a center with interdisciplinary expertise is associated with a significantly improved outcome for both mother and child (6). Intestine, neurovascular structures) are among the complications and increase maternal mortality up to 7% (3, 5). Neonatal morbidity and mortality is increased by prematurity, as delivery is often planned or indicated before the 37th week of gestation. To reduce maternal and neonatal morbidity and mortality, prenatal diagnosis is of key importance as a planned delivery in a center with interdisciplinary expertise is associated with a significantly improved outcome for both mother and child (6).
Etiology, risk factors and incidence
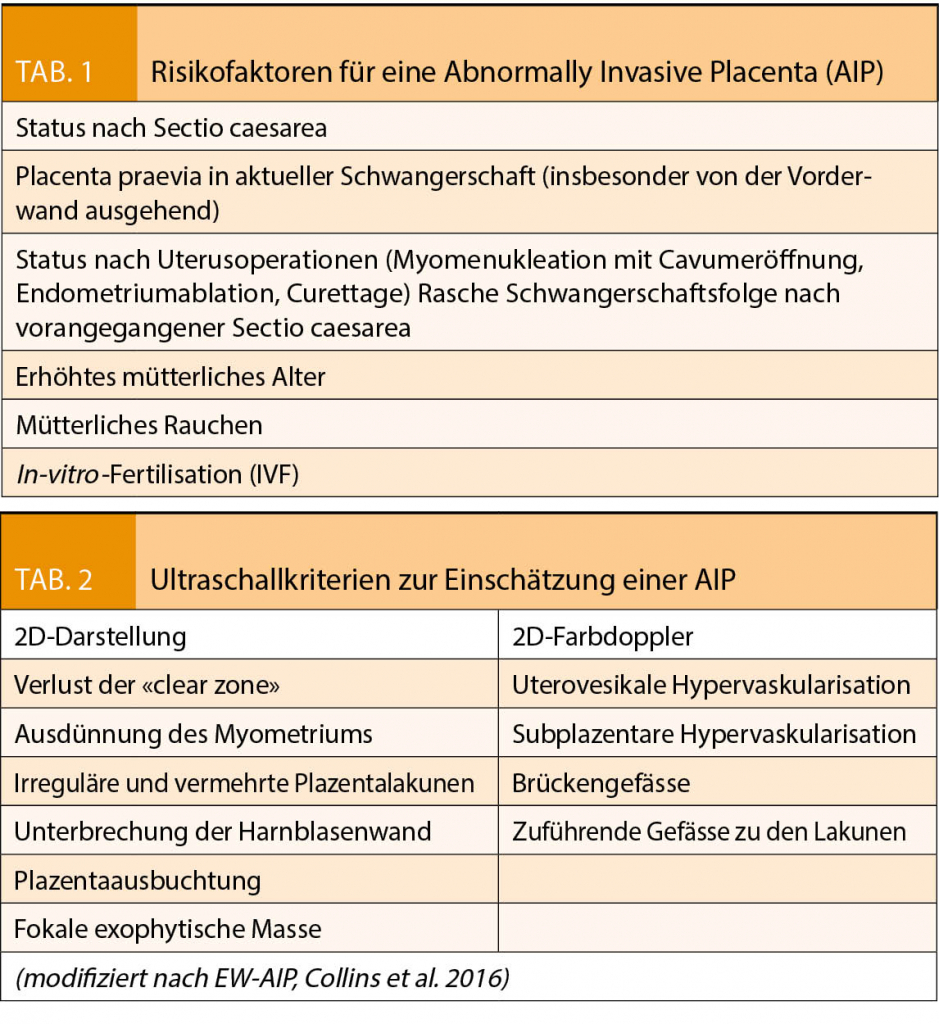
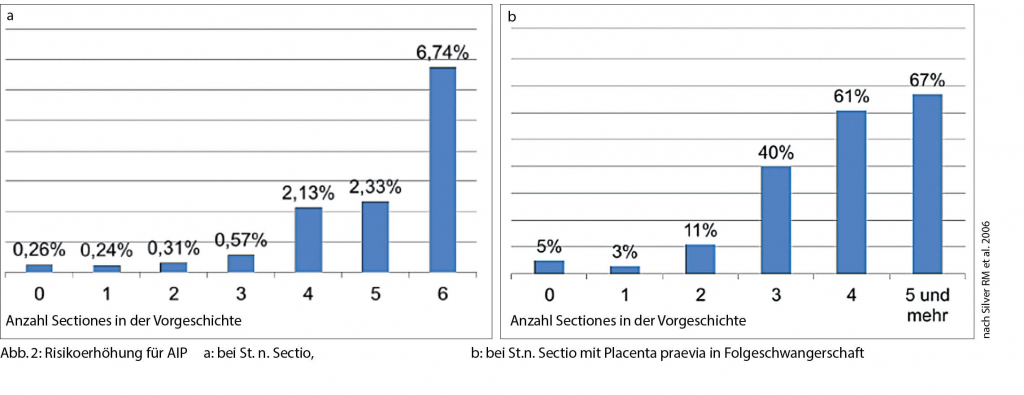
Die genaue Ätiologie der Plazentationsstörungen ist noch nicht gänzlich geklärt. Die meistvertretene Hypothese beschreibt jedoch, dass ein Defekt im Übergang vom Endometrium zum Myometrium zu einer fehlerhaften Dezidualisierung führt, woraus eine unnatürlich tiefe Infiltration des Trophoblasten an oder in das Myometrium resultiert (7). Insbesondere die Sectio caesarea in vorangegangenen Schwangerschaften geht mit einer deutlichen Risikoerhöhung hierfür einher. Bei gleichzeitigem Vorliegen einer Placenta praevia liegt das Risiko für eine AIP mit ihren Unterformen bei 11-25 % und erhöht sich signifikant mit der Anzahl vorangegangener Sectiones (Abb. 2a und 2b) (8-14). Auch andere Eingriffe am Uterus, die zur Verletzung des Endometriums führen (v. a. mit Cavum-Eröffnung) oder Endometriumablationen und Kürettagen tragen zur Entstehung von Plazentationsstörungen bei (15). Weitere Risikofaktoren stellen erhöhtes mütterliches Alter, kurzes Intervall zwischen Sectio caesarea und erneuter Schwangerschaft, In-vitro-Fertilisation (IVF) sowie mütterliches Rauchen dar (Tab. 1). Insbesondere die steigende Kaiserschnittrate trägt somit massgeblich zur aktuell ansteigenden Inzidenz der AIP bei. So findet sich in der Literatur eine Inzidenz von 1:4000 Geburten in den 1970er Jahren, (16), 1:2500 in den ‘80ern (17) und ca. 1:500 im Jahre 2015 (18, 19).
Diagnostik
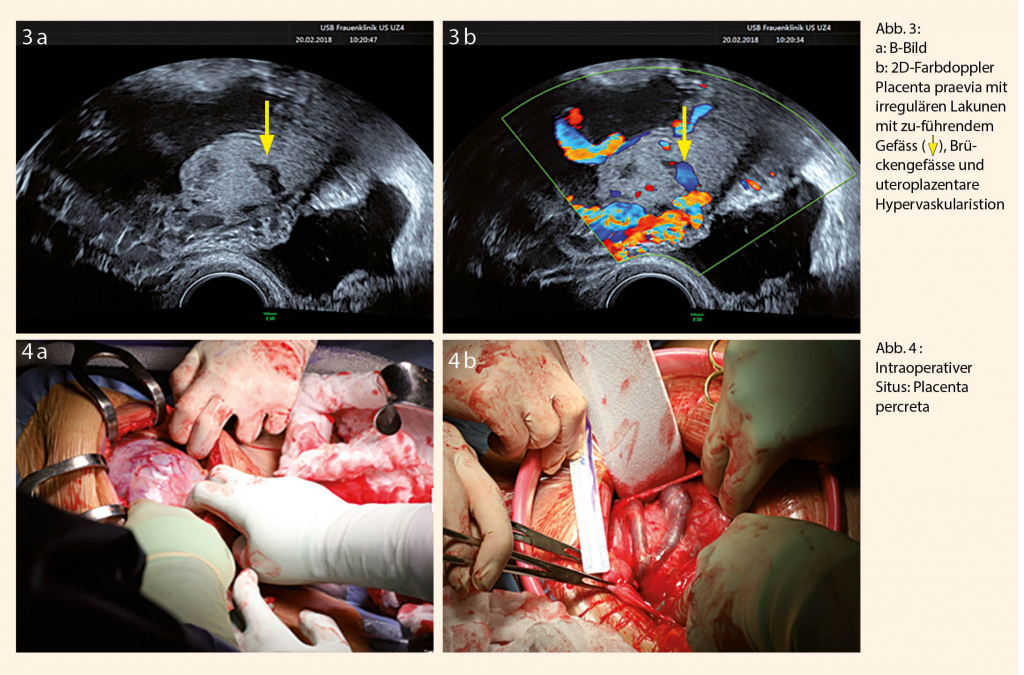
Die pränatale Diagnose ist von entscheidender Bedeutung für ein optimales mütterliches und kindliches Outcome. So lässt sich die Geburt im Zentrum mit interdisziplinärer Expertise planen, bevor es zu Wehen oder Blutungen vor oder unter der Geburt kommt (20). Hauptstütze der Diagnostik ist der transabdominale und ergänzend der transvaginale Ultraschall. Der Farbdoppler erhöht substantiell die Sensitivität und Spezifität bei der Diagnosestellung einer AIP. Bei Vorliegen der eingangs genannten Risikofaktoren sollte der Ultraschall von einem auf diesem Gebiet erfahrenen Untersucher erfolgen. In der Literatur wird die ultraschallbasierte Diagnose der AIP mit einer sehr hohen Sensitivität (77-97%) und Spezifität (97%) angegeben (21-25). Jedoch hatten die Untersucher in den meisten Studien Kenntnisse bezüglich der Anamnese und dem damit verbunden erhöhten Risiko. Zudem sollte beachtet werden, dass unter «AIP» verschiedene Subtypen mit unterschiedlichem Ausmass zusammengefasst werden. Folglich kann es auch nicht DAS diagnostische Kriterium geben. Vielmehr gilt es, auf verschiedene sonographische Charakteristika zu achten. Es konnten Ultraschallkriterien identifiziert werden, die wegweisend für die Diagnosestellung sein können. Diese zu standarisieren, hat sich die «European Working Group on Abnormally Invasive Placenta» (EW-AIP) zum Ziel gesetzt. Die Arbeitsgruppe definierte insgesamt 11 Ultraschallmarker, sechs in der 2D-Darstellung, vier im Farbdoppler und fakultativ einen im 3D-Power-Doppler-Modus (Tab. 2, Abb. 3 a und b) (26):
2D-Darstellung:
1. Verlust der physiologischen hypoechogenen retroplazentaren Zone («clear zone»)
2. Ausdünnung (<1mm) des darunterliegenden hypoechogenen Myometriums
3. Vermehrte irregulär geformte Lakunen (Gefässerweiterungen) innerhalb Plazenta
4. Unterbrechung oder Fehlen der hyperechogenen Linie zwischen Uterusserosa und Harnblasenlumen (wichtig: Untersuchung bei gefüllter Harnblase)
5. Unnatürliche Vorwölbung der Uterusserosa
6. Durchbruch von Plazentagewebe über die Uterusserosa hinweg und ggf. in benachbarte Organe (z.B. Harnblase)
2D-Farbdoppler:
1. Hypervaskularisation des Plazentabettes
2. Hypervaskularisation zwischen Myometrium und Hinterwand der Harnblase
3. Brückengefässe («bridging vessels»): kreuzende Gefässe an der myometralplazentaren Grenzzone und der uterovesikalen Grenzzone
4. Zuführende Gefässe zu den irregulär geformten Lakunen mit turbulentem Fluss (sogenannte «jet streams» >15cm/s)
3D-Power-Doppler (derzeit kein Standard, nur ergänzend):
Intraplazentare Hypervaskularisation mit stark verzweigten Gefässen, welche deutliche Kalibersprünge aufweisen.
Ergibt sich sonographisch der Verdacht auf AIP, kann zur weiterführenden Diagnostik eine Magnetresonanz-Imaging(MRI)-Untersuchung zusätzliche Informationen liefern. In einem systematischen Review konnte für das MRI zur Abklärung von Plazentationsstörungen eine Sensitivität von 75-100% sowie eine Spezifität von 65-100% (21) gezeigt werden. Jedoch sollte bei der Interpretation dieser Daten beachtet werden, dass diese relativ gute Testperfomance dadurch zu Stande kommt, dass ein MRI nur bei Patientinnen mit einem sehr hohen (sonographischen) Risiko für eine AIP durchgeführt wird (oder statistisch ausgedrückt: die Prävalenz des Krankheitsbildes in der mit MRI untersuchten Populationen ist deutlich höher als jene des Ultraschallkollektivs). Hilfreiche Informationen kann das MRI auch zur Beurteilung einer Hinterwandplazenta liefern oder um das Ausmass der Invasion bei Verdacht auf Placenta percreta besser abzuschätzen.
Geburtshilfliches Management
Die pränatale Diagnose ist wegweisend hinsichtlich des Entbindungsortes. Bei dringendem V.a. AIP sollte die Entbindung in einem Zentrum mit Erfahrung im Management von Plazentationsstörungen geplant werden. Dies ist von zentraler Bedeutung, da hierdurch maternale und neonatale Risiken erkannt und antizipiert werden können. Eine grosse Herausforderung stellt vor allem die Planung des Entbindungszeitpunktes dar. Es gilt, das Risiko der Frühgeburtlichkeit gegenüber dem Risiko für maternale Blutungen oder spontanenWehenbeginn abzuwägen. Als optimaler Zeitpunkt wird eine geplante Sectio caesarea in einem Zeitfenster zwischen 34+0 bis 35+6 SSW angesehen (27-30). Je nach Klinik (Blutungen, vorzeitige Wehentätigkeit, Ausmass der AIP etc.) kann der Entbindungszeitpunkt individuell angepasst werden. Bei absehbarer Frühgeburtlichkeit sollte eine Lungenreifungsinduktion (idealerweise 2 – 7 Tage vor geplanter Entbindung) erfolgen. Die Sectio caesarea sollte, wie eingangs erwähnt, in einem Zentrum mit operativer Erfahrung auf dem Gebiet der AIP erfolgen. Jede Schwangere mit V.a. AIP muss indiviualisiert und von einem Expertenteam (Geburtsmedizinern, Anästhesisten, interventionellen Radiologen, Urologen, Transfusionsmedizin und Neonatologen) betreut werden. Wichtig ist hierbei, dass frühzeitig das operative Managment mit den möglichen Komplikationen in einem interdiziplinären Gespräch festgelegt und dokumentiert wird. Präoperativ muss das mütterliche Hämoglobin optimiert werden und zur Operation müssen passende Blutprodukte in ausreichendem Mass zur Verfügung stehen. Zur intraoperativen Blutrückgewinnung und autologen Transfusion empfiehlt sich der Gebrauch eines Cell-Saver®. Zur Analgesie kann eine kontinuierliche Spinalanästhesie oder kombinierte Spinal-Epiduralanästhesie gewählt werden. Allenfalls muss bei verstärkter Blutung intraoperativ ein Umsteigen auf Allgemeinanästhesie erfolgen (21). Bei Verdacht auf Infiltration der Harnblase ermöglicht eine Zystoskopie die Beurteilung des Infiltrationsgrades und ggf. eine zystoskopische Ureterenkatheter-Einlage. Wenn ein hoher Blutverlust zu erwarten ist, können unmittelbar vor der Sectio femoral-arterielle Schleusen (zwecks möglicher intra- oder postoperativer Embolisation der Aa. uterinae) platziert werden. Je nach Ausdehnung des Befundes kann das Abdomen entweder per Längslaparotomie oder per Pfannenstielschnitt (ggf. jedoch mit Längsspaltung der Faszie) eröffnet werden. Die Uterotomie muss häufig, je nach Lage der Plazenta, fundal erfolgen (31, 32). Nach Entwicklung des Kindes kann versucht werden, uteruserhaltend (unter Resektion des betroffenen Uterusareals) zu operieren. Bei ausgedehnter Infiltation ist eine Hysterektomie oft unumgänglich. Diese erfolgt en bloc ohne vorherige Lösung der Plazenta. Gegenstand von Diskussionen ist nach wie vor das sog. «Konservative Management» mit Belassen der Plazenta in situ (33, 34). Das Ziel ist, dass sich die Plazenta im Verlauf selbst ablöst oder eine zweitzeitige Hysterektomie mit reduziertem Blutverlust und niedrigerem Komplikationsrisiko erfolgen kann. Methotrexat wird wegen fehlender Evidenz und potentieller Nebenwirkungen nicht mehr empfohlen (35, 36). Eine histologische Untersuchung zur abschliessenden Sicherung der Diagnose sowie Überprüfung der pränatal erhobenen Befunde wird dringend empfohlen.
Abkürzungen
Aa. – Arteriae, AIP – Abnormally Invasive Placenta,
DIC – Disseminierte intravasale Koagulopathie,
IVF – In-vitro-Fertilisation, MRI – Magnetresonanz-Imaging,
SSW – Schwangerschaftswoche
Universitätsspital Basel
Frauenklinik
Abteilung für gynäkologische Sonographie und Pränataldiagnostik
Spitalstrasse 21
4031 Basel
hannaelise.huerter@usb.ch
Universitätsspital Basel
Frauenklinik
Abteilung für gynäkologische Sonographie und Pränataldiagnostik
Spitalstrasse 21
4031 Basel
Die Autorinnen haben keine Interessenskonflikte in Zusammenhang mit diesem Artikel.
- Der grösste Risikofaktor für Plazentationsstörungen (AIP) ist die Placenta praevia bei St. n. Sectio.
- Die Inzidenz der AIP ist aktuell steigend aufgrund zunehmender Sectio-Raten. Dies führt zu erhöhter maternaler und neonataler
Morbidität und Mortalität. - Die pränatale Diagnose verbessert substanziell das maternale Outcome.
- Zur pränatalen Diagnosestellung sollten standardisierte Ultraschallkriterien herangezogen werden.
- Nur die korrekte Verdachtsdiagnose ermöglicht ein optimales Management, d.h. individualiserte Planung, Entbindung im Zentrum, Betreuung durch ein interdiziplinäres AIP-Expertenteam.
Messages à retenir
- Le facteur de risque le plus important pour un placenta anormalement invasif (anglais « AIP » ) est la présence d’un placenta praevia dans une grossesse après césarienne.
- L’incidence des « AIP » est croissante en raison du taux de césarienne toujours en augmentation. Il en résulte une augmentation de la morbidité et mortalité maternelle et fœtale.
- Le diagnostic posé/suspecté avant l’accouchement améliore nettement le devenir pour la mère.
- Pour établir le diagnostic au cours de la grossesse, on devrait se servir de critères ultrasonores standardisés.
- Seulement le diagnostic posé/suspecté avant l’accouchement permet une prise en charge optimale, à savoir la planification individualisée avec accouchement dans un centre qui dispose d’une équipe interdisciplinaire rôdée dans la problématique des anomalies d’invasion du placenta.
1. Chalubinski KM, Pils S, Klein K, Seemann R, Speiser P, Langer M, Ott J. Prenatal sonography can predict degree of placental invasion. Ultrasound Obstet Gynecol. 2013 Nov;42(5):518-24.
2. Seet EL, Kay HH, Wu S, Terplan M. Placenta accreta: depth of invasion and neonatal outcomes. J Matern Fetal Neonatal Med. 2012 Oct;25(10):2042-5.
3. O’Brien JM, Barton JR, Donaldson ES. The management of placenta percreta: conservative and operative strategies. Am J Obstet Gynecol 1996; 175:1632-8.
4. Silver RM, Branch DW. Placenta Accreta Spectrum. N Engl J Med. 2018 Apr 19;378(16):1529-1536.
5. Wright JD, Pri-Paz S, Herzog TJ, Shah M, Bonanno C, Lewin SN, Simpson LL, Gaddipasti S, Sun X, D’Alton ME, Devine P. Predictors of massive blood loss in women with placenta accreta. Am J Obstet Gynecol 2012;205:38.e1-6.
6. Silver RM, Fox KA, Barton JR, Abuhamad AZ, Simhan H, Huls CK, Belfort MA, Wright JD. Center of excellence for placenta accreta. Am J Obstet Gynecol. 2015 May;212(5):561-8.
7. Jauniaux E, Collins S, Burton GJ. Placenta accreta spectrum: pathophysiology and evidence-based anatomy for prenatal ultrasound imaging. Am J Obstet Gynecol. 2018 Jan;218(1):75-87.
8. Usta IM, Hobeika EM, Musa AA, Gabriel GE, Nassar AH. Placenta previa-accreta: risk factors and complications. Am J Obstet Gynecol. 2005 Sep;193(3 Pt 2):1045-9.
9. Eshkoli T, Weintraub AY, Sergienko R, Sheiner E. Placenta accreta: risk factors, perinatal outcomes, and consequences for subsequent births. Am J Obstet Gynecol. 2013 Mar;208(3):219.e1-7.
10. Bowman ZS, Eller AG, Bardsley TR, Greene T, Varner MW, Silver RM. Risk factors for placenta accreta: a large prospective cohort. Am J Perinatol. 2014 Oct;31(9):799-804.
11. Marshall NE, Fu R, Guise JM. Impact of multiple cesarean deliveries on maternal morbidity: a systematic review. Am J Obstet Gynecol. 2011 Sep;205(3):262.e1-8.
12. Garmi G, Salim R. Epidemiology, etiology, diagnosis, and management of placenta accreta. Obstet Gynecol Int. 2012;2012:873929.
13. Silver RM, Landon MB, Rouse DJ, Leveno KJ, Spong CY, Thom EA, Moawad AH, Caritis SN, Harper M, Wapner RJ, Sorokin Y, Miodovnik M, Carpenter M, Peaceman AM, O’Sullivan MJ, Sibai B, Langer O, Thorp JM, Ramin SM, Mercer BM; National Institute of Child Health and Human Development Maternal-Fetal Medicine Units Network. Maternal morbidity associated with multiple repeat cesarean deliveries. Obstet Gynecol. 2006 Jun;107(6):1226-32
14. Baldwin HJ, Patterson JA, Nippita TA, Torvaldsen S, Ibiebele I, Simpson JM, Ford JB. Antecedents of Abnormally Invasive Placenta in Primiparous Women: Risk Associated With Gynecologic Procedures. Obstet Gynecol. 2018 Feb;131(2):227-233.
15. Tantbirojn P, Crum CP, Parast MM. Pathophysiology of placenta creta: the role of decidua and extravillous trophoblast. Placenta. 2008 Jul;29(7):639-45.
16. Read JA, Cotton DB, Miller FC. Placenta accreta: changing clinical aspects and outcome. Obstet Gynecol. 1980 Jul;56(1):31-4.
17. Miller DA, Chollet JA, Goodwin TM. Clinical risk factors for placenta previa-placenta accreta. Am J Obstet Gynecol. 1997 Jul;177(1):210-4.
18. Bailit JL, Grobman WA, Rice MM, Reddy UM, Wapner RJ, Varner MW, Leveno KJ, Iams JD, Tita AT, Saade G, Rouse DJ, Blackwell SC; Eunice Kennedy Shriver National Institute of Child Health and Human Development (NICHD) Maternal-Fetal Medicine Units (MFMU) Network. Morbidly adherent placenta treatments and outcomes.Obstet Gynecol.2015Mar;125(3):683-9.
19. Wu S1, Kocherginsky M, Hibbard JU. Am J Obstet Gynecol. 2005 May;192(5):1458-61. Abnormal placentation: twenty-year analysis.
20. Eller AG, Bennett MA, Sharshiner M, Masheter C, Soisson AP, Dodson M, Silver RM. Maternal morbidity in cases of placenta accreta managed by a multidisciplinary care team compared with standard obstetric care. Obstet Gynecol. 2011 Feb;117(2 Pt 1):331-7.
21. D’Antonio F, Iacovella C, Bhide A. Prenatal identification of invasive placentation using ultrasound: systematic review and meta-analysis. Ultrasound Obstet Gynecol. 2013 Nov;42(5):509-17.
22. Bowman ZS, Eller AG, Kennedy AM, Richards DS, Winter TC 3rd, Woodward PJ, Silver RM. Accuracy of ultrasound for the prediction of placenta accreta. Am J Obstet Gynecol. 2014 Aug;211(2):177.e1-7.
23. Jauniaux E, Collins SL, Jurkovic D, Burton GJ. Accreta placentation: a systematic review of prenatal ultrasound imaging and grading of villous invasiveness. Am J Obstet Gynecol. 2016 Dec;215(6):712-721.
24. Berkley EM1, Abuhamad AZ. Prenatal diagnosis of placenta accreta: is sonography all we need? J Ultrasound Med. 2013 Aug;32(8):1345-50.
25. Bowman ZS, Eller AG, Kennedy AM, Richards DS, Winter TC 3rd, Woodward PJ, Silver RM. Interobserver variability of sonography for prediction of placenta accreta. J Ultrasound Med. 2014 Dec;33(12):2153-8.
26. Collins SL, Ashcroft A, Braun T, Calda P, Langhoff-Roos J, Morel O, Stefanovic V, Tutschek B, Chantraine F; European Working Group on Abnormally Invasive Placenta (EW-AIP). Proposal for standardized ultrasound descriptors of abnormally invasive placenta (AIP). Ultrasound Obstet Gynecol. 2016 Mar; 47 (3): 271-5.
27. Robinson BK, Grobman WA. Effectiveness of timing strategies for individuals with placenta previa and accreta. Obstet Gynecol. 2010 Oct; 116 (4): 835-42.
28. Belfort MA. Placenta accreta. Publications Committee, Society for Maternal-Fetal Medicine, Am J Obstet Gynecol. 2010 Nov; 203 (5): 430-9.
info@gynäkologie
- Vol. 9
- Ausgabe 1
- Februar 2019