- Risiken einer vaginalen Estrogengabe – worum geht es?
Der nachfolgende Beitrag stellt eine aktuelle Reaktion auf eine Publikation von PRAC/EMA und BfArM zum Thema vaginale Therapie mit Estrogenen vom 17. Januar 2020 dar. Obschon die EMA nicht direkt Anordnungen für die Schweiz geben kann, haben ihre Stellungsnahmen doch über die Medien einen Einfluss auf unsere Patientinnen und Ärzte.
Cet article est une prise de position d’actualité sur une publication du 17 janvier 2020 de l’autorité allemande (BfArM) – qui reprend un document de l’agence européenne des médicaments (PRAC/EMA) – concernant le traitement hormonal aux oestrogènes par voie vaginale. Quoique l’EMA ne soit pas habilitée à légiférer en Suisse, cette recommandation diffusée par les media exerce une influence notable sur les patientes et le corps médical dans notre pays.
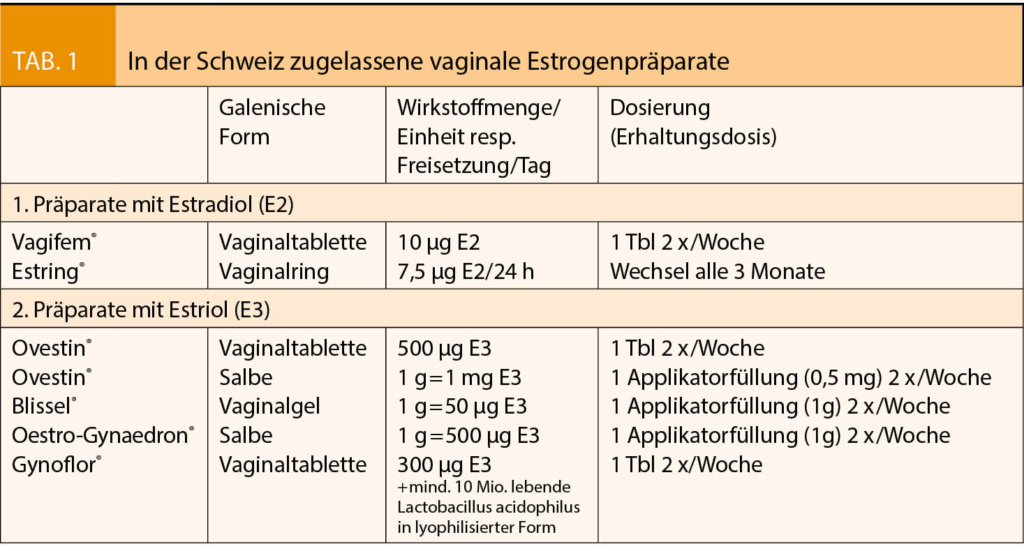
Ein vom Deutschen Bundesamt für Arzneimittel und Medizinprodukte (BfArM) vom PRAC (Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz der Europäischen Arzneimittel-Agentur (EMA)) übernommene Empfehlung vom 17.01.2020 (1) enthält eine neue Risikobewertung für hochdosierte estradiolhaltige Vaginal-Crèmen mit 100µg Estradiol/g Crème (0,01%). Die in der Schweiz zugelassenen niedrig- und ultraniedrig dosierten vaginalen Estradiol-Präparate (Tabelle 1) sind von den neuen Empfehlungen nicht betroffen.
Die Kernbotschaft der BfArM-Empfehlung vom 17.01.2020 lautet:
- Hochdosierte estradiolhaltige Crèmes sollten wegen der Risiken, die mit einer systemischen Wirkung von Estradiol assoziiert sind, nicht länger als für einen einzigen Behandlungszeitraum von 4 Wochen verschrieben werden.
- Pharmakokinetische Daten über hochdosierte estradiol-haltige Crèmes (100µg/g) für den intravaginalen Gebrauch weisen auf eine erhebliche systemische Estradiolresorption hin, deren Werte über dem normalen postmenopausalen Bereich liegen. Die systemische Exposition des Estradiols könnte mit Nebenwirkungen verbunden sein, die denen von oralen und transdermalen HRT-Arzneimitteln ähnlich sind, wie z.B. endometrialem Hyperplasie/Karzinom, Brust- und Eierstockkrebs und thromboembolische Ereignisse.
- Hochdosierte estradiol-haltige Crèmes sollten nicht mit anderen HRT-Medikamenten verschrieben werden.
Obwohl in der Schweiz keines der in Deutschland erhältlichen hochdosierten Präparate (Linoladiol®, Linoladiol N®, Linoladiol Estradiol® Estradiol Wolff®, Montadiol®) zugelassen zugelassen ist und die neue empfehlung von EMA und BfArM die Schweiz rechtlich nicht betrifft, sorgt die Publikation auch hier für Verunsicherung. Dies vor allem, weil auch in den Schweizer Beipackzetteln niedrig-dosierter vaginaler Estradiol-Präparate Warnungen vor möglichen Nebenwirkungen wie erhöhtem kardiovaskulärem, cerebrovaskulärem und thrombo-embolischem Risiko, erhöhtem Brustkrebsrisiko etc. aufgeführt sind, die nicht evidenz-basiert sind. Solche Warnungen können unsere Patientinnen ohne Grund verängstigen, so dass sie ihre korrekt indizierte vaginale Therapie absetzen.
Dieser Beitrag will die Grundlagen für die geltenden Richtlinien zur vaginalen Estrogen-Therapie und die geltenden Empfehlungen von BfArM und Swissmedic evaluieren. Dazu gehören auch die alten Beipackzettel zu niederdosierten Präparaten.
Grundlagen
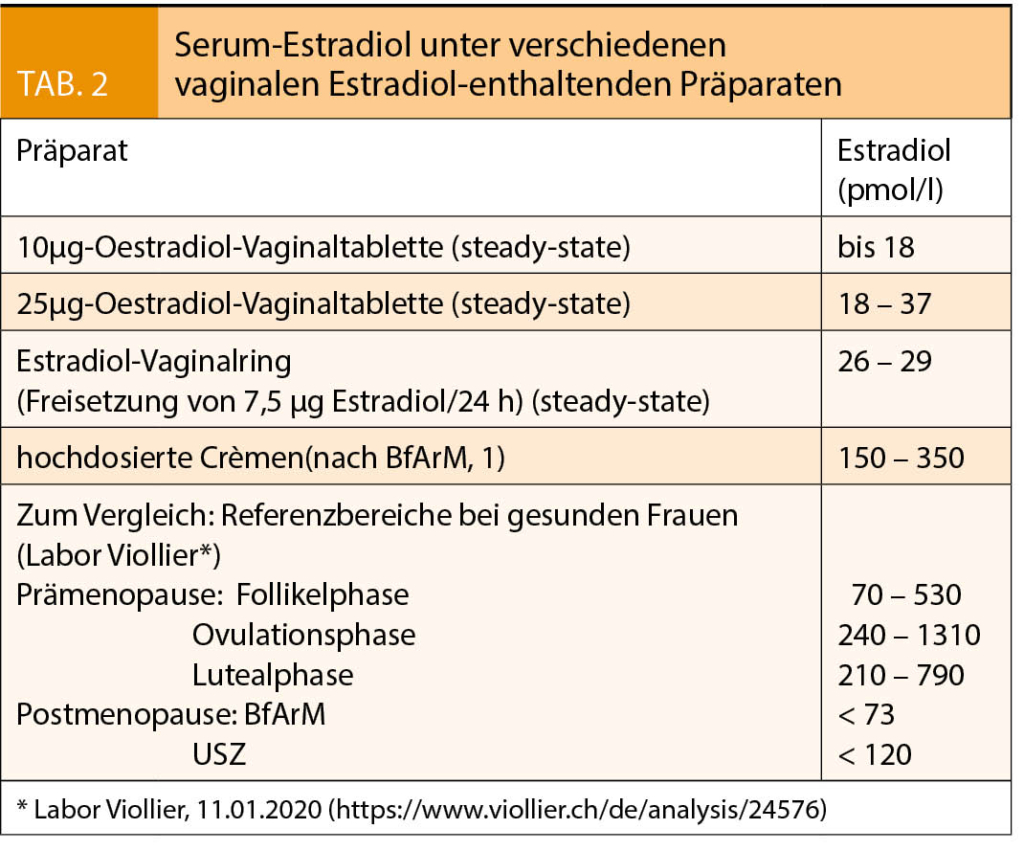
Die Serum-Estradiolspiegel liegen nach BfArM in der Prämenopause zwischen 147 und 1468 pmol/l (40–400 pg/ml) und sinken nach der Menopause auf < 73 pmol/l (20 pg/ml) ab (siehe auch Tab. 2). Diese Abnahme ist mit einer progressiven urogenitalen Atrophie assoziiert, die klinisch im Mittel 4–5 Jahre nach der Menopause manifest wird und zu Beschwerden führen kann, die unter dem Begriff genitourethrales menopausales Syndrom (GMS) zusammengefasst sind.
Objektive Veränderungen und subjektive Beschwerden werden von 25–50% aller postmenopausalen Frauen angegeben (2, 3, 4). Die tatsächliche Inzidenz ist sehr wahrscheinlich höher. Die optimale Therapie eines GMS ist für die urogenitale und sexuelle Gesundheit und damit auch die Sexualität und die Lebensqualität nach der Menopause entscheidend. Für weitere Informationen zum GMS und dessen Behandlung sei auf zwei neuere Übersichtsarbeiten (2, 3) verwiesen.
Risiken einer Behandlung
Niedrig-dosiertes vaginales Estradiol bei leichtem und mittelstarkem GMS
Sind bei einem GMS die nicht-hormonalen Behandlungsmöglichkeiten (2, 3) ausgeschöpft, so strebt eine rationale weitere Behandlung den Ersatz der fehlenden Estrogene und die Wiederherstellung der normalen urogenitalen Physiologie an, um dadurch eine Linderung der Symptome zu erreichen. Wenn eine systemische menopausale Hormontherapie (MHT) nicht aus anderen Gründen indiziert ist, soll die niedrig-dosierte vaginale Estrogengabe einer MHT vorgezogen werden. Sie ist zur Behandlung der vaginalen Atrophie wirksamer als die systemische MHT. Wenn nötig, kann eine vaginale Estrogengabe auch zusätzlich zu einer systemischen MHT angewandt werden.
Lokal-vaginale Estrogene können als Tabletten, Vaginalzäpfchen/Ovula, Crèmen oder als Vaginalring verabreicht werden. In der Cochrane-Review von 2016 (5) fanden sich für die verschiedenen vaginalen Estrogen-Präparate keine unterschiedliche Wirksamkeit. In der Schweiz sind nur Vaginalpräparate mit Estradiol und dem systemisch schwach wirksamen Estriol verfügbar (Tab 1). Hier wird nur auf Estradiol eingegangen, auf das sich die BfArM-Publikation bezieht.
Zur lokalen Behandlung eines leichten bis mittelschweren GMS werden im Vergleich zur systemischen Therapie deutlich kleinere Dosierungen benötigt. Die dabei erreichten Steady-State-Plasmaspiegel bleiben für Vaginalringe (Freisetzung von 7,5μg Estradiol/24h) und Estradioltabletten (25µg und 10µg) alle im normalen postmenopausalen Bereich (6, Tab. 2) und sind damit tiefer als die bei einer transdermalen systemischen Therapie erreichten Serumspiegel. Der Rückzug der vaginalen 25-µg-Estradioltablette vom Schweizer Markt aus Sicherheitsgründen war somit nicht gerechtfertigt. Er benachteiligt Frauen mit stärkeren Symptomen, da nach einem RCT die ultraniedrige 10µg-Estradiol-Tablette nicht in allen Kriterien einer modernen nicht-hormonalen Behandlung überlegen ist (13).
Die allfällige Notwendigkeit einer gleichzeitigen Gestagengabe bei Frauen unter niedrig-dosierten vaginalen Estrogenpräparaten wurde in der Cochrane-Review von 2016, in der Women’s Health Initiative (WHI) Observational Study (medianer Follow-Up 7,2 Jahre) und in zwei Reviews von 2019 und 2020 untersucht (5, 7, 8). Danach erhöht sich weder das Risiko für eine Veränderung der Endometriumhöhe noch dasjenige für Hyperplasien oder Endometriumkarzinome (5, 7, 8, 12). Die Schlussfolgerung, dass bei niedrigdosierter vaginaler Estrogentherapie keine Notwendigkeit für die gleichzeitige Gabe eines Gestagens zum Endometriumschutz besteht, ist auch in den Empfehlungen der IMS (International Menopause Society) (4), der SGGG (9) und der NAMS (North American Menopause Society) (10, 11) festgehalten und wird in den Beipackzetteln respektiert.
Wie die transdermale besitzt auch die vaginale Estradiol-Gabe keinen hepatischen First-Pass-Effekt. Deshalb und wegen der normal-postmenopausalen Estradiolspiegel unter Therapie (Tab. 2) ist es bei der niedrig-dosierten vaginalen Estradiolgabe nicht zu erwarten, dass es zu einer Risikoerhöhung von kardiovaskulären Erkrankungen, Schlaganfällen, thrombo-embolischen Ereignissen, gynäkologischen Karzinomen inkl. Mamma-Ca oder von Demenz kommt. Die WHI Observational Study belegt diese Annahme bei 45 663 nicht-hysterektomierten Studienteilnehmerinnen ohne systemische MHT (12). In diesem Kollektiv waren über die mediane Beobachtungsdauer von 7,2 Jahren die Risiken für CHD, Frakturen und Gesamtmortalität bei den Anwenderinnen von vaginalem Estrogen sogar signifikant niedriger als bei den Nichtanwenderinnen (Global Index, korrigierte Hazard Ratio 0.68; 95% Vertrauensintervall 0.55-0.86). Die übrigen Risiken waren nicht erhöht. Damit ist die in den meisten Beipackzetteln immer noch behauptete Risikozunahme für die in der WHI-Studie untersuchten Erkrankungen formell widerlegt. Diese Fehlinformation zu den Risiken sollte dringend entfernt werden.
Bei Patientinnen mit undiagnostizierten vaginalen Blutungen und solchen mit bekanntem oder vermutetem Endometriumkarzinom ist eine vaginale Estrogengabe kontraindiziert. Bei unklarer vaginaler Blutung unter Estrogen-Therapie muss eine endometriale Pathologie ausgeschlossen werden.
Mit Estrogenen bei schwerem GMS
Ein schweres GMS sollte mit höher bis hoch dosierten lokal-vaginalen Estradiol-Crèmen (0.01%) behandelt werden können (3), weil unter inadäquat niedrig-dosierter Therapie wie auch unter einer hochdosierten Behandlung von nur 4 Wochen keine dauerhafte Besserung eintreten kann. Da in der Schweiz keine entsprechenden Präparate erhältlich sind, muss zu Magistralrezepten oder zu im Ausland erhältlichen Präparaten gegriffen werden.
Die Anordnung von EMA/PRAC für die EU-Länder, dass eine Behandlung mit solchen Präparaten nicht länger als 4 Wochen dauern darf, widerspricht den Grundprinzipien zur vaginalen Gabe von Estrogenen beim GMS (Tab. 3) und ist nicht evidenzbasiert. Jedes deswegen nicht korrekt behandelte schwere GMS kann eine verheerende Wirkung auf die vulvovaginale, urogenitale und sexuelle Gesundheit der betroffenen Frauen haben. Sie kann Partnerschaft, Sexualleben, Selbstsicherheit und Lebensqualität zerstören.
Eine langdauernde höherdosierte vaginale Estradioltherapie ist bei richtiger Durchführung sicher. Unter hochdosierten Vaginalcrèmen fand sich bisher einzig eine mögliche dosisabhängige Zunahme der Endometriumdicke (5). Die WHI Observational Study, in der alle (auch hochdosierten) vaginalen Estrogenpräparate zusammen analysiert wurden, fand bei 45’663 Studienteilnehmerinnen ohne systemische MHT keine Zunahme der bereits oben erwähnten Risiken, auch nicht für Endometriumkarzinome (12).
Zur vom BfArM aus meiner Sicht weit überschätzten Gefahr hochdosierter vaginaler Präparate ist Folgendes festzuhalten: Gemäss BfArM werden unter hochdosierten vaginalen Estrogenen Serumwerte erreicht, die bis fünfmal über dem postmenopausalen Referenzbereich des BfArM liegen (1). Dies entspricht der frühen bis mittleren Follikelphase und damit auch den Estradiolwerten unter transdermaler systemischer MHT. Für diese wurde eine analoge Beschränkung der Behandlungsdauer nie in Betracht gezogen. Warum also bei den vaginalen Präparaten? Werden bei hoch-dosierter vaginaler Estradiol-Gabe Vorsichtsmassnahmen erwogen, so sollten diese aus pharmakodynamischen und metabolischen Gründen mit den Regeln übereinstimmen, die für eine transdermale systemische Estradiol-Gabe (Patches, Gels; ≤ 50µg/Tag) gelten. Ein Vergleich mit peroralen Studien (Million Women Study und WHI-Studie (RCT-Arm)) ist falsch und missachtet die entscheidenden Unterschiede zwischen oraler und vaginaler Estrogengabe. Zudem sollten in den Beipackzetteln, auf die aktuellesten neuen Datenanalysen der WHI-Studien Bezug genommen werden (16), und nicht auf alte, durch neue Daten überholte und deshalb unrichtige Auswertungen. Bestehen bei hochdosiertem vaginalen Estradiol begründete Bedenken wegen eines möglicherweise erhöhten Risikos für Endometrium-Karzinome, wäre die Empfehlung einer Gestagenbeigabe zu hochdosierten Präparaten ausreichend. Für darüber hinausgehende Massnahmen – wie einer Limitierung der Anwendungsdauer auf 4 Wochen – fehlt die erforderliche Evidenz.
Mögliche Alternative: Vaginale Gabe von DHEA
Ospemifen (2) wird vermutlich in der Schweiz nicht eingeführt. Dafür wird noch dieses Jahr ein vaginales Präparat zur Behandlung des GMS mit DHEA (Prasteron) registriert. Klinische Studien mit täglicher intravaginaler Administration von 6.5 mg DHEA (Prasteron) zeigen eine statistisch signifikante günstige Wirkung auf die Symptome einer vulvo-vaginalen Atrophie (GMS) (14). DHEA dringt in die Zelle ein und entfaltet dort durch die intrazelluläre Umwandlung von DHEA zu Estradiol und Testosteron eine intrakrine Wirkung. Die aus DHEA gebildeten intrazellulären Steroide Estradiol und Testosteron werden nicht nach aussen abgegeben: die Serum-Spiegel beider Steroide bleiben unter Therapie unverändert (15). Somit ist auch nicht mit einer Endometriumstimulation oder mit systemischen Nebenwirkungen zu rechnen. Dies bestätigen die klinischen Daten (14).
Gartenstrasse 67
4052 Basel
martin.birkhaeuser@bluewin.ch
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Beitrag deklariert.
- Für niedrig-dosierte vaginale Estrogenpräparate gilt weiterhin, dass auch bei einer Therapiedauer von > 1 Jahr eine Gestagenbeigabe nicht notwendig ist.
- In Beipackzetteln von niedrigdosierten vaginalen Estrogenpräparaten wird fälschlicherweise auf ein mögliches erhöhtes Risiko für Herz-Kreislauf-Erkrankungen, Thromboembolien, Schlaganfälle und Brustkrebs hingewiesen. Diese Warnung ist nicht evidenzbasiert, widerspricht einergrossen prospektiven langdauernden Beobachtungsstudie und verunsichert einzig die Patienti . Sie sollte entfernt werden.
- Bei hochdosierten vaginalen Präparaten wären höchstens Risiken zu erwarten, wie sie für eine normaldosierte transdermale systemische Gabe bekannt sind (≤ 50 μg Estradiol/Tag). Allfällige Empfehlungen zur Therapie sollten daher für beide Behandlungsprinzipien die gleichen sein. Eine zusätzliche Gestagengabe ist hier zum Endometriumschutz ausreichend.
- Die in der EU geltende Limitierung einer hochdosierten vaginalen Estrogen-Therapie auf < 4 Wochen steht im Gegensatz zum Prinzip, dass eine vaginale Behandlung lange (oft über Jahre!) fortgeführt werden muss, um den Nutzen aufrecht zu erhalten, und ist nicht evidenzbasiert. Sie führt einzig dazu, dass Frauen mit schwerem genito-urethralem menopausalen Syndrom nicht mehr korrekt behandelt werden können.
- Die europäische Arzneimittelbehörde (EMA) sollte nicht ohne sichere Grundlage und gegen solide Evidenz die alternativlose Behandlung eines schweren GMS mit einem hochdosierten vaginalen Estradiolpräparat durch Empfehlungen verunmöglichen, sondern sie im Rahmen einer verantwortungsbewussten Nutzen-Risiko-Abwägung sicherer machen.
Messages à retenir
- Pour les préparations oestrogéniques faiblement dosées, l’adjonction d’un progestatif n’est-pas nécessaire, même en cas de traitement prolongé (> 1 année).
- Les notices d’emballage de préparations hormonales vaginales faiblement dosées mentionnent à tort un risque potentiel augmenté pour les maladies cardiovasculaires, thrombo-emboliques et cérébrovasculaires ainsi que les cancers du sein. Cette mise en garde est contredite par les résultats d’une grande étude observationnelle prospective de longue durée, elle n’est pas fondée sur des preuves et devrait être éliminée des textes. Elle inquiète inutilement les patientes.
- Un traitement vaginal hautement dosé provoquerait au maximum des effets secondaires comparables à un traitement hormonal systémique percutané normalement dosé (≤ 50µg estradiol / jour). Les recommandations pour les deux formes de traitement devraient donc être les mêmes. L’adjonction d’un progestatif garantit la protection de l’endomètre.
- La limitation dans le temps (< 4 semaines) pour un traitement vaginal fortement dosé telle qu’elle figure dans la publication de l’UE, contredit le principe que, pour être efficace et durable, un traitement vaginal doit être maintenu pendant longtemps (souvent pendant des années). De plus, elle n’est pas fondée sur des preuves. Elle a comme seule conséquence de rendre impossible le traitement correct des femmes souffrant d’un syndrome génito-urinaire de la ménopause sévère (GMS).
- L’Agence Européenne des Médicaments (EMA) ne devrait pas empêcher un traitement vaginal à l’estradiol hautement dosé, pour lequel des alternatives manquent, sans fondements sûrs et contre toute évidence. Son rôle serait bien plus de rendre plus sûr un traitement du GMS, en l’occurrence le traitement vaginal à haute dose, par une analyse soigneuse des risques et bénéfices.
1. BfArM. Risikobewertungsverfahren. Hochdosierte, estradiolhaltige Cremes: Ueberprüfung der Risiken. Release-Datum: 17.01.2020. https://www.bfarm.de/SharedDocs/Risikoinformationen/Pharmakovigilanz/DE/RV_STP/a-f/estradiol-creme.html
2. Wüest A, Stute P. Vulvovaginale Beschwerden in der Menopause, Update 2018. GYNÄKOLOGIE 3: 12-17, 2018.
3. Crandall CJ, Treatment of Vulvovaginal Atrophy. JAMA Published online September 26, 2019. doi:10.1001/jama.2019.15100
4. D. W. Sturdee and N. Panay, on behalf of the International Menopause Society Writing Group. Recommendations for the management of postmenopausal vaginal atrophy. CLIMACTERIC; Early Online, 1–14, 2010.
5. Lethaby A, Ayeleke RO, Roberts H. Local estrogen for vaginal atrophy in postmenopausal women. Cochrane Database of Systematic Reviews 2016, Issue 8. Art. No.: CD001500. DOI: 10.1002/14651858.CD001500.pub3.2016.
6. aus United States Pharmacopeia (downloaded 10. Nov. 2010)
7. 32. Constantine GD, Graham S, Lapane K et al.Endometrial safety of low-dose vaginal estrogens in menopausal women: a systematic evidence review. Menopause, 26: 800-807, 2019.
8. Crandall CJ, Diamant A, Santoro N. Safety of vaginal estrogens, a systematic review. Menoopause: January 6, 2020. doi: 10.1097/GME.0000000000001468. [Epub ahead of print]
9. Birkhäuser M, Bürki R, De Geyter C, Imthurn B et al. Aktuelle Empfehlungen zur Menopausalen Hormon-Therapie (MHT). Expertenbrief No 42 der SGGG, 2015.https://www.sggg.ch/fileadmin/user_upload/Formulardaten/42_Menopausale_Hormon-Therapie 2015.pdf
10. NAMS. Management of symptomatic vulvovaginal atrophy: 2013 position statement of The North American Menopause Society. Menopause, Vol. 20, No. 9: 888-902, 2013.
11. Faubion AA, Larkin LC, Stuenkel CA et al. Management of genitourinary syndrome of menopause in women with or at high risk for breast cancer: consensus recommendations from The North American Menopause Society and The International Society for the Study of Women’s Sexual Health Menopause: Vol. 25, No. 6: 1-13, 2018.
12. Crandall CJ, Hovey KM, Andrews CA et al. Breast cancer, endometrial cancer, and cardiovascular events in participants who used vaginal estrogen in the Women’s Health Initiative Observational Study. Menopause; Jan;25(1):11-20, 2018
13. Mitchell CM, Reed SD, Diem S et al. Efficacy of Vaginal Estradiol or Vaginal Moisturizer vs Placebo for Treating Postmenopausal Vulvovaginal Symptoms. A Randomized Clinical Trial. JAMA Intern Med; 178(5): 681–690, 2018
14. Labrie F, Archer DF, Koltun W et al Efficacy of intravaginal dehydroepiandrosterone (DHEA) on moderate to severe dyspareunia and vaginal dryness, symptoms of vulvovaginal atrophy, and of the genitourinary syndrome of menopause. Menopause; 23: 243-256, 2016.
15. Labrie F, Bélanger A, Pelletier et al. Science of intracrinology in postmenopausal women- Menopause 24: 702-712, 2017.
16. JoAnn E. Manson Andrew M. Kaunitz. Menopause Management — Getting Clinical Care Back on Track. N Engl J Med 374;9: 803-806, 2016.
info@gynäkologie
- Vol. 10
- Ausgabe 1
- Februar 2020