- Schwangerschaft nach Tumorerkrankungen
Das zunehmende Alter von Schwangeren in der Schweiz stellt Gynäkologen wie Geburtshelfer vor verschiedene Herausforderungen. In den vergangenen Jahrzehnten ist das Alter der Mütter bei der ersten Geburt kontinuierlich bis aktuell auf 31 Jahre gestiegen (1). Gynäkologen und Geburtshelfer werden nicht selten damit konfrontiert, dass Schwangere in der persönlichen Anamnese über eine Tumorerkrankung berichten oder dass Patientinnen mit einem Brustkrebs oder einer gynäkologischen Krebserkrankung noch eine offene Familienplanung haben.
L’ âge continuellement croissant des femmes enceintes en Suisse met les gynécologues et obstétriciens devant de nombreux défis. Ainsi, dans les dernières décennies, l’ âge des mères au moment de la naissance de leur premier enfant a évolué jusqu’à actuellement 31 ans (1). De ce fait, il n’est pas rare que les gynécologues et obstétriciens se voient confrontés avec la situation d’une femme enceinte ayant une maladie tumorale dans son anamnèse ou celle d’ une femme atteinte d’un cancer du sein ou de la sphère gynécologique qui aimerait encore avoir des enfants.
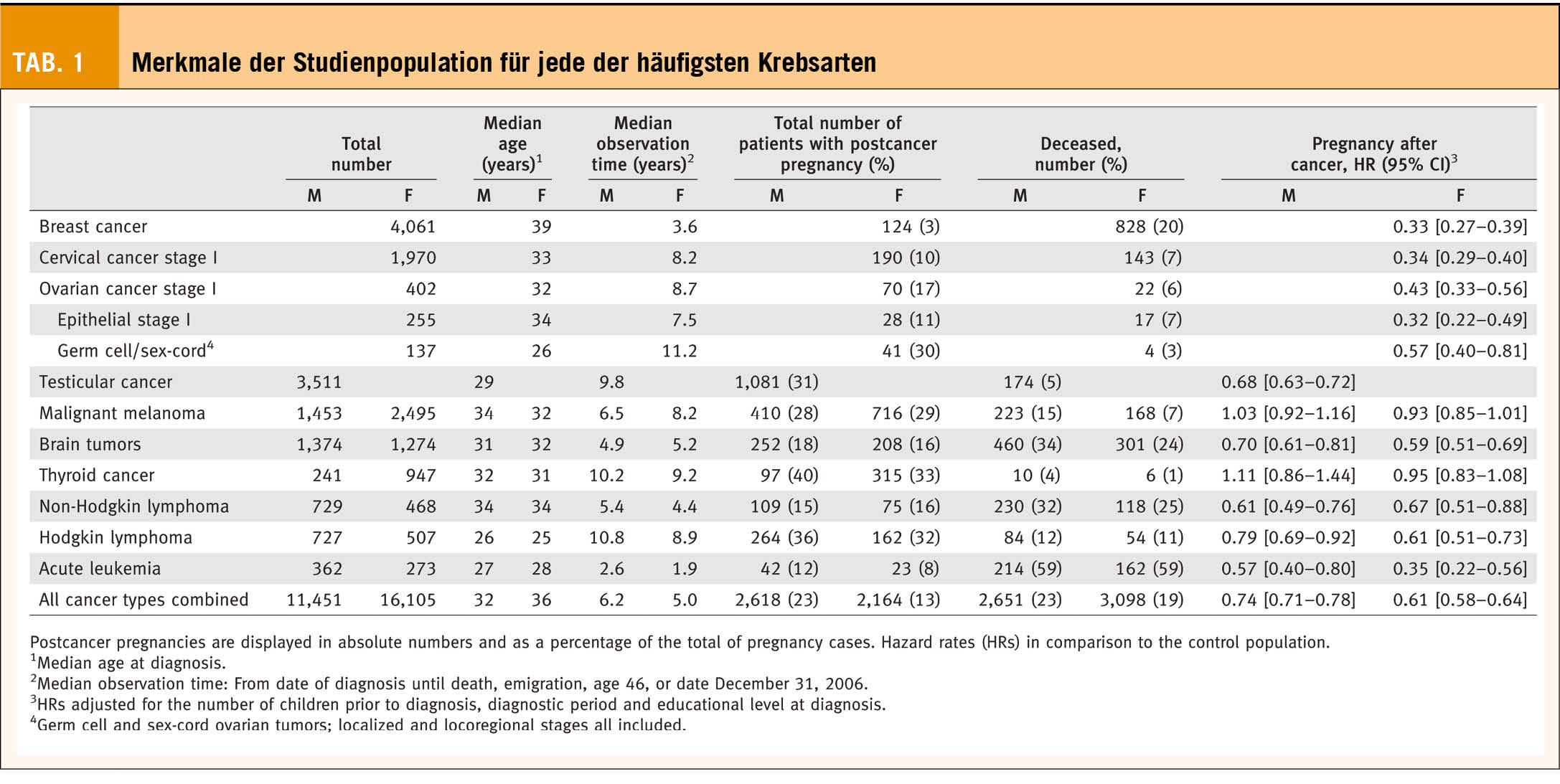
Immerhin 5% aller Tumorerkrankungen werden in der Altersgruppe der 15-39-Jährigen diagnostiziert. Schaut man sich die 5-Jahresüberlebensraten von Kindern, Adoleszenten und jungen Erwachsenen nach einer Tumorerkrankung an, finden sich hier erfreulicherweise Raten von fast 85% (2). Somit ist nach abgeschlossener Primärbehandlung nicht selten die Familienplanung ein wichtiges Thema. Der Brustkrebs ist bekanntermassen das häufigste Karzinom der Frau und ca. 11% der Frauen sind bei Diagnosestellung unter 45 Jahren alt, damit ist die Brustkrebserkrankung die zweithäufigste Tumorerkrankung in der Altersgruppe der bis 39-jährigen. Häufiger findet sich nur das Schilddrüsenkarzinom. Abhängig von der Art des Karzinoms finden sich Schwangerschaftsraten vergleichbar zur Normalpopulation (nach Melanom oder Schilddrüsenkarzinom) oder eben doch deutlich schlechtere Schwangerschaftsraten (Brustkrebs), vergleich hierzu Tabelle 1 (18).
Fertilitätserhaltende Massnahmen vor Therapiebeginn
Unbestritten ist, dass sowohl bei Jugendlichen als auch bei jungen Erwachsenen die Beratung rund um das Thema Fertilitätserhalt vor Beginn der Tumortherapie erfolgen soll. In einigen Studien erfolgte dies nur bei 50% aller Tumorpatientinnen (3). Nicht nur das teilweise lückenhafte Wissen der erstbehandelnden Ärzte stellt bisweilen eine Herausforderung dar, auch Patientinnen sind rund um die Diagnose mit vielen Informationen und Ängsten konfrontiert (3). Bereits eine einzelne Dosis einer gonadentoxischen Therapie kann die Fertilität negativ beeinflussen, mit jeder weiteren Gabe kumuliert dies aber deutlich. Hier ist vor allem das Cyclophosphamid zu nennen, welches einen Stellenwert in der Behandlung des Mammakarzinoms hat. Nach Abschluss der Pubertät ist die Oozytenkonservierung oder die Embryonenkonservierung die optimale Therapie für den Fertilitätserhalt. Dies setzt voraus, dass eine Verzögerung der Chemotherapie für 2-3 Wochen möglich ist, um eine ovarielle Stimulation und anschliessende Punktion durchzuführen. Auch bei hormonabhängigen Tumoren, i.b. dem rezeptorpositiven Mammakarzinom, ist durch den regelmässigen Einsatz von Aromataseinhibitoren im Rahmen des mittlerweile zyklusunabhängigen Protokolls nicht mit einem schlechteren Outcome zu rechnen. Sollte die Tumorbehandlung keinen Aufschub erlauben oder handelt es sich um präpubertäre Mädchen ist eine operative Entfernung, meist laparoskopisch, von Ovarialgewebe mit Kryokonservierung möglich. Die Gabe von GnRH-Analoga zur Ovarprotektion während der Chemotherapie wird widersprüchlich diskutiert; so gibt es Stimmen, die dies nicht empfehlen, wenn vor Chemotherapiestart eine erfolgreiche fertilitätserhaltende Massnahme durchgeführt wurde (5).
Fertilitätserhaltende Operationen abhängig vom Tumorstadium
Während das Endometriumkarzinom in nur 4% unter 40 Jahren diagnostiziert wird und das Ovarialkarzinom nur in ca. 10% der Fälle bei Frauen unter 45 Jahren, stellt diese Altersgruppe bei Zervixkarzinompatientinnen mit fast 40% einen grossen Anteil dar. Abhängig vom Tumorstadium bei Erstdiagnose und den begleitenden Risikofaktoren kann in folgenden Situationen ein fertilitätserhaltendes Vorgehen mit den Patientinnen diskutiert werden: es muss sich um Plattenepithel- oder Adenokarzinome handeln, die Tumorgrösse soll ≤ 2 cm betragen und es finden sich keine positiven Lymphknoten. Der histologische Subtyp des neuroendokrinen Zervixkarzinom sollte bei schlechteren Langzeitprognosen mit erhöhtem Rezidivrisiko nicht fertilitätserhaltend operiert werden. Konkret wird stadienabhängig das folgende Vorgehen empfohlen: im Stadium T1a1 und fehlender Lymphgefässinvasion ist kein operatives Lymphknotenstaging gefordert. Eine Konisation oder einfache Trachelektomie ist in den Stadien T1a1 und T1a2 mit negativen Lymphknoten und L0 möglich. In allen anderen Fällen ist eine radikale Trachelektomie gefordert. Bei allen Patientinnen mit einer Trachelektomie sollte eine permanente Cerclage gelegt werden (6). Die Schwangerschaftsrate nach radikaler Trachelektomie beträgt in retrospektiven Studien bis zu 66%. In einer Untersuchung von Speiser et al. (7) wurden 50 von 76 Patientinnen, die schwanger werden wollten, schwanger. Die Lebendgeburtenraten betrugen bis zu 70%, wobei kein Unterschied festgestellt werden konnte, welches operative Verfahren bei der Trachelektomie angewendet wurde (8). Die Standardtherapie des frühen Endometriumkarzinoms umfasst die einfache Hysterektomie mit Adnexektomie beidseits +/- Lymphonodektomie. Damit wird eine 5 Jahresüberlebensrate von 95% erreicht. Weicht man davon ab, müssen Patientinnen darüber aufgeklärt werden, dass sich allenfalls ihre Langzeitprognose verschlechtert (9). Ein organerhaltendes Vorgehen sollte bislang nur angeboten werden, wenn es sich um ein G1 Karzinom handelt, das mit einer Curettage diagnostiziert wurde, eine Pipelle-Untersuchung scheint hier unterlegen zu sein. Um die klinische Tumorausdehnung zu beurteilen ist neben dem Ultraschall eine MRI Untersuchung empfohlen. Einige Autoren weisen zudem daraufhin, dass durch das organerhaltende Vorgehen das synchrone Vorliegen eines Ovarialkarzinoms übersehen wird, dies lag in Studien bei bis zu 25% (10). Unter der Therapie mit oralen Gestagenen oder levonorgestrelhaltiger Spirale kam es in den Studien bei 75% der Patientinnen zu einer Remission. Das Therapieansprechen muss nach 6 Monaten mittels Curettage kontrolliert werden. Zeigt sich hier kein Therapieansprechen muss der Patientin die Operation empfohlen werden. Zu beachten ist ebenso ein Rezidivrisiko in 30-40%. Daher sollte auch nach abgeschlossener Familienplanung die Hysterektomie mit beidseitiger Adnexektomie empfohlen werden. Im Fall einer erfolgreichen medikamentösen Tumortherapie liegt die Lebengeburtenrate nach Endometriumkarzinom bei 28-39%. Bislang empfehlen alle Guidelines lediglich bei G1 Endometriumkarzinomen die Möglichkeit des konservativen Vorgehens. Eine aktuelle Studie untersuchte bei 23 Patientinnen mit einem G2 endometrioiden Endometriumkarzinom, ob auch hier ein solches Vorgehen möglich sei. Auch in diesem Kollektiv zeigt sich ein Ansprechen auf die Therapie von 58.8 % sowie eine Lebendgeburtenrate von 30%. Bis zum Ende der Beobachtungszeit waren 22 von 23 Patientinnen rezidivfrei. Kritisch betrachtet wird der Umstand, dass die Patientinnen, denen aufgrund des Alters oder der abgeschlossenen Familienplanung die definitive Operation empfohlen wurde, dies abgelehnt haben (11). Bei den Erkrankungen des Ovars müssen wir zwischen den epithelialen Tumoren mit einer Häufigkeit von 90-95%, mit der Unterscheidung in Borderlinetumore oder invasive Tumore und den nicht epithelialen Tumoren, die wesentlich seltener sind, unterscheiden. Insgesamt beträgt der Anteil der Borderlinetumoren an den epithelialen Tumoren ca. 15% und betrifft häufiger junge Patientinnen. Allen Ovarialtumoren gemein ist, dass ein korrektes operatives Staging gefordert ist. Wird ein fertilitätserhaltendes Vorgehen gewählt, ist die Patientin über das erhöhte Rezidivrisiko zu informieren. Im Falle der Borderlinetumoren ist die einfache Zystenentfernung mit einem signifikant höheren Rezidivrisiko verbunden als die einseitige Adnexektomie. In Bezug auf die Schwangerschaftsrate zeigten sich abhängig vom gewählten Vorgehen sehr ähnliche Schwangerschaftsraten von 40-45%, so dass auch aus diesem Grund die alleinige Zystenentfernung nicht bevorzugt werden soll (12). Das seltene einseitige frühe Ovarialkarzinom kann fertilitätserhaltend operiert werden, wobei sich hier in Studien 5-Jahresüberlebensraten von 87% zeigen mit Schwangerschaftsraten bis zu 60% (13).
Schwangerschaftsbetreuung
Bei der Schwangerschaftsbetreuung gilt es zu eruieren, ob die Patientinnen nach der Tumordiagnose spezielle Risiken aufgrund der erfolgten Therapie haben. Frauen, die im Kindesalter eine erfolgreiche Tumortherapie hatten, zeigten in Studien ein erhöhtes Risiko für Frühgeburtlichkeit und Kinder mit niedrigem Geburtsgewicht (14). Ebenso wird teilweise ein erhöhtes Risiko für Präeklampsie postuliert (15). Ein erhöhtes Risiko für kongenitale Anomalien oder chromosomale Syndrome wird hingegen nicht beschrieben. Bei der Betreuung von Patientinnen nach radikaler Trachelektomie sollte eine Schwangerschaft erst nach 6-12 Monaten angestrebt werden. In diesem Kollektiv ist das Hauptrisiko die Frühgeburt mit bis zu 57%. Durch den verkürzten Gebärmutterhals ist das Infektrisiko mit Chorioamnionitis und damit verbunden das Auftreten eines vorzeitigen Blasensprungs die Hauptursache für die Frühgeburt. Daher ist jede Schwangerschaft in dieser Situation als Hochrisikoschwangerschaft zu behandeln. Eine primäre Sectio ist obligat zu indizieren. Nach der Therapie eines Mammakarzinoms scheint das Risiko für Frühgeburtlichkeit und small-for-gestational-age-Kinder kleiner zu sein, wenn die Therapie, insbesondere eine Chemotherapie, mehr als 2 Jahre zurück liegt (16), in diesem Zeitraum treten zudem häufig Rezidive auf, so dass auch aus diesem Grund so lange mit der Familienplanung gewartet werden sollte. Eine obligate Kontrolle der Herzfunktion mittels Echokardiogarphie nach einer anthrazyklinhaltigen Chemotherapie oder Trastuzumabgabe ist individuell zu entscheiden. Eine Schwangerschaft nach Brustkrebs zeigte in Studien bessere Überlebensdaten für diese Frauen als für die Patientinnen, die nicht schwanger wurden, dies auch unabhängig vom Rezeptorstatus des Karzinoms (17). Unbestritten ist, dass nach der Schwangerschaft und Stillzeit eine unterbrochene antihormonelle Therapie für die verbleibende Zeitdauer fortgesetzt werden soll.
Copyright bei Aerzteverlag medinfo AG
Stadtspital Triemli
Frauenklinik
Birmensdorferstrasse 501
8063 Zürich
heike.passmann@triemli.zuerich.ch
Die Autorin hat im Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
- Jede Patientin mit offener Familienplanung und Krebsdiagnose soll
vor Therapiebeginn eine Fertilitätsberatung erhalten. - Die Oozytenkonservierung, Embryonenkonservierung oder die
Kryokonservierung von Ovarialgewebe sind je nach Altersgruppe die Möglichkeiten für einen Fertilitätserhalt. - Die operativen Guidelines sollten stadienabhängig korrekt durchgeführt werden, um die Prognose nicht negativ zu beeinflussen.
- Schwangere nach einer Krebsdiagnose haben kein erhöhtes Risiko
für kongenitale Anomalien oder chromosomale Syndrome.
Messages à retenir
- Toute patiente n’ayant pas complété son planning familial chez qui un cancer est diagnostiqué doit être conseillée sur les possibilités de préservation de sa fertilité avant le début du traitement oncologique.
- La conservation d’ovocytes, la conservation d’embryons ou la cryoconservation de tissu ovarien sont, selon le groupe d’âge, les possibilités de préservation de la fertilité.
- Pour le traitement chirurgical, les directives des guide-lines devraient être suivies par stades, afin de ne pas influencer négativement le pronostic.
- Dans une grossesse après traitement pour cancer il n’y a pas de risque accru pour des anomalies congénitales ou des syndromes
chromosomiques.
1. bfs.admin.ch 2019
2. seer.cancer.gov/statfacts/htmlC.
3. Armuand et al. Sex differences in fertility -related information received by young adult cancer survivors. J. Clin Oncol 2012 ; 30 : 2147
4. Benedict et al: Fertility preservation and cancer. Challenges for adolescent and young adult patients, Curr Opin Support Palliat Care, 2016 March, 10 (1) : 87-94
5. Oktay K, Harvey B. et al : Fertility preservation in Patients with Cancer : ASCO Clinical Practice Guideline Update, J Clin Oncol 36 : 1994-2001
6. Cibula D. et al : The European Society of Gynaecological Oncology/European Society for Radiotherapy and Oncology/European Society of Pathology Guidelines for the Management of Patients with Cervical Cancer 2018 Jun;472(6):919-936.
7. Speiser D. et al.: Radikale vaginale Trachelektomie. Dtsch Arztebl International, 2013. 110(17): p. 289-295.
8. Bentivegna E. et al. : Fertility results and pregnancy outcomes after conservative treatment of cervical cancer: a systematic review of the literature. Fertil Steril, 2016. 106(5): p. 1195-1211.e5
9. Gallos I.D. et al. : Regression, relapse, and live birth rates with fertility-sparing therapy for endometrial cancer and atypical complex endometrial hyperplasia: a systematic review and metaanalysis. Am J Obstet Gynecol, 2012. 207(4): p. 266 e1-12.
10. Walsh C. et al. : Coexisting ovarian malignancy in young women with endometrial cancer. Obstet Gynecol, 2005. 106(4): p. 693-9.
11. Falcone F. et al : Fertility-sparing treatment for intramucous, moderately differentiated, endometrioid endometrial cancer: a Gynecologic Cancer Inter-Group
12. (GCIG) study ; J Gynecol Oncol. 2020 Sep;31(5):e74
13. Vasconcelos I. et al : Conservative surgery in ovarian borderline tumours: a meta-analysis with emphasis on recurrence risk; Eur J for Cancer 2015 Mar;51(5):620-31
14. Feichtinger et al. : Fertility Preservation in women with cervical, endometrial or ovarian cancers ; Gynecol Oncol Res Pract. 2016 Jul 27;3 :8.
15. Mueller BA et al. : Pregnancy outcomes in female childhood and adolescent cancer survivors. A linked cancer-birth registry analysis : Arch Pediatr Adolesc Med. 2009 ; 163 :879-886
16. Armuand G. : Adverse obstetric outcomes among female childhood and adolescent cancer survivors in Sweden: A population‐based matched cohort study ; Acta Obstet Gynecol Scand. 2019 Dec (12) : 1603-1611
17. Black Kz et al. : Prevalance of preterm, low birthweight, and small for gestational age delivery after breast cancer diagnosis : a population based study. Breast Cancer Res. 2017 ; 19(1) :11
18. Azim HA Jr et al : Prognostic impact of pregnancy after breast cancer according to estrogen receptor status : a multicenter retrospectiv study. J Clin Oncol 2013 ; 31 :73
19. Stensheim et al: Pregnancy after adolescent and adult cancer : a population.based matched cohort study ; Int J Cancer. 2011 ;129 (5):1225-36
info@gynäkologie
- Vol. 11
- Ausgabe 1
- März 2021