- Therapie des Eisenmangels in der Schwangerschaft
schaft. Wegen der hohen Prävalenz und der Möglichkeit der Intervention lohnt es sich, Eisenmangel zu detektieren und zu behandeln. Die meisten Frauen verfügen nicht über ausreichende Eisenreserven bei einer Schwangerschaft, um den perinatalen Eisenbedarf für Mutter und Fötus zu decken. Durch die Eisenhandlung können zahlreiche Symptome bei der Mutter behandelt werden und das Kind kann quasi in utero vor schweren Konsequenzen geschützt werden. Die primäre Intervention bei isoliertem Eisenmangel ist orales Eisen, das allerdings eine hohe Unverträglichkeit bei geringer Wirksamkeit aufweist. Parenterales Eisen zeichnet sich durch eine hohe Wirksamkeit bei im Allgemeinen guter Verträglichkeit aus. Bei der Diagnostik des Eisenmangels hat sich ein Ferritingrenzwert von < 30 μg/L als guter Schwellenwert zur Detektion des Eisenspeichermangels durchgesetzt. Ein Hämoglobinwert < 110 G/L im ersten und dritten Trimenon und < 105 G/L im zweiten Trimenon kann als Anämie angesehen werden.
Iron deficiency and/or iron deficiency anemia complicate nearly 50 % of pregnancies globally, negatively impacting both maternal and fetal outcomes. Iron deficiency can cause a range of symptoms that range from aggravating to debilitating including fatigue, poor quality of life, pagophagia and restless leg syndrome. Iron deficiency and iron deficiency anemia are also associated with maternal complications including preterm labor, increased rates of cesarean delivery, postpartum hemorrhage and maternal death. Fetal complications include increased rates of low birth weight and small for gestational age newborns. Prenatal maternal anemia has also been associated with autism spectrum disorders in the neonate, although causation is not established. Deficiency in the newborn is associated with compromised memory, processing, and bonding, with some of these deficits persisting into adulthood. Despite the prevalence and consequences associated with iron deficiency in pregnancy, data show that it is routinely undertreated. Due to the physiologic changes of pregnancy, all pregnant individuals should receive oral iron supplementation. However, the bioavailability of oral iron is poor and it is often ineffective at preventing and treating iron deficiency. Likewise, it frequently causes gastrointestinal symptoms that can worsen quality of life in pregnancy. Intravenous iron formulations administered in a single or multiple dose series are now available. There is increasing data suggesting that newer intravenous formulations are safe and effective in the second and third trimesters and should be strongly considered in pregnant individuals without optimal response to oral iron repletion.
Keywords: Iron, Iron Deficiency, Anemia (Anaemia), symptoms, pregnancy, iron treatment, iron therapy
Einleitung
Eisenmangel ist der weltweit am häufigsten auftretende Mikronährstoffmangel und folglich ist die Anämie in der Schwangerschaft vor allem auf Eisenmangel zurückzuführen. Gemäss WHO-Daten führen Eisenmangel und Anämie bei etwa 30–60 % der Schwangerschaften weltweit zu Komplikationen. Während der Schwangerschaft leiden fast 75 % der Schwangeren unter Eisenmangel im dritten Trimester, wenn man einen cut off Wert von Ferritin < 30 µg/L zu Grunde legt. Trotz der hohen Prävalenz und den negativen Auswirkungen des Eisenmangels und der Anämie auf die mütterliche und fetale Morbidität, wird Eisenmangel oft nicht ausreichend diagnostiziert und behandelt (1–3).
Die Diagnose und Behandlung der Eisenmangelanämie in der Schwangerschaft ist zwar relativ einfach, wird aber häufig übersehen und/oder von den betreuenden Gynäkologinnen nicht optimal gehandhabt. Ein Problem bei der Labordiagnose des Eisenmangels in der Schwangerschaft ist der fehlende Konsens in der Literatur, da die vorliegenden Studien uneinheitliche Ferritingrenzwerte für die Bestimmung von Eisenmangel verwenden. Eisenmangelanämie in der Schwangerschaft wird meist definiert als Serum Ferritin < 15–30 µg/L und einem Hämoglobin < 110 G/L, wobei der Wert < 110 G/L nicht den physiologischen unteren Schwellenwert des Hämoglobins im zweiten Trimester von 105 G/L berücksichtigt. Die Verwendung eines Ferritingrenzwertes von < 30 µg/L erhöht die Sensitivität der Erfassung des Eisenmangels, es fehlen jedoch Untersuchungen zu schwangerschaftsspezifischen Grenzwerten (5, 10, 11).
Die Ursachen des Eisenmangels sind bekanntermassen vielfältig und abhängig von sozio-ökonomischen Faktoren, Ernährungsgewohnheiten, Alter und Herkunft der Schwangeren, vorbestehendem Eisenmangel und Komorbiditäten, vor allem gastro-intestinalen Erkrankungen wie Zöliakie oder Morbus Crohn. 30–50 % der Frauen weisen bereits vor der Konzeption einen Eisenmangel auf (6–8).
Folgen von Eisenmangel und Anämie für die Schwangere und den Fetus
Eisenmangel kann asymptomatisch sein oder belastende Symptome hervorrufen. Dazu gehören Müdigkeit, Reizbarkeit («Brain fog»), Atemnot, Kopfschmerzen, Haarausfall, Konzentrationsschwäche, verminderte körperliche Leistungsfähigkeit und Restless-Leg-Syndrom. Diese Symptome werden sowohl von den Schwangeren als auch von den Gynäkolog/-innen oft als normal abgetan, da sie auf physiologische Veränderungen in der Schwangerschaft zurückgeführt werden können. Der isolierte oder latente Eisenmangel (ohne Anämie) kann die mütterliche Morbidität erhöhen, da das Risiko für eine Anämie, Plazentahypertrophie und Hypothyreose erhöht ist (13, 16, 17, 19, 23, 26).
Daneben ist das Risiko für vorzeitige Wehen und Frühgeburtlichkeit erhöht (9). Eine peripartale Eisenmangelanämie geht mit einem erhöhten Risiko an postpartaler Depression, verminderter Lebensqualität, postpartaler Anämie und Bluttransfusion einher (21). Schwerer Eisenmangel erhöht nachweislich die fötale und neonatale Morbidität. Erkenntnisse aus Tiermodellen deuten darauf hin, dass Eisenmangel in kritischen Phasen der fötalen Entwicklung zu Veränderungen des Hirnstoffwechsels, der Neurotransmission, der Epigenetik und der Myelinisierung führt, die sich beim Neugeborenen auswirken. Neuere klinische Studien zeigen, dass diese Folgen auch beim Menschen auftreten und beispielsweise ein Zusammenhang zwischen Eisenmangel und Autismus-Spektrum-Störung und Aufmerksamkeitsdefizit bei Jugendlichen besteht. Mütterlicher Eisenmangel führt zu niedrigen fötalen und neonatalen Eisenspeichern mit den entsprechenden Folgen (14,15,18, 27–31) (Abb. 1).
Screenig des Eisenmangels
Es besteht kein Konsens über Screening-Protokolle oder die routinemässige Durchführung eines Screenings auf Eisenmangel in der Schwangerschaft. Nur wenige Organisationen unterstützen ein Screening auf isolierten Eisenmangel, da es nur wenige Studien gibt, die eine Risikoverbesserung durch eine Behandlung belegen. In England wird seit kurzem ein risikobasiertes Screening empfohlen, bei Frauen mit Anämie in der Vorgeschichte, Multipara, Mehrlingsschwangerschaft, kurzem Schwangerschaftsintervall, Vegetarierinnen, Frauen mit hohem Blutungsrisiko bei der Geburt und Frauen, die Bluttransfusionen ablehnen. Das American College of OBGYN (ACOG) empfiehlt ein Screening auf Anämie und die generelle Eisensupplementierung bei Schwangeren. Die Ferritintestung soll gemäss ACOG nur bei einer Anämie durchgeführt werden, mit einem Schwellenwert von < 30 µg/L (WHO < 15 µg/L!) (Practice Bulletin 233, August 2021). Im Expertenbrief der SGGG (Nr. 77) empfehlen wir die Bestimmung von Hämoglobin und Ferritin im ersten Trimester und bei etwa 24–28 SSW zur Erfassung von Eisenmangel und Anämie bei den Schwangeren.
Behandlung
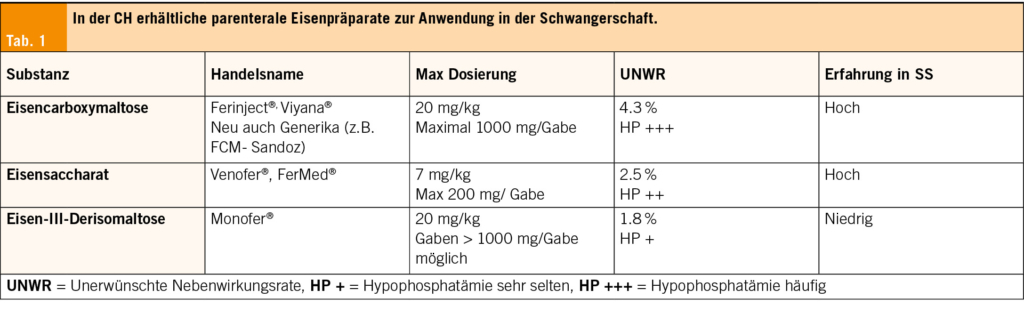
Mehrere nationale Guidelines empfehlen die generelle orale Eisensupplementierung bei Schwangeren (ACOG, Centers of Disease Control, WHO). Diese kann täglich oder alternierend alle zwei Tage erfolgen. Es konnte gezeigt werden, dass eine zweitägliche orale Eiseneinnahme die Eisenresorption bei erniedrigter unerwünschter Nebenwirkungsrate erhöht (4, 22). Es sollte die möglichst niedrigste Eisendosierung oral gewählt werden (etwa 30 mg elementares Eisen/ Dosis), da hohe Dosierungen zu einem Therapieabbruch bei bis zu 70 % der Frauen führen, aufgrund der gastrointestinalen Nebenwirkungen. Dabei ist darauf hinzuweisen, dass orales Eisen im ersten Trimester die einzige Behandlungsoption darstellt. Es sind zahlreiche orale Eisenpräparate vorhanden; generell gilt, dass Eisen-II-Salze eine höhere Rate an UWR aufweisen als beispielsweise Eisen-III-Komplexe. Gemäss Studien zeigen die sogenannten Eisen-Bisglycinate (Aminoeisenverbindung) eine gute Resorption und Wirksamkeit bei geringer UWR-Rate auf (16, 25). Ab dem zweiten Trimester stehen bei der Therapie der Eisenmangelanämie intravenöse Eisenpräparate zur Verfügung, die sich in der Schwangerschaft als sicher und wirksam erwiesen haben. Im Gegensatz zu oralem Eisen eignet sich nur intravenöses Eisen zur Therapie schwerer Eisenmangelzustände und Anämien, insbesondere, wenn wir eine Wirksamkeit in kurzer Zeit erwarten (24, 25, 42–49). Die Dosierungen entsprechen denen von nicht schwangeren Frauen.In den meisten Fällen können in der Schweiz heute hoch dosierte Einzeldosierungen verwendet werden, was aufgrund der Einfachheit der Anwendung und der Effektivität auch zu einer hohen Patientinnen-Zufriedenheit führt. Die häufigsten verwendeten parenteralen Eisenpräparate weltweit sind Eisen-Saccharat, Eisen-Dextran mit niedrigem Molekulargewicht (LMWD, Cave: NICHT hochmolekulares Dextran!). Eisen-Carboxymaltose (FCM), Ferumoxytol und Eisen-III-Derisomaltose (24, 25). In Bezug auf die allergischen Reaktionen und andere unerwünschte Nebenwirkungen sind die Präparate vergleichbar. In Vergleichsstudien zwischen parenteralem und oralem Eisen ist die Rate an UNW bei den oralen Präparaten im Allgemeinen höher. Vor allem aufgrund der gastro-intestinalen Nebenwirkungen. Eisencarboxymaltose hat gemäss vorliegenden Studien die höchste Rate an induzierter Hypophosphatämie nach Infusion, wobei schwere Hypophosphatämien nach Einzeldosierungen selten sind. In einer kürzlich publizierten Studie von der Klinik für Geburtshilfe der Universität Genf zeigte sich bei 3/22 Schwangeren eine Hypophosphatämie nach Eisencarboxymaltose vs 1/22 Schwangeren unter oralem Eisen (13 vs. 4 %). Der Unterschied war nicht signifikant und die Neugeborenen zeigten keine Hypophosphatämie in der Eisencarboxymaltose Gruppe (49). Die in der Schweiz empfohlenen und meist angewendeten Präparate sind in Tab. 1 aufgeführt. Bei der i.v. Eisentherapie sollen generell und speziell in der Schwangerschaft die von SWISSMEDIC empfohlenen Richtlinien eingehalten werden. Ebenso sind Kontraindikationen wie erstes Trimester, akute bakterielle Infektion und Status Anaphylaxie oder schwerer allergischer Reaktion nach i.v. Eisengabe zu beachten. Das Risiko einer anaphylaktischen Reaktion ist bei den neuen Eisenpräparaten unter 1 : 1000 einzuschätzen.
Indikationen für den Einsatz von parenteralem Eisen sind kein oder ungenügendes Ansprechen auf orales Eisen (Hb Anstieg
< 10G/L innert 14 Tagen), Unverträglichkeit und Non Compliance bei oraler Eiseneinnahme, gestörte Eisenresorption (bariatrische Eingriffe, chronische Darmerkrankungen, Zöliakie), schwere bestehende oder fortschreitende Anämie (vor allem
< 90 G/L), Notwendigkeit der raschen und effizienten Anämie Korrektur bei Risikofaktoren der Schwangeren (Plazenta praevia, hohes Blutungsrisiko, Gerinnungsstörungen, Ablehnung von Fremdblut, Status nach Atonie u.a.m) (42, 43, 48).
Die parenteralen Eisenpräparate werden auch vor allem zur Behandlung der postpartalen Anämie (Hb < 100G/L) in der Schweiz standardmässig im Wochenbett verwendet.
Copyright
Aerzteverlag medinfo AG
Gyn & Perinatal Zürich
Ärztezentrum Seefeld Hirslanden
Seefeldstrasse 214
8008 Zürich
C Breymann hält Vorträge und Fortbildungen für CLS-Vifor Schweiz und CLS- Vifor International und Pierre Fabre/ Robapharm Schweiz. Er ist ebenfalls an Publikationen über die jeweiligen Eisenpräparate beteiligt.
1. WHO/UNICEF/UNU. Iron deficiency anaemia: assessment, prevention and control, a guide for programme managers. World Health Organization Geneva Switzerland. 2001. WHO/NHD/01.3. In.
2. Lee AI, Okam MM. Anemia in pregnancy. Hematol Oncol Clin North Am. 2011;25(2):241–259, vii. [PubMed: 21444028] Murray C, Lopez AD. Global and regional cause-of-death patterns in 1990. Bulletin of the World Health Organization. 1994;72(3):447.
3. Osungbade KO, Oladunjoye AO. Preventive treatments of iron deficiency anaemia in pregnancy: a review of their effectiveness and implications for health system strengthening. J Pregnancy. 2012;2012:454601.
4. Zamani AR, Farajzadegan Z, Ghahiri A, KHADEMLOU M, Golshiri P. Effectiveness of twice weekly iron supplementation compared with daily regimen in reducing anemia and iron deficiency during pregnancy: a randomized trial in Iran. 2008.
5. Daru J, Allotey J, Peña-Rosas JP, Khan KS. Serum ferritin thresholds for the diagnosis of iron deficiency in pregnancy: a systematic review. Transfus Med. 2017;27(3):167–174.
6. Tang G, Lausman A, Abdulrehman J, et al. Prevalence of iron deficiency and iron deficiency anemia during pregnancy: a single centre Canadian study. Blood. 2019;134:3389.
7. Barton JC, Wiener HH, Acton RT, et al. Prevalence of iron deficiency in 62,685 women of seven race/ethnicity groups: The HEIRS Study. PLoS One. 2020;15(4):e0232125.
8. Campbell R, Wang H, Ahmed R. Risk Factors Contributing to Racial/Ethnic Disparities in Iron Deficiency in US Women. Current Developments in Nutrition. 2021;5(Supplement_2):725–725.
9. Ren A, Wang J, Ye RW, Li S, Liu JM, Li Z. Low first-trimester hemoglobin and low birth weight, preterm birth and small for gestational age newborns. Int J Gynaecol Obstet. 2007;98(2):124–128.
10. Read AJ, Waljee AK, Sussman JB, et al. Testing Practices, Interpretation, and Diagnostic Evaluation of Iron Deficiency Anemia by US Primary Care Physicians. JAMA Network Open. 2021;4(10):e2127827–e2127827.
11. Auerbach M, Abernathy J, Juul S, Short V, Derman R. Prevalence of iron deficiency in first trimester, nonanemic pregnant women. J Matern Fetal Neonatal Med. 2021;34(6):1002–1005.
12. Jaime-Perez JC, Herrera-Garza JL, Gomez-Almaguer D. Sub-optimal fetal iron acquisition under a maternal environment. Arch Med Res. 2005;36(5):598–602.
13. Scholl TO. Iron status during pregnancy: setting the stage for mother and infant. Am J Clin Nutr. 2005;81(5):1218s–1222s.
14. Kilbride J, Baker TG, Parapia LA, Khoury SA, Shuqaidef SW, Jerwood D. Anaemia during pregnancy as a risk factor for iron-deficiency anaemia in infancy: a case-control study in Jordan. Int J Epidemiol. 1999;28(3):461–468.
15. Kelly AM, MacDonald DJ, McDougall AN. Observations on maternal and fetal ferritin concentrations at term. Br J Obstet Gynaecol. 1978;85(5):338–343.
16. Elstrott B, Khan L, Olson S, Raghunathan V, DeLoughery T, Shatzel JJ. The role of iron repletion in adult iron deficiency anemia and other diseases. Eur J Haematol. 2020;104(3):153–161.
17. Bothwell TH. Iron requirements in pregnancy and strategies to meet them. Am J Clin Nutr. 2000;72(1 Suppl):257s–264s.
18. Colomer J, Colomer C, Gutierrez D, et al. Anaemia during pregnancy as a risk factor for infant iron deficiency: report from the Valencia Infant Anaemia Cohort (VIAC) study. Paediatr Perinat Epidemiol. 1990;4(2):196–204.
19. Gambling L, Danzeisen R, Gair S, et al. Effect of iron deficiency on placental transfer of iron and expression of iron transport proteins in vivo and in vitro. Biochem J. 2001;356(Pt 3):883–889. [PubMed: 11389698]
20. Soares NN, Mattar R, Camano L, Torloni MR. Iron deficiency anemia and iron stores in adultand adolescent women in pregnancy. Acta Obstet Gynecol Scand. 2010;89(3):343–349.
21. Juul SE, Derman RJ, Auerbach M. Perinatal iron deficiency: implications for mothers and infants. Neonatology. 2019;115(3):269–274.
22. Leonard AJ, Chalmers KA, Collins CE, Patterson AJ. Comparison of two doses of elemental iron in the treatment of latent iron deficiency: efficacy, side effects and blinding capabilities. Nutrients. 2014;6(4):1394–1405.
23. Yu X, Shan Z, Li C, et al. Iron deficiency, an independent risk factor for isolated hypothyroxinemia in pregnant and nonpregnant women of childbearing age in China. The Journal of Clinical Endocrinology & Metabolism. 2015;100(4):1594–1601.
24. Govindappagari S, Newman R, Burwick R. Iron-deficiency anemia in pregnancy and the role of intravenous iron. Contemporary OB/GYN Journal. 2021;66(07).
25. Auerbach M, James SE, Nicoletti M, et al. Results of the First American Prospective Study of Intravenous Iron in Oral Iron-Intolerant Iron-Deficient Gravidas. Am J Med. 2017;130(12):1402– 1407.
26. Zimmermann MB, Burgi H, Hurrell RF. Iron deficiency predicts poor maternal thyroid status during pregnancy. J Clin Endocrinol Metab. 2007;92(9):3436–3440.
27. Tran PV, Fretham SJ, Carlson ES, Georgieff MK. Long-term reduction of hippocampal brain- derived neurotrophic factor activity after fetal-neonatal iron deficiency in adult rats. Pediatr Res. 2009;65(5):493–498.
28. Tamura T, Goldenberg RL, Hou J, et al. Cord serum ferritin concentrations and mental and psychomotor development of children at five years of age. J Pediatr. 2002;140(2):165–170.
29. Lozoff B, Beard J, Connor J, Barbara F, Georgieff M, Schallert T. Long-lasting neural and behavioral effects of iron deficiency in infancy. Nutr Rev. 2006;64(5 Pt 2):S34–43; discussion S72–91.
30. McArdle HJ, Gambling L, Kennedy C. Iron deficiency during pregnancy: the consequences for placental function and fetal outcome. Proceedings of the Nutrition Society. 2014;73(1):9–15.
31. Wiegersma AM, Dalman C, Lee BK, Karlsson H, Gardner RM. Association of prenatal maternal anemia with neurodevelopmental disorders. JAMA psychiatry. 2019;76(12):1294–1304.
32. Shao J, Lou J, Rao R, et al. Maternal serum ferritin concentration is positively associated with newborn iron stores in women with low ferritin status in late pregnancy. J Nutr. 2012;142(11):2004–2009.
33. Moretti D, Goede JS, Zeder C, et al. Oral iron supplements increase hepcidin and decrease iron absorption from daily or twice-daily doses in iron-depleted young women. Blood. 2015;126(17):1981–1989.
34. Stoffel NU, von Siebenthal HK, Moretti D, Zimmermann MB. Oral iron supplementation in iron- deficient women: How much and how often? Molecular Aspects of Medicine. 2020;75:100865.
35. Tolkien Z, Stecher L, Mander AP, Pereira DI, Powell JJ. Ferrous sulfate supplementation causes significant gastrointestinal side-effects in adults: a systematic review and meta-analysis. PloS one. 2015;10(2):e0117383.
36. Neogi SB, Devasenapathy N, Singh R, et al. Safety and effectiveness of intravenous iron sucrose versus standard oral iron therapy in pregnant women with moderate-to-severe anaemia in India: a multicentre, open-label, phase 3, randomised, controlled trial. Lancet Glob Health. 2019;7(12):e1706–e1716.
37. Wong L, Smith S, Gilstrop M, et al. Safety and efficacy of rapid (1,000 mg in 1 hr) intravenous iron dextran for treatment of maternal iron deficient anemia of pregnancy. Am J Hematol. 2016;91(6):590–593.
38. Glaspy JA, Lim-Watson MZ, Libre MA, et al. Hypophosphatemia Associated with Intravenous Iron Therapies for Iron Deficiency Anemia: A Systematic Literature Review. Ther Clin Risk Manag. 2020;16:245–259.
39. Wolf M, Rubin J, Achebe M, et al. Effects of Iron Isomaltoside vs Ferric Carboxymaltose on Hypophosphatemia in Iron-Deficiency Anemia: Two Randomized Clinical Trials. JAMA. 2020;323(5):432–443
40. Froessler B, Collingwood J, Hodyl NA, Dekker G. Intravenous ferric carboxymaltose for anaemia in pregnancy. BMC Pregnancy and Childbirth. 2014;14(1):115.
41. Jose A, Mahey R, Sharma JB, et al. Comparison of ferric Carboxymaltose and iron sucrose complex for treatment of iron deficiency anemia in pregnancy- randomised controlled trial. BMC Pregnancy and Childbirth. 2019;19(1):54.
42. Kant S, Haldar P, Malhotra S, Kaur R, Rath R, Jacob OM. Intravenous ferric carboxymaltose rapidly increases haemoglobin and serum ferritin among pregnant females with moderate-to- severe anaemia: A single-arm, open-label trial. Natl Med J India. 2020;33(6):324–328.
43. Froessler B, Gajic T, Dekker G, Hodyl NA. Treatment of iron deficiency and iron deficiency anemia with intravenous ferric carboxymaltose in pregnancy. Arch Gynecol Obstet. 2018;298(1):75–82.
44. Karki NR, Auerbach M. Single total dose infusion of ferumoxytol (1020 mg in 30 minutes) is an improved method of administration of intravenous iron. Am J Hematol. 2019;94(9):E229–e231.
45. Khan H, May P, Kuo E, et al. Safety and efficacy of a single total dose infusion (1020 mg) of ferumoxytol. Ther Adv Hematol. 2021;12:20406207211006022.
46. Hansen R, Sommer VM, Pinborg A, et al. Intravenous ferric derisomaltose versus oral iron for persistent iron deficient pregnant women: a randomised controlled trial. Arch Gynecol Obstet. 2022.
47. Holm C, Thomsen LL, Norgaard A, Langhoff-Roos J. Single-dose intravenous iron infusion or oral iron for treatment of fatigue after postpartum haemorrhage: a randomized controlled trial. Vox Sang. 2017;112(3):219–228.
48. Daniilidis A, Panteleris N, Vlachaki E, Breymann C, Assimakopoulos E. Safety and efficacy of intravenous iron administration for uterine bleeding or postpartum anaemia: a narrative review. J Obstet Gynaecol. 2018;38(4):443–447. [
49. Fanny Schumacher 1, Francisca Barcos-Munoz 2, Margot Kunckler 1, Nicolas Vuilleumier 3 4, Begoña Martinez de Tejada. Newborn phosphocalcic metabolism after intravenous iron administration during pregnancy. J Matern Fetal Neonatal Med . 2024 Dec;37(1):2320671.
info@gynäkologie
- Vol. 15
- Ausgabe 1
- März 2025