- Therapie des Mammakarzinoms
Am diesjährigen San Antonio Breast Cancer Symposium (SABCS 2019) kamen die eindrucksvollsten Daten aus zwei Studien zum metastasierten HER2 positiven Mammakarzinom, die zusätzlich zu den Standardregimen mit Trastuzumab, Pertuzumab und T-DM1 neue Hoffnung geben. Bei der Therapie des Hormonrezeptor-positiven, metastasierten Mammakarzinoms gehören die CDK 4/6 Inhibitoren zum neuen Standard. Neben der guten Verträglichkeit sind sie den Standard-Chemotherapien bezüglich progressionsfreiem Überleben (PFS) sogar überlegen. Die Immuntherapie hat sich beim triple negativen Mammakarzinom (TNBC) weiter etabliert. Nach den letztjährigen Daten der IMpassion130 Studie in der Metastasierung, könnten sie auch in der Neoadjuvans zum Standard werden, wie die präsentierten Daten zur pathologischen Komplettremission (pCR) zeigen konnten.
Le San Antonio Breast Cancer Symposium (SABCS 2019) de cette année a présenté les données très impressionnantes de 2 études sur le cancer du sein métastatisé HER-2-positif. Elles ajoutent un espoir supplémentaire aux résultats obtenus avec les régimes standard avec Trastuzumab, Pertuzumab und T-DM1. Pour les cancers métastatisés récepteurs-positifs, les inhibiteurs CDK 4/6 font désormais partie du nouveau standard thérapeutique. Ils sont bien tolérés et dépassent même les chimiothérapies standards dans la survie sans progression (PFS). Pour les cancers triple négatifs (TNBC) l’immunothérapie s’établit de plus en plus. D’après les données de l’étude IMpassion130 (présentées il y a une année) pour les tumeurs métastatisées et de celles présentées actuellement (taux de rémissions histologiques complètes (pCR) amélioré), l’immunothérapie ne tardera pas à devenir le standard dans la situation néo-adjuvante.
Das Hormonrezeptor-positive Mammakarzinom
Verlängerte adjuvante endokrine Therapie mit Letrozol
Auch dieses Jahr wurden die Empfehlungen zur Dauer der endokrinen Therapie mit Aromatasehemmer (5 Jahre oder 10 Jahre) diskutiert.
Dr. Mamounas von der NRG Oncology Gruppe präsentierte die 10-Jahres Daten der NRG Oncology/NSABP B-42 Studie. Nachdem am SABCS 2016 noch kein signifikanter Vorteil auf das krankheitsfreie Überleben (DFS) bei verlängerter Letrozol Gabe gezeigt werden konnte, ist das DFS nach 10 Jahren nun signifikant (HR 0.84). Die Subgruppenanalyse zeigte den positiven Effekt auf das DFS insbesondere bei nodal positiven Patientinnen. Weiterhin statistisch nicht signifikant verbessert ist das Gesamtüberleben.
Daher bleibt die Entscheidung zur Verlängerung der endokrinen Standardtherapie mit AI weiterhin eine individuelle Nutzen-Risiko-Abwägung. Hierbei sollten die Faktoren wie Tumorcharakteristika, Alter, Nodalstatus, Komorbiditäten, Informationen zur Knochendichte, Verträglichkeit von AI in den ersten 5 Jahren einbezogen werden.
Betreffend Sicherheit kam es nicht zu einer signifikanten Erhöhung osteoporotischer Frakturen oder arteriell-thrombotischer Ereignisse.
Die Rolle der CDK 4/6 Inhibitoren in der (Neo-) Adjuvans
Basierend auf den Daten der PALOMA 3, MONALEESA 3 und MONARCH 2 Studie mit CDK 4/6 Inhibitoren (1, 2, 3) mit hervorragenden Resultaten in Bezug auf das krankheitsfreie und Gesamtüberleben, werden die Substanzen nun in mehreren Phase III Studien in der Adjuvans evaluiert (z.B. NATALEE, PALLAS und PENELOPE-B).
Der Frage, wie durch Einsatz dieser Substanzen die Chemotherapie weiter deeskaliert werden kann, stellte sich J Gavilà vom Valencia Institut of Oncology. Er präsentierte die Daten der SOLTI-1402 CORALLEEN Phase II Studie zur neoadjuvanten Therapie mit Ribociclib plus Letrozol versus Chemotherapie bei den durch PAM50 definierten Luminal B Mammakarzinomen. Die Gruppe der Hormonrezeptor-positiven, HER2 negativen Mammakarzinome ist klinisch und biologisch sehr heterogen. Der PAM50 luminale Subtyp B macht ca. 30-40% aus und wird bis heute grösstenteils mit einer Chemotherapie behandelt (4). In der Studie wurden postmenopausale Frauen 1:1 randomisiert, entweder zum neoadjuvanten Standardregime AC-T (Adriblastin und Cyclophosphamid gefolgt von Paclitaxel) versus Letrozol und Ribociclib über 6 Monate gefolgt von der operativen Therapie. Dabei wurde der Risk of Recurrence Score (ROR score), berechnet aus Subtyp, Proliferation (Ki-67) und Tumorgrösse bei Behandlungsbeginn, nach 14 Tagen sowie vor der operativen Therapie analysiert. Es konnte gezeigt werden, dass unter neoadjuvanter Therapie mit Ribociclib und Letrozol bei Hochrisiko Luminal-B Mammakarzinomen zum Zeitpunkt der Chirurgie hohe Raten an ROR score low erzielt wurden. Dies wird durch die Chemotherapie ebenso erreicht, jedoch bei höherer Toxizität.
Wieviel Chemotherapie braucht es beim Luminal B/ HER2 nega-tiven, nodal negativen frühen Mammakarzinom und für wen?
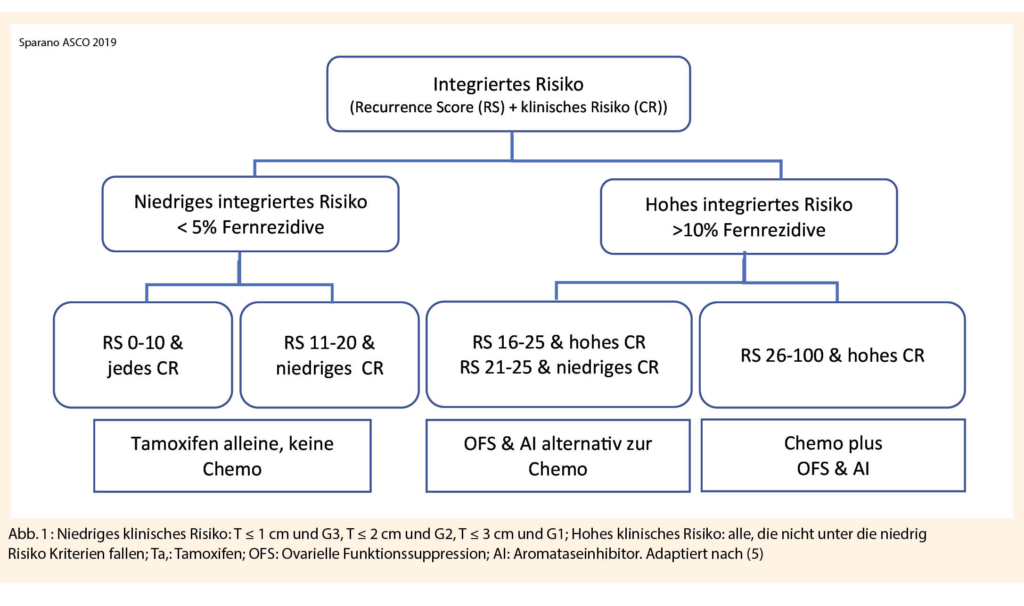
Die Veröffentlichung der Daten aus der TAILORx Studie änderte die Praxis zur Entscheidungsfindung betreffend adjuvanter Chemotherapie anhand der prognostischen Information aus dem Recurrence Score (RS) (5). Frauen mit einem niedrigen RS von zwischen 0-10 profitieren nicht von einer Chemotherapie. Bei hohem RS > 25 besteht ein klarer Vorteil für die adjuvante Chemotherapie. Neue Daten aus der TAILORx Studie zeigen, dass auch bei intermediärem RS zwischen 11 und 25 auf eine adjuvante Chemotherapie verzichtet werden kann. Allerdings steht die Subgruppe der prämenopausalen Patientinnen mit intermediärem RS und einem Alter ≤ 50 Jahre immer wieder in Diskussion, da hier ein kleiner Vorteil durch die zusätzliche Chemotherapie gezeigt werden konnte. Ob der Benefit allein durch die zusätzliche Chemotherapie bedingt ist oder durch die chemotherapie-induzierte Menopause, konnte bisher nicht abschliessend geklärt werden und wurde am SABCS 2019 erneut durch Dr. Sparano diskutiert. Die Daten aus der TEXT/SOFT Studie unterstützen die These bezüglich der chemotherapie-induzierten Menopause. Prämenopausale Frauen aus der TAILORx Studie erhielten überwiegend Tamoxifen und die TEXT/SOFT Studie konnte bei prämenopausalen Frauen einen signifikanten Vorteil der ovariellen Funktionssuppression (OFS) in Kombination mit Aromatasehemmer zeigen (6, 7). Die Kombination von klinischem Risiko (CR), basierend auf Tumorgrösse und Grading, und genomischem Risiko (RS) führt zu einer besseren prognostischen Präzision betreffend Rückfall (8).
Abbildung 1 liefert eine mögliche Strategie zum Therapieentscheid bei prämenopausalen Patientinnen.
Das HER2 positive Mammakarzinom
Adjuvante Therapie des frühen HER2 positiven Mammakarzinoms
In der adjuvanten Therapie des HER2 positiven, operablen Mammakarzinoms wurde in der APHINITY Studie zwischen Trastuzumab + Pertuzumab (n = 2400) versus Trastuzumab + Placebo (n = 2405) randomisiert, wobei sich nach gut 3 Jahren Nachbeobachtung in Bezug auf das invasive Krankheit-freie Überleben (IDFS) ein statistisch signifikanter Vorteil für die duale HER2-Blockade zeigte (9). Dieser Vorteil war bei den Hormonrezeptor-negativen- sowie den nodal positiven Mammakarzinomen am bedeutendsten, was zur limitierten Zulassung der dualen Antikörperblockade beim Hochrisiko-HER2 positiven Mammakarzinom in der Adjuvans führte.
Martine Piccard vom Jules Bordet Institut in Brüssel präsentierte am SABCS 2019 die Interim Gesamtüberleben Analyse der APHINITY Studie nach 6 Jahren Nachbeobachtung. In der APHINITY Studie wurde die Wirksamkeit der dualen Blockade beim HER2- positiven Mammakarzinom als adjuvante Therapie für insgesamt 12 Monate untersucht. Dabei zeigte sich nun mit längerem Follow-up nicht nur für die ER-negativen HER2-positiven Karzinome mit pN+, wie initial im 2017 berichtet wurde, sondern auch für die ER-positiven HER2-positiven Karzinome ein signifikanter Vorteil der dualen Blockade in Bezug auf das IDFS mit einem absoluten Vorteil von 4.5% (95% CI). Betreffend Sicherheit wurden auch unter dualer Antikörperblockade weniger als 1% kardiale Ereignisse verzeichnet. Obwohl weniger Todesfälle in der Pertuzumab-Gruppe verzeichnet wurden, waren die Daten zum Gesamtüberleben aber noch unreif und werden für 2022 erwartet.
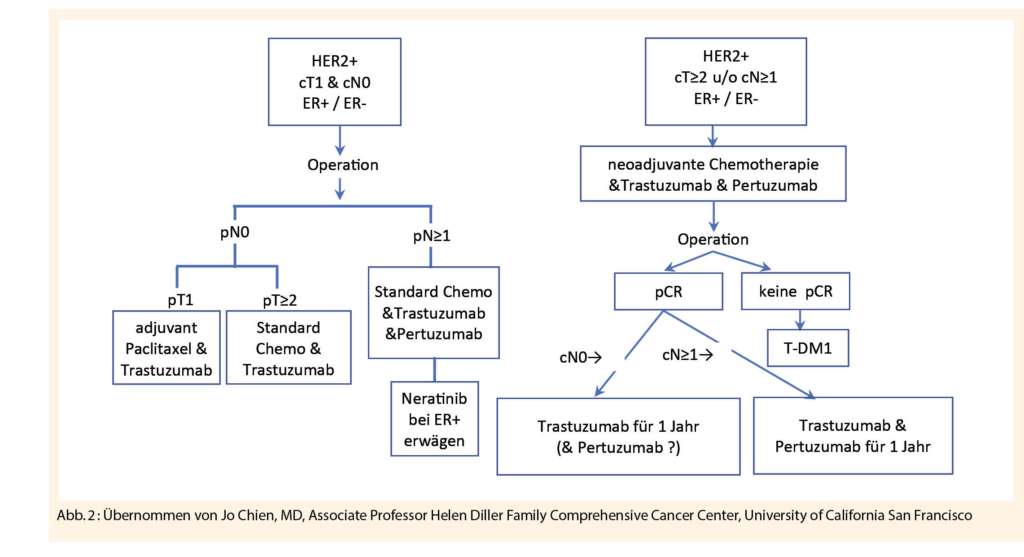
An dieser Stelle sei angemerkt, dass – wenn immer möglich – Patientinnen mit frühen HER2 positiven Mammakarzinom, wenn nodal positiv oder T2, neoadjuvant behandelt werden sollten. Einerseits, um ein Downstaging zwecks weniger radikaler Chirurgie zu erreichen, andrerseits um das Risiko optimal zu stratifizieren. Patientinnen ohne komplettes Ansprechen haben eine schlechtere Prognose, profitieren aber von einer Eskalation der anti-HER2-gerichteten Therapie nach der neoadjuvanten Behandlung mit T-DM1 anstelle von Trastuzumab (10). Pertuzumab soll in neoadjuvanten Regimes auch ausserhalb von Studien immer enthalten sein, wobei der Nutzen von Pertuzumab bei nodal negativen Patientinnen unklar ist. Ein potenzieller Nutzen besteht in der Erhöhung der pathologischen Komplettremissionsrate (pCR), was die Notwendigkeit von adjuvantem T-DM1 reduzieren könnte. Eine Übersicht zum aktuellen Behandlungsstandard des frühen, HER2 positiven Mammakarzinoms gibt die Abbildung 2.
Das metastasierte HER2 positive Mammakarzinom
Einer der Hot Topics, die HER2CLIMB-Studie, wurde durch Rashmi K. Murthy vom MD Anderson Cancer Center in Texas präsentiert. Beim metastasierten, HER2 positiven Mammakarzinom nach Vortherapie mit Trastuzumab, Pertuzumab und T-DM1 liegt kein weiteres Standardregime mit vergleichbarer Wirksamkeit vor. Zudem entwickelt die Hälfte der HER2 positiven metastasierten Mammakarzinom-Patientinnen Hirnmetastasen.
Tucatinib ist ein oraler Tyrosinkinase-Inhibitor, ähnlich dem seit längerem zugelassenen Lapatinib, zeigt aber eine viel spezifischere Hemmung von HER2. Die Studie randomisierte 2:1 Tucatinib (n = 410) versus Placebo (n = 202) in Kombination mit Trastuzumab und Capecitabine bei Patientinnen mit oder ohne Hirnmetastasen. Dabei lag die Ansprechrate mit 41% fast doppelt so hoch wie im Placebo Arm mit 23%. Der Vorteil auf das PFS war auch unter der Subgruppe mit Hirnmetastasen konsistent und signifikant. Der Tyrosinkinase-Inhibitor ist hoch selektiv für die Kinase-Domäne des HER2 mit minimaler Hemmung von EGFR (HER1) und zeigt zudem eine bessere Verträglichkeit verglichen mit Neratinib oder Lapatinib betreffend Diarrhoe, eine der Hauptnebenwirkungen von Tyrosinkinaseinhibitoren. Es ist die erste randomisierte Studie, die unter den Teilnehmerinnen mit HER2 positivem, metastasiertem Mammakarzinom auch Patientinnen mit unbehandelten, vortherapierten oder progredienten Hirnmetastasen einschloss. Somit könnte die Kombinationstherapie bei dieser Population zum neuen Behandlungsstandard werden.
Ian Krop, MD vom Dana-Faber Cancer Institut Boston präsentierte die DESTINY-BREAST01 Phase II-Studie (n = 243). Diese kann den Behandlungsstandard in der Metastasierung von HER2 positiven Mammakarzinom Patientinnen zukünftig entscheidend beeinflussen. Hierbei wurde bei T-DM1 vortherapierten Patientinnen mit Trastuzumab-Deruxtecan (DS-8201) therapiert. Behandelte oder stabile Hirnmetastasen waren zum Studieneinschluss erlaubt. Dabei handelt es sich wie bei T-DM1 um einen neuartigen Antikörper-Medikamenten-Konjugat, bestehend aus Trastzumab, dem Topoisomerase-Inhibitor Deruxtecan und einem spaltbaren Linker. Die Studienpopulation war mit im Mittel 6 Vortherapielinien stark vortherapiert, was die mediane Gesamtansprechrate von 60.9% umso eindrucksvoller macht (Abb. 3). Die Zahlen zum ereignisfreien Überleben (median 16.4 Monate) und Gesamtüberleben müssen aufgrund der Phase II Studie mit Vorsicht interpretiert werden. Zudem sind die Daten in einem nicht randomisierten Studiendesign erhoben und noch unreif, um Angaben zum Gesamtüberleben zu machen.
Das Nebenwirkungsprofil zeigte leichte gastrointestinale Beschwerden und hämatologische Nebenwirkungen. Die kardiale Toxizität ist mit Trastuzumab oder T-DM1 vergleichbar. Ein Risiko stellt die interstitielle Pneumonitis oder Interstitial Lung Disease (ILD) dar, an der in dieser Studie 4 Patientinnen (1.1%) verstarben. Notwendig ist eine gezielte Patientenaufklärung über die Symptome sowie ein sofortiges Sistieren des Medikamentes mit zeitgleichem Beginn von Steroiden.
Es laufen mehrere Phase III Studien zu Trastuzumab-Deruxtecan, worauf wir auf die DESTINY-BREAST04 Studie im Speziellen hinweisen möchten. Hierbei wird bei vortherapierten, metastasierten Patientinnen mit HER2 low (Immun-Histochemie: HER2 1 +, 2 + / ISH negativ) zwischen Trastuzumab-Deruxtecan versus chemotherapy of physicians choice 2:1 randomisiert. Das Universitätsspital Zürich wird ab Januar 2020 Patientinnen in die Studie aufnehmen können.
Immuntherapie im Vormarsch beim triple negativen Mammakarzinom (TNBC)
Die Prognose ist bei diesem aggressiven Subtyp bekannterweise schlecht, mit möglicherweise frühzeitiger Metastasierung und rascher Resistenzentwicklung gegenüber Chemotherapeutika. Die Chemotherapie des frühen Mammakarzinoms wurde in den letzten Jahren, basierend auf den Standardregimes, immer mehr eskaliert, um die Rate an pathologischer Komplettremission (pCR) und somit das Outcome zu verbessern (11, 12). Neben den Standardregimes wurde in vorhergehenden Studien durch die Eskalation mit Bevacizumab und Carboplatin zwar eine Erhöhung der pCR Rate erreicht, jedoch ohne Verbesserung des ereignisfreien Überlebens (EFS). Zunehmend wird beim TNBC die Immuninfiltration untersucht. Durch die Blockade der Immunsystem-«Bremsen» PD-L1 und PD1 kann ein dauerhaftes Ansprechen ermöglicht werden. In der metastasierten Situation konnte in der IMpassion130 Studie ein verbessertes PFS unter Hinzunahme des PD-L1 Antikörpers Atezolizumab zu nab-Paclitaxel bei PD-L1 positiven TNBC gezeigt werden (13). Metastasierte Tumorzellen scheinen jedoch immunologisch inerter zu sein. Beim primären Karzinom ist die Anzahl tumor-infiltrierender Lymphozyten (TILs) höher. Ebenso die Expression von PD-L1 (14). Dies stellt die Rationale für neoadjuvante Studiendesigns mit Checkpoint-Inhibitoren dar.
Prof. Dr. med. Peter Schmid vom Barts Cancer Institute London präsentierte die Daten zur KEYNOTE-522 Phase III Studie. Dabei wurden die Patientinnen mit Stadium IIA-IIIB 2:1 randomisiert. Das Standardregime war Carboplatin mit Paclitaxel, gefolgt von Doxo- oder Epirubicin mit Cyclophosphamid. Zusätzlich erhielten die Patientinnen durchgehend Pembrolizumab oder Placebo. Nach der Operation wurde im Pembrolizumab-Arm dieses Regime adjuvant während 1-9 Zyklen weitergeführt versus Placebo. In der Pembrolizumab-Gruppe zeigte sich sowohl eine verbesserte pCR Rate (64.8 vs.51.2%) als auch ein Trend zu verbessertem ereignisfreien Überleben (EFS). Die Wirksamkeit ist umso besser, je grösser die Tumorlast und der nodale Befall sind (13). Mehr Therapie bedeutet auch mehr Nebenwirkungen. Unter der Hinzunahme der Immuntherapie kommt es zu vermehrtem Auftreten von immunvermittelten Nebenwirkungen wie Hypo- und Hyperthyreose, Hautreaktionen, Nebenniereninsuffizienz, Pneumonitis, Kolitis. Dies muss bei kurativer Therapieabsicht sicher kritisch betrachtet werden. Insbesondere bei Patientinnen mit sonst relativ guter Prognose (nodale negative und kleine Tumore).
Brustzentrum
Klinik für Gynäkologie
Universitätsspital Zürich
Frauenklinikstr. 10
8091 Zürich
denise.vorburger@usz.ch
Brustzentrum
Klinik für Gynäkologie
Universitätsspital Zürich
Frauenklinikstr. 10
8091 Zürich
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
- Die verlängerte Therapie mit einem Aromatasehemmer über 10 Jahre kann bei den nodal positiven Patientinnen empfohlen werden, bleibt aber weiterhin eine Abwägung von Nutzen und Risiko bei bisher fehlendem Vorteil für das Gesamtüberleben.
- Beim HER2 positiven frühen Mammakarzinom entscheidet das klinische Stadium (cT und cN) sowohl über die Sequenz der Primärbehandlung (Operation oder Chemo zuerst), als auch über die Eskalation oder Deeskalation der Chemoimmuntherapie.
- Beim metastasierten HER2 positiven Mammakarzinom zeigen zwei neue Substanzen (Tucatinib und Trastuzumab-Deruxtecan) bei schwer vortherapierten Patientinnen eine hohe Ansprechrate einschliesslich derer mit cerebraler Metastasierung.
- Die Immuntherapie könnte beim triple negativen Mammakarzinom künftig als Neoadjuvans Einzug halten und lässt bei diesem aggressiven Subtyp durch die höheren pCR Raten, insbesondere bei nodal positiven Karzinomen, auf eine verbesserte Prognose hoffen.
Messages à retenir
- Le traitement avec un inhibiteur de l’aromatase prolongé sur 10 ans peut être proposé pour les cancers nodal-positifs. Vu qu’à l’heure actuelle un avantage sur la survie globale manque, l’indication sera toujours posée au cas par cas en pesant individuellement les bienfaits et les risques.
- En cas de cancer précoce HER2-positif, c’est le stade clinique (cT et cN) qui est déterminant soit pour la séquence de la thérapie primaire (opération. ou chimio d’abord), soit pour l’escalation voire la désescalation de la chimio-immunothérapie.
- En cas de cancer métastatisé HER2-positif lourdement prétraité, deux nouvelles substances (Tucatinib und Trastuzumab-Deruxtecan) montrent un taux de réponse élevé, en particulier chez les patientes avec métastases cérébrales.
- L’immunothérapie pourrait faire son entrée comme traitement néo-adjuvant pour les cancers triple négatifs. Dans ce sousgroupe agressif, l’espoir d’une amélioration du pronostic est permis du fait d’un taux plus important de rémissions complètes histologiques (pCR), surtout en cas de tumeurs nodal-positives.
1. Turner C. N., M.D., Slamon D. J, M.D., Ro J., M.D. et al. N Engl J Med 2018;
379:1926-1936
2. Im S-A., M.D., Lu Y-S, M.D., Ph.D., Bardia A., M.D. et al. N Engl J Med 2019; 381:307-316
3. Sledge G., M.D., Toi M., Neven P. et al. ESMO 2019 Congress
4. Cejalvo JM, Pascual T, Fernandez-Martinez A et al. Cancer Treat Rev 67 (2018) 63-70
5. Sparano J.A., MD, Gray R.J., PhD, Makower D.F., MD et al. N Engl J Med 2018; 379:111-121
6. Pagani O, MD, Regan M.M., Sc.D, Walley B.A., MD et al, N Engl J Med 2014; 371:107-118
7. Francis P.A., MD, Pagani O, MD, Fleming G.F. MD et al. N Engl J Med 2018; 379:122-137
8. Sparano J.A. MD, Gray R.J., PhD., Ravdin P.M., MD et al. N Engl J Med 2019; 380:2395-2405
9. Von Minckwitz, M.D., Procter, Ph.D., de Azumbuja M.D. et al. N Engl J Med 2017;377:122-131
10. Von Minckwitz, M.D., Huang, M.D., Ph.D., Mano, M.D., Ph.D. et al N Engl J Med 2019; 380:617-628
11. Cortazar P, Zhang L, Untch M et al. Lancet 2014; 384:164-72
12. Prowell T.M. MD and Pazdur R. MD N Engl J Med 2012; 366:2438-2441
13. Schmid P, MD, PhD, Adams S, MD, Rugo H, MD et al. N Engl J Med 2018; 379:2108-2121
14. Szekely B, Bossuyt v, Li X et al. Annals of Oncology 29: 2232-2239, 2018
info@gynäkologie
- Vol. 10
- Ausgabe 2
- April 2020