- Tumorerkrankungen während der Schwangerschaft
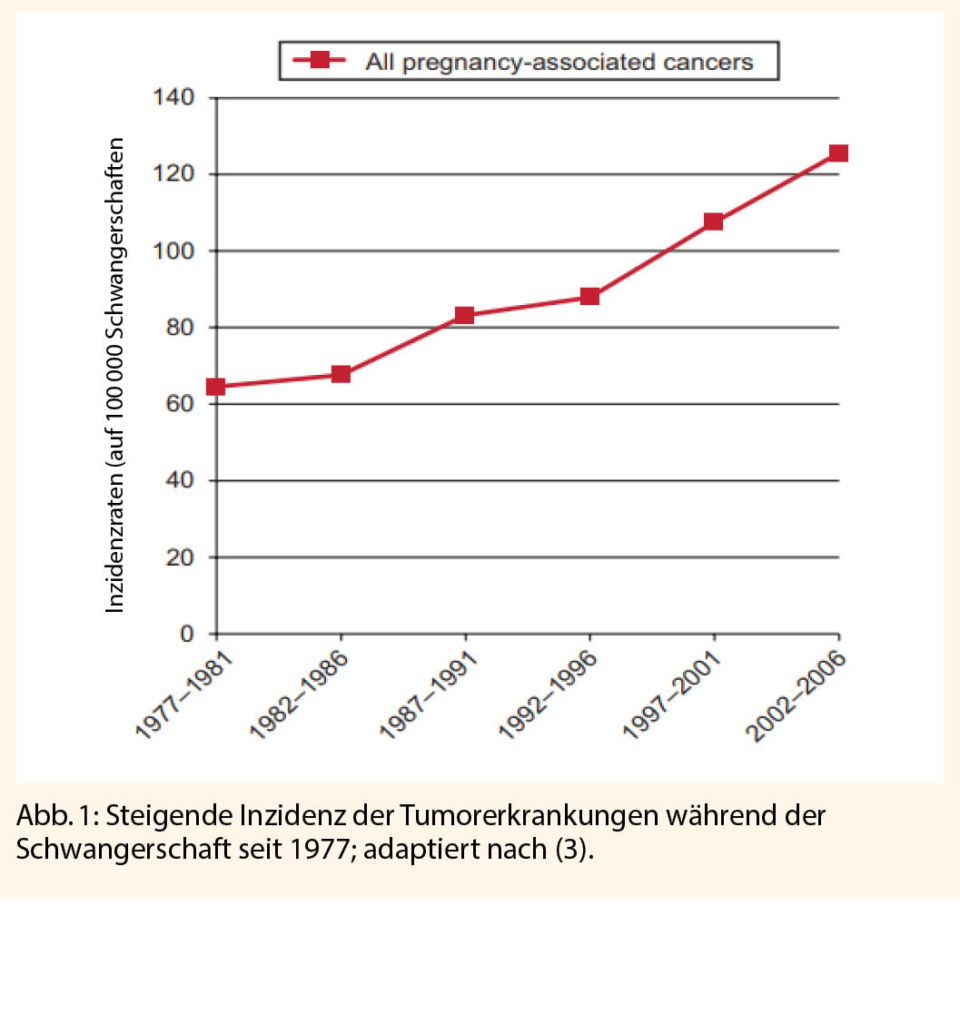
Das Auftreten einer Tumorerkrankung während der Schwangerschaft ist selten, die Inzidenz steigt jedoch in den letzten Jahren und beträgt 1 auf 1000 Schwangerschaften (1-3). Ursachen dafür sind ein zunehmendes maternales Alter der schwangeren Frauen, ein genereller Anstieg der Krebsinzidenz während des fertilen Alters, ein steigendes Risikoprofil (z.B. Sonnenexposition beim Melanom) und verbesserte diagnostische Möglichkeiten, was auch zur Entdeckung von frühen Karzinomstadien führt.
La survenue d’une maladie tumorale pendant la grossesse est rare. Dans les dernières années/décennies, toutefois, l’incidence a continuellement progressé et se situe à 1 sur 1000 grossesses (1-3). Les raisons sont l’ âge maternel augmentant des femmes enceintes, un accroissement général de l’incidence des cancers durant la période fertile de la vie, un profil de risque en hausse (p.ex. l’exposition au soleil pour les mélanomes) et les possibilités diagnostiques améliorées ce qui en plus mène à la découverte de cancers dans des stades précoces.
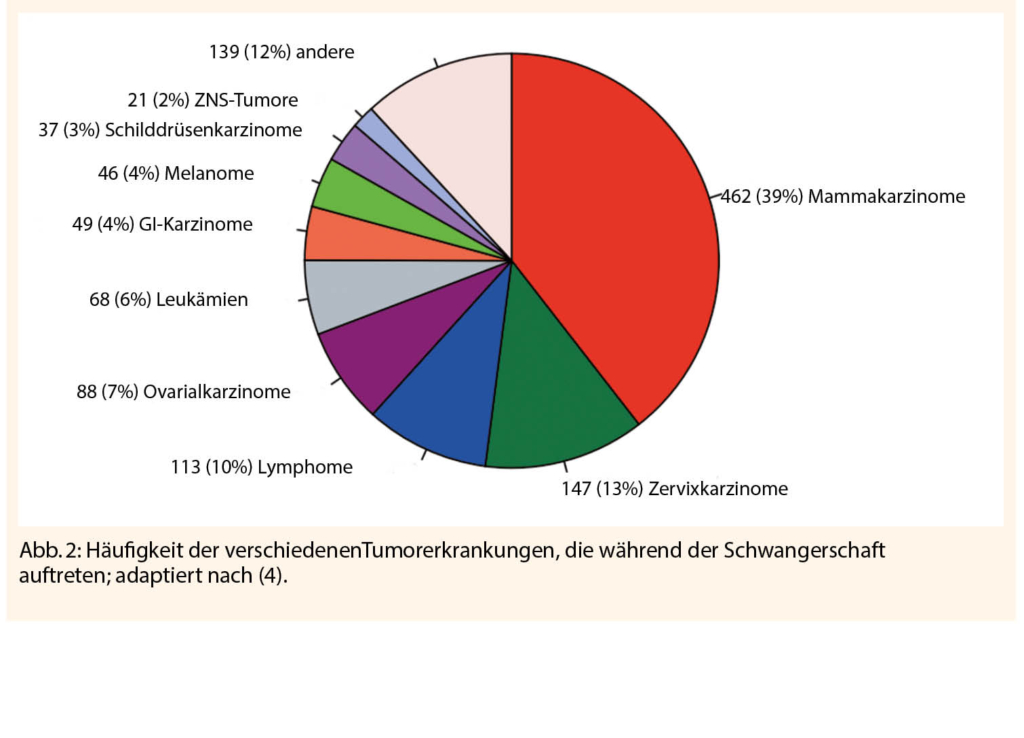
Die häufigsten Tumorarten, die während der Schwangerschaft vorkommen, sind das Mammakarzinom in 39% der Fälle, gefolgt vom Zervixkarzinom mit 13% und Lymphome mit 10 % (4). Weitere in der Literatur beschriebene Tumorerkrankungen umfassen das Schilddrüsenkarzinom, Kolorektalkarzinom das Ovarialkarzinom, maligne Melanome und Leukämien. Sehr selten kommt es auch zu ZNS-Tumoren, Lungenkarzinomen und Sarkomen.
Management von Tumorerkrankungen während der Schwangerschaft
Beobachtungsstudien haben keine Verschlechterung der Prognose für eine maligne Tumorerkrankung bei Schwangeren im Vergleich zur Gesamtbevölkerung gezeigt (5).
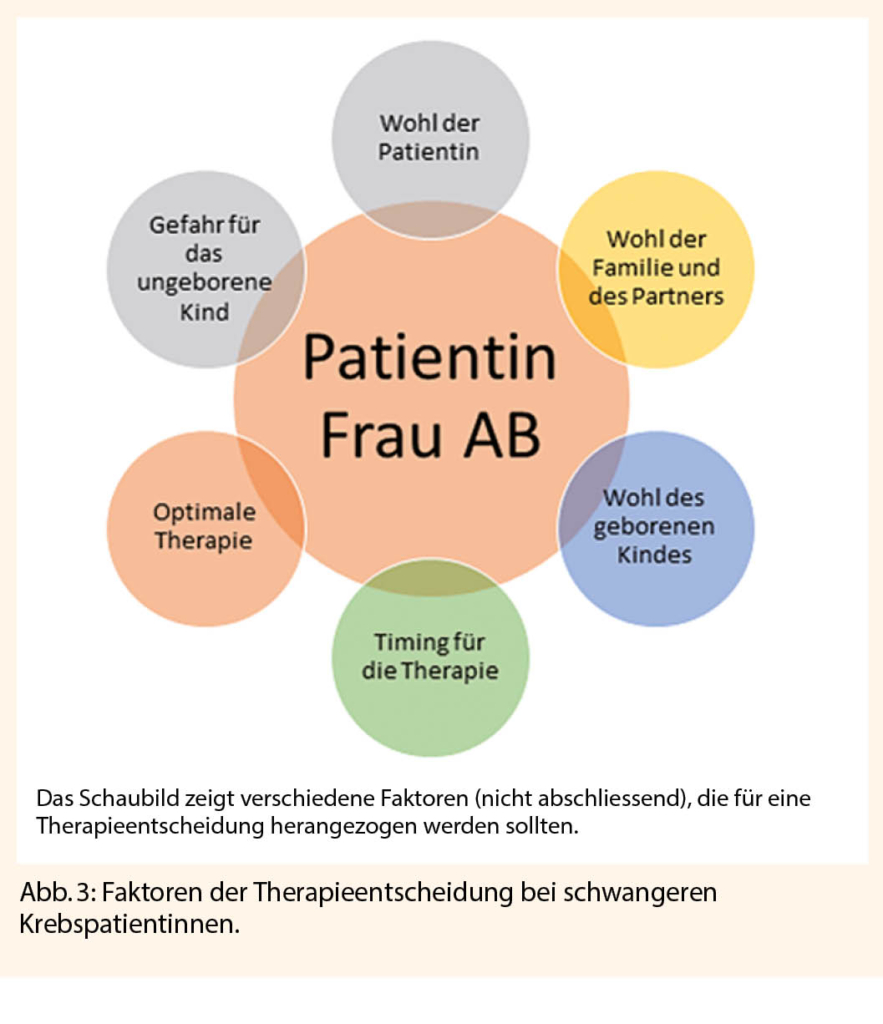
Grundsätzlich stellt die Diagnose einer Krebserkrankung in der Schwangerschaft eine grosse Herausforderung dar, da es um das Wohl der Patientin, ihrer Angehörigen, des ungeborenen Kindes, gegebenenfalls von Geschwisterkindern, um das richtige «Timing» und die optimale Therapie geht.
Deswegen ist ein gutes interdisziplinäres Management wichtig. Die wichtigsten Disziplinen umfassen: Geburtshilfe, Pädiatrie, Neonatologie, Hämatologie, Onkologie, Genetik, Pathologie, Radiologie, Chirurgie, gynäkologische Onkologie, Psychosomatik und Pharmakologie. Da eine Krebserkrankung in der Regel lebensbedrohlich ist, kann ein Verzögern der Therapie zu einer Verschlechterung der Prognose führen.
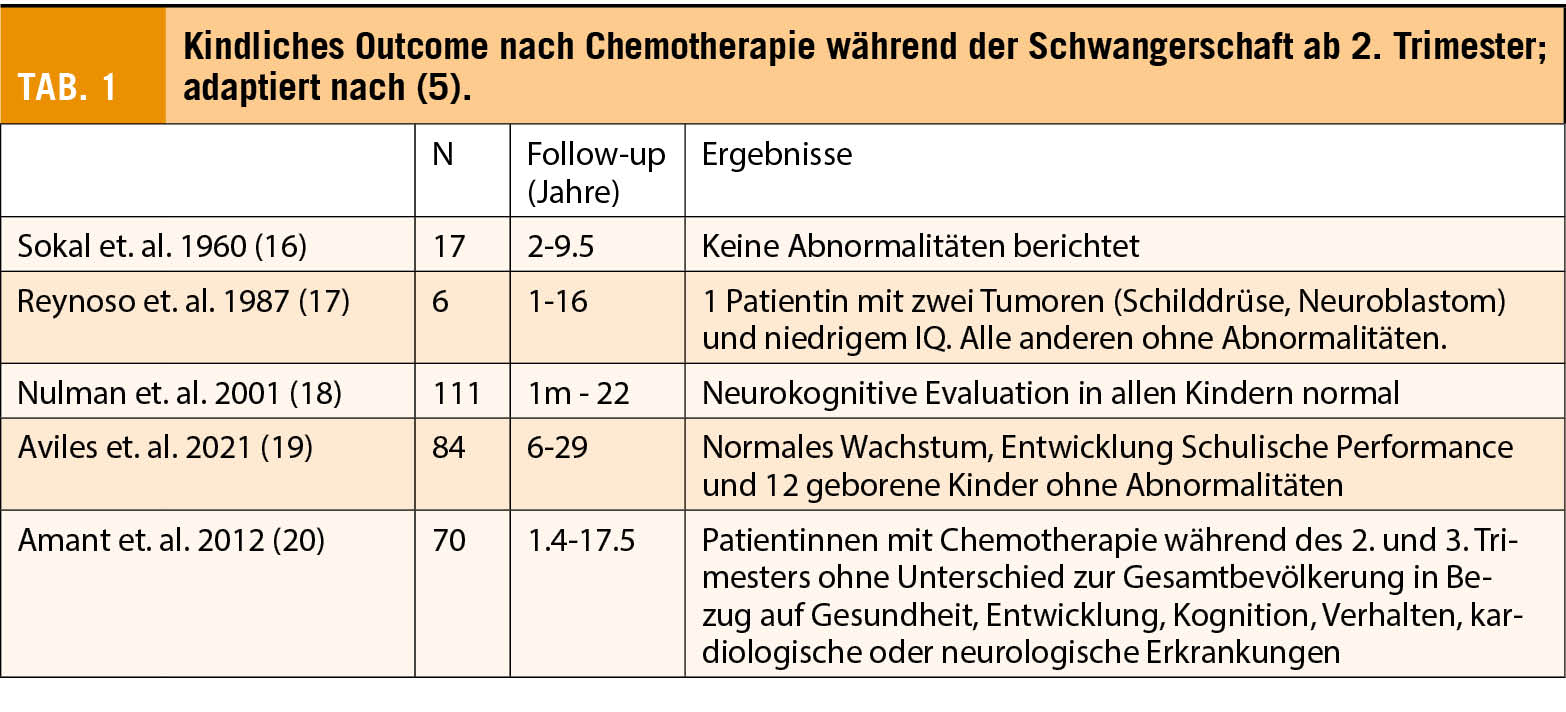
Aber auch für den Feten können sich durch die Therapie Risiken ergeben. Trotzdem stellt eine Krebserkrankung in der Schwangerschaft auch in Bezug auf das kindliche Outcome in aller Regel keine Indikation für einen Schwangerschaftsabbruch dar. Studien konnten zeigen, dass es zwar ein erhöhtes Risiko für eine Frühgeburt gibt, dass sich aber die kognitive Entwicklung dieser Kinder im Vergleich zu Müttern ohne Krebserkrankung nicht unterscheidet (6) (Tab. 1). Die Häufigkeit eines SGA (small for gestational age) war in der pränatal exponierten Gruppe etwas höher, statistisch aber nicht signifikant.
Risiko einer Übertragung von Tumorzellen auf den Fetus
In der Literatur gibt es weltweit nur vereinzelte Berichte, dass eine Tumorerkrankung auf den Fetus übergeht und dort Metastasen bildet. Das Risiko einer Entstehung von Tumorerkrankungen im Menschen ist besonders erhöht, wenn Faktoren wie Aufbau der zirkulierenden Tumorzellen, vor allem eine Clusterung der Tumorzellen, Immunschwäche und andere Faktoren zusammenkommen. Fallberichte gibt es vor allem für das Mammakarzinom, maligne Melanom und Lymphom. Die Kinder wurden postoperativ mit systemischen Therapien behandelt. In unserer Klinik konnten wir bei einer Patientin mit metastasiertem Mammakarzinom während der Schwangerschaft plazentare Tumorzellen nachweisen. Das Kind wurde gesund geboren und ist im Follow-up tumorfrei (7). Welche Faktoren einen Übertritt der Tumorzellen in den kindlichen Kreislauf ermöglichen, ist bis heute nicht sicher geklärt. Dies scheint jedoch auch eine Rarität zu sein. Zu empfehlen bleibt eine akribische Untersuchung der Plazenta postpartal auf Tumorzellen oder Cluster von Tumorzellen. Für prophylaktische Massnahmen oder eine spezielle Nachsorge des Kindes gibt es keine Empfehlungen.
Bildgebende Abklärungen
Zur Ausbreitungsdiagnostik benötigt es bei Tumorerkrankungen ein klinisches und radiologisches Staging. Danach richten sich die weitere Therapieempfehlung und Therapieplanung. Potentielle und dosisabhängige Risiken des Einsatzes ionisierender Strahlung sind
- Störungen der Schwangerschaft (Fehl-, Früh-, Totgeburt)
- Fehlbildungen
- Wachstums- und Entwicklungsstörungen
Für das ungeborene Kind wird als niedrigster Schwellenwert für relevante Schäden eine Dosis von 100 mSv, für eine schwere geistige Retardierung von mindestens 300 mSv angenommen.
Mutagene und karzinogene Effekte weisen keinen Schwellenwert auf. Hier ist die Dosis mit der Auftretenswahrscheinlichkeit korreliert. Daher sollte die Indikation für bildgebende Verfahren, wie z.B. ein CT. sehr streng gestellt werden. Generell sollte auf eine Computertomographie des Abdomens und Beckens und auch eine Kontrastmittelgabe (KM) verzichtet werden. Die besonders kritische Phase umfasst die Wochen 2-15 der Schwangerschaft (8).
Eine Magnet-Resonanz-Tomographie ist in der Regel in allen Stadien der Schwangerschaft möglich. Eine kanadische Kohorten Studie zeigte keine erhöhten Raten an Teratogenität oder Karzinogenese (9) Die Verwendung von Gadolinium KM war jedoch mit einer erhöhten Entwicklung von rheumatologischen Erkrankungen und Hauterkrankungen wie auch einer erhöhten Sterblichkeit verbunden.
Empfehlungen zur Behandlung
Zunächst bleibt festzuhalten, dass für eine schwangere Patientin die optimale Therapie gewählt werden sollte, mit den besten Überlebenschancen. Abgewogen werden muss in erster Linie, der Wunsch der Patientin, medizinische Nebendiagnosen, die Prognose für die Tumorerkrankung, die Prognose für das Kind und das Umfeld der Patientin (Abb. 3). Selbstverständlich spielen bei der weiteren Therapieplanung ethische, religiöse und kulturelle Aspekte auch eine bedeutende Rolle.
Operative Verfahren
Ein operatives Verfahren ist in der Schwangerschaft möglich. Es gibt keinerlei humane oder auch präklinische Daten, welche eine Teratogenität der gängigen Narkosemedikamente aufweist. Wenn eine notwendige Tumoroperation ansteht, kann in allen Stadien der Schwangerschaft operiert werden (10). Alle elektiven Operationen sollten auf den Zeitpunkt nach der Geburt verschoben werden. Zu bedenken bleibt, dass es zu einem frühen Zeitpunkt der Schwangerschaft zu gehäuften Aborten auch durch Chirurgie kommen kann. Der Nutzen für eine operative Therapie sollte mit dem Abortrisiko und onkologischen Sicherheit abgewogen werden. Ab dem 2. Trimenon kann in der Regel gut verträglich eine neo-adjuvante Chemotherapie durchgeführt werden, ohne ein negatives Outcome für das Kind oder die Mutter zu erzeugen (6). Die aktuellen Empfehlungen des ACOG umfassen weiterhin das Screening auf Risiko für Thromboembolien, den Einsatz von Steroiden, falls ein Benefit für den Fetus zu erwarten ist. Weiterhin sollte die OP an feto-maternalen Zentren mit Neonatologie durchgeführt werden. Wenn möglich sollte die Patientin rechtzeitig für eine Notfall-Sectio aufgeklärt werden.
Radiotherapie
Eine Strahlentherapie während der Schwangerschaft kann dem sich entwickelnden Fetus schaden. Generell wird Schwangeren mit Krebserkrankungen empfohlen, die Strahlentherapie bis nach der Entbindung aufzuschieben. Diese Empfehlung basiert jedoch nicht auf Kenntnissen über die Strahlenrisiken für das ungeborene Kind (11).
Eine Strahlentherapie während der Schwangerschaft sollte sorgfältig evaluiert werden, da sie den Embryo/Fetus mit höheren Strahlendosen als die oben genannten diagnostischen Verfahren exponiert. Strahlendosen über 100 mSv und bis zu 500 mSv im ersten Trimenon können zu geistiger Behinderung in bis zu 6% der Fälle, im 2. Trimester in 2% der Fälle führen. Das Risiko einer geistigen Behinderung ist während des 3. Trimenon niedriger. Daher sollte die fetale Dosis als Folge der Strahlentherapie während einer Schwangerschaft 500 mSv nicht überschreiten (12). Diese Dosis wird meist nicht erreicht, wenn der Tumor weit genug vom Fetus entfernt ist. Da die Strahlendosis umgekehrt proportional zum Abstand ist, sollte eine Strahlentherapie im Oberkörperbereich, z.B. bei Brustkrebs, vorzugsweise während des ersten und zweiten Trimenon erfolgen. Dann kann durch eine präzise Radiotherapie der Brust beispielsweise die fetale Dosis auf unter 200 mSv limitiert und bei sehr strenger Indikation auch eine Radiotherapie während der Schwangerschaft durchgeführt werden.
Systemtherapie
In den letzten zwei Dekaden kam es zu einer deutlichen Verbesserung des Outcomes für verschiedene Tumorerkrankungen. Unter anderem hat auch die Systemtherapie dazu beigetragen. Tumoren, die weiterhin eine schlechte Prognose haben, sind das Pankreaskarzinom, das Lungenkarzinom ohne Ansprechen auf Immuntherapie und targeted Therapie, das undifferenzierte Schilddrüsenkarzinom und das Glioblastom. Generell ist die Systemtherapie ab dem 2. Trimenon der Schwangerschaft möglich. Die meisten Daten kommen aus dem Bereich des Mammakarzinoms. Dies ermöglicht ein peri-operatives Management. Beim Triple-negativen wie auch HER2+ Mammakarzinom ist in den meisten Fällen die Therapie der Wahl die neo-adjuvante Chemotherapie. Anthracyline und Taxane können ab dem 2. Trimenon ohne erhöhtes Risiko für das Ungeborene appliziert werden. In einer Beobachtungsstudie mit 447 Schwangeren wurde die Behandlung und das Outcome für die Mutter analysiert. Das mittlere Gestationsalter bei Beginn der Behandlung lag bei 24 Wochen (Range 5-40 Wochen). Insgesamt erhielten 48% der Schwangeren eine Chemotherapie. Das mediane krankheitsfreie Überleben war in der Gruppe der Patientinnen, die die Chemotherapie während der Schwangerschaft erhielten, nicht signifikant schlechter (70,6 Monate vs. 94,4 Monate p= 0.0539). In der Gesamtkohorte war die Tumorbiologie insgesamt deutlich aggressiver als in einer nicht-schwangeren Kohorte. Insgesamt 31% TNBC und 36% HER2-positive Karzinome. In der Regel haben jüngere Patientinnen aber auch generell aggressivere Mammakarzinome.
Soweit beurteilbar mit den wenigen Studiendaten, erscheint das Langzeit-Outcome für das Kind nach einer intrauterinen Chemotherapie gut zu sein, ohne Einschränkung auf die Herzfunktion oder geistige Entwicklung. In einer Beobachtungsstudie von Amant et al. (6) mit 129 Kindern konnte dies gezeigt werden. Insgesamt hatten 96 Kinder (74.4%) eine Chemotherapie während der Schwangerschaft. Radiotherapie erhielten 11 (8,5%) Kinder und alleinige Chirurgie erhielten 13 (10,1%) Kinder. Die Kohorte wurde mit einer Schwangeren-Kohorte ohne Krebsdiagnose gematched. Es fand sich kein Unterschied bzgl. der kognitiven Funktion in beiden Gruppen (6). Weitere kleinere Observationsstudien mit 6-111 Schwangeren zeigten ähnliche Ergebnisse (siehe Tab. 1, (5)).
Bezüglich der einzelnen Chemotherapie-Substanzen gibt das National Toxicology Program (NTP) des Amerikanischen Gesundheitsministeriums eine gute Übersicht über die wichtigsten Substanzen und ihre Auswirkungen auf die Schwangerschaft und den Föten. Anhand von Normogrammen kann der teratogene Effekt auf den Föten in Abhängigkeit vom Applikationszeitpunkt abgeschätzt werden. Dabei haben vor allem die Anthracyline und Taxane ein sehr geringes Risiko für Geburtsdefekte im Vergleich zur Prävalenz in der Gesamtbevölkerung.
Ethische Aspekte
Die Behandlung von Schwangeren mit einer Krebserkrankung ist nicht nur medizinisch, sondern oft auch ethisch herausfordernd. Der Grundkonflikt ist dabei, dass die optimale Behandlung der Patientin die normale Entwicklung des Fötus gefährden kann. In der Schweiz ist die medizinische und reproduktive Autonomie von Patientinnen und Patienten verfassungsrechtlich geschützt. Aufklärung und Einwilligung der Patientin hinsichtlich der Behandlung sind daher auch hier von zentraler Bedeutung. Für das ungeborene Leben besteht ein abgestuftes Schutzkonzept, wobei der volle Persönlichkeitsschutz erst ab Geburt gegeben ist. Um eine vitale Gefährdung der Schwangeren abzuwenden, ist rechtlich ein Schwangerschaftsabbruch bis zur Geburt möglich.
Aus ethischer Sicht ist in einer solchen Situation eine sorgfältige Abwägung der Chancen und Risiken aller Handlungsoptionen zu empfehlen (13). Gemäss dem Modell der gemeinsamen Entscheidungsfindung (Shared Decision Making) sollten dabei Informationsaustausch, Abwägung und Entscheidung gemeinsam zwischen behandelndem Arzt und Patientin erfolgen. Beim Informationsaustausch sind insbesondere auch prognostische Unsicherheiten mit der Patientin zu reflektieren. Die Abwägung hat sowohl die Autonomie und das Wohlergehen der Patientin, als auch das Wohlergehen des Fötus zu beachten. Das Gespräch sollte primär die Patientin befähigen, eine informierte und für sie und ihr Kind verantwortbare Entscheidung zu treffen. Es sollte daher von ärztlicher Seite aus nicht-direktiv erfolgen. Sofern eine Behandlung ohne Nachteile für die Patientin verschoben werden kann, kann es jedoch ethisch geboten sein, eine Verschiebung zu empfehlen. Um Konflikte im weiteren Behandlungsverlauf zu vermeiden, ist eine vorausschauende Behandlungsplanung (Advance Care Planning) sinnvoll, die auch mögliche Komplikationen antizipiert.
Die existentielle Tragweite der Entscheidungssituation kann die Patientin und Angehörige psychisch schwer belasten. Deren Sorgen und Ängsten gilt es daher empathisch, offen und kompetent zu begegnen. Eine Begleitung durch Psychosomatik, Palliative Care oder Seelsorge kann diesbezüglich hilfreich sein und sollte angeboten werden (14). Bei ethischen Konflikten kann es zudem sinnvoll sein, eine ethische Beratung in Anspruch zu nehmen.
Perinatales Management unter Therapie
Grundsätzlich ist die Betreuung der Patientin, aufgrund der grossen medizinischen und ethischen Herausforderung, an einem sowohl onkologischen als auch perinatalen Zentrum zu empfehlen.
Regelmässige Schwangerschaftskontrollen alle 3-4 Wochen sind zu empfehlen, da der Einsatz von Chemotherapeutika zu Frühgeburtlichkeit, IUWR und Oligohydramnion führen kann.
Der Geburtszeitpunkt sollte optimal gewählt werden, abhängig von der geplanten Therapie. So sollte nach einer Chemotherapie ein Abstand von mindestens 3 Wochen eingehalten werden (15). Gleichzeitig ist zu bedenken, dass nach der Geburt eine Therapie vonnöten ist, die während der Schwangerschaft nicht empfohlen ist, wie z. B. eine Trastuzumab basierte Therapie beim HER2 positiven Mammakarzinom. Dann ist gegebenenfalls eine frühzeitige Entbindung immer unter Abwägung der Frühgeburtlichkeit zu erwägen.
Auch der Geburtsmodus ist abhängig von der Art des Tumors und der jeweiligen Therapie und muss gut bedacht werden.
1 Dr. med. Grit Vetter
2 Jan Schürmann
3 PD Dr. med. Markus Gross
4 Prof. Dr. med. Christoph Rochlitz
4,5 PD Dr. med. Marcus Vetter
grit.vetter@usb.ch
1 Klinik für Schwangeren- und Geburtsmedizin,
Universitätsfrauenklinik, Basel
2 Abteilung Klinische Ethik, Universitätsspital Basel
3 Abteilung für Radioonkologie, Universitätsspital Basel
4 Abteilung für Medizinische Onkologie, Universitätsspital Basel
5 Medizinische Onkologie, Hämatologie und Immuntherapie, Medizinische
Universitätsklinik, Kantonsspital Baselland, Liestal
Frauenklinik, Universitätsspital Basel, Spitalstr. 21, 4031 Basel
Copyright bei Aerzteverlag medinfo AG
Klinik für Schwangeren- und Geburtsmedizin,
Universitätsfrauenklinik, Basel
grit.vetter@usb.ch
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Beitrag deklariert.
◆ Krebserkrankungen in der Schwangerschaft treten selten auf, mit steigender Inzidenz (1/1000 Schwangerschaften).
◆ Eine interdisziplinäre Zusammenarbeit ist zu empfehlen.
◆ Die Behandlung von Tumorerkrankungen kann in der Regel während der Schwangerschaft erfolgen.
◆ Die Prognose von Tumorerkrankungen während der Schwangerschaft scheint nicht schlechter als in der Gesamtbevölkerung.
◆ Die Patientin sollte gut beraten und vollumfänglich über die bestehende Situation und Prognose aufgeklärt werden.
◆ Ethische Aspekte sollten bei der Beratung berücksichtigt werden.
◆ Die Beratung soll die Patientin befähigen, eine informierte und auto-nome Entscheidung zu treffen, die sie für sich und ihr Kind verantworten kann.
Messages à retenir
◆ Les maladies cancéreuses pendant la grossesse sont rares, mais ont une incidence croissante (1 grossesse sur 1000).
◆ Une collaboration interdisciplinaire est à recommander.
◆ Le traitement d’une maladie tumorale peut être entrepris en règle générale pendant la grossesse.
◆ Le pronostic d’une maladie cancéreuse pendant la grossesse ne semble pas être inférieur à celui dans la population générale.
◆ La patiente doit être bien conseillée et informée de manière éclairée sur sa situation et son pronostic.
◆ Le counselling devrait prendre en compte les aspects éthiques.
◆ Le counselling doit permettre à la patiente de prendre, de manière autonome et en toute connaissance de cause, les décisions qu’elle pourra assumer pour elle-même et son enfant.
1. Donegan WL. Cancer and pregnancy. CA Cancer J Clin. 1983;33(4):194–214.
2. Jhaveri MB, Driscoll MS, Grant-Kels JM. Melanoma in pregnancy. Clin Obstet Gynecol. 2011;54(4):537–545.
3. Eibye S et. al., Incidence of pregnancy-associated cancer in Denmark, 1977-2006. Obstetrics & Gynecology, 2013 Sep;122(3):608-17.
4. De Haan J et al., Oncological management and obstetric and neonatal outcomes for women diagnosed with cancer during pregnancy: a 20-year international cohort study of 1170 patients. Lancet Oncol. 2018 Mar;19(3):337-346.
5. Hepner A et al., Cancer During Pregnancy: The Oncologist Overview, World Journal of Oncology Volume 10, Number 1, February 2019, pages 28-34.
6. Amant F et. al., Pediatric outcome after maternal Cancer during pregnancy, NEJM 2015
7. Vetter G, Zimmermann F, Bruder E, Schulzke S, Hösli I, Vetter M. Aggressive Breast Cancer during Pregnancy with a Rare Form of Metastasis in the Maternal Placenta. Geburtshilfe Frauenheilkd. 2014 Jun;74(6):579-582
8. Wagner LK, Lester RG, Saldana LR. Exposure of the pregnant patient to diagnostic radiations: a guide to medical management. Philadelphia; Lippincott 1985; 19-223.
9. Ray JG et al. JAMA. 2016;316(9):952-961
10. Committee on Obstetric Practice. Nonobstetric Surgery During Pregnancy. Replaces Committee Opinion No. 696, April 2017. Reaffirmed 2021.
11. Kal HB, Struikmans H, Radiotherapy during pregnancy: fact and fiction. Lancet Oncol 2005 May;6(5):328-33
12. Mazzola R et al. Modern radiotherapy in cancer treatment during pregnancy. Crit Rev Oncol Hematol. 2019 Apr;136:13-19.
13. Chervenack F. et. al. A clinically comprehensive ethical framework for offering and recommending cancer treatment before and during pregnancy. Ethics and Law in Oncology, Cancer, Volume 100, Issue 2 p. 215-222 2004.
14. Zanetti-Dällenbach R, Tschudin S, Lapaire O, Holzgreve W, Wight E, Bitzer J. Psychological management of pregnancy-related breast cancer. The Breast 2006; 15:S53-S59.
15. Buekers TE, Lallas TA. Chemotherapy in pregnancy. Obstet Gynecol Clin North Am. 1998 Jun;25(2):323-9.
16. Sokal JE, Lessmann EM. Effects of cancer chemotherapeutic agents on the human fetus. J Am Med Assoc. 1960;172:1765-1771.
17. Reynoso EE, Shepherd FA, Messner HA, Farquharson HA, Garvey MB, Baker MA. Acute leukemia during pregnancy: the Toronto Leukemia Study Group experience with long-term follow-up of children exposed in utero to chemotherapeutic agents. J Clin Oncol. 1987;5(7):1098-1106.
18. Nulman I, Laslo D, Fried S, Uleryk E, Lishner M, Koren G. Neurodevelopment of children exposed in utero to treatment of maternal malignancy. Br J Cancer. 2001;85(11):1611-1618.
19. Aviles A, Neri N. Hematological malignancies and pregnancy: a final report of 84 children who received chemotherapy in utero. Clin Lymphoma. 2001;2(3):173-177.
20. Amant F, Van Calsteren K, Halaska MJ, Gziri MM, Hui W, Lagae L, Willemsen MA, et al. Long-term cognitive and cardiac outcomes after prenatal exposure to chemotherapy in children aged 18 months or older: an observational study. Lancet Oncol. 2012;13(3):256-264.
info@gynäkologie
- Vol. 11
- Ausgabe 5
- Oktober 2021