- 17. Zürcher Review Kurs in Klinischer Kardiologie
Vom 5.4. bis 7.4. fand unter der Leitung von Frau Prof Dr. med. Christine Attenhofer-Jost, Zürich, Prof. Dr. med. Heidi M. Connolly, Mayo Clinic, Rochester und Prof. Dr. med. Perry Elliott, London, der 17. Zürcher Review Kurs in Klinischer Kardiologie statt. Unter den verschiedenen hervorragenden Vorträgen wurden Antikoagulation und Dyslipidämie zur Berichterstattung ausgewählt.
Direkte orale Antikoagulantien (DOAK 2019): Worauf ist in der Praxis zu achten?
Wie viel Gerinnung soll gemessen werden?
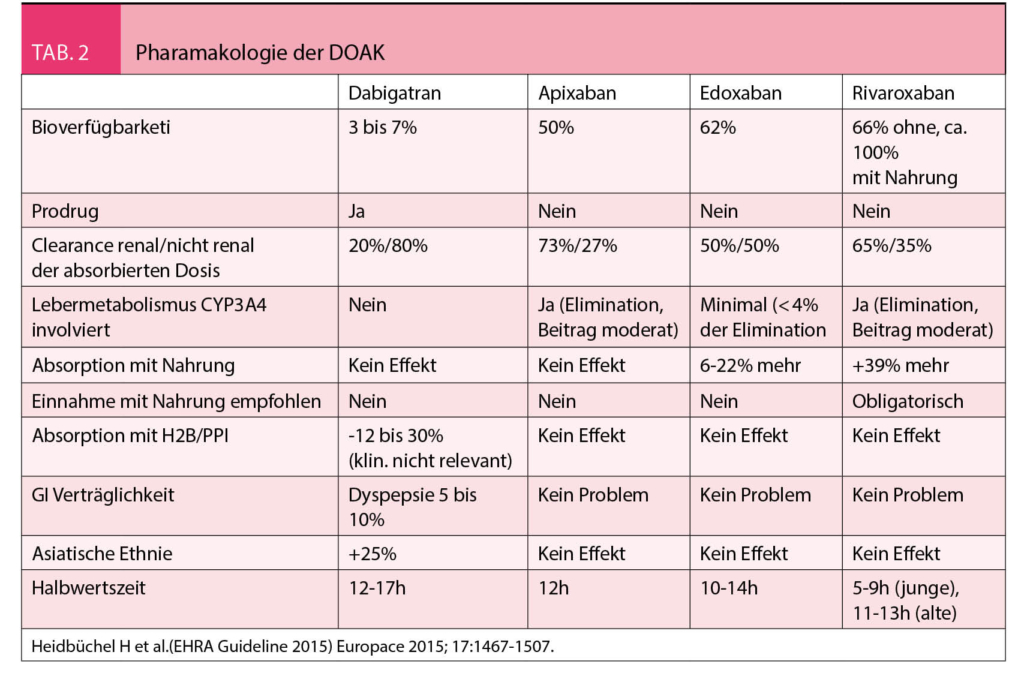
Die Antikoagulantien umfassen die Vitamin-K-Antagonisten, die Heparine, Heparinoide und die direkten Antikoagulantien Dabigatran, Rivaroxaban, Apixaban und Edoxaban, erklärte PD Dr. med. Lars Asmis, Zürich, zu Beginn seiner Ausführungen. Bei den Wirkmechanismen wird zwischen direkter und indirekter Antikoagulation unterschieden. Die direkten Antikoagulantien wirken direkt am aktiven Ort, d.h. am Zielmolekül FXa bzw. FIIa (direkte orale Antikoagulantien (DOAK), während die indirekten Antikoagulantien, die Heparine am Antithrombin, die Vitamin K Antagonisten am y-COOH wirken, die Zielmoleküle sind in diesem Fall freier FIIa und FXa bzw. «freier» II, VII, IX, PrC, PrS (Tab. 2).
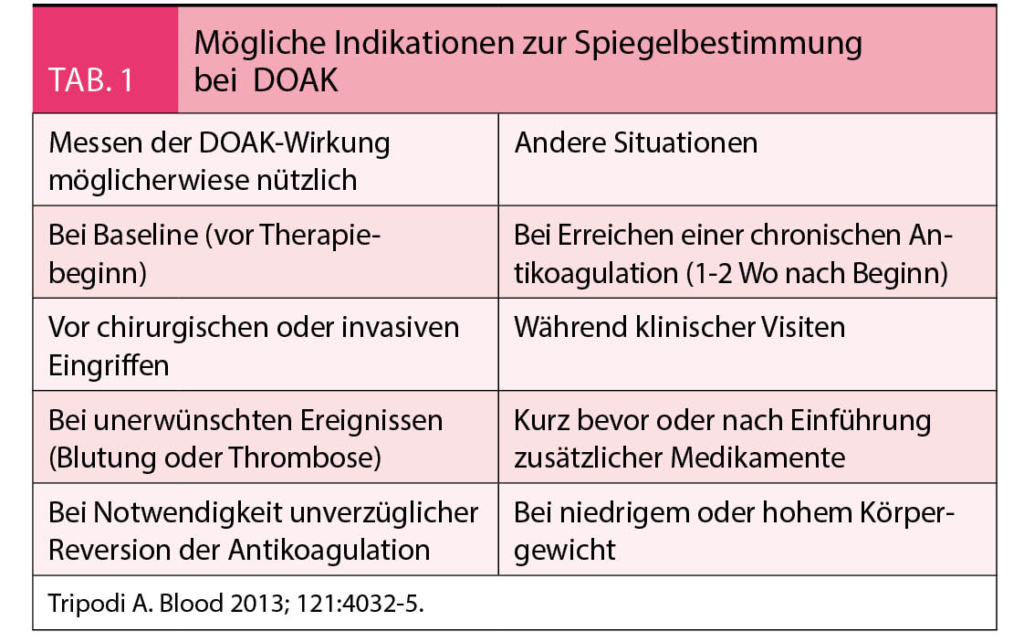
Spiegelmessung bei DOAK: Der maximale Spiegel wird ca. 2-4h nach Einnahme gemessen, der Tal-Spiegel vor der nächsten Einnahme. Routinemässige Spiegelmessungen sind nicht indiziert, wie der Referent erläuterte.
Rivaroxaban verändert die Prothrombinzeit, die aktivierte partielle Thromboplastinzeit und die Faktoranalyse für intrinsische und extrinsische Faktoren signifikant. Die Bestimmung der Thrombinzeit, des Fibrinogens, der FXIII- und D-Dimer-Werte werden dagegen nicht beeinflusst.
Situationen, bei denen die Messung der Wirkung von DOAKs möglicherweise nützlich ist, sind die folgenden:
Der Referent wies auf die Pharmakologie der verschiedenen DOAKs hin, die in der Tabelle 2 wiedergegeben sind.
Take-Home Messages
• Laborkontrollen bei DOAK: Was ist die Indikation? Dosis?
• Pharmakologie: Nierenabhängigkeit, Leberabhängigkeit (Komedikation), Nahrungsabhängigkeit
• Anti-FXa- oder Anti-FIIa Messung: Timing (Maximal- oder Minimalspiegel)
• Interaktionen mit anderen Labortests
PCSK9-Hemmer oder Lebensstilmodifikationen bei KHK und Statinintoleranz?
Fallvignette:
Ein 58-jähriger Mann mit progredienter koronarer Dreigefäss-erkrankung, der vor 15 Jahren einen inferioren Myokardinfarkt erlitten hat, wird von Prof. Dr. med. Franz Eberli, Chefarzt Triemlispital vorgestellt. Verschluss RCA → PCI/Stent x 1, Stenose RIVA/D1 → PCI/Stent x 1, LV-Funktion bei inferiorer Hypokinesie erhalten. Kardiovaskuläre Risikofaktoren: Hypertonie, Hypercholesterinämie, Nikotin (12 py), FA. Die medikamentöse Therapie besteht unter anderem aus Sortis 40 mg/Tag. Der Patient zeigt eine eingeschränkte Leistungsfähigkeit. Zusätzlich wurde die Diagnose einer Hypothyreose gestellt und eine Therapie mit Eltroxin gestartet. Eine zweite Intervention wurde wegen zunehmender AP notwendig (3/2005). Unter Erhöhung der Atorvastatin-Dosis auf 80mg betrug das LDL-C nun 1.9mmol/l. Die daraufhin registrierte Erhöhung der CK- und der Leberwerte wurde auf die hohe Atorvastatin-Dosis zurückgeführt. Im Mai 2006 klagte der Patient über Schulterschmerzen beidseits. Er wies eine Ulzeration am Finger D2 auf. Die Ulzeration wurde beschrieben, als der Patient unter hohen Statindosen stand. Entsprechend wurde die Atorvastatin-Therapie gestoppt und durch Inegy (Simvastatin 20 mg, Ezetimibe 10mg) ersetzt. Inegy wurde darauf auf 40mg Simvastatin erhöht. Im April 2008 zeigten sich eine starke Leistungsintoleranz und eine Erhöhung der Leberenzyme, LDL-C betrug 2.5 mmol/l. 2009/2010 stellten sich Schmerzen unter Belastung an der Tibiavorderkante beidseits ein. Wegen zunehmender Wadenschmerzen erfolgte eine Inegy-Pause 5/2012. Nach 2 Wochen war der Patient schmerzfrei und die Schwellung der Wadenmuskulatur verschwunden. Beginn mit Rosuvastatin 5mg/Tag. Kopfschmerzen, Übelkeit, Fieber, Beinödeme beidseits, Stopp Rosuvastatin. Am 28.6.2012 dritte Intervention: akutes Koronarsyndrom, Plaqueruptur CX: PCI/Stent (x 4). De-novo-Läsion RCA: PCI/Stent (x 2). Therapie Aspirin Cardio, Efient, Rosuvastatin 5 mg, Eltroxin, Cosaar Plus, Beloc ZOK 50 mg. Cholesterin 6.0 mmol/l, HDL-C 0.61 mmol/l, LDL-C 3.98 mmol/l. Da sich der Patient weigerte, Rosuvastatin weiter einzunehmen, wurde mit Ezetimibe allein 10 mg/Tag begonnen. Die LDL-C-Konzentration betrug 3.19 mmol/l. 4/2013 erneute Angina Pectoris, positive Ergometrie, Koronarangiographie. 5-facher ACBP, Venenbypass zu RPL und RIVPO der RCA. 10/2013 keine Angina Pectoris, aber deutliche Leistungsminderung wegen bilateraler Wadenschmerzen. Ezetimibe wird gestoppt. Beschwerden verbleiben lange Zeit, ebenso die Erhöhung der CK und der Transaminasen. Abklärung wegen Polyneuropathie und Myopathie ist unergiebig. Cholesterin 5.6 mmol/l, HDL 0.53 mmol/l, LDL-C 3.85 mmol/l. 1/2017 Kostengutsprache für Evolocumab und Beginn mit Repatha 140 mg jede 2. Woche. Keine Myalgien, keine Wadenkrämpfe, gute Leistungsfähigkeit. 5/2017 Cholesterin 3.3 mmol/l, HDL-C 0.7 mmol/l, LDL-C 1.43 mmol/l. 01/2018 Cholesterin 2.6 mmol/l, HDL-C 0.77 mmol/l, LDL-C 0.94 mmol/l.
Nebenwirkungen der Statine
Gute klinische Evidenz gibt es für die Myopathie, für Leberenzymerhöhung und die Entwicklung eines Diabetes mellitus. Weniger gute Evidenz für Krebs, intrazerebrale Blutung, Psychiatrische Krankheiten, erektile Dysfunktion, Müdigkeit, Kopfschmerzen, Schwindel, Katarakt, Rheumatoide Arthritis, Bauchschmerzen, Brustschmerzen, bleibende Leber- und Nierenschäden, so der Referent. Die Statin-assoziierten Muskelschmerzen teilen sich in Myalgie, bis 5% in klinischen Studien, Myositis 1% in klinischen Studien, CK erhöht (< 10 x), mit oder ohne Myalgien, Rhabdomyolyse, 1 pro 10 000 Patientenjahre, CK >10x erhöht, Myoglobinurie, Niereninsuffizienz und Statin-assoziierte Autoimmun-Myopathie, 2-3 pro 100 000 Patienten. Ursache sind Autoantikörper gegen HMGCoA-Reduktase-Behandlung durch immunsuppresive Therapie.
Lebensstiländerung bei Statinintoleranz: Was nützt? Wie gut?
Nahrungsergänzungsmittel, denen eine cholesterinsenkende Wirkung nachgesagt wird, sind roter Reis, Bergamotte, Artischocken, faserreiche Kost, pflanzliche Sterole, Phytosterole, Berberitze, Knoblauch, Grüntee, Soja, Omega-3-ungesättigte Fettsäuren. Der rote Reis senkt Cholesterin um 15-25% wegen seines Gehalts an Monacolin K, das chemisch identisch mit Lovastatin ist (Klasse I/A-Empfehlung). Es können daher zu den Statinen identische Nebenwirkungen auftreten. Die Phytosterine senken LDL-C zwischen 7 und 10%. Sie sollten bei Patienten mit Phytosterolämie und den für ABCG5 und ABCG8 Heterozyten vermieden werden (IIa/C-Empfehlung).
In verschiedenen Studien wurde eine Reduktion der kardiovaskulären Mortalität durch Omega-3-Fettsäuren festgestellt. Basierend auf diesen Studien (u.a. DART und GISSI) empfehlen alle Guidelines eine fischreiche Ernährung und die Einnahme von 1g Fischölkapseln. Bereits in den Nachfolgestudien zu DART und GISSI, von den gleichen Autoren durchgeführt, konnten die guten Resultate nicht reproduziert werden. In der Folge fanden die meisten Studien keinen Effekt, das Interesse für die Fischölkapseln blieb aber aufgrund von Open-Label-Studien hoch, insbesondere zum Verhindern von Arrhythmien, Herzinsuffizienz und bei Diabetikern. Ein Cochrane Review mit 79 randomisierten Studien an 112 059 Probanden fand keinen Effekt oder wenig bezüglich Gesamtmortalität (RR0.98), kardiovaskuläre Mortalität (RR 0.99), Schlaganfall (RR1.06) und Arrhythmien (RR0.97). In einer Sensitivitätsanalyse der qualitativ guten Studien tendierten alle Effekte gegen Null (RR1.0).
Die im letzten Jahr veröffentlichte ASCEND-Studie an 15 480 Patienten mit Diabetes, aber ohne chronische Herzerkrankung, zeigte keinen Nutzen von Omega-3-Fettsäuren bei Diabetes mellitus.
In der REDUCE-IT-Studie mit Icosapent Ethyl, einem speziellen Omega-3-FS-Präparat wurde in diesem Jahr eine 25%-Risikoreduktion gegenüber Placebo beschrieben. Das in der REDUCE-IT-Studie verwendete Vascepa® (Icosapent Ethyl) senkt die Triglyceride nur leicht > (-0.44 mmol/l), der Effekt war unabhängig vom Ausgangswert der Triglyceride, LDL-C blieb unverändert (+ 0.05 mmol/l). Placebo verhielt sich in der Studie nicht neutral (Erhöhung von LDL-C um 10.2% (0.18 mmol/l), CRP wurde um 30% erhöht. Die Resultate sind zu gut, um wahr zu sein! Denn PCSK9-Inhibitoren senken LDL-C um 54-59% auf unter 1 mmol/l. Trotzdem haben sie das Risiko für ein kardiovaskuläres Ereignis nur um 15% (ODYSSEY OUTCOMES), respektive um 20% (FOURIER) gesenkt. Weder die kardiovaskuläre noch die Gesamtmortalität wurden durch die PCSK9-Hemmer gesenkt. Vascepa® wurde von der FDA zugelassen.
Ökonomische und ökologische Fakten zu Omega-3-Fettsäuren
Der Fischölkapselkonsum hat sich in den letzten Jahren in den USA verzehnfacht. Weltweit werden Fischölkapseln im Wert von 33 Milliarden Dollar verbraucht. Fischölkapseln werden aus kleinen Fischen (z.B. Sardellen und Heringen) hergestellt. Ein Achtel des gesamten Weltfischfangs geht in die Produktion von Omega-3-Fettsäuren-Nahrungssupplemente. Die Produktion der unwirksamen Fischölkapseln stellt ein riesiges Umweltproblem dar.
Kardiovaskuläre Effekte von intensiver Lebensstilintervention bei Typ-2-Diabetes:
Im Look AHEAD Trial (NEJM 2013;369:145-152) absolvierten von 5145 übergewichtigen Patienten mit Typ-2-Diabetes 2570 ein intensives Training und Gewichtsreduktion, 2575 erhielten eine normale Betreuung. Primärer Endpunkt war kardiovaskulärer Tod, Myokardinfarkt, Schlaganfall, Hospitalisierung wegen Angina Pectoris. Die Nachbetreuung war für 13.5 Jahre vorgesehen, die Studie wurde nach 9.6 Jahren gestoppt. Die Effekte des intensiven Trainings waren -4 kg Gewichtsreduktion (p < 0.001), körperliche Fitness +0.6 (MET) (p< 0.001), Bauchumfang -3.2cm (P < 0.01), HbA1c -0.22 (P < 0.001). Das intensive Training und die Gewichtsreduktion verringerten indessen die kardiovaskulären Ereignisse beim Typ-2-Diabetiker nicht.
Therapieversuche bei Statinintoleranz und Alternativen zu Statinen
Der Referent erwähnt Diät und Lebensstiländerung, Reduktion von Fett und cholesterinhaltigen Lebensmitteln, Ersatz von gesättigten durch mono- und poly-ungesättigte Fette (Omega 3 >), körperliches Training, Gewichtsabnahme. Reduktion der Statindosierung, Wechsel des Statins, intermittierende Dosis z.B. jeden 2. Tag.
Behandlung der Muskelschmerzen: Coenzym Q10, Vitamin D. Als medikamentöse Alternativen zu den Statinen nannte der Referent Ezetimibe, PCSK9-Inhibitoren: Antikörper gegen PCSK9, Alirocumab und Evolocumab, Inclisiran: small interfering RNA zur Hemmung der PCSK9-Synthese. Ferner Bempedoinsäure, ein Hemmer der ATP-Citrat-Lyase (ACL). ACL ist das Enzym, das im Zytosol eukaryotischer Zellen eine Acetylgruppe von Citrat auf Coenzym A überträgt, woraus unter anderem Acetyl-CoA resultiert.
PCSK9-Inhibitoren bei Statinintoleranz: In der GAUSS-3-Studie (Intoleranz gegen 3 Statine) senkte Evolocumab das LDL besser als Ezetimibe. Nebenwirkungen waren Muskelschmerzen (Evolocumab vs. Ezetimibe) 20.7% vs. 28.8%, Nasopharyngitis 9.7% vs. 2.7%, Arthralgie 9.0% vs. 1.4%, Schmerzen in den Extremitäten 9.0% vs. 1.4%. In der ODYSSEY ALTERNATIVE mit Alirocumab wurden medikamentabhängige unerwünschte Muskelwirkungen unter Alirocumab in 32.5%, unter Ezetimibe in 42.2% und unter Atorvastatin in 46.0% festgestellt (HR vs. Alirocumab 1.41 bzw. 1.61). Medikamentabhängige, unerwünschte Muskelwirkungen, die zum Therapieabbruch führten, wurden unter Alirocumab in 15.9%, unter Ezetimibe in 20.2% und unter Atorvastatin in 22.2% registriert (HR vs. Alirocumab 1.28 bzw. 1.52).
Die Dosierungen der PCSK9-Inhibitoren sind für Evolocumab (Repatha®) 140mg s.c. alle 2 Wochen, 420mg s.c. alle 4 Wochen, für Alirocumab (Praluent®) 75 mg s.c. alle 2 Wochen, 150 mg s.c. alle 2 Wochen.
Der PCSK9-RNA-Inhibitor Inclisiran ergab in der ORION-Studie eine LDL-C-Senkung von 28% bis 52% in den verschiedenen Dosierungen. Die Wirkung erstreckte sich über 180 Tage.
Für Bempedoinsäure lieferte die CLEAR-Harmony-Studie den Beweis dafür, dass dieses Medikament sicher ist. Das Nebenwirkungsprofil von Bempedoinsäure war im Allgemeinen ähnlich wie das von Placebo.
Die Hintergrund-Statinintensität hatte keinen Einfluss auf das Sicherheitsprofil von Bempedoinsäure.
Bempedoinsäure reduzierte LDL-C in Woche 12 um 18,1% (ITT) und 19,8% (On-Treatment), signifikante Reduzierungen von LDL-C wurden bis Woche 52 beobachtet.
Bempedoinsäure senkte auch signifikant Non-HDL-C, Gesamtcholesterin, apoB und hsCRP.
Bempedoinsäure bietet eine zusätzliche therapeutische Option zur sicheren Senkung von LDL-C in hohen Konzentrationen bei ASCVD-Risikopatienten, die mit Statinen behandelt werden.
Quelle: 17. Zürcher Review Kurs in Klinischer Kardiologie, 5.4.-7.4.2019 Zürich Oerlikon.
riesen@medinfo-verlag.ch