- Ablation von ventrikulären Extrasystolen bei Herzinsuffizienz
Ventrikuläre Extrasystolen (VES) sind eine häufige Rhythmusstörung bei Patienten mit Herzinsuffizienz. Die klinische Relevanz einer Suppression von ventrikulären Extrasystolen in dieser Population ist komplex und die prognostische Bedeutung kontrovers. Der nachfolgende Artikel bildet eine Übersicht über die Bedeutung der Radiofrequenzablation bei Patienten mit ventrikulären Extrasystolen und Herzin-suffizienz.
Les extrasystoles ventriculaires (VES) sont un trouble fréquent du rythme cardiaque chez les patients atteints d’ insuffisance cardiaque. La pertinence clinique de la suppression des extrasystoles ventriculaires dans cette population est complexe et la signification pronostique est controversée. L’ article suivant donne un aperçu de l’ importance de l’ ablation par radiofréquence chez les patients atteints d’ extrasystoles ventriculaires et d’ insuffisance cardiaque.
VES Epidemiologie und Ätiologie
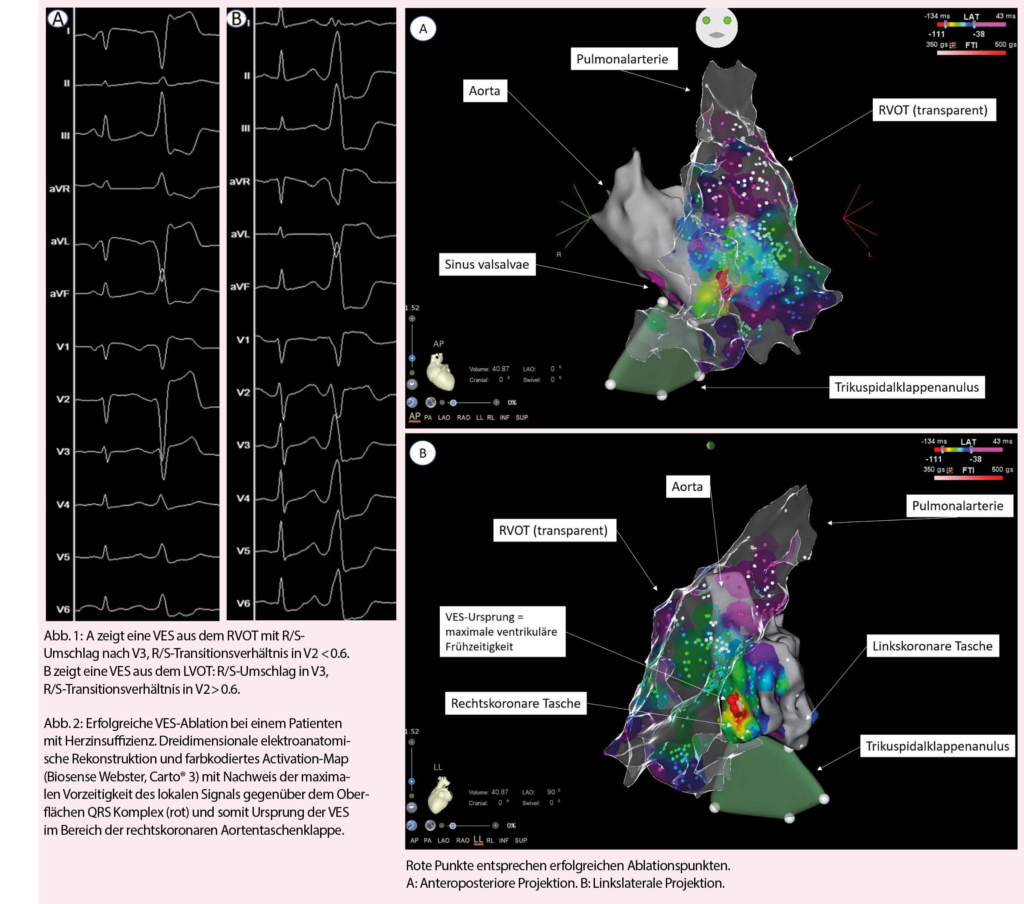
VES sind eine sehr häufige Rhythmusstörung mit einer geschätzten Inzidenz von 75% in der Gesamtbevölkerung und 95% bei Patienten mit Herzinsuffizienz (1-3). Die Prävalenz und Häufigkeit steigen mit dem Alter, kardiovaskulärem Risikoprofil und den assoziierten Komorbiditäten (4-6). Bei Erstdiagnose sollten strukturelle Herzerkrankungen ausgeschlossen werden, da sich VES bei diesen Patienten wesentlich von den idiopathischen VES ohne zugrundeliegende Herzerkrankung unterscheiden. Bei Ersteren treten VES oft im Zusammenhang mit einem Substrat auf und sie sind häufiger im linken Ventrikel lokalisiert mit resultierender Rechtsschenkelblock-Morphologie (7). Ist der Ursprungsort der Ausflusstrakt, dann ist es häufiger der linksventrikuläre oder auch anatomisch benachbarte Strukturen (8). Im Gegensatz dazu treten die idiopathischen VES ohne strukturelle Herzerkrankung durch die Mechanismen der getriggerten Aktivität oder Automatizität auf, insbesondere bei Frauen im jungen Erwachsenenalter. Bei diesen Patienten entstammen die VES in circa 70-80% aus dem Ausflusstrakt (9, 10) und dabei typischerweise aus dem unmittelbar subvalvulären Myokard des rechtsventrikulären Ausflusstraktes (RVOT) oder der myokardialen Extensionen bis knapp oberhalb der Taschenklappen der Pulmonalklappe (11). Klassischerweise zeigen RVOT-VES eine inferiore Achse mit Linksschenkelblock-Morphologie, aufgrund der Proximität anderer Strukturen können VES mit Ursprung im linksventrikulären Ausflusstrakt aber eine ähnliche Morphologie aufweisen (12). Hinweise für eine RVOT-Ätiologie im Oberflächen-EKG ist ein präkordialer R/S-Umschlag nach V3 oder später als im Sinusrhythmus, sowie eine QS-Morphologie in V1. Leider findet sich der R/S-Umschlag oft in V3 (Abb. 1) oder zeitgleich mit dem Sinusrhythmus (13), sodass der Ursprung letztlich nur während einer elektrophysiologischen Untersuchung genau lokalisiert werden kann. Bei einem R/S-Umschlag vor V3 kann jedoch nicht-invasiv das R-Zacken-Transitionsverhältnis in V2 (RVOT ≤ 0.6) zur weiteren Unterscheidung zwischen rechts- und linksventrikulärem Ursprung verwendet werden (14); dabei wird der Anteil der R-Zacke am gesamten vertikalen Vektor des QRS-Komplexes verglichen zwischen VES- und Sinus-QRS-Komplex. Ebenfalls prädiktiv für eine linksventrikuläre Lokalisation einer Ausflusstrakt-VES sind Alter>50 Jahre, männliches Geschlecht, kardiovaskuläres Risikoprofil und systolische Herzinsuffizienz (HFrEF) als Marker für eine strukturelle Herzerkrankung (15). Mittels Holter-EKG können VES durch Angabe des «Burden» (Prozentanzahl VES aller QRS-Komplexe) quantifiziert werden, allerdings kann damit die tatsächliche VES-Last aufgrund zeitlicher Variabilität der VES unterschätzt werden (16).
VES und Herzinsuffizienz
Für Patienten mit struktureller Herzerkrankung oder Herzinsuffizienz ist eine Assoziation von gehäuften VES mit erhöhter Morbidität und Mortalität hinreichend bekannt (17-20). Retrospektive Daten zeigen aber auch für herzgesunde Patienten mit VES ein signifikant höheres Risiko für die Entwicklung einer Herzinsuffizienz, unabhängig von kardiovaskulären Risikofaktoren und mit proportional zur VES-Häufigkeit ansteigendem Risiko (21). Das Konzept einer durch VES induzierten Herzinsuffizienz wurde erstmals 1998 postuliert, basierend auf der Normalisierung der LVEF nach medikamentöser Suppression der ventrikulären Extrasystolie (22). Im Anschluss zeigten mehrere Fallserien mit Patienten ohne strukturelle Herzerkrankung aber gehäuften VES (meist > 10 000/24h) nach erfolgreicher Radiofrequenzablation (RFA) der VES eine Verbesserung der LVEF, der kardialen Dimensionen und klinischen Parameter (23-27). In den nachfolgenden Jahren konnte auch eine Verbesserung der LVEF nach RFA bei vorbestehender ischämischer oder nicht-ischämischer Herzerkrankung und erst sekundär aufgetretener VES nachgewiesen werden (28-30). Die daraus resultierende kontroverse Diskussion, ob VES bei Patienten mit struktureller Herzerkrankung nur Ausdruck letzterer sind oder einen kausalen Bestandteil der Kardiomyopathie darstellen, dauert bis heute an (31). Immerhin ist mittlerweile bekannt, dass sich der positive Effekt einer erfolgreichen VES-RFA auf die LVEF und Herzinsuffizienz-Symptomatik unabhängig der zugrundliegenden Erkrankung auswirkt (32, 33). Bis zu 50% aller Patienten mit ätiologisch unklarer HFrEF und relevanter ventrikulärer Extrasystolie scheinen dabei eine rein VES-induzierte Kardiomyopathie mit kompletter Normalisierung der LVEF nach erfolgreicher RFA aufzuweisen, während bei den anderen «nur» eine Verbesserung ohne Normalisierung der LVEF erzielt werden kann im Sinne einer durch VES akzentuierten Kardiomyopathie (34). Diese reproduzierbaren Beobachtungen prägten die aktuelle «Definition» einer VES-assoziierten Kardiomyopathie: eine linksventrikuläre Dilatation und eingeschränkte LVEF mit oder ohne zugrundeliegende strukturelle Herzerkrankung bei Patienten mit gehäuften VES und Besserung der linksventrikulären Dysfunktion nach pharmakologischer oder interventioneller Suppression der VES (35). Die linksventrikuläre Funktion scheint proportional mit dem VES-Burden abzunehmen (36), eine absolute Grenze mit sicherer Prädiktion für die Entwicklung einer VES-induzierten Kardiomyopathie existiert aber nicht; Anhand verschiedener retrospektiver Analysen wurden unterschiedliche Grenzwerte (> 10% Burden, > 24% Burden, > 10 000 VES/24h) vorgeschlagen (36-38). Interessanterweise tritt bei den einen Patienten mit sehr hohem VES-Burden keine Kardiomyopathie auf, während andere Patienten mit vergleichsweise wenig VES eine linksventrikuläre Dysfunktion entwickeln. Dies suggeriert eine individuelle Suszeptibilität der Entwicklung einer VES assoziierten Kardiomyopathie, welche aktuell noch unklar ist – bekannt sind bisher einige Patienten- und VES-spezifische Einflussfaktoren (Tab. 1) (24, 39, 40).
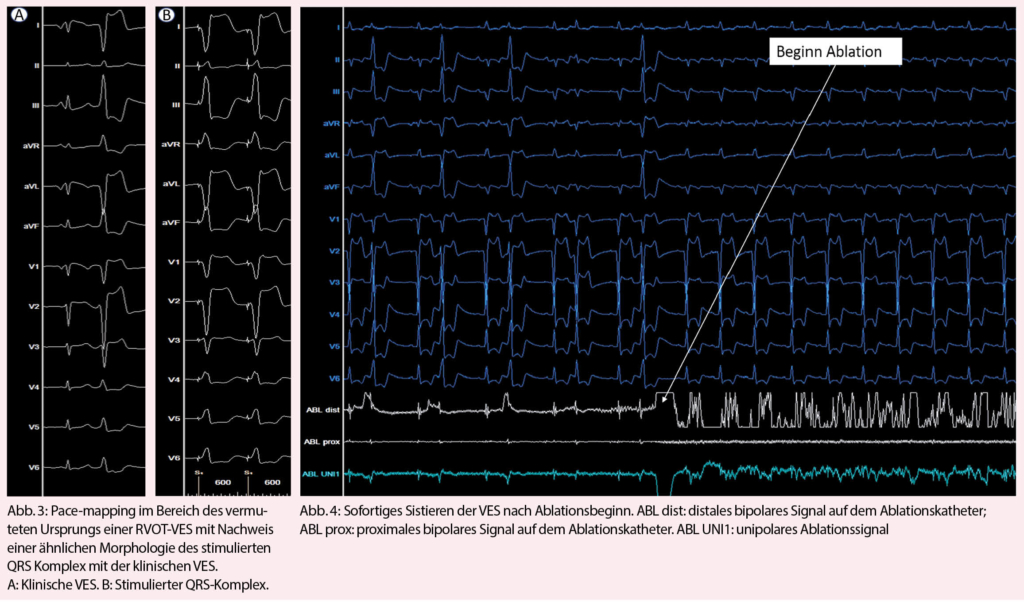
VES Therapie
Eine Therapie-Indikation von VES besteht bei hoher Symptomlast, systolischer Herzinsuffizienz ohne eindeutig therapierbare andere Ursache, anhaltenden ventrikulären Tachykardien oder insuffizienter biventrikulärer Stimulation einer kardialen Resynchronisationstherapie. Bei asymptomatischen Patienten mit normaler LVEF und hohem VES-Burden empfiehlt sich ein expektatives Verhalten mit regelmässigen echokardiographischen Verlaufskontrollen, um die Entwicklung einer VES-assoziierten Kardiomyopathie rechtzeitig zu erkennen (41) – allerdings scheint das Intervall bis zur Abnahme der LVEF bei asymptomatischen Patienten mit gehäuften VES teilweise mehrere Jahre zu dauern und insgesamt einen sehr kleinen Anteil (geschätzte Inzidenz 5-7%) dieser Gesamtpopulation zu betreffen (36, 42). Lebensstil-Modifikationen im Sinne von reduziertem Alkohol-, Koffein- und Nikotinkonsum haben nur einen geringen Effekt auf die VES-Häufigkeit (43, 44). Ungefähr 25% der Patienten mit VES scheinen aber auf eine Kalium- oder Magnesiumsubstitution anzusprechen, wobei keine Daten bezüglich dem Effekt bei Herzinsuffizienz verfügbar sind (45). Betablocker können den VES-Burden gegenüber Plazebo signifikant senken (46), gleiches gilt für Amiodaron und Mexiletin, welche aber aufgrund des Nebenwirkungspotentials zurückhaltend eingesetzt werden (47). Klasse I Antiarrhythmika sind bei Patienten mit struktureller Herzerkrankung seit dem Nachweis einer erhöhten Mortalität von Flecainid in der CAST-Studie formal kontraindiziert, wobei das Resultat vermutlich primär durch eine heute obsolete Indikationsstellung (6VES/h = 144VES/24h) bei Patienten nach Myokardinfarkt zustande kam (48). Die elektrophysiologische Untersuchung mit RFA stellt eine interventionelle Alternative dar und muss bezüglich Eingriffsrisiko, Erfolgsaussicht und Eingriffsnutzen abgewogen werden. Die letzten zwei Jahrzehnte zeichneten sich durch enorme technische Fortschritte aus durch Entwicklung von dreidimensionalen Mapping-Verfahren mit Integration von Activation- und Pace-Mapping (Abb. 2, 3) und neue Erkenntnisse über den Effekt der RFA auf die langfristige Symptomlast, Morbidität und Mortalität. Entsprechend ist die Radiofrequenztherapie gemäss den aktuellen Leitlinien der europäischen Gesellschaft für Kardiologie eine Klasse I Indikation für die Behandlung von VES aus dem RVOT (49). Ernsthafte Komplikationen sind mit < 1% selten (39, 50). Gegenüber der pharmakologischen Therapie ist eine Ablationstherapie deutlich effizienter und anhaltender (Abb. 3) (51, 52). Der Erfolg einer RFA reicht von > 90% bei monomorphem Auftreten und Lokalisation im RVOT bis circa 60% bei Polymorphie, epikardialer oder Papillarmuskel-Lokalisation (39). Grundsätzlich ist eine RFA im Ausflusstrakt gegenüber anderen Lokalisationen mit einer grösseren Erfolgsaussicht verbunden, und ein Ursprung aus dem RVOT mit der besten Erfolgsaussicht überhaupt (Abb. 4) (53).
Nach erfolgreicher VES-RFA bei Patienten mit HFrEF zeigt sich eine Verbesserung der LVEF, sowie funktioneller, laborchemischer und klinischer Parameter in 60-75% der Patienten, abhängig vom VES-Burden und Erfolg der RFA (29, 32, 33, 54, 55). Weitere Prädiktoren für eine Verbesserung der LVEF nach VES-RFA sind wenig Fibrose im Herz-MRI, ein intrinsischer QRS<130ms und eine fehlende linksventrikuläre Dilatation – Parameter, welche als Indikatoren für eine noch nicht weit fortgeschrittene Kardiomyopathie verwendet werden können (34, 56). Ähnlich wie bei der Vorhofflimmern-RFA scheint also die VES-RFA primär in frühen Stadien der Herzinsuffizienz erfolgversprechend zu sein. Eine kürzliche Meta-Analyse mit 712 Patienten mit HFrEF und VES zeigte eine mittlere Verbesserung der LVEF nach VES-RFA um 12.4%, was deutlich höher ist gegenüber dem geschätzten Effekt von ACE-Hemmer, Betablockern oder sogar einer kardialen Resynchronisations-Therapie (54, 57, 58). Erst kürzlich konnte auch ein positiver Effekt der VES-RFA bei HFrEF auf klinische Endpunkte (kardiale Mortalität, Transplantation, Hospitalisation) nachgewiesen werden (59). Bezüglich VES-Burden und Indikation für eine RFA bei HFrEF konnte bereits bei einem Burden > 4% in Patienten mit schwer eingeschränkter linksventrikulärer Funktion eine RFA zur anhaltenden Verbesserung der LVEF führen, sodass 42 von 66 Patienten nach einem Jahr nicht mehr für eine ICD-Implantation qualifizierten (60).
Abkürzungen:
VES – Ventrikuläre Extrasystole
LVEF – Linksventrikuläre systolische Funktion
RVOT – Rechtsventrikulärer Ausflusstrakt
HFrEF – Systolische Herzinsuffizienz
RFA – Radiofrequenz-Ablation
Dr. med. Daniel Hofer
PD Dr. med. Ardan M. Saguner
PD Dr. med. Alexander Breitenstein
Prof. Dr. med. Firat Duru
Prof. Dr. med. Corinna B. Brunckhorst
– Rhythmologie, Klinik für Kardiologie, Stadtspital Triemli
Birmensdorferstrasse 497, 8063 Zürich
– Rhythmologie, Klinik für Kardiologie, Universitätsspital Zürich
Rämistrasse 100, 8091 Zürich
Universitäres Herzzentrum Zürich
Klinik für Kardiologie
Universitätsspital Zürich
Rämistrasse100, 8091 Zürich
corinna.brunckhorst@usz.ch
Dr. Hofer erhielt Educational Grants, Speaker Fees oder Fellowship Support von Abbott (SJM), Medtronic, Biotronik, Boston Scientific, Biosense Webster, Novartis, Bayer. Dr. Saguner erhielt Educational Grants von Abbott (SJM), Medtronic, Biotronik, Boston Scientific, Biosense Webster und Pfizer-BMS sowie ein Vortragshonorar von BostonScientific. PD Dr. med. Alexander Breitenstein gibt an, Beratungshonorare von BMS/Pfizer, Biotronik, Medtronic, Daiichy Sankio, Boston Scientific und Bayer Health Care erhalten zu haben sowie Forschungsstipendien von Biosense Webster, Biotronik und Actelion und Referentenhonorare von BMS/Pfizer, Bayer Health Care, Abbott, Spectranetics, Biotronik und Medtronic.
- Gehäufte VES können eine linksventrikuläre Dysfunktion induzieren oder aggravieren, aber auch Ausdruck einer strukturellen Herzerkrankung sein.
- Nach Ausschluss spezifischer Erkrankungen mit kausalen Therapiemöglichkeiten zeigt letztlich nur der klinische und echokardiographische Verlauf nach erfolgreicher medikamentöser oder interventioneller VES-Suppression den kausalen Anteil der VES an der systolischen Herzinsuffizienz.
- Der Krankheitswert von VES in Patienten mit HFrEF und der prognostische Nutzen einer RFA wird aber vermutlich unterschätzt.
- Die VES-RFA ist in dieser Population eine effektive Therapie mit positivem Effekt auf Morbidität und Mortalität, die Komplikationsrate der Intervention ist niedrig.
- Der Erfolg der Ablation ist abhängig von der Morphologie der ventrikulären Extrasystolie und damit der Lokalisation, dem VES-Burden und Krankheitsstadium.
- Es existiert kein allgemein gültiger Grenzwert bezüglich Häufigkeit der VES zur Therapie-Indikation, sodass diese Entscheidung individualisiert werden muss.
Messages à retenir
- L’ accumulation d’ extrasystoles ventriculaires peut induire ou aggraver le dysfonctionnement du ventricule gauche, mais peut aussi être l’ expression d’ une maladie cardiaque structurelle.
- Après l’ exclusion de maladies spécifiques avec options thérapeutiques causales, seule l’ évolution clinique et l’ échocardiographique après une suppression médicamenteuse ou une suppression interventionnelle d’ extrasystoles ventriculaires réussie montre la contribution causale de l’ extrasystole ventriculaire à l’ insuffisance cardiaque systolique.
- Cependant, la valeur de maladie de l’ extrasystole ventriculaire chez les patients atteints de HFrEF et le bénéfice pronostique d’ une
ablation par radiofréquence sont probablement sous-estimés. - L’ ablation par radiofrèqunece de l’ extrasystole ventriculaire dans cette population est une thérapie efficace avec un effet positif sur
la morbidité et la mortalité, le taux de complication de l’ intervention est faible. - Le succès de l’ ablation dépend de la morphologie de l’ extrasystole ventriculaire et donc de la localisation, de la charge de l’ extrasystole ventriculaire et du stade de la maladie.
- Il n’ y a pas de limite généralement valable pour la fréquence de l’ extrasystole ventriculaire pour l’ indication thérapeutique ; cette décision doit donc être individualisée.
1. Hiss, R.G. and L.E. Lamb, Electrocardiographic findings in 122,043 individuals. Circulation, 1962. 25: p. 947-61.
2. Kennedy, H.L., et al., Long-term follow-up of asymptomatic healthy subjects with frequent and complex ventricular ectopy. N Engl J Med, 1985. 312(4): p. 193-7.
3. Podrid, P.J., R.I. Fogel, and T.T. Fuchs, Ventricular arrhythmia in congestive heart failure. Am J Cardiol, 1992. 69(18): p. 82G-95G; discussion 95G-96G.
4. Camm, A.J., et al., The rhythm of the heart in active elderly subjects.
Am Heart J, 1980. 99(5): p. 598-603.
5. Bikkina, M., M.G. Larson, and D. Levy, Prognostic implications of asymptomatic ventricular arrhythmias: the Framingham Heart Study. Ann Intern Med, 1992. 117(12): p. 990-6.
6. Morshedi-Meibodi, A., et al., Clinical correlates and prognostic significance of exercise-induced ventricular premature beats in the community: the Framingham Heart Study. Circulation, 2004. 109(20): p. 2417-22.
7. Nucifora, G., et al., Prevalence and prognostic value of concealed structural
abnormalities in patients with apparently idiopathic ventricular arrhythmias of left versus right ventricular origin: a magnetic resonance imaging study.
Circ Arrhythm Electrophysiol, 2014. 7(3): p. 456-62.
8. Ellis, E.R., A. Shvilkin, and M.E. Josephson, Nonreentrant ventricular arrhythmias in patients with structural heart disease unrelated to abnormal myocardial substrate. Heart Rhythm, 2014. 11(6): p. 946-52.
9. Sheldon, S.H., J.J. Gard, and S.J. Asirvatham, Premature Ventricular Contractions and Non-sustained Ventricular Tachycardia: Association with Sudden Cardiac Death, Risk Stratification, and Management Strategies. Indian Pacing Electrophysiol J, 2010. 10(8): p. 357-71.
10. Del Carpio Munoz, F., et al., Characteristics of premature ventricular complexes as correlates of reduced left ventricular systolic function: study of the burden,
duration, coupling interval, morphology and site of origin of PVCs. J Cardiovasc Electrophysiol, 2011. 22(7): p. 791-8.
11. Gami, A.S., et al., Anatomical correlates relevant to ablation above the semilunar valves for the cardiac electrophysiologist: a study of 603 hearts. J Interv Card Electrophysiol, 2011. 30(1): p. 5-15.
12. Asirvatham, S.J., Correlative anatomy for the invasive electrophysiologist: outflow tract and supravalvar arrhythmia. J Cardiovasc Electrophysiol, 2009. 20(8):
p. 955-68.
13. Tanner, H., et al., Outflow tract tachycardia with R/S transition in lead V3: six different anatomic approaches for successful ablation. J Am Coll Cardiol, 2005. 45(3): p. 418-23.
14. Betensky, B.P., et al., The V(2) transition ratio: a new electrocardiographic criterion for distinguishing left from right ventricular outflow tract tachycardia origin.
J Am Coll Cardiol, 2011. 57(22): p. 2255-62.
15. Penela, D., et al., An easy-to-use, operator-independent, clinical model to predict the left vs. right ventricular outflow tract origin of ventricular arrhythmias. Europace, 2015. 17(7): p. 1122-8.
16. Anastasiou-Nana, M.I., et al., Spontaneous variability of ventricular arrhythmias in patients with chronic heart failure. Am Heart J, 1991. 122(4 Pt 1): p. 1007-15.
17. Bigger, J.T., Jr., et al., The relationships among ventricular arrhythmias, left ventricular dysfunction, and mortality in the 2 years after myocardial infarction. Circulation, 1984. 69(2): p. 250-8.
18. Meinertz, T., et al., Significance of ventricular arrhythmias in idiopathic dilated cardiomyopathy. Am J Cardiol, 1984. 53(7): p. 902-7.
19. De Maria, R., et al., Ventricular arrhythmias in dilated cardiomyopathy as an independent prognostic hallmark. Italian Multicenter Cardiomyopathy Study (SPIC) Group. Am J Cardiol, 1992. 69(17): p. 1451-7.
20. Le, V.V., et al., Rest premature ventricular contractions on routine ECG and prognosis in heart failure patients. Ann Noninvasive Electrocardiol, 2010. 15(1): p. 56-62.
21. Dukes, J.W., et al., Ventricular Ectopy as a Predictor of Heart Failure and Death.
J Am Coll Cardiol, 2015. 66(2): p. 101-9.
22. Duffee, D.F., W.K. Shen, and H.C. Smith, Suppression of frequent premature ventricular contractions and improvement of left ventricular function in patients with presumed idiopathic dilated cardiomyopathy. Mayo Clin Proc, 1998. 73(5): p. 430-3.
23. Takemoto, M., et al., Radiofrequency catheter ablation of premature ventricular complexes from right ventricular outflow tract improves left ventricular dilation and clinical status in patients without structural heart disease. J Am Coll Cardiol, 2005. 45(8): p. 1259-65.
24. Yarlagadda, R.K., et al., Reversal of cardiomyopathy in patients with repetitive
monomorphic ventricular ectopy originating from the right ventricular outflow tract. Circulation, 2005. 112(8): p. 1092-7.
25. Bogun, F., et al., Radiofrequency ablation of frequent, idiopathic premature ventricular complexes: comparison with a control group without intervention. Heart Rhythm, 2007. 4(7): p. 863-7.
26. Taieb, J.M., et al., Reversal of dilated cardiomyopathy by the elimination of frequent left or right premature ventricular contractions. J Interv Card Electrophysiol, 2007. 20(1-2): p. 9-13.
27. Chugh, S.S., et al., First evidence of premature ventricular complex-induced
cardiomyopathy: a potentially reversible cause of heart failure. J Cardiovasc
Electrophysiol, 2000. 11(3): p. 328-9.
28. Mountantonakis, S.E., et al., Reversal of outflow tract ventricular premature depolarization-induced cardiomyopathy with ablation: effect of residual arrhythmia burden and preexisting cardiomyopathy on outcome. Heart Rhythm, 2011. 8(10): p. 1608-14.
29. El Kadri, M., et al., Effect of ablation of frequent premature ventricular complexes on left ventricular function in patients with nonischemic cardiomyopathy. Heart Rhythm, 2015. 12(4): p. 706-13.
30. Sarrazin, J.F., et al., Impact of radiofrequency ablation of frequent post-infarction premature ventricular complexes on left ventricular ejection fraction. Heart Rhythm, 2009. 6(11): p. 1543-9.
31. Simantirakis, E.N., E.P. Koutalas, and P.E. Vardas, Arrhythmia-induced cardiomyopathies: the riddle of the chicken and the egg still unanswered? Europace, 2012. 14(4): p. 466-73.
32. Penela, D., et al., Neurohormonal, structural, and functional recovery pattern after premature ventricular complex ablation is independent of structural heart disease status in patients with depressed left ventricular ejection fraction: a prospective multicenter study. J Am Coll Cardiol, 2013. 62(13): p. 1195-202.
33. Abdelhamid, M.A. and R. Samir, Reversal of premature ventricular complexes induced cardiomyopathy. Influence of concomitant structural heart disease. Indian Heart J, 2018. 70(3): p. 410-415.
34. Penela, D., et al., Clinical recognition of pure premature ventricular complex-induced cardiomyopathy at presentation. Heart Rhythm, 2017. 14(12): p. 1864-1870.
35. Lee, G.K., et al., Premature ventricular contraction-induced cardiomyopathy: a treatable condition. Circ Arrhythm Electrophysiol, 2012. 5(1): p. 229-36.
36. Niwano, S., et al., Prognostic significance of frequent premature ventricular contractions originating from the ventricular outflow tract in patients with normal left ventricular function. Heart, 2009. 95(15): p. 1230-7.
37. Kanei, Y., et al., Frequent premature ventricular complexes originating from the right ventricular outflow tract are associated with left ventricular dysfunction.
Ann Noninvasive Electrocardiol, 2008. 13(1): p. 81-5.
38. Baman, T.S., et al., Relationship between burden of premature ventricular complexes and left ventricular function. Heart Rhythm, 2010. 7(7): p. 865-9.
39. Latchamsetty, R., et al., Multicenter Outcomes for Catheter Ablation of Idiopathic Premature Ventricular Complexes. JACC Clin Electrophysiol, 2015. 1(3): p. 116-123.
40. Yokokawa, M., et al., Relation of symptoms and symptom duration to premature ventricular complex-induced cardiomyopathy. Heart Rhythm, 2012. 9(1): p. 92-5.
41. Rillig, A., et al., Which Is The Appropriate Arrhythmia Burden To Offer RF Ablation For RVOT Tachycardias? J Atr Fibrillation, 2014. 7(4): p. 1157.
42. Hasdemir, C., et al., Tachycardia-induced cardiomyopathy in patients with idiopathic ventricular arrhythmias: the incidence, clinical and electrophysiologic characteristics, and the predictors. J Cardiovasc Electrophysiol, 2011. 22(6): p. 663-8.
43. DeBacker, G., et al., Ventricular premature contractions: a randomized non-drug intervention trial in normal men. Circulation, 1979. 59(4): p. 762-9.
44. Prineas, R.J., et al., Coffee, tea and VPB. J Chronic Dis, 1980. 33(2): p. 67-72.
45. Zehender, M., et al., Antiarrhythmic effects of increasing the daily intake of magnesium and potassium in patients with frequent ventricular arrhythmias. Magnesium in Cardiac Arrhythmias (MAGICA) Investigators. J Am Coll Cardiol, 1997. 29(5): p. 1028-34.
46. Krittayaphong, R., et al., Effect of atenolol on symptomatic ventricular arrhythmia without structural heart disease: a randomized placebo-controlled study.
Am Heart J, 2002. 144(6): p. e10.
47. Singh, S.N., et al., Amiodarone in patients with congestive heart failure and
asymptomatic ventricular arrhythmia. Survival Trial of Antiarrhythmic Therapy in Congestive Heart Failure. N Engl J Med, 1995. 333(2): p. 77-82.
48. Cardiac Arrhythmia Suppression Trial, I., Preliminary report: effect of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. N Engl J Med, 1989. 321(6): p. 406-12.
49. Priori, S.G., et al., 2015 ESC Guidelines for the management of patients with
ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the
Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J, 2015. 36(41): p. 2793-2867.
50. Wellens, H.J., Catheter ablation of cardiac arrhythmias: usually cure, but complications may occur. Circulation, 1999. 99(2): p. 195-7.
51. Zhong, L., et al., Relative efficacy of catheter ablation vs antiarrhythmic drugs in treating premature ventricular contractions: a single-center retrospective study. Heart Rhythm, 2014. 11(2): p. 187-93.
52. Ling, Z., et al., Radiofrequency ablation versus antiarrhythmic medication for treatment of ventricular premature beats from the right ventricular outflow tract: prospective randomized study. Circ Arrhythm Electrophysiol, 2014. 7(2):
p. 237-43.
53. Calkins, H., et al., Relation between efficacy of radiofrequency catheter ablation and site of origin of idiopathic ventricular tachycardia. Am J Cardiol, 1993. 71(10): p. 827-33.
54. Zang, M., et al., Beneficial effects of catheter ablation of frequent premature ventricular complexes on left ventricular function. Heart, 2014. 100(10): p. 787-93.
55. Yokokawa, M., et al., Recovery from left ventricular dysfunction after ablation of frequent premature ventricular complexes. Heart Rhythm, 2013. 10(2): p. 172-5.
56. Penela, D., et al., Influence of myocardial scar on the response to frequent premature ventricular complex ablation. Heart, 2018.
57. Solomon, S.D., et al., Changes in ventricular size and function in patients treated with valsartan, captopril, or both after myocardial infarction. Circulation, 2005. 111(25): p. 3411-9.
58. de Groote, P., et al., The effects of beta-blockers in patients with stable chronic heart failure. Predictors of left ventricular ejection fraction improvement and impact on prognosis. Am Heart J, 2007. 154(3): p. 589-95.
59. Berruezo, A., et al., Mortality and morbidity reduction after frequent premature ventricular complexes ablation in patients with left ventricular systolic dysfunction. Europace, 2019.
60. Penela, D., et al., Ablation of frequent PVC in patients meeting criteria for primary prevention ICD implant: Safety of withholding the implant. Heart Rhythm, 2015. 12(12): p. 2434-42.
info@herz+gefäss
- Vol. 9
- Ausgabe 4
- Juli 2019