- Auswirkungen von Lebensstilveränderungen auf das Vorhofflimmern
Die Bedeutung modifizierbarer kardiovaskulärer Risikofaktoren für den Verlauf der koronaren Herzkrankheit sind hinlänglich belegt und deren stete Überprüfung und Einstellung ärztliche Routinearbeit. Dass ebenjene Risikofaktoren auch eine krankheitsbeeinflussende Rolle beim Vorhofflimmern einnehmen, konnte in der jüngeren Vergangenheit eindrucksvoll nachgewiesen werden. Anhand dieses Artikels möchten wir den aktuellen Wissensstand zum Thema Lebensstilmodifikation und deren Auswirkung auf das Vorhofflimmern wiedergeben und daraus Therapieempfehlungen für die tägliche Praxis ableiten.
L’ importance des facteurs de risque cardiovasculaire modifiables dans l’ évolution des maladies coronariennes est bien établie et leur surveillance et leur ajustement constants font partie du travail médical de routine. Dans un passé récent, il a été démontré de façon impressionnante que ces mêmes facteurs de risque jouent également un rôle dans la fibrillation auriculaire. À l’ aide de cet article, nous souhaitons présenter l’ état actuel des connaissances sur le sujet de la modification du mode de vie et de ses effets sur la fibrillation auriculaire et en tirer des recommandations thérapeutiques pour la pratique quotidienne.
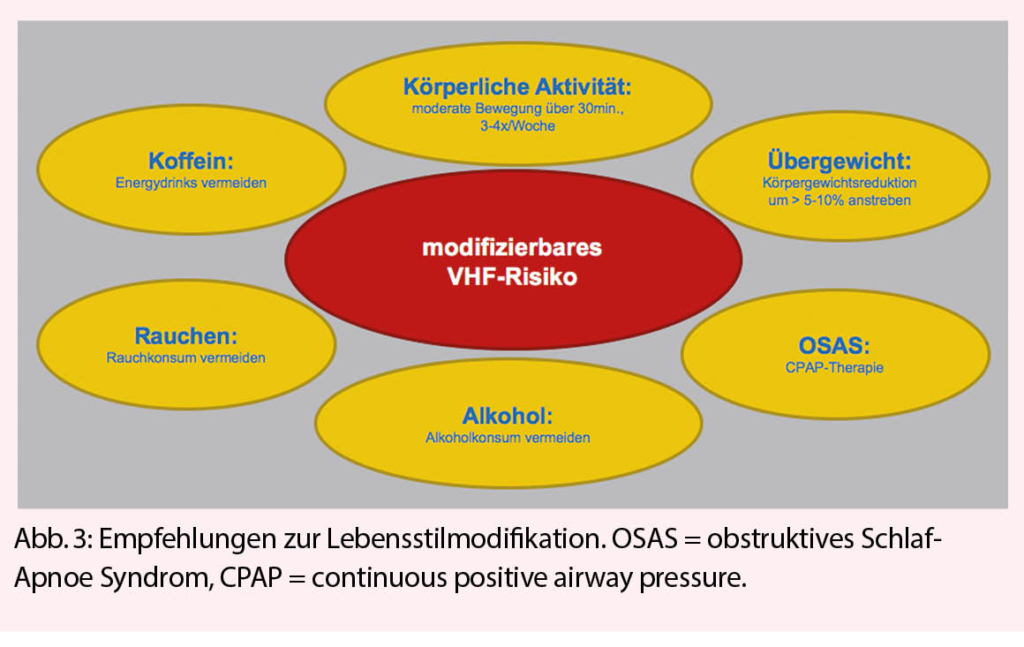
Das Kontinuum eines ungesunden Lebensstils, kardiovaskulärer Risikofaktoren oder bereits bestehender kardiovaskulärer Erkrankungen erhöht das Risiko für das Auftreten von Vorhofflimmern. Unter Berücksichtigung der bereits gegenwärtig hohen und künftig prognostiziert noch signifikant steigenden Vorhofflimmerprävalenz und den daraus resultierenden wirtschaftlichen Konsequenzen wurde der Stellenwert modifizierbarer Risikofaktoren in den letzten Guidelines der grossen Gesellschaften für Kardiologie daher deutlich stärker gewichtet (1-3). So wurden in ersten Ländern bereits eigene Vorhofflimmer-Ambulanzen eingeführt, mit dem Ziel, krankheitsmodulierende Risikofaktoren systematisch zu erfassen und Empfehlungen im Umgang damit abzugeben, um das Outcome von Vorhofflimmerpatienten künftig zu verbessern (4).
Übergewicht
Epidemiologische Studien konnten einen direkten Zusammenhang zwischen Übergewicht und einer erhöhten Vorhofflimmer-Inzidenz nachweisen, welche auch nach Korrektur für parallel auftretende krankheitsmodifizierende Risikofaktoren wie arterieller Hypertonie, Diabetes mellitus oder bereits existierender kardiovaskulärer Erkrankungen bestehen bleibt (5). So nahm das Risiko, an Vorhofflimmern zu erkranken, in der Framingham Heart Studien Population pro BMI-Einheit, im Sinne einer linearen Dosis-Wirkungs-Beziehung, um 4% zu (6). Reziprok konnte bewiesen werden, dass eine signifikante Gewichtsreduktion mit einer geringeren Wahrscheinlichkeit an Vorhofflimmern zu erkranken einhergeht (7). Die eindrucksvollsten Daten diesbezüglich stammen aus der australischen LEGACY-Studie, in welcher bei Patienten mit paroxysmalem Vorhofflimmern und BMI >27kg/m2 durch eine Reduktion des Körpergewichts um >10% vom Ausgangswert über einen Zeitraum von 5 Jahren gezeigt werden konnte, dass 6x weniger Patienten an Rezidiven von Vorhofflimmern litten als in der Kontrollgruppe (Gewichtsreduktion <3%) (8). Ferner führt Übergewicht zu einer gesteigerten Vorhofflimmerlast, einem erhöhten Risiko für Vorhofflimmer-bedingten Hospitalisationen und Komplikationen sowie einem schlechteren Erfolg der medikamentösen oder interventionellen Rhythmisierung (9-11). Als Ursache hierfür wird ein multifaktorieller pathophysiologischer Zusammenhang zwischen Übergewicht und Vorhofflimmern postuliert. Übergewicht führt zu einer veränderten Hämodynamik, welche in erhöht-gemessenen linksatrialen Drucken in morphologisch dilatierten Vorhöfen mit konsekutiv verzögerter und heterogener Reizleitung resultiert. Zudem führen die vermehrten epi-und perikardialen Fetteinlagerungen zu komplexen neurohormonellen, entzündlichen und metabolischen Prozessen, einem bevorzugten Milieu für das Auftreten von Vorhofflimmern (11-13). Basierend auf dieser Evidenz sollten übergewichtige Patienten wiederholt motiviert werden, eine Gewichtsreduktion von mindestens 5% (sofern realisierbar besser 10%) durch Einhalten einer proteinreichen Diät mit einem tiefen glykämischen Index (z.B. mediterrane Diät) sowie regelmässige körperliche Aktivität anzustreben. Da Gewichtsfluktuationen >5% den entstandenen Vorteil zunichtemachen, ist das so erlangte reduzierte Körpergewicht konstant zu halten (8, 14). Um diese Gewichtskonstanz zu erleichtern, empfiehlt sich ein striktes Dokumentieren der zugeführten Kalorien mit regelmässigen Supervisionen.
Alkoholkonsum
Es besteht ein gut belegter Zusammenhang zwischen Alkoholkonsum und erhöhtem Risiko für das Auftreten von Vorhofflimmern. Die pathophysiologischen Ursachen hierfür sind gleichsam multifaktoriell wie komplex und können zum einen durch direkt toxische Effekte, zum anderen durch indirekte Faktoren (OSAS, arterielle Hypertonie und Übergewicht) erklärt werden. An direkt toxischen Alkoholeffekten werden vor allem elektrophysiologische (Reizleitungsverzögerung mit daraus resultierendem Substrat für Reentry-Kreisläufe sowie eine Verkürzung der Refraktärperiode) und strukturelle (atriales Remodelling und Fibrosierung sowie die Möglichkeit einer äthyltoxischen dilatativen Kardiomyopathie) kardiale Alterationen angenommen (15-17). So erhöht sowohl unregelmässig exzessiver Alkoholkonsum (= binge-drinking, definiert als >4 Standardgetränke bei Frauen und >5 Standardgetränke bei Männern bei einem Anlass) – im Sinne eines resultierenden «Holiday Heart» Syndroms, als auch regelmässiger Alkoholkonsum das Risiko für Vorhofflimmern (15). Die Frage hinsichtlich des Bestehens eines Alkoholschwellenwertes und für ebenjenen Fall dessen Höhe, ist bis dato nicht eindeutig geklärt. So lässt der derzeitige Wissensstand den Schluss zu, dass prinzipiell jeglicher Alkoholkonsum in ein erhöhtes Vorhofflimmerrisiko mündet, und dieses Risiko ab einem täglichen Konsum von >2 Standardgetränken (24g Alkohol) bei Frauen und >3 Standardgetränken (36g Alkohol) bei Männern stark zunimmt weshalb hiervon definitiv abgeraten werden muss (16, 18-20). In Ergänzung hierzu konnte kürzlich gezeigt werden, dass eine absolute Alkoholkarenz bei Patienten mit vorbestehend moderatem Alkoholkonsum (17 +/- 8 Standardgetränke/Woche) und paroxysmalem Vorhofflimmern in einem signifikant längeren vorhofflimmerfreien Intervall resultiert (21). Unabhängig davon stellt übermässiger Alkoholkonsum zudem ein Risiko für Blutungskomplikationen, schlechte Therapieadhärenz, Lebererkrankungen, Traumata und Tumoren dar (22).
Körperliche Aktivität
Der Benefit moderater regelmässiger körperlicher Aktivität für die kardiovaskuläre Gesundheit ist hinlänglich belegt. So wurde bei körperlich aktiven Probanden eine tiefere Vorhofflimmerprävalenz gefunden, als in der dazugehörigen Kontrollpopulation (23). Der Effekt körperlicher Aktivität geht über die alleinige Prävention von Übergewicht hinaus und basiert unter anderem auf einer verbesserten Insulinsensitivität, einem optimierten autonomen Nervensystem sowie einer Reduktion endogener Entzündungsprozesse (24-25). Allein die Frage durch welche Häufigkeit, Intensität und Dauer körperlicher Aktivität dieser protektive Effekt erzielt werden kann, ist bis anhin nicht abschliessend beantwortet, da gegenwärtig von einer U-förmigen Dosis-Wirkungs-Beziehung mit nachteiligem Effekt oberhalb eines bestimmten Schwellenwertes ausgegangen wird (26-27). Im Vergleich zu einem rein sedentären Lifestyle führt bereits moderates Jogging im Ausmass von 5-10 Minuten pro Tag zu einer signifikanten Reduktion der kardiovaskulären Mortalität, sodass Patienten im Allgemeinen empfohlen werden sollte, 3-4x pro Woche in leichter bis moderater Intensität (Walking, Radfahren) im Ausmass von je 30 Minuten bis zu einer Obergrenze von 2.000 MET-Minuten (entspricht in etwa 4h Joggen oder 8h flottes Gehen) pro Woche Sport zu treiben (28-29).
Patienten, denen es dadurch gelungen ist, ihr Fitnesslevel um ≥2 metabolische Äquivalente (METs) zu steigern, konnten nicht nur ihre Vorhofflimmerlast und Vorhofflimmersymptome, sondern auch die Notwendigkeit Vorhofflimmer-bedingter Hospitalisationen und Elektrokardioversionen signifikant reduzieren (25, 30).
Obstruktives Schlaf-Apnoe Syndrom (OSAS)
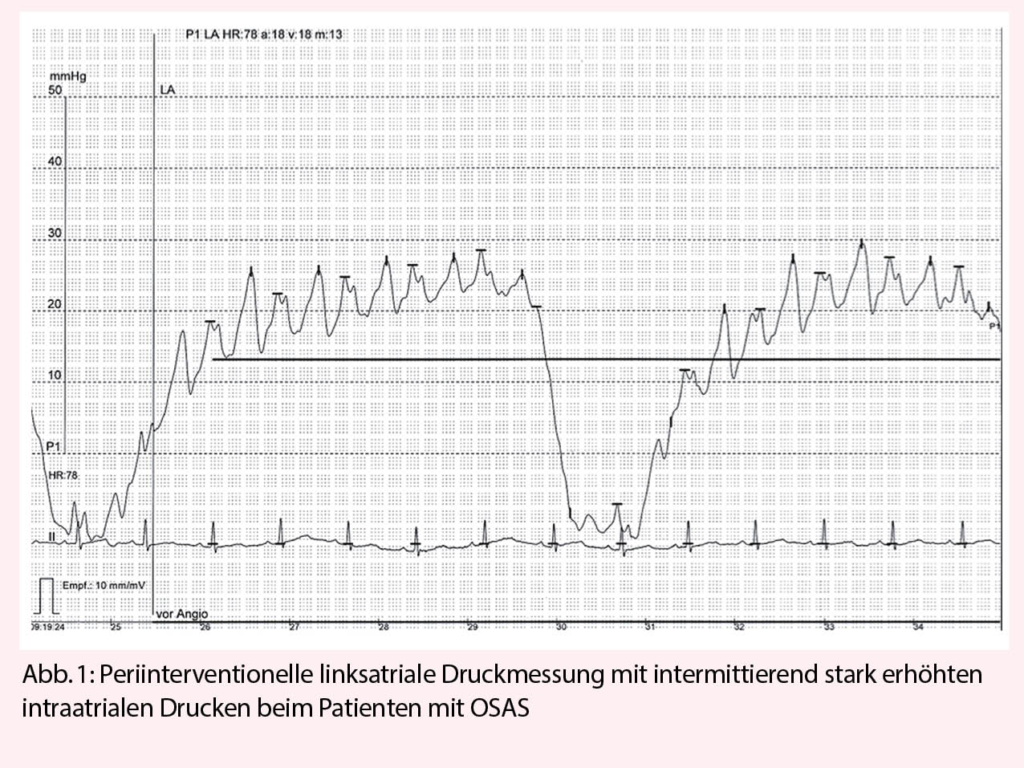
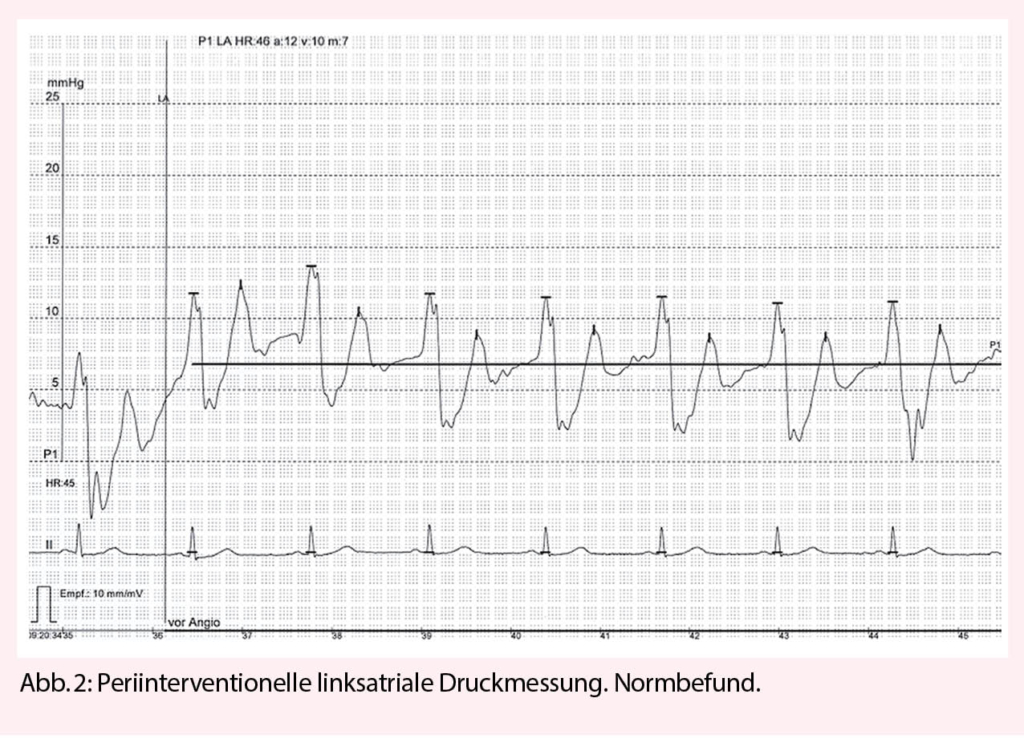
Es besteht ein gut belegter, BMI-unabhängiger Zusammenhang zwischen OSAS und einem ungünstigen Vorhofflimmerverlauf. So konnte nicht nur gezeigt werden, dass Patienten, welche unter einem unentdeckten/unbehandelten OSAS leiden, signifikant häufiger an Vorhofflimmern erkranken, sondern auch, dass sich OSAS negativ auf unterschiedliche Rhythmus-kontrollierende Therapieansätze (medikamentös, Ablation, als auch Elektrokardioversion) auswirkt. Dieses Risiko nimmt zudem mit dem OSAS-Schweregrad zu (31-32). Gegenwärtig wird ein multifaktorieller pathophysiologischer Hintergrund postuliert. Neben den krankheitsspezifisch wiederkehrenden Apnoephasen, welche über intermittierend stark erhöhte intrathorakale Drucke letztendlich zu einer atrialen Dilatation führen, werden hierfür zudem Hypoxämie-bedingt schädliche Effekte auf die atriale Refraktärperiode, als auch entzündlich bedingte Fibrosierungs- sowie elektrische Remodellingprozesse verantwortlich gemacht (33-34).
Die nachteiligen OSAS-Effekte können durch eine adäquate Krankheitstherapie (CPAP) abhängig von den Studienangaben jedoch deutlich reduziert, bis vollkommen aufgehoben werden. Daher sollten Vorhofflimmer-Patienten routinemässig auf ein Vorliegen von OSAS gescreent werden (z.B.: STOP-BANG Sleep Apnea Questionnaire) und im Falle ebenjenes Vorliegens sollte eine CPAP-Therapie etabliert und deren Compliance regelmässig kontrolliert werden (35-37).
Koffeinkonsum
In der Vergangenheit konnte gezeigt werden, dass eine akute, exzessive Koffeinexposition durch Konsum von Energydrinks zu einem erhöhten Auftreten von Vorhofflimmern bei Jugendlichen führt, sodass man konsekutiv von einer proarrhythmogenen Eigenschaft koffeinhaltiger Getränke ausging (38-39). Diese Annahme liess sich in diversen Metaanalysen nicht bestätigen (40-42). Gegenteilig zeigten jene Analysen einen protektiven Effekt von einem regelmässigen und moderaten Koffeinkonsum, dessen exakter pathophysiologischer Mechanismus trotz diverser Hypothesen bis anhin nicht definitiv geklärt ist (41, 43-44). Inwiefern diese Erkenntnisse auf den Konsum von Energydrinks im Allgemeinen umgelegt werden können, ist aufgrund der teils schwer nachvollziehbaren Angaben zu Inhaltsstoffen und exakten Koffeinmengen gegenwärtig nicht eindeutig zu beantworten. Abschliessend lässt sich somit anhand des aktuellen Wissenstands keine generelle Empfehlung zu regelmässigem moderaten Koffeinkonsum aussprechen. Da Energydrinks teils sehr hohe Koffeinmengen aufweisen und häufig mit Alkohol kombiniert werden sind mehrere Fallberichte von Vorhofflimmern nach Einnahme dieser Substanzen publiziert (45). Interessanterweise gibt es trotz milliardenfacher Verkäufe dieser Getränke praktisch keine randomisierten prospektiven Studien zu diesen Themen (46).
Rauchen
Die Kausalität zwischen Rauchen und einer erhöhten Vorhofflimmerprävalenz ist weniger gut untersucht, als jene der zuvor genannten Risikofaktoren. Nichtsdestotrotz konnten einige Studien ein erhöhtes Risiko für Vorhofflimmern unter Rauchern belegen, welches durch den Rauchstopp zu einem gewissen Grad reversibel war (47-52). Zudem konnten bei Rauchern mit Vorhofflimmern vermehrt thrombo-embolische Ereignisse sowie eine erhöhte Sterblichkeit aufgezeigt werden (53). Gegenwärtig wird von einer multifaktoriell-bedingten pathophysiologischen Grundlage (gesteigerter Sympathikotonus, erhöhte Wahrscheinlichkeit für entzündliche Prozesse, endotheliale Dysfunktion, atriale Fibrosierung sowie vermehrt oxidativer Stress) ausgegangen (54). Analog zur koronaren Herzkrankheit sollte bei allen Vorhofflimmerpatienten systematisch der Raucherstatus erhoben und von Rauchkonsum jeglicher Art strikt abgeraten werden.
Dr. med. univ. Sebastian Seidl
Dr. Dr. med. Roman Brenner
Dr. med. David Altmann
Prof. Dr. med. Peter Ammann
Copyright bei Aerzteverlag medinfo AG
Kantonsspital St. Gallen
Rorschacherstrasse 95
9007 St. Gallen
sebastian.seidl@kssg.ch
Die Autoren haben im Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
◆ Das systematische Erfassen und die Einstellung modifizierbarer kardiovaskulärer Risikofaktoren stellen einen wesentlichen Bestandteil in der Betreuung von Vorhofflimmerpatienten dar.
◆ Übergewichtige Vorhofflimmerpatienten sollten zur Körpergewichtsreduktion angeleitet werden, um die Vorhofflimmerlast und das Risiko vorhofflimmerbedingter Hospitalisationen, Komplikationen sowie eines schlechteren Therapieerfolgs zu minimieren.
◆ Regelmässige moderate körperliche Aktivität hilft das Auftreten von Vorhofflimmern zu reduzieren. Von exzessivem Ausdauersport wird abgeraten.
◆ Vorhofflimmerpatienten sollten regelmässig auf das Vorliegen einer obstruktiven Schlaf-Apnoe Erkrankung gescreent werden.
◆ Jeglicher Alkoholkonsum wirkt sich nachteilig auf das Auftreten von Vorhofflimmern aus und erhöht das Risiko für Blutungskomplikationen bei Patienten mit bestehender oraler Antikoagulation.
◆ Bei Vorhofflimmerpatienten sollte der Raucherstatus erhoben und von Rauchkonsum jeglicher Art abgeraten werden.
Messages à retenir
◆ L’ évaluation et la gestion systématiques des facteurs de risque cardiovasculaire modifiables sont une composante essentielle des soins aux patients souffrant de fibrillation auriculaire.
◆ Les patients en surpoids souffrant de fibrillation auriculaire doivent recevoir des instructions sur la réduction du poids corporel afin de minimiser le fardeau de la fibrillation auriculaire et le risque d’ hospitalisations, de complications et de mauvais résultats liés à la fibrillation auriculaire.
◆ Une activité physique modérée et régulière contribue à réduire l’ incidence de la fibrillation auriculaire. Il n’ est pas recommandé de faire des exercices d’ endurance excessifs.
◆ Les patients souffrant de fibrillation auriculaire doivent être régulièrement soumis à un dépistage de la maladie d’ apnée obstructive du sommeil.
◆ Toute consommation d’ alcool est préjudiciable à l’ apparition de la fibrillation auriculaire et augmente le risque de complications hémorragiques chez les patients ayant déjà une anticoagulation orale.
◆ Le statut de fumeur doit être obtenu chez les patients souffrant de fibrillation auriculaire et le tabagisme, quel qu’ il soit, doit être découragé.
1. Hindricks G. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2020 Aug 29.
2. January CT. 2019 AHA/ACC/HRS Focused Update of the 2014 AHA/ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society in Collaboration With the Society of Thoracic Surgeons. Circulation. 2019 Jul 9;140(2):e125-e151.
3. Andrade JG. The Canadian Cardiovascular Society Atrial Fibrillation Guidelines Program: A Look Back Over the Last 10 Years and a Look Forward. Can J Cardiol. 2020 Dec;36(12):1839-1842
4. Cruz J. Atrial Fibrillation Clinics in Canada: A Nationwide Project Report. Can J Cardiol. 2018 Sep;34(9):1219-1224
5. Berkovitch A. Body mass index and the risk of new-onset atrial fibrillation in middle-aged adults. Am Heart J 2016;173:41-48
6. Wang TJ. Obesity and the risk of new-onset atrial fibrillation. JAMA 2004;292:2471-2477
7. Tedrow UB. The long- and short-term impact of elevated body mass index on the risk of new atrial fibrillation the WHS (women´s health study). J Am Coll Cardiol 2010;55:2319-27.
8. Pathak RK. Long-term effect of goal-directed weight management in an atrial fibrillation cohort: a long-term follow-up study (legacy). J Am Coll Cardiol 2015;65:2159-69
9. Guglin M. Relation of obesity to recurrence rate and burden of atrial fibrillation. Am J Cardiol 2011;107:579-582
10. Deshmukh A. Impact of obesity on atrial fibrillation hospitalization. Int J Cardiol 2012;159:241-242
11. Wong CX. Pericardial fat is associated with atrial fibrillation severity and ablation outcome. J Am Coll Cardiol 2011;57:1745-51
12. Abed HS. Obesity results in progressive atrial structural and electrical remodeling: implications for atrial fibrillation. Heart Rhythm 2013;10:90-100
13. Stritzke J. The aging process of the heart: obesity is the main risk factor for left atrial enlargement during aging the MONICA/KORA (monitoring of trends and determinations in cardiovascular disease/cooperative research in the region of Augsburg) study. J Am Coll Cardiol 2009;54:1982-9
14. Gehi AK. Implications of the LEGACY trial on US Atrial Fibrillation Patients: an NCDR Research to Practice (R2P) project. Am J Cardiol 2017;119:579-584
15. Ettinger PO. Arrhythmias and the “Holiday Heart”: alcohol-associated cardiac rhythm disorders. Am Heart J 1978;95:555-562
16. Samokhvalov AV. Alcohol consumption as a risk factor for atrial fibrillation: a systematic review and meta-analysis. Eur J Cardiovasc Prev Rehabil 2010;17:706-712
17. Cha MJ. Alcohol consumption and risk of atrial fibrillation in asymptomatic healthy adults. Heart Rhythm 2020 Dec;17(12):2086-2092
18. Gallagher C. Alcohol and incident atrial fibrillation – A systematic review and meta-analysis. Int J Cardiol 2017;246:46-52
19. Kodama S. Alcohol consumption and risk of atrial fibrillation: a meta-analysis. JACC 2011;57:427-436
20. Larsson SC. Alcohol consumption and risk of atrial fibrillation. a prospective study and dose-response meta-analysis. JACC 2014;64:281-289
21. Chung MK. Lifestyle and Risk Factor Modification for Reduction of Atrial Fibrillation: A Scientific Statement From the American Heart Association. Circulation 2020;141:e750-72
22. Overvad TF. Alcohol intake and prognosis of atrial fibrillation. Heart 2013;99:1093-1099
23. Qureshi WT. Cardiorespiratory fitness and risk of incident atrial fibrillation: results from the Henry Ford Exercise Testing (FIT) project. Circulation 2015;131:1827-1834
24. Garnvik LE. Physical activity modifies the risk of atrial fibrillation in obese individuals: the HUNT3 study. Eur J Prev Cardiol 2018;25:1646-52
25. Pathak RK. Impact of cardiorespiratory fitness on arrhythmia recurrence in obese individuals with atrial fibrillation: the CARDIO-FIT study. JACC 2015;66:985-996
26. Khan H. Cardiorespiratory fitness and atrial fibrillation: a population-based follow-up study. Heart Rhythm 2015;12:1424-1430
27. Calvo N. Emerging risk factors and the dose-response relationship between physical activity and lone atrial fibrillation: a prospective case-control study. Europace 2016;18:57-63
28. Lee D-chul. Leisure-time running reduces all-cause and cardiovascular mortality risk. J Am Coll Cardiol 2014;64:472-81
29. Mishima RS. Self-reported Physical Activity and Atrial Fibrillation Risk: A Systematic Review and Meta-analysis. Heart Rhythm online 2020 Dec 19.
30. Malmo V. Aerobic interval training reduces the burden of atrial fibrillation in the short term. Circulation 2016;133:466-73
31. Gami AS. Obstructive sleep apnea, obesity, and the risk of incident atrial fibrillation. JACC 2007;49:565-571
32. Linz D. Associations of obstructive sleep apnea with atrial fibrillation and continuous positive airway pressure treatment. JAMA Cardiol 2018;3:532-40
33. Dimitri H. Atrial remodeling in obstructive sleep apnea: implications for atrial fibrillation. Heart rhythm 2012;9:321-7
34. Linz D. Negative tracheal pressure during obstructive respiratory events promote atrial fibrillation by vagal activation. Heart Rhythm 2011;8:1436-1443
35. Kanagala R. Obstructive sleep apnea and the recurrence of atrial fibrillation. Circulation 2003;107:2589-2594
info@herz+gefäss
- Vol. 11
- Ausgabe 3
- Mai 2021