- Ballonangioplastie der Lungenarterien
Chronisch Thromobembolische Pulmonale Hypertension (CTEPH) ist eine seltene, aber prognostisch bedeutsame Erkrankung, die durch eine ungenügende Auflösung von Thromboembolien in den Lungenarterien entsteht. Obwohl die pulmonale Endarteriektomie die kurative Therapie der Wahl darstellt, werden wenigstens die Hälfte aller CTEPH-Patienten nicht operiert oder leiden nach einer Operation weiterhin an Lungenhochdruck. Für diese Patienten steht ein neues interventionelles Therapieverfahren, die Ballonangioplastie der Lungenarterien (BPA), zur Verfügung. Registerdaten zeigen eine hämodynamische und symptomatische Verbesserung mit einer 30-Tages-Mortalität von unter 2%.
L’ hypertension pulmonaire thromboembolique chronique (CTEPH) est une maladie rare mais d’ importance pronostique causée par une résolution insuffisante de thromboembolies dans les artères pulmonaires. Bien que l’ endartériectomie pulmonaire soit le traitement curatif de choix, au moins la moitié des patients avec CTEPH ne subissent pas de chirurgie ou continuent de souffrir d’ hypertension pulmonaire après la chirurgie. Une nouvelle thérapie interventionnelle, l’ angioplastie par ballonnet des artères pulmonaires (BPA), est disponible pour ces patients. Les données du registre montrent une amélioration hémodynamique et symptomatique avec un taux de mortalité à 30 jours inférieur à 2 %.
Epidemiologie und Pathophysiologie
Die CTEPH ist eine relativ seltene, aber potentiell lebensbedrohliche Erkrankung der pulmonalen arteriellen Gefässe und ist Teil der Gruppe 4 der WHO Klassifikation für pulmonale Hypertension. CTEPH ist die Folge von Thromboembolien der Lungenarterien, die sich nicht auflösen und in fibröses Material umwandeln, was zu einer chronischen Obliteration der Pulmonalarterien führt. Dies führt schlussendlich auch zu einem Remodelling der Mikrozirkulation, was wiederum den pulmonalen Hypertonus verstärkt. Die Hypertension ist also bedingt durch die fibrotische Verlegung der Gefässe und durch eine beeinträchtigte Mikrozirkulation. Die Inzidenz nach akuter Lungenembolie ist schwierig zu erfassen und schwankt je nach Studie zwischen 0.1-9.1%, was nahelegt, dass der direkte Übergang von einer symptomatischen akuten Lungenembolie zu einer CTEPH selten passiert und nicht vorauszusagen ist (1).
Klinik und Diagnostik
Es gibt keine verlässlichen CTEPH spezifischen Symptome, die es erlauben, die Erkrankung von anderen Formen der pulmonalen Hypertension zu unterscheiden. Die Diagnostik gestaltet sich selbst an spezialisierten Zentren schwierig mit durchschnittlicher Dauer von 14 Monaten zwischen Symptombeginn und Diagnose. Nicht alle CTEPH-Patienten berichten in ihrer Vorgeschichte über eine LE. Die wichtigsten prädisponierenden Faktoren für eine CTEPH sind in absteigender Reihenfolge ventrikulo-atriale Shunts oder Schrittmachersonden, Zustand nach Splenektomie, grosse und rezidivierende venöse Thrombose- Ereignisse, Hypothyreose mit Hormonersatz, entzündliche Darmerkrankungen, und Karzinome (2).
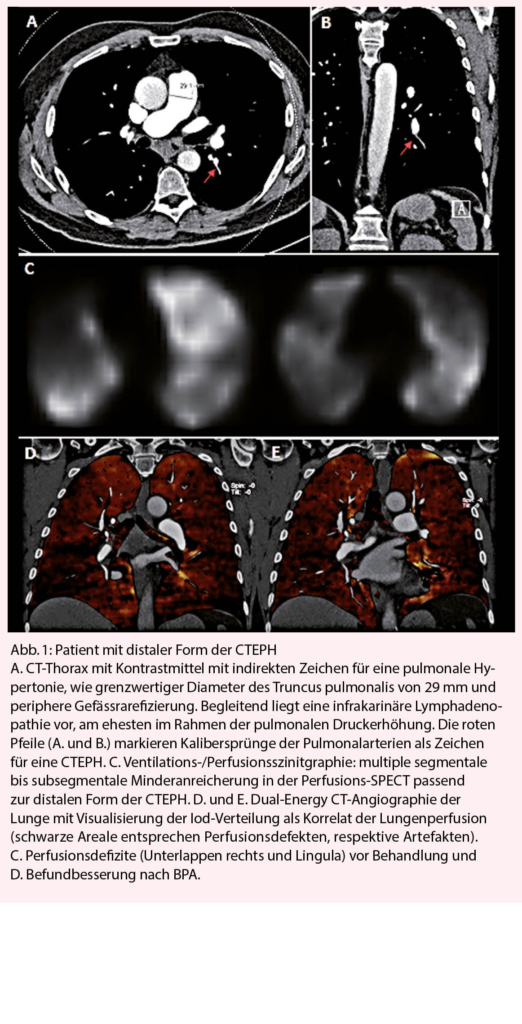
Die diagnostischen Kriterien umfassen eine invasiv bestätigte pulmonale Hypertension mit einem pulmonalen Mitteldruck (mPAP) von >20mmHg und einem Wedge Druck ≤15mmHg, segmentale Perfusionsdefizite bei erhaltener Ventilation im V/Q Szintigramm (Abbildung 1 C) sowie eine CT (Abbildung 1 A, B) oder invasive Angiographie mit den typischen vaskulären Läsionen einer CTEPH. Dazu gehören ringförmige Stenosen, Webs, hochgradige oder chronische Verschlüsse und Tortuositäten. Diese Veränderungen sind teilweise schwierig zu erkennen mittels CT oder der nicht selektiven Pulmonalisangiographie, weswegen diese Verfahren alleine nicht zum Auschluss einer CTEPH genügen. Vorteilhaft ist die Anwendung des Dual Energy CT (Abbildung 1 D), welche sowohl Anatomie als auch Perfusion darstellt und/oder die Anwendung der selektiven Angiographie einzelner Pulmonalarterien. Symptomatische Patienten nach akuter LE mit einem Perfusionsdefizit auf dem V/Q scan > 3 Monate nach LE sollten am PH-Zentrum abgeklärt werden. Das Screening für CTEPH bei asymptomatischen Risiko Patienten ist gemäss den neusten ESC-Richtlinien eine Klasse IIb, C Indikation (3).
Chirurgie und BPA
Die Therapie der Wahl bei der symptomatischen CTEPH ist die pulmonale Endarterektomie. Der Eingriff bedingt eine tiefe Hypothermie mit Kreislaufstillstand. Die Mortalität der chirurgischen BPA ist ca. 5% und an sehr erfahrenen Zentren weniger. Die Operabilität sollte von einem interdisziplinären Team beurteilt werden. Die Thromben sollten der Chirurgie zugänglich sein, d.h. im Hauptstamm, lobär und segmental, und es sollten keine prohibitiven Komorbiditäten vorhanden sein und keine sonstigen Limitationen, die das Risiko-Nutzen-Verhältnis relevant einschränkten (z.B. Gebrechlichkeit). Gemäss dem europäischen CTEPH Register waren von 679 untersuchten Patienten 36.5% als nicht operabel eingestuft und von den operablen Patienten wiederum wurden 14% nie operiert. Mit der Operation wird meistens eine Normalisierung des mPAP und Symptomfreiheit erreicht, der Therapieansatz ist also durchaus kurativ. In 17-31% kommt es allerdings zu einer nicht ausreichenden Drucksenkung wegen inkompletter Entfernung der Obstruktionen, Reperfusionsödem oder schwerer sekundärer Mikrovaskulopathie.
Zusammenfassend werden also fast 50% der CTEPH-Patienten keiner Operation unterzogen (4), und weitere 20% haben weiterhin einen Lungenhochdruck. Als Alternative für diese Patienten hat sich in der letzten Dekade die Ballonangioplastie der Lungenarterien etabliert, für welche die aktuellen PH Richtlinien eine Klasse IIb, C Indikation vorsehen, da die Technik aus Japan kommend in Europa erst gerade Fuss fasst. Welche Patienten am besten von einer BPA profitieren, bleibt derzeit unklar.
Entwicklung der BPA
Die erste BPA wurde 1988 in Leiden, Holland bei einem 30-Jährigen mit CTEPH erfolgreich durchgeführt mit einer mPAP Senkung von 46 auf 35 mmHg (5).
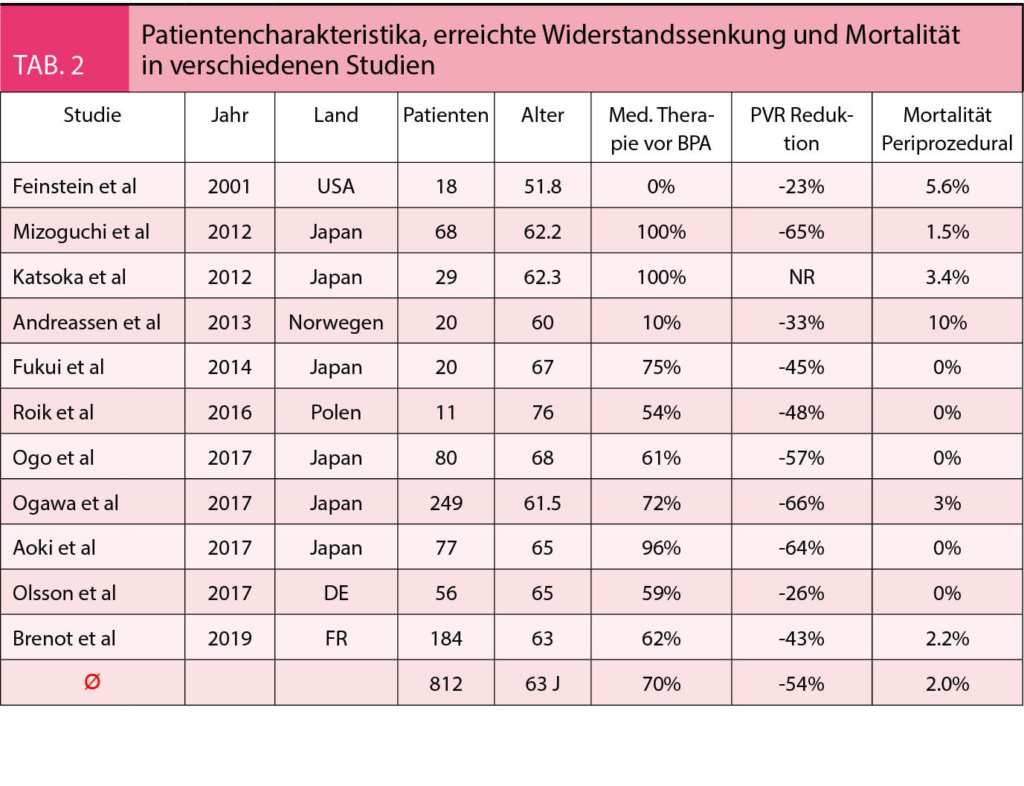
Eine erste 18 Patienten umfassende Serie wurde an der Harvard Medical School in Boston zwischen 1994 und 1999 behandelt (6). Hinsichtlich Effizienz war die BPA nach durchschnittlich nur 2.6 Interventionen in insgesamt 6 Segmenten erfolgreich (mPAP Senkung von 43 auf 34 mmHg), allerdings traten Reperfusionsödeme in 61% auf, was in 17% eine mechanische Ventilation bedingte und die Mortalität war mit 5.7% deutlich zu hoch. Die Sicherheitsbedenken verhinderten eine Entwicklung der Therapie längerfristig. Erst eine modifizierte Form der BPA entwickelt in Okayama, Japan hat der Methode neuen Aufwind gegeben und die aktuelle Entwicklung weltweit erst ermöglicht. Die japanischen Ärzte haben pro Sitzung weniger Segmente behandelt und die Ballondilatation äusserst vorsichtig durchgeführt (kleine Durchmesser, tiefe Inflationsdrucke), und keine Stents verwendet. Ein Vorgehen, dass sich wesentlich von der perkutanen Koronarintervention unterscheidet, bei welcher das Credo «the bigger the better» gilt und an welcher sich die Aerzte in Boston orientiert hatten (6). Eine erste Serie aus Okayama umfasste 68 Patienten, welche nach insgesamt 255 Sessionen (durchschnittlich 4 pro Patient) mit 2-3 Segmenten pro Sitzung untersucht wurden. Das mittlere Alter betrug 62 Jahre, und 78% waren Frauen. Der mPAP wurde von 45 auf 24mmHg (p < 0.019) reduziert und das Herzzeitvolumen von 2.2 auf 3.2 l/min (p = 0.02) gesteigert. Perforationen kamen in 2% vor, eine mechanische Beatmung war in 5.9% der Patienten notwendig und eine ECMO bei 2.9%. Die Sterblichkeit betrug nur 1.5%, womit wesentliche Fortschritte sowohl in der Effizienz als auch der Sicherheit demonstriert wurden. Zurzeit findet BPA weltweit an verschiedenen ausgewählten Zentren Anwendung und es gibt > 10 Register mit Daten von > 600 Patienten. Eine Übersicht über die Patientencharakteristika und die erreichte Widerstandssenkung sowie die Mortalität sind in Tabelle 2 aufgeführt. Zusammengefasst lässt sich eine Widerstandssenkung um 50% erreichen, bei einer periprozeduralen Mortalität von durchschnittlich 1.8%.
Durchführung
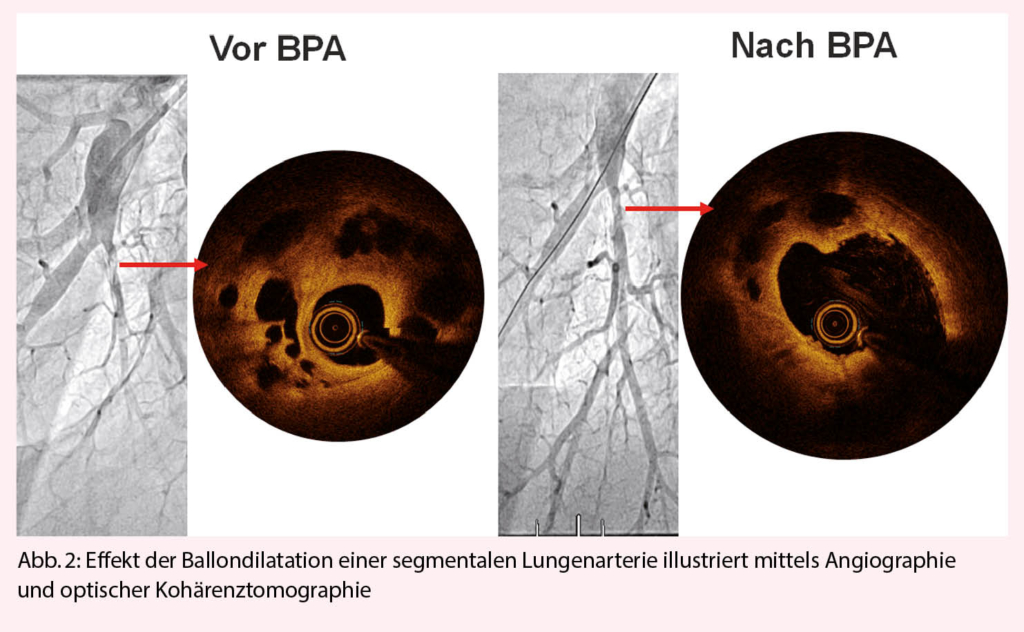
Das prinzipielle Setup der Ballonangioplastie-Eingriffe ist vergleichbar mit der perkutanen Koronarbehandlung. Die Anatomie ist allerdings wesentlich komplexer, da anstelle von 3 Gefässen 20 Segmentarterien zu intubieren sind und je nach Befund behandelt werden müssen. Der Zugang ist femoral venös unter Lokalanästhesie. Der Biox sollte während der Intervention > 95% sein, O2-Gabe ist also erforderlich. Die Therapie wird unter fortgeführter Antikoagulation durchgeführt (INR Ziel 2-2.5) und die periprozedurale Antikoagulation erfolgt mit niedrigen Heparindosen (2000 IE pro Stunde). Für die Durchführung der BPA verwendet man einen koronaren 6F Führungskatheter, gestützt durch einen kürzeren 8F Katheter, den man im Pulmonalishauptstamm positioniert (mother-in-child Technik). Für die Sondierung der Stenosen oder Verschlüsse werden Koronardrähte verwendet (0.6 g bis 12 g). Die Kontrastmittelapplikation erfolgt über Handinjektion. Die BPA sollte in den Lungensegmenten mit der schlechtesten Perfusion gemäss Szintigraphie beginnen. Ein gutes primäres Ziel stellt der rechte Unterlappen dar, wegen seiner Grösse und dem relativ grossen Blutfluss. Nach distaler Positionierung des Koronardrahts erfolgt die Ballondilatation mit konventionellen Koronarballonen. Deren Effekt ist in Abbildung 2 illustriert. Bei Patienten mit einem pulmonalen Mitteldruck > 40 mmHg sollten die Ballondiameter vorsichtig gewählt werden (2.0 mm) und die Inflationsdrucke sollten 6-8 bar nicht übersteigen, um das Risiko eines Gefässschadens mit konsekutivem Reperfusionsödem zu verringern. In Folgesitzungen oder bei einem Mitteldruck unter 40 mmHg erfolgt die Ballon Diameterwahl grosszügiger, mit dem Ziel, die Rest-Stenose < 50% zu halten (typischerweise Diameter zwischen 4-7 mm) und einen guten venösen Rückfluss zu ermöglichen. Ungleich der Koronarintervention werden praktisch nie Stents verwendet, da diese einerseits zu viele Komplikationen verursachen (6) und in der Regel gar nicht benötigt werden, da Recoil und Thrombose eine untergeordnete Bedeutung haben. Die wesentlichen Schritte der Intervention werden meist in tiefer Inspiration durchgeführt, weswegen die Patienten fähig sein sollten, Atemmanöver verlässlich auszuführen. Auch die Anzahl der behandelten Segmente pro Sitzung hängt vom mPAP ab. Während bei einem mPAP > 40 nicht mehr als 2-3 Läsionen angegangen werden sollten, sind bei tieferen Läsionen einzig das Kontrastmittel, die Bestrahlungszeit und die Ermüdung des Patienten die limitierenden Faktoren.
Komplikationen
Während der BPA können in ca. 1-2% Lungenblutung auftreten bedingt durch Drahtperforation der distalen Äste oder Perforation bei zu grossen Ballonen. Bereits sehr kleine Blutungen, die angiographisch nicht zwingend erkennbar sind, führen zu Husten (mit oder ohne Hämoptoe), womit dieser ein wichtiges Kriterium darstellt, die Intervention zu pausieren. Im Nachgang der Intervention (24-72h) ist das Reperfusionsödem (RPO) die gefürchtetste Komplikation, die durch vaskuläre Schäden (Kontrastapplikation, Führungsdraht) und Cytokinbedingte Inflammation entsteht. In den rezentesten Registern ist die Auftretenswahrscheinlichkeit ca. 5%. Das Risiko für RPO ist bei einem mPAP >40mmHg erhöht. Das RPI kann zu einem ARDS mit Notwendigkeit einer mechanischen Ventilation oder ECMO führen.
Nachsorge
Die Patienten sollten wegen den akuten Komplikationsgefahren wie Blutung oder Reperfusionsödem während mindestens 12h auf einer IMC kardiopulmonal überwacht, bei Risikopatienten während 24-48h. Ein konventionelles Lungenröntgen zwecks Ausschluss von Reperfusionsödem wird routinemässig durchgeführt. Die Entlassung kann bei gutem Verlauf am Folgetag erfolgen. Die Behandlungsintervalle richten sich nach der Nierenfunktion und der applizierten Strahlendosis. Die medikamentöse Therapie beinhaltet eine konventionelle OAK (Klasse I Indikation (3) und meist den guanylate Cyclase Stimulator Riociguat, dem einzigen zugelassenen Medikament für die Behandlung der inoperablen oder persistenten/rezidivierenden CTEPH.
Berner Erfahrung
Seit 2018 wurden am Inselspital 9 Patienten in 41 Sitzungen behandelt ohne relevante Komplikationen (keine Perforation, mechanische Ventilation oder Todesfall). Zwei der Patienten haben ihre Behandlung nach Erreichung eines mPAP < 25 mmHg bereits abgeschlossen. Eine detaillierte Auswertung wird später publiziert werden.
Ausblick
Derzeit bestehen kaum randomisierte Daten, welche die konservative medikamentöse Therapie mit der BPA (mit oder ohne medikamentöse Therapie) vergleichen. Kürzlich wurde die allererste Studie (NCT02634203) vorgestellt, welche die BPA mit medikamentöser Therapie verglichen hat bei inoperablen Patienten. Der Effekt der BPA auf den Lungengefässwiderstand nach 26 Wochen Therapie war signifikant grösser als der durch Riociguat in Höchstdosis (7). Ob die medikamentöse Therapie mit Riociguat nach erfolgreicher BPA sistiert werden kann, bleibt derzeit noch unklar.
Copyright bei Aerzteverlag medinfo AG
Leiter Herzkatheterlabor
Universitätsklinik für Kardiologie
Inselspital
Freiburgstrasse 18
3010 Bern
lorenz.raeber@insel.ch
Universitätsklinik für Kardiologie und Interdisziplinäres Zentrum
für pulmonale Hypertonie, Universität Bern, Inselspital,
Freiburgstrasse 18
3010 Bern
Department Innere Medizin II, Abteilung für Kardiologie, Medizinische
Universität Wien
Währinger Gürtel 18-20
A-1090 Wien, Oesterreich
LR und JPH melden keinerlei Interessenkonflikte in Bezug auf dieses Manuskript. IL erhielt Forschungsgelder von AOPOrphan und Actelion sowie Sprecherhonorare von AOPOrphan, Actelion, Medtronic, Ferrer und Astra Zeneca.
- Die CTEPH ist eine relativ seltene aber prognostisch bedeutsame Langzeitkomplikation der akuten Lungenembolie, die schwierig zu diagnostizieren ist.
- Die Goldstandarddiagnostik umfasst Lungen-Perfusions-Szintigraphie, CT Angio und Rechtsherzkatheter mit Angiographie.
- Die BPA stellt in erfahrener Hand eine sichere Option für CTEPH-
Patienten dar, die durch ein interdisziplinäres PH-Zentrum als inoperabel eingestuft werden. - Die BPA erlaubt eine PVR Reduktion von 60% des Ausgangswerts.
- Es werden 5-8 Behandlungssitzungen benötigt, um diese Resultate zu erreichen.
Messages à retenir
- La CTEPH est une complication à long terme relativement rare mais d’ importance pronostique de l’ embolie pulmonaire aiguë qui est difficile à diagnostiquer.
- L’ étalon ore du diagnostic comprend la scintigraphie de perfusion pulmonaire, l’ angio par tomodensitométrie et le cathéter du cœur droit avec angiographie.
- La BPA est une option expérimentée et sûre pour les patients avec CTEPH qui sont classés comme inopérables par un centre interdisciplinaire d’ hypertension pulmonaire
- La BPA permet une réduction du PVR de 60 % par rapport au niveau de référence.
- 5 à 8 séances de traitement sont nécessaires pour atteindre ces résultats.
1. Coquoz N, et al. Multicentre observational screening survey for the detection of CTEPH following pulmonary embolism. Eur Respir J 2018;51:1702505.
2. Lang I, et al. Balloon pulmonary angioplasty in chronic thromboembolic pulmonary hypertension. Eur Respir Rev. 2017:26:165119.
3. Galiè N, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the
European Respiratory Society (ERS):. Eur Heart J. 2016;37:67-119.
4. Pepke-Zaba J, et al. Chronic thromboembolic pulmonary hypertension (CTEPH): results from an international propspective registry. Circulation 2011;124:1973-1981.
5. Voorburg JA, et al. Balloon angioplasty in the treatment of pulmonary hypertension caused by pulmonary embolism. Chest 1988;94:1249-1253.
6. Feinstein JA, et al. Balloon pulmonary angioplasty for treatment of chronic
thromboembolic pulmonary hypertension. Circulation 2001;103:10-13.
7. Jais X, et al. Late Breaking Clinical Trial Presentation at ERS Madrid, Madrid, Spain on Sept 30, 2019.
info@herz+gefäss
- Vol. 10
- Ausgabe 1
- Februar 2020