- Behandlung der chronischen Herzinsuffizienz
Die durch linksventrikuläre Dysfunktion bedingte chronische Herzinsuffizienz ist in nahezu einem Drittel der Fälle mit einer sekundären (funktionellen) Mitralinsuffizienz verbunden und betroffene Patienten weisen eine schlechtere Prognose auf. Neben der leitliniengerechten medikamentösen Therapie und der kardialen Resynchronisation haben sich in den letzten Jahren minimal-invasive Methoden wie die perkutane Edge-to-Edge Rekonstruktion etabliert. Dieser Beitrag soll Einsicht geben in den Stellenwert der perkutanen Edge-to-Edge Rekonstruktion bei Patienten mit chronischer Herzinsuffizienz.
L’ insuffisance cardiaque chronique relative à la dysfonction du ventricule gauche est associée à une insuffisance mitrale secondaire (ou fonctionelle) dans presque un tiers des cas. La combinaison de ces deux entités péjore le pronostic. En complément du traitement médicamenteux et de la resynchronisation cardiaque, des méthodes de traitement percutané, en particulier la reconstruction mitrale edge-to-edge se sont imposées. Cette contribution a pour but de donner une vue d’ ensemble du rôle de la reconstruction mitrale edge-to-edge dans le traitement de l’ insuffisance cardiaque.
Entstehung und Bedeutung der Mitralinsuffizienz
Bei der chronischen Herzinsuffizienz (HI) kann sich sekundär infolge morphologischer Veränderungen (Remodelling) des linken Ventrikels mit konsekutiver Verlagerung der Papillarmuskeln eine Mitralinsuffizienz (MI) entwickeln. Diese kann auf einer Koaptationsstörung durch Zug an den Mitralklappensegeln (Tethering) und/oder der Dilatation und Abflachung des Mitralklappenannulus beruhen. (1) . Die MI selbst führt zu einer Volumenüberladung und erhöhten Wandspannung, welche ein Fortschreiten der linksventrikulären Dilatation und Dysfunktion zur Folge haben kann, so dass hier ein Circulus vitiosus mit weiterer Zunahme der MI entsteht. Bei bis zu 30% der Patienten mit Herzinsuffizienz liegt eine begleitende mittelschwere bis schwere MI vor (2). Letztere zeigen häufig aggravierte HI-Symptome, müssen öfter aufgrund akuter kardialer Dekompensationen hospitalisiert werden und haben eine hohe Mortalität (47% während einem medianen Follow-Up von ca. 5 Jahren) (3).
Generell unterscheidet man zwischen sekundärer MI auf dem Boden einer ischämischen Kardiopathie als Folge einer koronaren Herzkrankheit (ca. 60% der Fälle), oder einer dilatativen Kardiopathie, welche idiopathisch, postmyokarditisch oder hypertensiv bedingt sein kann (4).
Optionen für die Behandlung der sekundären Mitralinsuffizienz
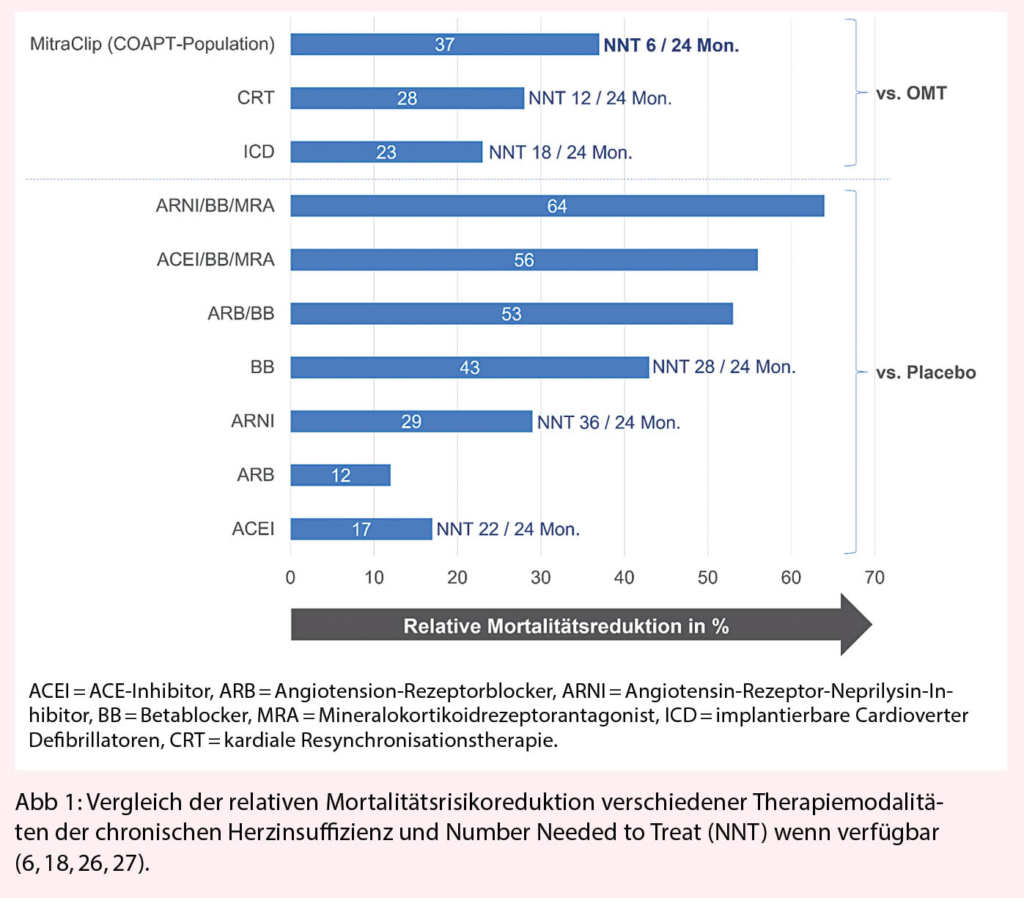
Die medikamentöse Behandlung stellt die Erstlinientherapie von herzinsuffizienten Patienten mit MI dar und richtet sich vorrangig nach den allgemeinen Therapieempfehlungen der chronischen Herzinsuffizienz. (5). Der Einsatz von Betablockern, ACE-Inhibitoren und Mineralokortikoidrezeptorantagonisten ist für Patienten mit eingeschränkter linksventrikulärer Funktion und NYHA-Funktionsklasse ≥ II empfohlen. Diuretika werden zusätzlich als symptomatische Therapie eingesetzt. In einer umfassenden Metaanalyse wurde der Effekt der medikamentösen Therapie gegenüber Placebo bei Herzinsuffizienz im Sinne einer Mortalitätsreduktion untersucht. (6). Am wirksamsten zeigte sich mit einer relativen Mortalitätsreduktion von 63% eine Kombinationstherapie mit einem Angiotensin-Rezeptor-Neprilysin-Inhibitor (Sacubitril/ Valsartan), einem Betablocker und einem Mineralokortikoidrezeptorantagonisten (Abb. 1).
Die Wirksamkeit medikamentöser Therapien spezifisch bei Patienten mit funktioneller MI wurde bisher nur in wenigen kleinen randomisierten Studien untersucht. Durch den Einsatz von Betablockern (Carvedilol und Metoprolol) konnte bei knapp der Hälfe der Patienten eine Verbesserung der MI gezeigt werden (7, 8). In der 2019 veröffentlichen randomisierten PRIME-Studie konnte bei rund 40% der Patienten in der Sacubitril/Valsartan-Gruppe (vs. 25% in der Valsartan-Gruppe) eine Verbesserung der MI gezeigt werden (9).
Eine kardiale Resynchronisationstherapie ist zusätzlich indiziert bei symptomatischen Patienten mit Herzinsuffizienz (LVEF ≤ 35%, NYHA-Funktionsklasse ≥ II) mit einem QRS-Komplex ≥ 150 Millisekunden. Diese vermindert Herzinsuffizienzsymptome, Rehospitalisationrate sowie Mortalität und kann ebenfalls über Verbesserung der globalen linksventrikulären Funktion, Umkehrung der Remodellingprozesse und Verbesserung der Papillarmuskelsynchronizität zu einer teilweisen Reduktion des Schweregrades der MI beitragen (10, 11). Sollte sich jedoch nach Installation der kardialen Resynchronisationstherapie eine persistierende relevante MI zeigen, ist dies als unabhängiger prognostischer Faktor mit einer schlechteren Prognose verbunden (12).
Gemäss den Europäischen Guidelines wird im Kontext der schweren sekundären MI die chirurgische Behandlung empfohlen, wenn bei begleitender koronarer Kardiopathie eine aortokoronare Bypass-Operation vorgesehen ist und die linksventrikuläre Funktion >30% beträgt. Allerdings fehlt es hier an Evidenz und ein Effekt der chirurgischen Korrektur der sekundären MI konnte nie schlüssig gezeigt werden. In vielen Fällen sind die Patienten aufgrund des Operationsrisikos, ihrer Komorbiditäten (insbesondere bei eingeschränkter LVEF) und ihrem Alter wenig für eine Operation geeignet (13). Ebenfalls besteht eine hohe Rezidivrate (>30-50%) innerhalb von 2-5 Jahren nach chirurgischer Anuloplastie aufgrund fortschreitender Dilatation des LV (14).
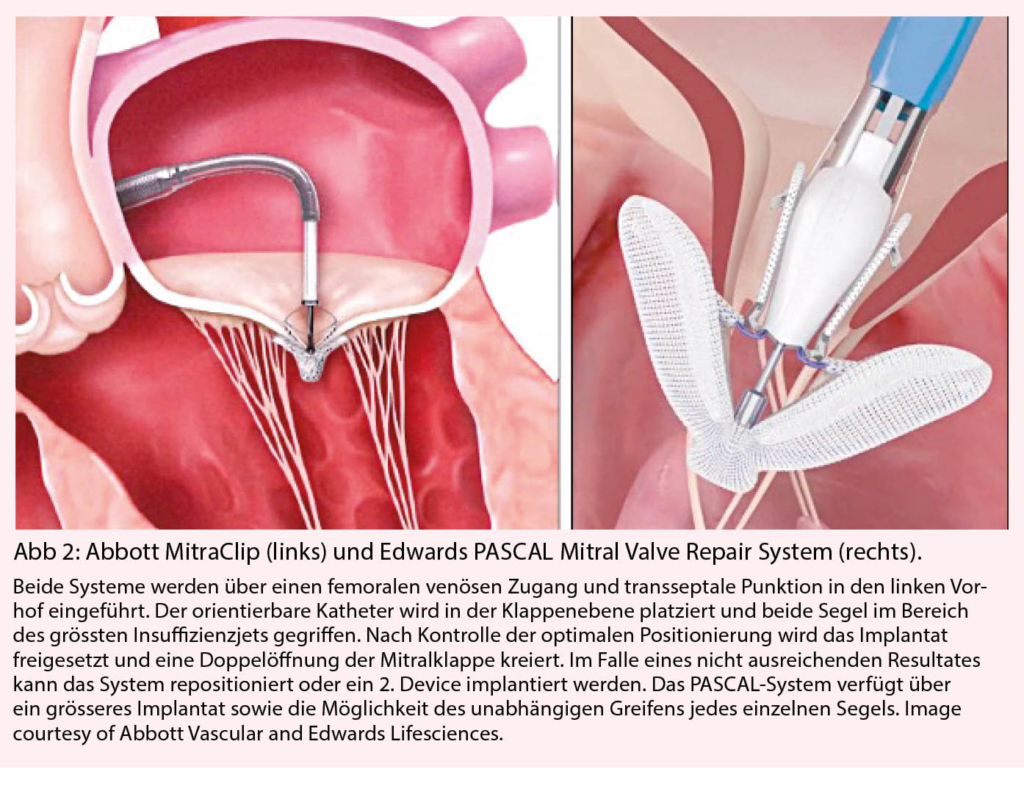
Unter den aktuell zur Verfügung stehenden katheterbasierten Verfahren hat sich vor allem die sogenannte Edge-to-Edge Rekonstruktion etabliert, welche auf eine verbesserte Koaptation der Segel abzielt. Für die Edge-to-Edge Rekonstruktion der Mitralklappe stehen aktuell das Abbott MitraClip-System und das Edwards PASCAL Mitral Valve Repair System zur Verfügung. (Abb. 2) Seit der ersten Implantation des MitraClip im Jahr 2003 wurden weltweit bereits mehr als 100 000 Eingriffe durchgeführt und auch für das PASCAL System konnten in ersten Studien gute Ergebnisse gezeigt werden (15, 16). Beide Systeme sind für die Behandlung der primären und sekundären MI in Europa zugelassen.
Edge-to-Edge Rekonstruktion: aktuelle Datenlage
Im vergangenen Jahr wurden zwei randomisierte Studien im New England Journal of Medicine veröffentlicht, welche den Nutzen der Edge-to-Edge Rekonstruktion mit dem MitraClip System bei Patienten mit schwerer MI und eingeschränkter linksventrikulärer Funktion untersucht haben.
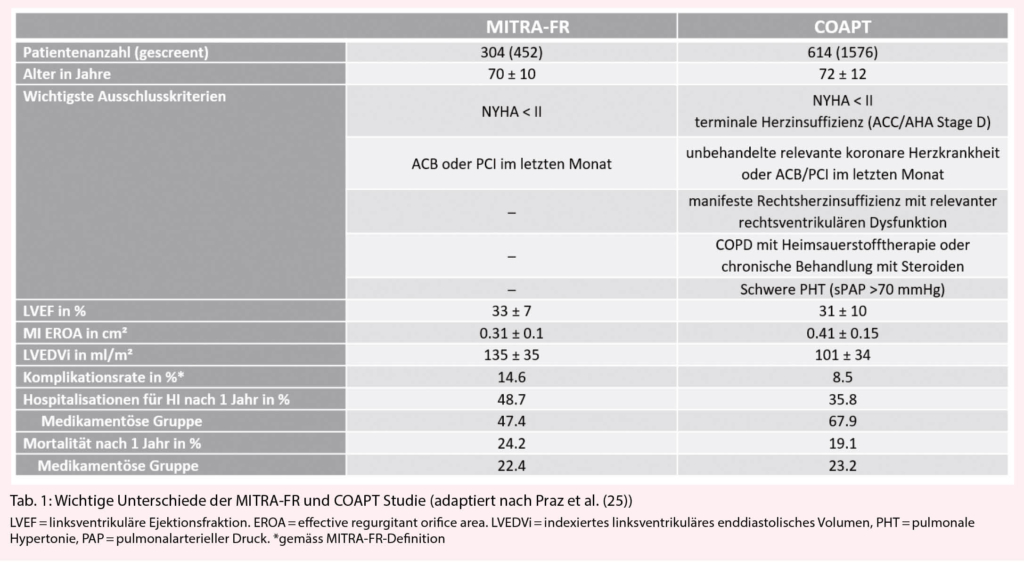
In der französischen MITRA-FR Studie wurden 304 Patienten mit HI (LVEF 15-40%) und schwerer MI (effektive Regurgitationsfläche EROA > 20 mm² oder Regurgitationsvolumen von > 30 ml/Schlag) randomisiert einer MitraClip Intervention plus medikamentöse Therapie (OMT) oder einer alleinigen OMT zugeordnet (17). Bei 59% der Patienten lag eine ischämische Genese der HI vor, in 27% war eine kardiale Resynchronisationstherapie vorhanden. Der prozedurale Erfolg (Reduktion des Schweregrades der MI auf Grad 2+ oder weniger, entsprechend den europäischen Richtlinien (1)) war 92%. Nach 2 Jahren Follow-Up konnte keine Auswirkung auf den primären Endpunkt, bestehend aus der Gesamtsterblichkeit und Re-Hospitalisationen für HI, gezeigt werden.
Die US-amerikanische COAPT Studie wurde kurze Zeit später publiziert und lieferte ein ganz anderes Bild (18). Es wurden 614 Patienten mit symptomatischer HI (LVEF 20-50%) und mittelschwerer bis schwerer MI (Grad 3+/4+ gemäss der Richtlinien der amerikanischen Gesellschaft für Echokardiographie (19)) eingeschlossen und ebenfalls zu MitraClip plus OMT oder alleiniger OMT randomisiert. Im Gegensatz zu MITRA-FR wurde die Eignung der Patienten für die Studienteilnahme durch ein echokardiographisches Core lab geprüft und die Umsetzung der OMT durch ein zentrales Komitee supervisiert. Eine ischämisch bedingte HI lag in 61% und eine installierte kardiale Resynchronisationstherapie in 36% der Fälle vor. Die erfolgreiche Reduktion des MI Schweregrades (auf Grad 2+ oder weniger) konnte in 98% der Fälle erzielt werden und hatte in 95% auch nach 2 Jahren im Follow-Up Bestand.
Die Intervention zeigte ein sehr gutes Sicherheitsprofil: bei 97% der Patienten kam es zu keinen interventionsbezogenen Komplikationen. Für die MitraClip-Gruppe konnte eine eindrückliche Reduktion des primären Endpunktes Rehospitalisationsrate für HI (47%-ige relative Risikoreduktion nach 2 Jahren sowie eine Number Needed to Treat von 3.1) sowie des sekundären kombinierten Endpunktes Rehospitalisationen und Mortalität (37%-ige relative Risikoreduktion nach 2 Jahren) festgestellt werden.
Wie können die unterschiedlichen Ergebnisse dieser auf den ersten Blick ähnlichen Studien erklärt werden?
Beide Studien weisen teils erhebliche Unterschiede in punkto Studiendesign, Ein- und Ausschlusskriterien und Beständigkeit des nach der Prozedur erreichten Resultates auf.
Folgende entscheidende Faktoren sind hier zu nennen:
1. Die Diskrepanz in der Definition des Schweregrades der MI je nach europäischen (in MITRA-FR) und amerikanischen Richtlinien (in COAPT).
In Europa wird die MI je nach Ätiologie unterschiedlich gradiert. Die sekundäre MI wird gemäss der prognostischen Bedeutung bereits ab einer nach der PISA-Methode errechneten effektiven Regurgitationsfläche (EROA) von ≥ 20mm² (Regurgitationsvolumen > 30 ml) als schwer betrachtet, während die Richtlinien der amerikanischen Gesellschaft für Echokardiographie weiterhin 40mm2 (Regurgitationsvolumen 60 ml) als Grenzwert beibehalten haben (20-23). Die amerikanischen echokardiographischen Richtlinien schlagen eine integrative semiquantitative Gradierung (von Grad 0+ bis Grad 4+) vor, welche therapeutische Massnahmen ab Grad 3+ (moderate to severe; EROA > 30mm2) vorsieht. Dieser grundlegende Unterschied führte zum Einschluss von Patienten mit deutlich schwererer MI in der COAPT-Studie.
2. Der Ausschluss von Patienten mit schwerer linksventrikulärer Dilatation (linksventrikulärer endsystolischer Diameter/LVESD > 70 mm) sowie terminaler Herzinsuffizienz (ACC/AHA Stage D) in der COAPT-Studie. Dies führte zum Einschluss von Patienten mit deutlich höheren linksventrikulären enddiastolischen Volumina in MITRA-FR (135 ± 35ml/m2) im Vergleich zu COAPT (101 ± 34ml/m2).
3. Die Supervision der implementierten OMT und eine Run-in Periode unter maximal verträglicher medikamentöser Therapie in der COAPT-Studie, wobei in der MITRA-FR-Studie die medikamentöse Behandlung während des Studienzeitraumes nicht monitorisiert wurde. Demzufolge wurde in MITRA-FR eine deutliche Abnahme der MI sowie eine Besserung des funktionellen Zustandes ebenfalls in der medikamentösen Gruppe beobachtet, welche am ehesten auf eine Intensivierung der medikamentösen Therapie während der Studienperiode zurückzuführen ist. Ein ähnlicher Effekt wurde in COAPT nicht beobachtet, was auf eine bereits ausgeschöpfte OMT bei Studieneintritt hinweist.
4. In der MITRA-Fr Studie häufigere peri-prozedurale Komplikationen (14.6% vs. 8.5% in COAPT) und schlechtere Beständigkeit des Resultates (MI Grad ≤2+ nach 1 Jahr 83% vs. 95% in COAPT).
5. Unvollständige echokardiographische und klinische Follow-Up Daten in der MITRA-FR Studie, was Aussagen bezüglich sekundärer Endpunkte einschränkt.
Die wichtigsten Merkmale der beiden Studien bezüglich Ein- und Ausschlusskriterien, Baseline-Charakteristika und Resultate werden in Tabelle 1 zusammengefasst und verglichen.
Bedeutung für den klinischen Alltag
Die COAPT-Studie ist die erste Studie, welche einen signifikanten Überlebensvorteil durch die perkutane Edge-to-Edge Rekonstruktion bei Patienten mit HI und sekundärer MI zeigen konnte, bei welchen andere Therapieoptionen ausgeschöpft sind. Mit einer Number Needed to Treat von 6 Patienten, um einen Todesfall über 24 Monaten zu vermeiden, stellt die Intervention eine im Vergleich zu etablierten Therapien äusserst effiziente Behandlungsoption dar (siehe Abb. 1). Ferner unterstreicht die Studie die unabhängige prognostische Relevanz der MI bei herzinsuffizienten Patienten, welche bisher vorwiegend als Begleiterscheinung im Rahmen der myokardialen Erkrankung betrachtet wurde. Zudem wird konsequent in beiden Studien die schlechte Prognose der Kontrollgruppe bestätigt. In COAPT wurden 68% der Patienten wegen HI rehospitalisiert (siehe Tab. 1) und nahezu die Hälfte der Patienten war nach 2 Jahren verstorben. Somit sollten Patienten mit symptomatischer HI und mittelschwerer bis schwerer MI frühzeitig einem multidisziplinären Heart Team zugewiesen werden, wobei hier die notwendige enge Zusammenarbeit von Bildgebungs-Spezialisten, Rhythmologen, invasiven Kardiologen und HI-Spezialisten zu betonen ist.
Konkret lassen sich aus der Synthese beider obenerwähnten Studien folgende Kriterien formulieren, nach welchen bei Patienten mit sekundärer MI aus prognostischen Gründen eine Edge-to-Edge Rekonstruktion der Mitralklappe indiziert ist: (24, 25)
- Symptomatische Herzinsuffizienz (NYHA ≥ II) trotz maximal tolerierter medikamentöser Therapie und, falls indiziert, erfolgter Revaskularisation und Resynchronisation;
- Schwere MI (integrativ beurteilt Grad 3 + oder 4 +, entsprechend unter anderem einem EROA ≥ 30 mm2 und/oder Regurgitationsvolumen > 45 ml) und geeignete Anatomie gemäss echokardiographischer Evaluation (üblicherweise transösophageale Echokardiographie);
- Fehlende fortgeschrittene linksventrikuläre Dilatation (LVESD < 70 mm);
Zudem sollten Patienten mit symptomatischer schwerer MI trotz OMT, welche diese Kriterien nicht erfüllen, auf individueller Basis ebenfalls für eine perkutane Mitralklappenrekonstruktion, im Sinne einer potenten und sicheren symptomatischen Therapie, evaluiert werden.
Während der präinterventionellen Abklärungen ist die dynamische Natur der MI zu beachten, insbesondere deren Abhängigkeit vom systemischen Blutdruck. So kann eine im Wachzustand schwere MI nach Sedation in der transösophagealen Echokardiographie mittelgradig erscheinen.
Die klinische Erfahrung zeigt, dass die Edge-to-Edge Rekonstruktion zur Stabilisation der Herzerkrankung dienen und somit die Notwendigkeit einer Unterstützung mit einem linksventrikulären Assist device verzögern kann. Somit können Patienten auf der Warteliste für eine Herztransplantation stabilisiert werden. In COAPT war die Anzahl Herztransplantationen oder Implantationen eines Unterstüzungssystems signifikant tiefer in der interventionellen Gruppe (4.4% versus 9.5%; p = 0.01) (18).
Von einem technischen Standpunkt ist die Effizienz der MI-Reduktion am Ende der Intervention von entscheidender Bedeutung. Subanalysen der COAPT-Studie zeigen, dass Patienten mit residueller MI Grad 3 + oder 4 + 30 Tage nach der Intervention eine höhere Mortalität im 2-Jahres Follow-Up aufweisen.
Zur Optimierung des prozeduralen Resultates stehen verschiedene Systeme zur Verfügung, welche gemäss der individuellen Patientenanatomie selektiert und kombiniert werden können. Zur Gewährleistung der Behandlungssicherheit und –qualität sollte der Eingriff von einem Team erfahrener Interventionalisten und Bildgebungsspezialisten durchgeführt werden. Bei Patienten, welche aufgrund anatomischer Parameter oder fortgeschrittener links- oder rechtsventrikulärer Dysfunktion für die perkutane Edge-to-Edge Rekonstruktion nicht infrage kommen, sind in enger Zusammenarbeit mit HI-Spezialisten alternative interventionelle Verfahren, sowie der frühzeitige Einsatz von Herzunterstützungssystemen oder eine Herztransplantation zu diskutieren.
Ausblick und offene Fragen
Um die Patientenselektion präziser und den geeigneten Interventionszeitpunkt im Erkrankungsverlauf genauer definieren zu können, braucht es zukünftige Studien und Metaanalysen, welche eine detaillierte Analyse von sekundären Endpunkten, eine längere Follow-Up Zeit sowie übergreifende Analysen von Patientenmerkmalen erlauben. Die aktuell laufenden europäischen Studien RESHAPE-HF2 (MitraClip versus OMT) und MATTERHORN (MitraClip versus Chirurgie in sekundärer MI) werden hier neue Erkenntnisse liefern können. Im Bereich der perkutanen Edge-to-Edge Rekonstruktion sind die Langzeitresultate sowie der Vergleich der inzwischen zur Wahl stehenden Systeme zu prüfen und mit anderen Therapieverfahren zu vergleichen. Neben der Edge-to-Edge Rekonstruktion stehen weitere katheterbasierte Therapieoptionen, zur Verfügung, deren Nutzen im Kontext der HI noch zu evaluieren ist.
Universitätsklinik für Kardiologie
Freiburgstrasse 18
3010 Bern
Universitätsklinik für Kardiologie
Freiburgstrasse 18
3010 Bern
fabien.praz@insel.ch
Inselspital, Universitätsspital Bern
Universitätsklinik für Kardiologie
Herz Gefäss Zentrum
Freiburgstrasse 20
3010 Bern
Universitätsklinik für Kardiologie
Freiburgstrasse 18
3010 Bern
Die Autoren haben keine Interessenskonflikte in Zusammenhang mit diesem Artikel.
- Die sekundäre Mitralinsuffizienz im Kontext einer Herzinsuffizienz mit eingeschränkter linksventrikulärer Funktion ist häufig und hat negative Auswirkungen auf die Prognose der betroffenen Patienten.
- Patienten mit anhaltender mittelschwerer bis schwerer Mitralinsuffizienz trotz maximal verträglicher medikamentöser Therapie sollten einem spezialisierten Heart Team zur Evaluation einer Intervention zugewiesen werden. Bei sorgfältig selektionierten Patienten wurde eine deutliche Mortalitätsreduktion im Vergleich zur medikamentösen Therapie nach perkutaner Mitralklappenrekonstruktion im Rahmen einer randomisierten Studie beobachtet.
- Die aktuell verfügbaren Daten erlauben eine verfeinerte Patienten-
selektion, doch weitere Untersuchungen sind notwendig um die am besten geeignete Population sowie den optimalen Behandlungszeitpunkt zu definieren.
Messages à retenir
- L’ insuffisance mitrale secondaire dans le contexte d’ une insuffisance cardiaque chronique due à une dysfonction du ventricule gauche est fréquente et a des effets négatifs sur le pronostic.
- Dans le cas d’ une insuffisance mitrale persistante malgré une thérapie médicamenteuse optimisée, la consultation d’ un Heart Team spécialisé est nécessaire. Au sein d’ une population selectionnée, un essai randomisé a montré une très nette diminution de la mortalité après reconstruction mitrale percutanée en comparaison à la thérapie médicamenteuse.
- Les données actuellement disponibles permettent d’ affiner la sélection des candidats à une reconstruction percutanée de la valve mitrale. Des recherches supplémentaires sont en revanche nécessaires pour définir la population la plus adaptée ainsi que le timing optimal du traitement.
1. Baumgartner, H., et al., 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J, 2017. 38(36): p. 2739-2791.
2. Varadarajan, P., et al., High prevalence of clinically silent severe mitral regurgitation in patients with heart failure: role for echocardiography. J Am Soc Echocardiogr, 2006. 19(12): p. 1458-61.
3. Goliasch, G., et al., Refining the prognostic impact of functional mitral regurgitation in chronic heart failure. Eur Heart J, 2018. 39(1): p. 39-46.
4. Asgar, A.W., M.J. Mack, and G.W. Stone, Secondary mitral regurgitation in heart failure: pathophysiology, prognosis, and therapeutic considerations. J Am Coll Cardiol, 2015. 65(12): p. 1231-1248.
5. Ponikowski, P., et al., 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J, 2016. 37(27): p. 2129-2200.
6. Burnett, H., et al., Thirty Years of Evidence on the Efficacy of Drug Treatments for Chronic Heart Failure With Reduced Ejection Fraction: A Network Meta-Analysis. Circ Heart Fail, 2017. 10(1).
7. Capomolla, S., et al., Beta-blockade therapy in chronic heart failure: diastolic function and mitral regurgitation improvement by carvedilol. Am Heart J, 2000. 139(4): p. 596-608.
8. Waagstein, F., et al., Increased exercise ejection fraction and reversed remodeling after long-term treatment with metoprolol in congestive heart failure: a randomized, stratified, double-blind, placebo-controlled trial in mild to moderate heart failure due to ischemic or idiopathic dilated cardiomyopathy. Eur J Heart Fail, 2003. 5(5): p. 679-91.
9. Kang, D.H., et al., Angiotensin Receptor Neprilysin Inhibitor for Functional Mitral Regurgitation. Circulation, 2019. 139(11): p. 1354-1365.
10. Cleland, J.G., et al., The effect of cardiac resynchronization on morbidity and mortality in heart failure. N Engl J Med, 2005. 352(15): p. 1539-49.
11. St John Sutton, M.G., et al., Effect of cardiac resynchronization therapy on left ventricular size and function in chronic heart failure. Circulation, 2003. 107(15): p. 1985-90.
12. Spartera, M., et al., Role of cardiac dyssynchrony and resynchronization therapy in functional mitral regurgitation. Eur Heart J Cardiovasc Imaging, 2016. 17(5): p. 471-80.
13. Mirabel, M., et al., What are the characteristics of patients with severe, symptomatic, mitral regurgitation who are denied surgery? Eur Heart J, 2007. 28(11): p. 1358-65.
14. Magne, J., et al., Ischemic mitral regurgitation: a complex multifaceted disease. Cardiology, 2009. 112(4): p. 244-59.
15. Praz, F., et al., Compassionate use of the PASCAL transcatheter mitral valve repair system for patients with severe mitral regurgitation: a multicentre, prospective, observational, first-in-man study. Lancet, 2017. 390(10096): p. 773-780.
16. Lim, D., Transcatheter Valve Repair for Patients with Mitral Regurgitation – 30-Day Results of the CLASP Study. JACC Int, 2019. in press.
17. Obadia, J.F., et al., Percutaneous Repair or Medical Treatment for Secondary Mitral Regurgitation. N Engl J Med, 2018. 379(24): p. 2297-2306.
18. Stone, G.W., et al., Transcatheter Mitral-Valve Repair in Patients with Heart Failure. N Engl J Med, 2018. 379(24): p. 2307-2318.
19. Zoghbi, W.A., et al., Recommendations for Noninvasive Evaluation of Native Valvular Regurgitation: A Report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Magnetic Resonance. J Am Soc Echocardiogr, 2017. 30(4): p. 303-371.
20. Lancellotti, P., et al., Prognostic importance of exercise-induced changes in mitral regurgitation in patients with chronic ischemic left ventricular dysfunction. Circulation, 2003. 108(14): p. 1713-7.
21. Grigioni, F., et al., Ischemic mitral regurgitation: long-term outcome and prognostic implications with quantitative Doppler assessment. Circulation, 2001. 103(13): p. 1759-64.
22. Rossi, A., et al., Independent prognostic value of functional mitral regurgitation in patients with heart failure. A quantitative analysis of 1256 patients with ischaemic and non-ischaemic dilated cardiomyopathy. Heart, 2011. 97(20): p. 1675-80.
23. Cioffi, G., et al., Functional mitral regurgitation predicts 1-year mortality in elderly patients with systolic chronic heart failure. Eur J Heart Fail, 2005. 7(7): p. 1112-7.
24. Pibarot, P., V. Delgado, and J.J. Bax, MITRA-FR vs. COAPT: lessons from two trials with diametrically opposed results. Eur Heart J Cardiovasc Imaging, 2019. 20(6): p. 620-624.
25. Praz, F., et al., Mitral regurgitation in heart failure: time for a rethink. Eur Heart J, 2019.
26. Bardy, G.H., et al., Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med, 2005. 352(3): p. 225-37.
27. Fonarow, G.C., et al., Potential impact of optimal implementation of evidence-based heart failure therapies on mortality. Am Heart J, 2011. 161(6): p. 1024-30 e3.
info@herz+gefäss
- Vol. 9
- Ausgabe 6
- November 2019