- Die VERTIS-CV-Studie
Die kardiovaskuläre Wirksamkeit und die Sicherheit des SGLT2-Hemmers Ertugliflozin (Steglujan®), der als fixe Kombination mit dem DPP4-Hemmer Sitagliptin verfügbar ist, wurden in der VERTIS-CV-Studie (eValuation of ERTugliflozin effIcacy and Safety CardioVascular outcomes) bei Patienten mit Diabetes mellitus Typ 2 (T2DM) und atherosklerotischen kardiovaskulären Erkrankungen untersucht. Ertugliflozin hat die Erwartungen in dieser grossen Studie nur zum Teil erfüllt: Zwar konnte seine kardiovaskuläre Sicherheit belegt werden. Das Ziel, auch eine Reduktion kardiovaskulärer Ereignisse unter Beweis zu stellen, wurde aber – mit Ausnahme der Senkung des Risikos für Herzinsuffizienz – verfehlt.
Studiendesign
In die prospektive, multizentrische, randomisierte, Endpunkt-gesteuerte Placebo-kontrollierte Studie wurden 8238 Patienten im Alter von mindestens 40 Jahren mit T2DM seit mehr als 13 Jahren und gesicherter stabiler atherosklerotischer kardiovaskulärer Erkrankung aufgenommen. Die Teilnehmer waren überwiegend adipöse und weisse Männer im Vergleich zu anderen Ergebnisstudien. Das HbA1c war mässig eingestellt (HbA1c-Wert 7,0 bis 10,5%, im Mittel 8,2%). Die HF-Population war mit 23,7% der Population doppelt so gross wie in anderen Studien.
Die Patienten erhielten randomisiert Ertugliflozin 5 mg/Tag, Ertugliflozin 15 mg/Tag oder Placebo zusätzlich zu ihrer bisherigen Standardtherapie über eine Dauer bis zu 6,1 Jahren.
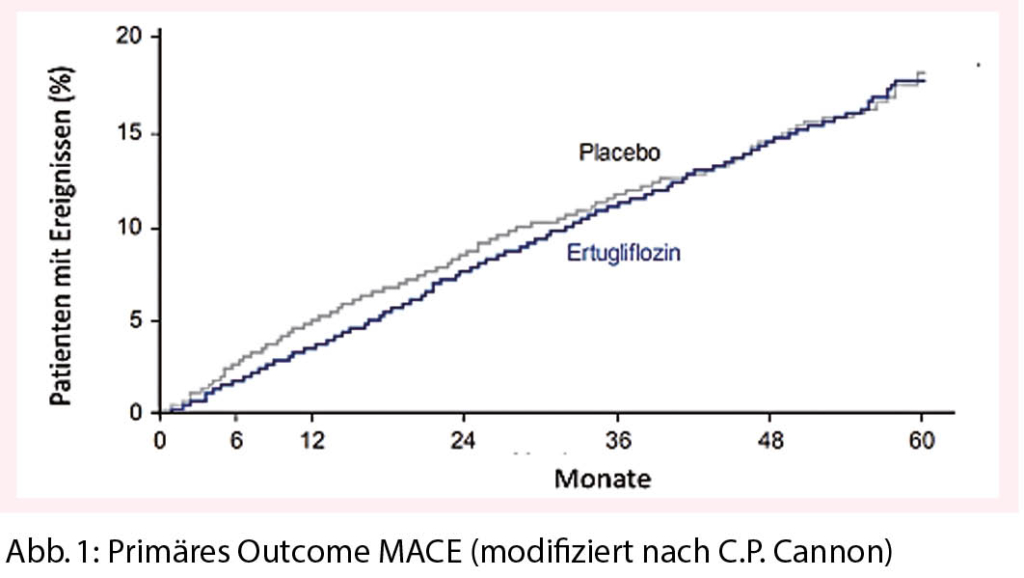
Primärer Endpunkt (Nicht-Inferiorität) war das kombinierte Outcome von MACE (Koronartod, nicht tödlicher Myokardinfarkt und nicht tödlicher Schlaganfall).
Sekundäre Endpunkte (Überlegenheit) waren das kombinierte Outcome von kardiovaskulärem Tod/Herzinsuffizienz, kardiovaskulärem Tod und das renale Komposit (renaler Tod, Dialyse/Transplantation und Verdoppelung des Serumkreatinins).
Andere präspezifizierte Endpunkte waren die individuellen Komponenten von MACE, Komposit von MACE-plus (MACE plus Hospitalisierung wegen instabiler Angina), tödlicher oder nicht tödlicher Myokardinfarkt, tödlicher oder nicht tödlicher Schlaganfall, Herzinsuffizienz und Gesamtmortalität.
Resultate
Der primäre Endpunkt (Non-Inferiorität) wurde erreicht, d.h. dass das Medikament in Bezug auf kardiovaskuläre Ereignisse sicher ist. Das primäre Outcome betrug 11,9% in der Ertugliflozin-Gruppe versus 11,9% in der Placebogruppe, die HR war 0,97 (95% KI 0,85-1,11); p < 0.001 für Non-Inferiorität (Abb. 1).
Die HR für kardiovaskulären Tod betrug: 1,8% vs. 1,9% (p = 0.39), für Myokardinfarkt 1,7% vs. 1,6% (p = 0.66) und für Schlaganfall 0,8% vs. 0,8% (p = 0.99). Das kombinierte renale Outcome (Nierentod, Dialyse/Transplantation, Verdoppelung des Serumkreatinins) betrug 3,2% vs. 3,9% (p = 0,08), die Verdoppelung des Serumkreatinins 3,1% vs. 3,8%.
Es gab einen nicht signifikanten Unterschied zwischen den beiden Ertugliflozin-Dosierungen 5 mg und 15 mg, inklusive nicht signifikanter Unterschiede in den Sicherheitsoutcomes.
Die am ADA veröffentlichten Details zeigen, dass es bei der Erzielung einer Überlegenheit nicht gelungen ist, die kardiovaskulären Todesfälle im Vergleich zu Placebo zu reduzieren; so betrug die HR für das Komposit aus kardiovaskulärem Tod und Herzinsuffizienz 0,88 (95,8% KI, 0,75-1,03; P = 0,11 für Überlegenheit). Die HR für kardiovaskuläre Ereignisse allein betrug 0,92 (95,8% KI, 0,77-1,11).
Herzinsuffizienz war ein präspezifizierter Endpunkt, obschon kein sekundärer Schlüsselendpunkt. Die HR für Herzinsuffizienz war 0,70 (95% KI, 0,54-0,90).
Die HR für das kombinierte renale Outcome (Komposit von renalem Tod, Dialyse/Transplantation oder Verdoppelung des Serumkreatinins) betrug 0,81 (95% KI, 0,63-1,04), was einen positiven Trend andeutet, die Überlegenheit wurde aber verpasst.
Sicherheit
Die unerwünschten Ereignisse waren sowohl in der Ertugliflozin 5 mg Gruppe als auch in der 15mg Gruppe ähnlich wie in der Placebogruppe. Ausgewählte unerwünschte Ereignisse waren Infektionen der Harnwege (12,2 in der 5mg Gruppe, 12,0 in der 15mg Gruppe vs. 10,2 in der Placebogruppe, genitale mykotische Infektionen (Mann) wurden in 4,4% bzw. 5,1% vs. 1,2% registriert, genitale mykotische Infektionen (Frau) 6,0% bzw. 7,8% vs. 2,4%. Symptomatische Hypoglykämien waren in den Behandlungsgruppen eher seltener als in der Placebogruppe (28,0%, bzw. 26,5% vs. 28,8%. Diabetische Ketoazidose wurde bei 0,3%, bzw. 0,4% vs. 0,1% beobachtet, Amputationen mussten in 2,0%, bzw. 2,1% vs. 1,6% erfolgen.
Fazit
- Die Ergebnisse dieser Studie deuten darauf hin, dass Ertugliflozin dem Placebo zur Reduktion von CV-Ereignissen bei Patienten mit T2DM und etablierter CVD nicht unterlegen ist.
- Ertugliflozin senkt das Risiko für Herzinsuffizienz.
- Tendenziell wurde eine positive Wirkung auf die Nierenfunktion festgestellt.
- Ertugliflozin erwies sich als sicher, es zeigte zudem keine Sicherheitssignale in Bezug auf Amputationen.
Quelle: «Results of the eValuation of ERTugliflozin EffIcacy and Safety CardioVascular outcomes Trial (VERTIS-CV)» vorgestellt am 16. Juni 2020 in der Sitzung im Rahmen des virtuellen Kongresses der American Diabetes Association (ADA) 2020 durch Christopher P. Cannon, Boston.
riesen@medinfo-verlag.ch