- Ein Segen für Patienten mit Herzinsuffizienz
Nachdem 30 Jahre lang die Blockierung des Renin-Angiotensin-Aldosteron Systems der Schlüssel zum Erfolg der Behandlung der Herzinsuffizienz mit reduzierter Ejektionsfraktion (HFrEF) war, wird neu die Blockierung des renalen Sodium-Glucose Transporters 2 (SGLT2) als vierte Therapiesäule, neben ACE-Hemmer/ARNI, Betablocker und Aldosteron-Antagonisten, für die Therapie von Patienten mit HFrEF unentbehrlich.
Après 30 ans au cours desquels le blocage du système rénine-angiotensine-aldostérone a été la clé du succès dans le traitement de l’insuffisance cardiaque à fraction d’éjection réduite (HFrEF), le blocage du transporteur rénal du glucose sodique 2 (SGLT2) comme quatrième pilier thérapeutique, en plus des inhibiteurs de l’ECA/ARNI, des bêtabloquants et des antagonistes de l’aldostérone, est devenu indispensable pour la thérapie des patients atteints de HFrEF.
Die Umnutzung bereits bekannter Wirkstoffe, das sogenannte «Drug Repurposing», hat in der Kardiologie Tradition. Die Acetylsalicylsäure, welche vor über 100 Jahren als Schmerzmittel entwickelt wurde und ihre grössten und nachhaltigsten Erfolge in der Kardiologie feierte, ist nur ein Beispiel hierfür. Aktuell erleben wir ein weiteres, sehr erfolgreiches Beispiel eines «Drug Repurposing» in der Kardiologie. Der Einsatz von SGLT2-Hemmern, oder auch Gliflozine genannt, zur Behandlung der Herzinsuffizienz mit reduzierter Ejektionsfraktion (HFrEF). Voraussetzung für eine erfolgreiche Umnutzung eines in einer anderen Indikation erprobten Wirkstoffs sind molekularbiologische und pathophysiologische Gemeinsamkeiten der zu behandelnden Erkrankungen. Bei Diabetes und Herzinsuffizienz sind solche Gemeinsamkeiten auf den ersten Blick nicht offensichtlich. Schaut man sich beide Erkrankungen aus einer metabolischen Perspektive an, gibt es aber doch einige interessante Parallelen.
Bidirektionale Assoziation zwischen Diabetes und Herzinsuffizienz
Epidemiologisch betrachtet haben Patienten mit Herzinsuffizienz eine 4-fach erhöhte Diabetes-Prävalenz (20%) verglichen mit Patienten ohne Herzinsuffizienz (4-6%) (1). Bei wegen Herzinsuffizienz hospitalisierten Patienten beträgt die Prävalenz von Diabetes sogar bis 40% (2). Andererseits haben Diabetiker ein 2.5-fach erhöhtes Risiko, eine Herzinsuffizienz zu entwickeln. Die Koexistenz beider Erkrankungen geht mit einem 10-fach erhöhten Mortalitätsrisiko bei Patienten > 65 Jahre einher. Neben den typischen makrovaskulären Komplikationen (Koronare Herzkrankheit, Herzinfarkt) trägt der Diabetes über inflammatorische und metabolische Effekte zu einer erhöhten Myokardmasse und Myokardsteifigkeit, sowie einer endothelialen Dysfunktion bei (3, 4). Diese Veränderungen begünstigen die Entwicklung einer Herzinsuffizienz.
Myokardiale Energiesubstrate und myokardialer Natrium Haushalt
Im Normalzustand basiert die myokardiale Energiegewinnung auf freien Fettsäuren (ca. 70%) und zu einem kleineren Teil auf Glucose (ca. 30%) (5). Das Herz gilt allerdings als «Omnivor» und kann dadurch die Wahl der Energiesubstrate äusserst flexibel den aktuellen metabolischen Gegebenheiten anpassen. Diese metabolische Flexibilität erlaubt bei hohen Blut-Glucose-Werten die Oxidationsrate freier Fettsäuren zu drosseln und vice versa. Bezüglich Energieeffizienz ist Glucose den freien Fettsäuren überlegen. Sowohl bei Diabetes als auch bei Herzinsuffizienz besteht jedoch ein Überangebot an freien Fettsäuren. Diese Konstellation mindert die Effizienz und Flexibilität der myokardialen Energiegewinnung. Zusätzlich wirkt sich das Überangebot an freien Fettsäuren negativ auf die mitochondriale ATP Produktion (Mitochondriales Uncoupling) (6) aus und beeinträchtigt die myokardiale Relaxation und Elastizität durch die Förderung einer perivaskulären und myokardialen Fibrose (7). Auch gehen beide Erkrankungen mit einer erhöhten myokardialen Natriumkonzentration einher, was das energetische Ungleichgewicht zusätzlich fördert und zu vermehrtem oxidativen Stress führt (8).
Wirkungsmechanismen der Sodium-Glucose Cotransporter 2 Hemmer
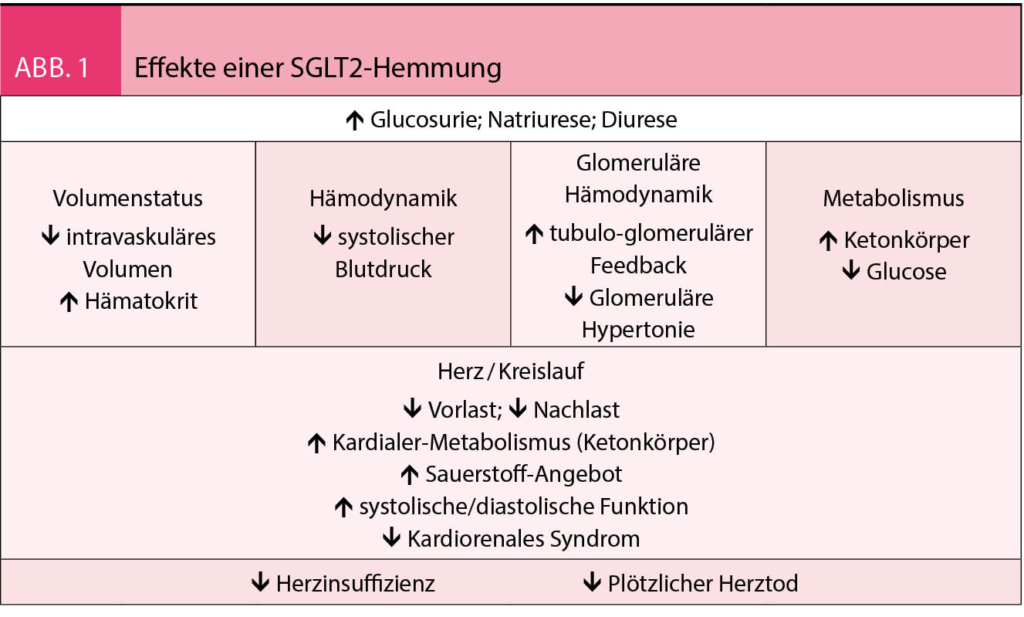
Der Sodium-Glucose Cotransporter 2 (SGLT2) ist im proximalen Tubulus der Niere lokalisiert und reabsorbiert 90% der filtrierten Glucose. Durch die Hemmung des Transporters wird weniger Glucose rückresorbiert. Dem Körper wird somit Glucose entzogen. Dieses Konzept unterscheidet sich grundsätzlich von anderen Glucose-senkenden Therapien, indem es unabhängig von Insulin die intravaskuläre und intrazelluläre Glucosekonzentration senkt. Eine SGLT2-Hemmung hat sowohl metabolische als auch hämodynamische Folgen. Die Therapie mit SGLT2-Inhibitoren führt zu einer bevorzugten Metabolisierung von Ketonkörpern (9). Diese stellen eine ideale Energiequelle für das Myokard dar. Die Oxidation von Ketonkörper hat mehrere Vorteile. Sie ist energetisch effizienter als die Oxidation von freien Fettsäuren. Indem Keton-Körper freie Radikale neutralisieren, wirken sie zudem dem oxidativen Stress entgegen. Ketonkörper werden deshalb insbesondere bei Herzinsuffizienz bevorzugt gegenüber freien Fettsäuren verstoffwechselt (10). Hämodynamisch wirken SGLT2-Inhibitoren leicht blutdrucksenkend und hemmen das Renin-Angiotensin-Aldosteron System (RAAS). Aufgrund der gesteigerten Glucosurie und Natriurese wirken sie ähnlich wie ein Diuretikum. Die Behandlung mit Empagliflozin führte in der EMPA-REG Studie zu einer durchschnittlichen Blutdrucksenkung von ca. 4 mmHg (11). In der DAPA-HF Studie sank der Blutdruck unter Dapagliflozin um ca. 2 mmHg bei
Patienten mit Herzinsuffizienz (12). Die erhöhte Natrium Konzentration an der Macula densa führt zudem über den tubulo-glomerulären Feedbackmechanismus zu einer Konstriktion des glomerulären Vas afferens. Dadurch sinkt der hydrostatische Druck im Glomerulum, was einer glomerulären Hyperfiltration entgegenwirkt und dadurch die Albuminurie reduziert. In diesem Sinne wirken SGLT2-
Inhibitoren additiv zu ACE-Inhibitoren nephroprotektiv. Mechanismen der kardioprotektiven Wirkungen einer SGLT2-Inhibition sind in Abbildung 1 zusammengefasst.
Klinische Evidenz einer SGLT2-Inhibition zur Behandlung der Herzinsuffizienz
Bereits die grossen Studienprogramme (EMPA-REG, CANVAS, DECLARE-TIMI 58), welche den Effekt einer SGLT2-Inhibition in der Primär- und Sekundärprävention bei Diabetikern mit kardiovaskulären Risiken untersuchten, zeigten ohne Ausnahme eine beeindruckende Senkung der Herzinsuffizienz-bedingten Hospitalisationen (11, 13, 14). In der EMPA-REG Outcome-Studie führte Empagliflozin gegenüber Plazebo zu einer Reduktion der Herzinsuffizienz-Hospitalisationen von 35%. Die Gesamtmortalität wurde um 32%, die kardiovaskuläre Mortalität um 38% gesenkt (11). Obwohl in CANVAS und DECLARE-TIMI, möglicherweise aufgrund der Selektion von gesünderen Patienten, keine signifikante Senkung der Gesamtmortalität durch die entsprechenden SGLT2-Hemmer erzielt werden konnte, wurden die Herzinsuffizienz-Hospitalisationen analog zu EMPA-REG um 33% (CANVAS) resp. 27% (DECLARE-TIMI 58) reduziert (13, 14). Bemerkenswerterweise stellte sich die Reduktion des Herzinsuffizienz-Endpunktes bereits sehr früh nach Therapiebeginn ein, was einen unmittelbaren hämodynamischen, respektive kardiometabolischen Effekt vermuten lässt und nicht durch die bessere Kontrolle der Glykämie zu erklären ist. Aufgrund der positiven Effekte der SGLT2-Hemmer zur Verhinderung einer Herzinsuffizienz wurden in der Folge reine Herzinsuffizienz Studienprogramme ins Leben gerufen. In DAPA-HF wurden 4744 symptomatische Patienten (NYHA Klasse II-IV) mit reduzierter linksventrikulärer Ejektionsfraktion (LVEF < 40%) und erhöhtem NT-proBNP (> 600 pg/ml) zu 10 mg Dapagliflozin versus Plazebo randomisiert (12). Die Studienmedikation wurde zusätzlich zu einer optimalen medikamentösen Basistherapie (> 90% ACE-I/ARB/ARNI; > 90% Betablocker; > 70% Aldosteron Antagonisten) verabreicht. Nach einer medianen Beobachtungszeit von 18 Monaten resultierte die Gabe von Dapagliflozin in einer hochsignifikanten Reduktion des kombinierten primären Endpunktes (kardiovaskulärer Tod oder Herzinsuffizienz-Hospitalisation) um 26% (NNT 21). Auch die Endpunkte Herzinsuffizienz-Hospitalisation (Risikoreduktion 30%), kardiovaskulärer Tod (Risikoreduktion 18%) und die Gesamtmortalität (Riskoreduktion 17%) wurden signifikant reduziert. Dabei zeigte sich, dass die positive Wirkung der SGLT2-Hemmer-Therapie auf die genannten klinischen Endpunkte absolut losgelöst vom Diabetesstatus war. Somit ist die SGLT2-Hemmer Therapie mehr als eine klassische Herzinsuffizienztherapie als eine rein antidiabetische Therapie zu betrachten. Insgesamt wurde die SGLT2- Hemmer Therapie von herzinsuffizienten Patienten sehr gut vertragen. Eine potentiell gefährliche Ketoazidose trat lediglich bei 0.1% der mit Dapagliflozin behandelten Patienten auf, und dies war ausschliesslich bei Diabetikern der Fall. Andere unerwünschte Nebenwirkungen wie beispielsweise Hypovolämie, Nierenversagen, Frakturen oder Amputationen traten gleich häufig wie in der Plazebogruppe auf. Bemerkenswert ist, dass auch die älteren Patienten (> 75 Jahre) gleichermassen von der Therapie profitierten und sogar die grösste Verbesserung der Lebensqualität erfuhren (12).
Copyright bei Aerzteverlag medinfo AG
Klinik für Kardiologie
Universitätsspital Basel
Petersgraben 4
4031 Basel
otmar.pfister@usb.ch
Der Autor deklariert in Zusammenhang mit diesem Artikel Beraterhonorare und unrestricted grants von AstraZeneca und Boehringer Ingelheim.
- Die prognostisch bedeutsamen Effekte von SGLT-2 Hemmern auf die Entstehung und den Verlauf einer Herzinsuffizienz dürfen als Klasseneffekt betrachtet werden. Diese sind unabhängig vom Diabetes Status.
- Ob sich einzelne Substanzen in Bezug auf Wirkung und/oder Nebenwirkungen voneinander unterscheiden, und ob Patienten mit einer Herzinsuffizienz mit erhaltener Ejektionfraktion (HFpEF) gleichermassen von einer SGLT-2 Hemmer Therapie profitieren wie Patienten mit HFrEF, werden die ausstehenden Studienergebnisse zeigen.
- Neben der bereits publizierten DAPA-HF Studie (LVEF < 40%) werden 2020 und 2021 die Studienergebnisse von EMPEROR-Reduced (LVEF < 40%) und EMPEROR-Preserved (LVEF > 40%) mit Empagliflozin, sowie DELIVER (LVEF > 40%) mit Dapagliflozin erwartet.
Messages à retenir
- Les effets significatifs des inhibiteurs de SGLT-2 sur le développement et la progression de l’insuffisance cardiaque peuvent être considérés comme des effets de classe. Celles-ci sont indépendantes du statut du diabète.
- Les résultats de l’étude en cours montreront si les substances individuelles diffèrent les unes des autres en termes d’effet et/ou d’effets secondaires, et si les patients souffrant d’insuffisance cardiaque avec fraction d’éjection préservée (HFpEF) bénéficient du même traitement par inhibiteur SGLT-2 que les patients souffrant de HFrEF.
- En plus de l’étude DAPA-HF déjà publiée (LVEF < 40 %), les résultats des études EMPEROR-Reduced (LVEF < 40 %) et EMPEROR-Preserved (LVEF > 40 %) avec empagliflozine et DELIVER (LVEF > 40 %) avec dapagliflozine sont attendus en 2020 et 2021.
1. Lombardi C, Spigoni V, Gorga E and Dei Cas A. Novel insight into the dangerouEs connection between diabetes and heart failure. Herz. 2016;41:201-7.
2. Greenberg BH, Abraham WT, Albert NM, Chiswell K, Clare R, Stough WG, Gheorghiade M, O’Connor CM, Sun JL, Yancy CW, Young JB and Fonarow GC. Influence of diabetes on characteristics and outcomes in patients hospitalized with heart failure: a report from the Organized Program to Initiate Lifesaving Treatment in Hospitalized Patients with Heart Failure (OPTIMIZE-HF). Am Heart J. 2007;154:277 e1-8.
3. van Heerebeek L, Hamdani N, Handoko ML, Falcao-Pires I, Musters RJ, Kupreishvili K, Ijsselmuiden AJ, Schalkwijk CG, Bronzwaer JG, Diamant M, Borbely A, van der Velden J, Stienen GJ, Laarman GJ, Niessen HW and Paulus WJ. Diastolic stiffness of the failing diabetic heart: importance of fibrosis, advanced glycation end products, and myocyte resting tension. Circulation. 2008;117:43-51.
4. Falcao-Pires I, Hamdani N, Borbely A, Gavina C, Schalkwijk CG, van der Velden J, van Heerebeek L, Stienen GJ, Niessen HW, Leite-Moreira AF and Paulus WJ. Diabetes mellitus worsens diastolic left ventricular dysfunction in aortic stenosis through altered myocardial structure and cardiomyocyte stiffness. Circulation. 2011;124:1151-9.
5. Bertero E and Maack C. Metabolic remodelling in heart failure. Nat Rev Cardiol. 2018;15:457-470.
6. Cadenas S. Mitochondrial uncoupling, ROS generation and cardioprotection. Biochim Biophys Acta Bioenerg. 2018;1859:940-950.
7. Leichman JG, Aguilar D, King TM, Vlada A, Reyes M and Taegtmeyer H. Association of plasma free fatty acids and left ventricular diastolic function in patients with clinically severe obesity. Am J Clin Nutr. 2006;84:336-41.
8. Lambert R, Srodulski S, Peng X, Margulies KB, Despa F and Despa S. Intracellular Na+ Concentration ([Na+]i) Is Elevated in Diabetic Hearts Due to Enhanced Na+-Glucose Cotransport. J Am Heart Assoc. 2015;4:e002183.
9. Mudaliar S, Alloju S and Henry RR. Can a Shift in Fuel Energetics Explain the Beneficial Cardiorenal Outcomes in the EMPA-REG OUTCOME Study? A Unifying Hypothesis. Diabetes Care. 2016;39:1115-22.
10. Aubert G, Martin OJ, Horton JL, Lai L, Vega RB, Leone TC, Koves T, Gardell SJ, Kruger M, Hoppel CL, Lewandowski ED, Crawford PA, Muoio DM and Kelly DP. The Failing Heart Relies on Ketone Bodies as a Fuel. Circulation. 2016;133:698-705.
11. Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S, Mattheus M, Devins T, Johansen OE, Woerle HJ, Broedl UC, Inzucchi SE and Investigators E-RO. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med. 2015;373:2117-28.
12. McMurray JJV, Solomon SD, Inzucchi SE, Kober L, Kosiborod MN, Martinez FA, Ponikowski P, Sabatine MS, Anand IS, Belohlavek J, Bohm M, Chiang CE, Chopra VK, de Boer RA, Desai AS, Diez M, Drozdz J, Dukat A, Ge J, Howlett JG, Katova T, Kitakaze M, Ljungman CEA, Merkely B, Nicolau JC, O’Meara E, Petrie MC, Vinh PN, Schou M, Tereshchenko S, Verma S, Held C, DeMets DL, Docherty KF, Jhund PS, Bengtsson O, Sjostrand M, Langkilde AM, Committees D-HT and Investigators. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med. 2019;381:1995-2008.
13. Neal B, Perkovic V, Mahaffey KW, de Zeeuw D, Fulcher G, Erondu N, Shaw W, Law G, Desai M, Matthews DR and Group CPC. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med. 2017;377:644-657.
14. Wiviott SD, Raz I, Bonaca MP, Mosenzon O, Kato ET, Cahn A, Silverman MG, Zelniker TA, Kuder JF, Murphy SA, Bhatt DL, Leiter LA, McGuire DK, Wilding JPH, Ruff CT, Gause-Nilsson IAM, Fredriksson M, Johansson PA, Langkilde AM, Sabatine MS and Investigators D-T. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2019;380:347-357.
info@herz+gefäss
- Vol. 10
- Ausgabe 2
- April 2020