- Elektroporation mit pulsed-field Ablation
Bereits seit über 20 Jahren existiert die interventionelle Behandlung von Vorhofflimmern mittels Pulmonalvenenisolation (PVI) auf Basis der Beobachtungen von Prof. Haïssaguerre et al in 1998 (1). Seither wird die PVI immer häufiger durchgeführt mit über die Jahre zunehmender Effektivität, Effizienz und Sicherheit der Ablation. In ihrer Grundform hat sich die Prozedur über die Jahre jedoch kaum verändert: Mittels thermischer Energie werden die Pulmonalvenen elektrisch isoliert (2). Die Radiofrequenzablation erhitzt das Gewebe und die Kryoablation entzieht dem Gewebe Wärme. Beide Modalitäten führen dadurch zu einem thermischen Schaden des Myokards mit vergleichbarer Effektivität und Sicherheit (3). Obwohl die Komplikationsrate sehr gering ist, kann es jedoch aufgrund der thermischen Energien bei beiden Modalitäten zu Schäden an umliegenden Strukturen kommen, insbesondere des Oesophagus und des Nervus phrenikus. Im Idealfall benötigen wir daher eine Energieform, welche effektiv die Pulmonalvenen isolieren kann und gleichzeitig die umliegenden Strukturen nicht verletzt. In diesem Artikel möchten wir auf eine neue, primär nicht-thermische Modalität der Ablation eingehen, welche diese Anforderungen erfüllen könnte: Die Elektroporation mittels pulsed-field Ablation.
Interventional treatment of atrial fibrillation by pulmonary vein isolation (PVI) has existed for more than 20 years based on the observations of Prof. Haïssaguerre et al in 1998 (1). Since then, PVI has been performed with increasing frequency with increasing effectiveness, efficiency, and safety of ablation over the years. However, in its basic form, the procedure has changed little over the years: Thermal energy is used to electrically isolate the pulmonary veins (2). Radiofrequency ablation heats the tissue, and cryoablation extracts heat from the tissue. Both modalities thereby result in thermal damage to the myocardium with comparable efficacy and safety (3). However, although the complication rate is very low, damage to surrounding structures, particularly the esophagus and phrenic nerve, may occur due to the thermal energies in both modalities. Ideally, therefore, we need a form of energy that can effectively isolate the pulmonary veins while not injuring surrounding structures. In this article, we would like to discuss a new, primarily nonthermal modality of ablation that may meet these requirements: Electroporation by pulsed-field ablation.
Key Words: atrial fibrillation, pulmonary vein isolation, radiofrequency ablation, cryoablation
Prinzip der Elektroporation mit pulsed-field Ablation
Die Elektroporation via pulsed-field Ablation ist im Gegensatz zu primär thermalen Ablationsformen, wie der Radiofrequenz- oder Kryoablation, in der verwendeten Stärke eine nicht-thermale Alternative. Bei der Elektroporation kommt es durch den Aufbau eines Hochenergiefelds zu Veränderungen an den Zellmembranen, sogenannten Nano-Poren, die die Zellintegrität und –viabilität stören (4). Dieses Hochenergiefeld wird über mehrere Impulse, welche einzeln nur wenige Nanosekunden dauern und in Paketen gruppiert werden, abgegeben. Dabei können die Impulse je nach Katheter monophasisch oder biphasisch abgegeben werden. Konzeptionell handelt es sich dabei um die gleiche Energieform wie bei einem Gleichstromschock.
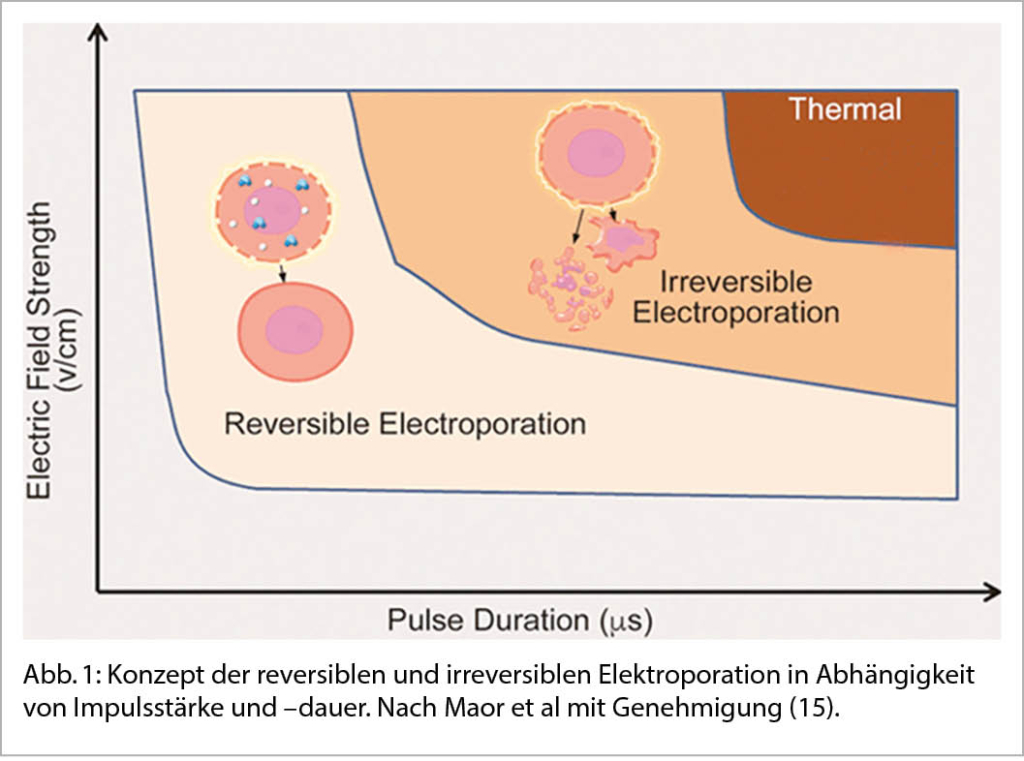
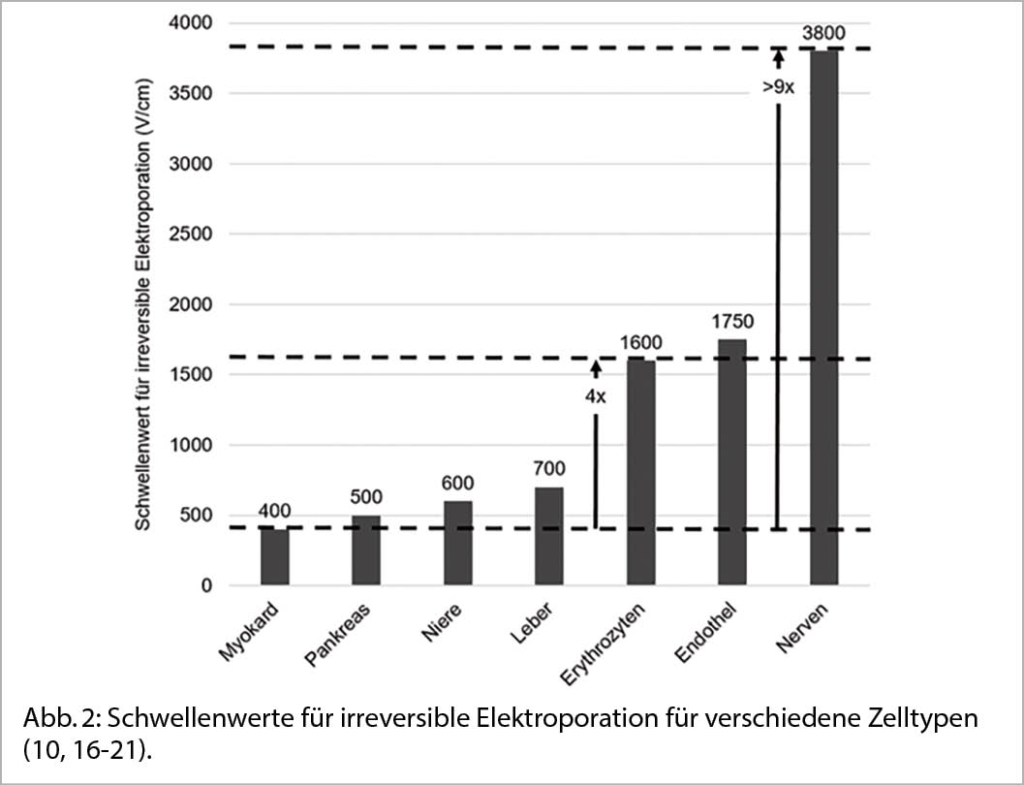
Elektroporation wird bereits seit Dekaden in anderen Disziplinen, insbesondere der Grundlagenforschung, eingesetzt (5). Dort wird die Elektroporation verwendet um die Zellmembranen temporär durchlässig zu machen und dadurch Moleküle in lebende Zellen zu transportieren. Erst später kam es zur klinischen Anwendung der Elektroporation in der Onkologie, um Chemotherapeutika effektiver in Zellen zu transportieren und in der weiteren Entwicklung diese Zellen direkt mittels Elektroporation abzutöten (6). Diese unterschiedlichen Anwendungsmöglichkeiten der Elektroporation beruhen auf zwei Grundprinzipien: 1. Während eine niedrigere Feldstärke zu einer reversiblen Elektroporation führt mit Erholung der Zellmembran, führt eine höhere Feldstärke über einem gewissen Schwellenwert zu einer irreversiblen Elektroporation und einem dauerhaften Zelltod. 2. Der Schwellenwert für die irreversible Elektroporation ist je nach Gewebetyp unterschiedlich. Dieser unterschiedliche Schwellenwert je nach Gewebetyp ist vor allem in der kardiologischen Anwendung essentiell. Myokardzellen haben einen viel tieferen Schwellenwert, sind also viel sensibler, als Nervenzellen oder Endothelzellen. Abbildung 1 zeigt das Konzept der reversiblen und irreversiblen Elektroporation und Abbildung 2 zeigt die unterschiedlichen Schwellenwerte je nach Zelltyp. Aufgrund dieser beiden Grundkonzepte bietet Elektroporation zwei Versprechen: Einerseits eine dauerhafte Ablation im Bereich der irreversiblen Feldstärke und andererseits eine sicherere Ablation ohne Kollateralschaden des Nervus phrenikus oder des Oesophagus aufgrund des fehlenden oder nur sehr geringen thermalen Effekts sowie der höheren Schwellenwerte für diese Gewebe.
Erste Daten der PVI mit pulsed-field Ablation
Präklinische Experimente im Tiermodell konnten die Machbarkeit von dauerhafter PVI mittels pulsed-field Ablation zeigen bei hervorragender Sicherheit (7 – 9). Trotz mehrfacher Impulsabgabe direkt auf den entsprechenden Strukturen zeigten sich keine Pulmonalvenenstenosen, Verletzungen des Oesophagus oder dauerhaften Paresen des Nervus phrenikus. Basierend auf diesen vielversprechenden Daten folgten klinische Studien mit den ersten publizierten Daten in 2018 (10). In der ersten Studie wurden 22 Patienten mit Vorhofflimmern mittels pulsed-field Ablation behandelt. Es konnten dabei alle Pulmonalvenen erfolgreich isoliert werden ohne Komplikationen akut oder nach einem Monat. Daraufhin wurden im Jahr 2019 zwei weitere Studien publiziert, die IMPULSE und die PEFCAT Studien (11). Zusammen wurden in diesen beiden Studien 81 Patienten mit pulsed-field Ablation behandelt. Während der Studiendurchführung wurde die Impulsabgabe von einem monophasischen zu einem biphasischen Impuls mit höherer Stärke optimiert. Dies hat den Vorteil, dass Patienten weniger tief sediert werden mussten, da monophasische Impulse zu starken Skelettmuskelkontraktionen führen. In diesen Studien erfolgte in allen Patienten nach 3 Monaten eine erneute elektrophysiologische Untersuchung mit Mapping des linken Vorhofs. Hierin zeigten sich in der ersten, monophasischen Impulsform nur 16% der Pulmonalvenen dauerhaft isoliert, mit der optimierten biphasischen Impulsform jedoch 100%. Es zeigten sich keine Verletzungen des Oesophagus in den Patienten, die anschliessend im Rahmen der Studie endoskopiert (29 Patienten) wurden und/oder ein MRI (8 Patienten) erhielten. Diese vielversprechenden Ergebnisse konnten in weiteren Studien, auch mit anderen pulsed-field Ablationssystemen sowohl in Patienten mit paroxysmalem als auch persistierendem Vorhofflimmern reproduziert werden (12, 13).
Aktuelle Anwendung und Daten
In Europa ist aktuell ein pulsed-field Ablationssystem zugelassen und wird in grossen Zentren für Elektrophysiologie bereits routinemässig angewandt. Aus dieser klinischen Anwendung heraus wurden vor kurzem die Ergebnisse des MANIFEST-PF Registers publiziert (14). Darin wurden 1’758 Patienten in 24 europäischen Zentren mit pulsed-field Ablation behandelt. In 99.9% konnten die Pulmonalvenen akut isoliert werden mit 0% oesophagealen Komplikationen, 0% Pulmonalvenenstenosen und 0% dauerhaften Nervus phrenikus Paralysen. In 0.5% kam es zu transienten Paresen des Nervus phrenikus mit Erholung in allen Patienten innerhalb von einem Tag. Die durchschnittliche Eingriffsdauer lag mit 65 Minuten in einem ähnlichen Bereich wie wir sie von der Radiofrequenz- und Kryoablation kennen. Am ESC Kongress dieses Jahres wurden auch erste Daten des Registers vorgestellt mit 1 Jahres Erfolgsraten, welche vergleichbar zu der Radiofrequenz- und Kryoablation waren. Somit zeigt sich in den bisher publizierten Daten ein sehr gutes Sicherheitsprofil der pulsed-field Ablation bei zu thermalen Energien vergleichbarer Langzeit-Effektivität und Eingriffsdauer.
Ausblick
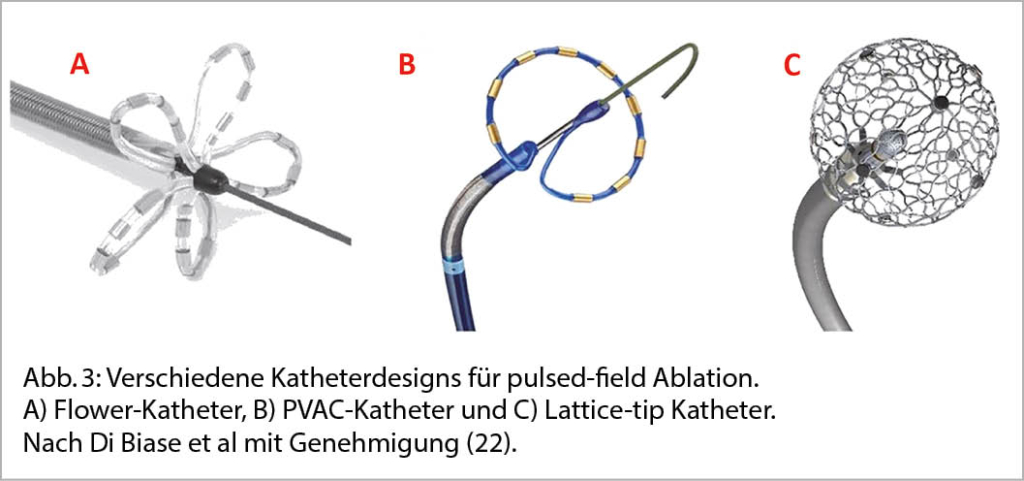
Aktuell werden mehrere, grosse randomisierte Studien, welche verschiedene pulsed-field Ablationssysteme mit Radiofrequenz- und Kryoablation in Patienten mit Vorhofflimmern vergleichen, durchgeführt. Abbildung 3 zeigt ausgewählte pulsed-field Ablationskatheter von verschiedenen Herstellern und unterschiedlichen Designs. Erwähnenswert ist die «Single Shot Champion» Studie (NCT05534581), welche pulsed-field Ablation mit Cryoballon-Ablation in Patienten mit paroxysmalem Vorhofflimmern vergleicht und in der Schweiz am Inselspital Bern und Universitätsspital Basel durchgeführt wird. Aufgrund der Vielzahl der aktuell laufenden Studien, gehen wir davon aus, dass wir in den nächsten Jahren Daten von mehreren tausend Patienten aus randomisierten Studien zu verschiedenen pulsed-field Ablationssystemen erhalten werden. Dies wird dazu führen, dass weitere pulsed-field Ablationssysteme mit verschiedenen Katheterdesigns für Patienten mit Vorhofflimmern zugelassen werden.
Zusätzlich werden zurzeit auch kleinere Studien bei Patienten mit ventrikulären Arrhythmien durchgeführt. Für ventrikuläre Arrhythmien gibt es jedoch noch keine offiziell zugelassenen Systeme.
Zusammenfassung
Die Elektroporation mittels pulsed-field Ablation ist eine nicht-thermale Energieform zur PVI bei Patienten mit Vorhofflimmern. Die bisher vorliegenden Daten zeigen ein sehr gutes Sicherheitsprofil bei vergleichbarer Effektivität zu Radiofrequenz- und Kryoablation. Aktuell ist ein pulsed-field Ablationssystem in Europa zugelassen und es werden mehrere, grosse randomisierte Studien durchgeführt, welche unterschiedliche pulsed-field Ablationssysteme untersuchen.
Zweitabdruck aus «der informierte Arzt» 11-2022
Copyright bei Aerzteverlag medinfo AG
Klinik für Kardiologie, Universitätsspital Basel, Cardiovascular Research
Institute Basel, Universitätsspital Basel
Klinik für Kardiologie, Universitätsspital Basel, Cardiovascular Research
Institute Basel, Universitätsspital Basel
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Haïssaguerre M, Jaïs P, Shah DC, Takahashi A, Hocini M, Quiniou G, Garrigue S, Le Mouroux A, Le Métayer P, Clémenty J. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med. 1998;339:659–666.
2. Calkins H, Hindricks G, Cappato R, Kim Y-H, Saad EB, Aguinaga L, Akar JG, Badhwar V, Brugada J, Camm J, Chen P-S, Chen S-A, Chung MK, Cosedis Nielsen J, Curtis AB, Davies DW, Day JD, d’Avila A, Natasja de Groot NMS, Di Biase L, Duytschaever M, Edgerton JR, Ellenbogen KA, Ellinor PT, Ernst S, Fenelon G, Gerstenfeld EP, Haines DE, Haissaguerre M, Helm RH, Hylek E, Jackman WM, Jalife J, Kalman JM, Kautzner J, Kottkamp H, Kuck KH, Kumagai K, Lee R, Lewalter T, Lindsay BD, Macle L, Mansour M, Marchlinski FE, Michaud GF, Nakagawa H, Natale A, Nattel S, Okumura K, Packer D, Pokushalov E, Reynolds MR, Sanders P, Scanavacca M, Schilling R, Tondo C, Tsao H-M, Verma A, Wilber DJ, Yamane T, Document Reviewers: 2017 HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation. Eur Eur Pacing Arrhythm Card Electrophysiol J Work Groups Card Pacing Arrhythm Card Cell Electrophysiol Eur Soc Cardiol. 2018;20:e1–e160.
3. Kuck K-H, Brugada J, Fürnkranz A, Metzner A, Ouyang F, Chun KRJ, Elvan A, Arentz T, Bestehorn K, Pocock SJ, Albenque J-P, Tondo C, FIRE AND ICE Investigators. Cryoballoon or Radiofrequency Ablation for Paroxysmal Atrial Fibrillation. N Engl J Med. 2016;374:2235–2245.
4. Ramirez FD, Reddy VY, Viswanathan R, Hocini M, Jaïs P. Emerging Technologies for Pulmonary Vein Isolation. Circ Res. 2020;127:170–183.
5. Sale AJ, Hamilton WA. Effects of high electric fields on micro-organisms. 3. Lysis of erythrocytes and protoplasts. Biochim Biophys Acta. 1968;163:37–43.
6. Mir LM, Orlowski S, Belehradek J, Paoletti C. Electrochemotherapy potentiation of antitumour effect of bleomycin by local electric pulses. Eur J Cancer Oxf Engl 1990. 1991;27:68–72.
7. Wittkampf FH, van Driel VJ, van Wessel H, Vink A, Hof IE, Gründeman PF, Hauer RNW, Loh P. Feasibility of electroporation for the creation of pulmonary vein ostial lesions. J Cardiovasc Electrophysiol. 2011;22:302–309.
8. Stewart MT, Haines DE, Verma A, Kirchhof N, Barka N, Grassl E, Howard B. Intracardiac pulsed field ablation: Proof of feasibility in a chronic porcine model. Heart Rhythm. 2019;16:754–764.
9. Koruth J, Kuroki K, Iwasawa J, Enomoto Y, Viswanathan R, Brose R, Buck ED, Speltz M, Dukkipati SR, Reddy VY. Preclinical Evaluation of Pulsed Field Ablation. Circ Arrhythm Electrophysiol. 2019;12:e007781.
10. Reddy VY, Koruth J, Jais P, Petru J, Timko F, Skalsky I, Hebeler R, Labrousse L, Barandon L, Kralovec S, Funosako M, Mannuva BB, Sediva L, Neuzil P. Ablation of Atrial Fibrillation With Pulsed Electric Fields: An Ultra-Rapid, Tissue-Selective Modality for Cardiac Ablation. JACC Clin Electrophysiol. 2018;4:987–995.
11. Reddy VY, Neuzil P, Koruth JS, Petru J, Funosako M, Cochet H, Sediva L, Chovanec M, Dukkipati SR, Jais P. Pulsed Field Ablation for Pulmonary Vein Isolation in Atrial Fibrillation. J Am Coll Cardiol. 2019;74:315–326.
12. Verma A, Boersma L, Haines DE, Natale A, Marchlinski FE, Sanders P, Calkins H, Packer DL, Hummel J, Onal B, Rosen S, Kuck K-H, Hindricks G, Wilsmore B. First-in-Human Experience and Acute Procedural Outcomes Using a Novel Pulsed Field Ablation System: The PULSED AF Pilot Trial. Circ Arrhythm Electrophysiol. 2022;15:e010168.
13. Reddy VY, Anic A, Koruth J, Petru J, Funasako M, Minami K, Breskovic T, Sikiric I, Dukkipati SR, Kawamura I, Neuzil P. Pulsed Field Ablation in Patients With Persistent Atrial Fibrillation. J Am Coll Cardiol. 2020;76:1068–1080.
14. Ekanem E, Reddy VY, Schmidt B, Reichlin T, Neven K, Metzner A, Hansen J, Blaauw Y, Maury P, Arentz T, Sommer P, Anic A, Anselme F, Boveda S, Deneke T, Willems S, van der Voort P, Tilz R, Funasako M, Scherr D, Wakili R, Steven D, Kautzner J, Vijgen J, Jais P, Petru J, Chun J, Roten L, Füting A, Rillig A, Mulder BA, Johannessen A, Rollin A, Lehrmann H, Sohns C, Jurisic Z, Savoure A, Combes S, Nentwich K, Gunawardene M, Ouss A, Kirstein B, Manninger M, Bohnen JE, Sultan A, Peichl P, Koopman P, Derval N, Turagam MK, Neuzil P, MANIFEST-PF Cooperative. Multi-national survey on the methods, efficacy, and safety on the post-approval clinical use of pulsed field ablation (MANIFEST-PF). Eur Eur Pacing Arrhythm Card Electrophysiol J Work Groups Card Pacing Arrhythm Card Cell Electrophysiol Eur Soc Cardiol. 2022;24:1256–1266.
15. Maor E, Sugrue A, Witt C, Vaidya VR, DeSimone CV, Asirvatham SJ, Kapa S. Pulsed electric fields for cardiac ablation and beyond: A state-of-the-art review. Heart Rhythm. 2019;16:1112–1120.
16. Kaminska I, Kotulska M, Stecka A, Saczko J, Drag-Zalesinska M, Wysocka T, Choromanska A, Skolucka N, Nowicki R, Marczak J, Kulbacka J. Electroporation-induced changes in normal immature rat myoblasts (H9C2). Gen Physiol Biophys. 2012;31:19–25.
17. Maor E, Ivorra A, Rubinsky B. Non thermal irreversible electroporation: novel technology for vascular smooth muscle cells ablation. PloS One. 2009;4:e4757.
18. Li W, Fan Q, Ji Z, Qiu X, Li Z. The effects of irreversible electroporation (IRE) on nerves. PloS One. 2011;6:e18831.
19. Arena CB, Szot CS, Garcia PA, Rylander MN, Davalos RV. A three-dimensional in vitro tumor platform for modeling therapeutic irreversible electroporation. Biophys J. 2012;103:2033–2042.
20. Neal RE, Garcia PA, Kavnoudias H, Rosenfeldt F, Mclean CA, Earl V, Bergman J, Davalos RV, Thomson KR. In vivo irreversible electroporation kidney ablation: experimentally correlated numerical models. IEEE Trans Biomed Eng. 2015;62:561–569.
21. Bao N, Le TT, Cheng J-X, Lu C. Microfluidic electroporation of tumor and blood cells: observation of nucleus expansion and implications on selective analysis and purging of circulating tumor cells. Integr Biol Quant Biosci Nano Macro. 2010;2:113–120.
22. Di Biase L, Diaz JC, Zhang X-D, Romero J. Pulsed field catheter ablation in atrial fibrillation. Trends Cardiovasc Med. 2022;32:378–387.
info@herz+gefäss
- Vol. 13
- Ausgabe 1
- Februar 2023