- Entscheidung von der Dauer und traditionellen Risikofaktoren abhängig
Subklinische Episoden atrialer Tachyarrhythmien als Vorstufe von Vorhofflimmern lassen sich heute mithilfe von Schrittmachern oder ICDs detektieren. Dabei stellt sich die Frage nach der Antikoagulation. Dieser Artikel gibt einen Überblick über den aktuellen Wissenstand über subklinisches Vorhofflimmern, die verfügbaren Devices zur Früherkennung und die noch offenen Fragen.
Les épisodes subcliniques de tachyarythmie auriculaire comme précurseur de la fibrillation auriculaire peuvent maintenant être détectés à l’aide de stimulateurs cardiaques ou de ICDs. Cela soulève la question de l’anticoagulation. Cet article donne un aperçu de l’état actuel des connaissances sur la fibrillation auriculaire subclinique, les dispositifs disponibles pour la détection précoce et les questions qui restent ouvertes.
Einleitung
Vorhofflimmern ist die häufigste Arrhythmie weltweit mit einer prognostizierten Verdopplung der betroffenen Patienten bis 2060 (1,2). Patienten mit Vorhofflimmern haben im Vergleich zur Normalbevölkerung ein deutlich erhöhtes Risiko für Tod, Schlaganfall, Herzinsuffizienz und kognitive Dysfunktion (3,4). Somit ist es wichtig, Patienten mit Vorhofflimmern früh zu erkennen und adäquat, insbesondere mit Antikoagulation, zu behandeln. Über die letzten Jahre sind Ärzte neben klinischem Vorhofflimmern immer mehr mit stillem, subklinischem Vorhofflimmern, welches durch ein implantierbares oder tragbares Device detektiert wurde, konfrontiert. Subklinisches Vorhofflimmern ist dabei als Vorhofflimmern ohne Symptome, welches erstmalig mit einem implantierten oder tragbaren Monitoring Device dokumentiert und durch einen Arzt bestätigt wurde, definiert. Die erfolgreiche klinische Testung von Apps und Smart-Devices zur Vorhofflimmerdetektion und die Aufnahme dieser Modalitäten zum Vorhofflimmer-Screening in die internationalen Guidelines, ermöglichen eine ungleich niederschwelligere Suche nach Rhythmusstörungen als noch wenige Jahre zuvor (5-7). Die genaue Zeitdauer, ab wann man von Vorhofflimmern spricht ist weiterhin Gegenstand von Forschung und Diskursen und wurde aktuell empirisch bei mindestens 30 Sekunden festgelegt. Einerseits eröffnet die frühe Detektion von subklinischem Vorhofflimmern die Möglichkeit einer frühen, präventiven Schlaganfallprophylaxe. Andererseits ist noch nicht etabliert ob eine Langzeitantikoagulation bei subklinischem Vorhofflimmern sicher indiziert ist und falls ja, welche Patientengruppen davon am meisten profitieren und ab welcher Vorhofflimmerdauer der Nutzen gegenüber dem Blutungsrisiko überwiegt. Dieser Artikel gibt einen Überblick über den aktuellen Wissenstand über subklinisches Vorhofflimmern, die verfügbaren Devices zur Früherkennung und die noch offenen Fragen.
Detektion, Diagnose und Prävalenz
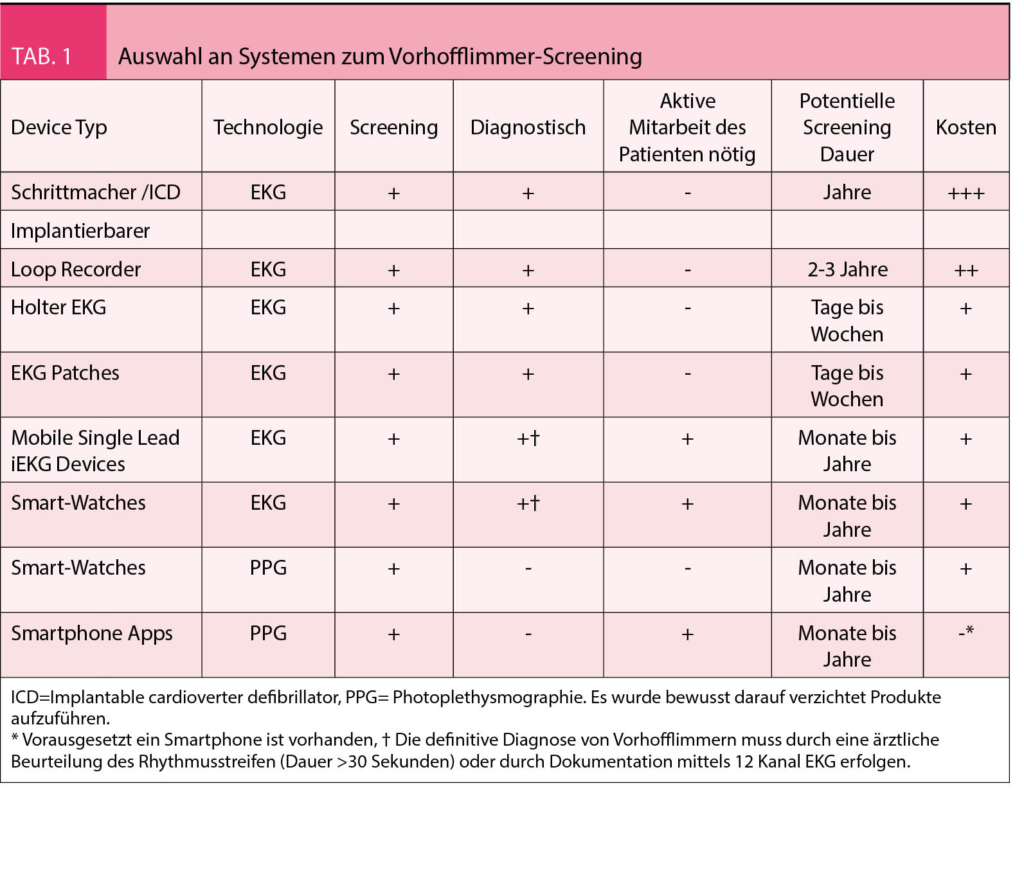
Die verfügbaren Geräte zur Detektion von subklinischem Vorhofflimmern umfassen intrakardiale, subkutane und tragbare Geräte mit intermittierendem oder kontinuierlichen Monitoring. Diese reichen von implantierten Herzschrittmachern über aufklebbare Patches bis zu Smart-Watches und Smart-Phones. Jedes dieser Systeme hat spezifische Vor- und Nachteile und eignet sich daher für unterschiedliche Umstände. Genauso wie der Preis des Screenings eine Rolle bei der Entscheidung spielen sollte, müssen potentielle Nebenwirkungen, der Anteil unnötiger Folgeuntersuchungen und Komplikationen, neben Komfort, zu erwartender Compliance und der schlichten Verfügbarkeit der Devices berücksichtigt werden. Unbedingt sollte darauf geachtet werden, dass die Geräte und die verwendete Software für den vorgesehenen Zweck als Medizinprodukt zertifiziert sind. Idealerweise sind auch Eckdaten wie Sensitivität und Spezifität der verwendeten Algorithmen publiziert, um die resultierenden Informationen bestmöglich interpretieren zu können. Da es sich bei stillem Vorhofflimmern um ein wiederkehrendes Ereignis mit überschaubarem akutem Risiko für den Patienten handelt, ist zum Beispiel eine etwas geringere Sensitivität (nicht jede Episode wird erkannt) zum Preis einer maximalen Spezifität (praktisch jede detektierte Episode ist tatsächlich Vorhofflimmern) durchaus vertretbar.
Tabelle 1 gibt einen Überblick über die wichtigsten, aktuellen verfügbaren Geräte zur Detektion von subklinischem Vorhofflimmern. Bisher stammt die meiste Evidenz von Herzschrittmachern mit einer atrialen Sonde zur Erkennung des Vorhofflimmerns durch verschiedene Algorithmen mit P-Wellenerkennung und Irregularität der P-P und R-R Abstände (8-13). Aufgrund von unterschiedlichen Definitionen von subklinischem Vorhofflimmern, variierendem Follow-up und verschiedenen, oft multimorbiden Patientenpopulationen, gibt es eine grosse Bandbreite von berichteten Prävalenzen. Diese reichen von 10 bis 55% über Beobachtungszeiträume von 6 Monaten bis 7 Jahre. Leider gibt es auch keine kongruenten Prädiktoren für die Entwicklung von subklinischem Vorhofflimmern in den publizierten Herzschrittmacherstudien. Risikofaktoren wie arterielle Hypertonie, höheres Alter, frühere thromboembolische Ereignisse, ein dilatierter linker Vorhof und eine bestehende Herzinsuffizienz scheinen jedoch die Wahrscheinlichkeit für subklinisches Vorhofflimmern zu erhöhen (8-13). Die kürzlich publizierte Apple-Heart Studie gibt erstmals einen Anhaltspunkt über die Prävalenz von subklinischem Vorhofflimmern in der Allgemeinbevölkerung: Eine beeindruckende Anzahl von 419.297 Teilnehmer wurde dabei im Median über 117 Tage monitorisiert. Davon erhielten 0.5% der Teilnehmer eine Notifikation über einen unregelmässigen Puls. In 84% wurden die Notifikationen als Vorhofflimmern interpretiert und bei 34% der Personen mit Notifikationen konnte ein Vorhofflimmern mittels zusätzlichen EKG Patches dokumentiert werden (14). Dies zeigt, dass die Prävalenz von subklinischem Vorhofflimmern in der Allgemeinbevölkerung niedrig ist, sodass die number needed-to-screen um Vorhofflimmern bei einer Person zu finden entsprechend gross ist. Bei Notifikationen ist der positive prädiktive Wert für Vorhofflimmern jedoch sehr hoch.
Assoziation mit ischämischem Schlaganfall
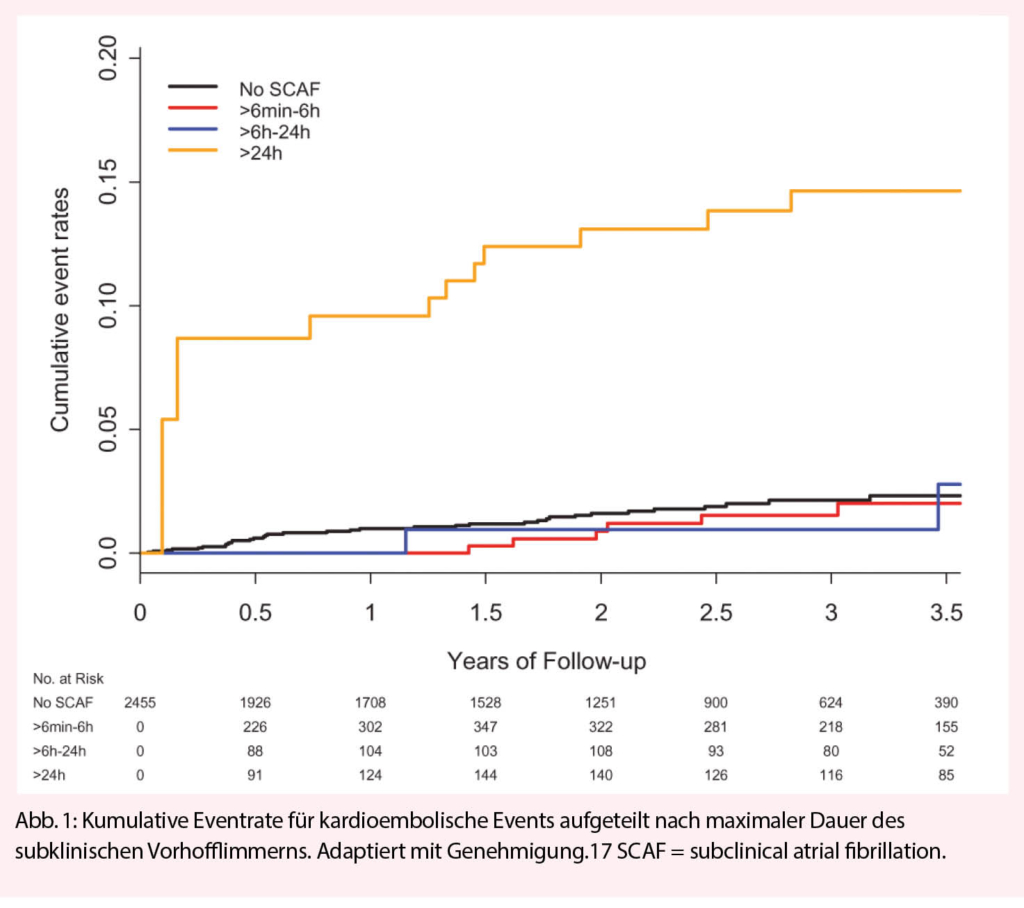
Screening für subklinisches Vorhofflimmern macht nur Sinn, wenn daraus auch ein erhöhtes Risiko für kardiovaskuläre Endpunkte und ein entsprechender Nutzen einer frühen Behandlung hervorgeht. Dieser Frage nahm sich eine kürzlich publizierte Meta-analyse in über 15.000 Patienten von 7 Studien an. Diese zeigte ein 2.4-fach erhöhtes Risiko für ischämische Schlaganfälle in Patienten mit subklinischem Vorhofflimmern. In absoluten Zahlen entspricht dies einer Inzidenz von 1.9 pro 100 Patientenjahren (15). Dabei wurde ein Zusammenhang zwischen der Dauer des Vorhofflimmerns und des Schlaganfallrisikos festgestellt. Während kurze Episoden unter 15-20 Sekunden kein erhöhtes Risiko zeigten, waren Episoden >24 Stunden mit einem deutlich erhöhten Schlaganfallrisiko assoziiert (Abbildung 1) (8,16,17). Zusätzlich ist das Schlaganfallrisiko neben der Zeitdauer des subklinischen Vorhofflimmerns auch von traditionellen Risikofaktoren, wie Diabetes mellitus, arterieller Hypertonie und vaskulärer Erkrankung, welche Teile des CHA2DS2-VASc bzw. CHA2DS2-VASc Scores sind, abhängig. So konnte gezeigt werden, dass Patienten mit einem CHADS2 Score von 1 Punkt erst ab Episoden >24 Stunden ein relevant erhöhtes Risiko haben, Patienten mit einem CHADS2 Score ≥2 Punkte jedoch schon ab Episoden >5 Minuten. Die wichtige Rolle von traditionellen Risikofaktoren ist durch die inkongruente zeitliche Assoziation von Vorhofflimmerepisoden mit Schlaganfällen in der ASSERT Studie unterstrichen. In dieser Studie, mit kontinuierlichen Rhythmusmonitoring mit Herzschrittmachern, konnte gezeigt werden, dass die zeitliche Korrelation zwischen Vorhofflimmerepisoden und Schlaganfällen sehr niedrig ist (18). Dies hat zu der Diskussion geführt, ob Vorhofflimmern neben der direkten Ursache für einen Schlaganfall auch lediglich ein Risikoindikator für ein erhöhtes Schlaganfallrisiko sein könnte. Zusammenfassend ist das endgültige Schlaganfallrisiko von einem komplexen Zusammenspiel von der Zeitdauer des Vorhofflimmerns und Risikofaktoren abhängig.
Progression zu klinischem Vorhofflimmern
Patienten mit subklinischem Vorhofflimmern haben ein fast 6-fach erhöhtes Risiko in den nächsten 2-3 Jahren klinisches Vorhofflimmern zu entwickeln. In einer Studie mit 2580 Patienten mit einem Herzschrittmacher entwickelten 16% der Patienten mit subklinischen Vorhofflimmerepisoden, zwischen 6 Minuten bis 24 Stunden, längere Episoden >24 Stunden über einen Zeitraum von 2.5 Jahren. Risikofaktoren für eine Progression von subklinischem zu klinischem Vorhofflimmern waren höheres Alter, ein höherer BMI und längere subklinische Episoden (8). Diese Progression ist klinisch relevant, da Patienten mit zunehmenden subklinischen Vorhofflimmerepisoden unter anderem ein erhöhtes Risiko für eine Herzinsuffizienz haben (19).
Behandlung
Bisher gibt es keine klar definierten Grenzwerte, ab welcher Dauer des subklinischen Vorhofflimmerns eine Behandlung, insbesondere eine Antikoagulation, indiziert ist. Dies führt zu einer grossen Variation in der Praxis. So konnte in einer Registerstudie in den USA eine grosse Bandbreite an Antikoagulationsraten von 3 bis 67% in verschiedenen Zentren gezeigt werden (20). Solange keine Ergebnisse von randomisierten Studien vorliegen, ist die Entscheidung zur Antikoagulation individuell mit der Abwägung des ischämischen Risikos und des Blutungsrisikos. Wir empfehlen sowohl die Zeitdauer des subklinischen Vorhofflimmerns wie auch den CHA2DS2-VASc Score in die Entscheidung einfliessen zu lassen. Aufgrund der vorliegenden, oben erwähnten Daten von Beobachtungsstudien (8), empfehlen wir eine Antikoagulation bei subklinischem Vorhofflimmern >24 Stunden. Bei Episoden <24 Stunden sollte der CHA2DS2-VASc Score zur weiteren Risikostratifizierung herangezogen werden. Hier ist jedoch zu beachten, dass der Score in dieser Population nicht spezifisch getestet wurde.
Aktuell untersuchen zwei grosse, randomisierte Studien den Nutzen von Antikoagulation gegenüber Aspirin hinsichtlich ischämischen Schlaganfällen in Patienten mit subklinischem, mittels Schrittmacher aufgezeichneten Vorhofflimmern mit einer Dauer >6 Minuten. Die NOAH (Non-Vitamin K Antagonist Oral Anticoagulants in Patients With Atrial High Rate Episodes) Studie vergleicht Edoxaban mit Aspirin und die ARTESiA (Apixaban for the Reduction of Thrombo-Embolism in Patients with Device-Detected Sub-Clinical Atrial Fibrillation) Studie vergleicht Apixaban mit Aspirin. Beide Studien schliessen Patienten mit subklinischem Vorhofflimmern von >6 Minuten (bis maximal 24 Stunden in ARTESiA) und zusätzlichen Risikofaktoren für einen Schlaganfall ein. An der ARTESiA Studie nehmen auch mehrere Spitäler in der Schweiz teil um diese wichtige Forschungsfrage zu beantworten. Die Ergebnisse beider Studien werden in den nächsten 1-2 Jahren erwartet.
Copyright bei Aerzteverlag medinfo AG
Klinik für Kardiologie, Universitätsspital Basel, Cardiovascular Research
Institute Basel, Universitätsspital Basel
Klinik für Kardiologie, Universitätsspital Basel, Cardiovascular Research
Institute Basel, Universitätsspital Basel
Klinik für Innere Medizin, Universitätsspital Basel
Department of Digitalization and ICT Universitätsspital Basel
Petersgraben 4
4031 Basel
jens.eckstein@usb.ch
JE hat 0.5 Virtuelle Anteile an Preventicus (Herstellerin einer AF-Detektions App); die anderen Autoren haben keinen Interessenskonflikt.
- Die Detektion von subklinischem Vorhofflimmern mittels implantierbaren oder mobilen Devices stellt eine Herausforderung und gleichzeitig eine Chance zur frühen Behandlung, insbesondere mit Antikoagulation, dar.
- Jede vom Gerät automatisch als Vorhofflimmern identifizierte Episode sollte durch manuelle Durchsicht bestätigt werden.
- In Abwesenheit von Ergebnissen von randomisierten Studien in dieser Population, sollte die Entscheidung zu einer Antikoagulation von der Dauer der längsten Episode und traditionellen Risikofaktoren abhängig gemacht werden.
- Eine Antikoagulation sollte, bei vertretbarem Blutungsrisiko, sicher bei Episoden >24 Stunden begonnen werden und bei kürzeren Episoden mit einem hohen CHA2DS2-VASc Score erwogen werden.
- Ergebnisse von randomisierten Studien sollten eine Datenbasis für genauere Empfehlungen bereiten und werden in den nächsten 1-2 Jahren erwartet.
Messages à retenir
- La détection de la fibrillation auriculaire subclinique au moyen de dispositifs implantables ou mobiles représente un défi et en même temps une opportunité pour un traitement précoce, en particulier avec l’anticoagulation.
- Chaque épisode automatiquement identifié par l’appareil comme étant une fibrillation auriculaire doit être confirmé par un examen manuel.
- En l’absence de résultats d’études randomisées dans cette population, la décision de recourir à l’anticoagulation devrait être fondée sur la durée de l’épisode le plus long et sur les facteurs de risque traditionnels.
- L’anticoagulation devrait être amorcée de façon sécuritaire lors d’épisodes > 24 heures avec un risque acceptable de saignement et devrait être envisagée pour des épisodes plus courts avec un score CHA2DS2-VASc élevé.
- Les résultats des études randomisées devraient fournir une base de données pour des recommandations plus précises et sont attendus dans les 1 à 2 prochaines années.
1. Lloyd-Jones DM, Wang TJ, Leip EP, Larson MG, Levy D, Vasan RS, D’Agostino RB, Massaro JM, Beiser A, Wolf PA, Benjamin EJ. Lifetime risk for development of atrial fibrillation: the Framingham Heart Study. Circulation. 2004;110:1042–1046.
2. Krijthe BP, Kunst A, Benjamin EJ, Lip GYH, Franco OH, Hofman A, Witteman JCM, Stricker BH, Heeringa J. Projections on the number of individuals with atrial fibrillation in the European Union, from 2000 to 2060. Eur Heart J. 2013;34:2746–2751.
3. Conen D, Chae CU, Glynn RJ, Tedrow UB, Everett BM, Buring JE, Albert CM. Risk of death and cardiovascular events in initially healthy women with new-onset atrial fibrillation. JAMA. 2011;305:2080–2087.
4. Conen D, Rodondi N, Müller A, Beer JH, Ammann P, Moschovitis G, Auricchio A, Hayoz D, Kobza R, Shah D, Novak J, Schläpfer J, Di Valentino M, Aeschbacher S, Blum S, Meyre P, Sticherling C, Bonati LH, Ehret G, Moutzouri E, Fischer U, Monsch AU, Stippich C, Wuerfel J, Sinnecker T, Coslovsky M, Schwenkglenks M, Kühne M, Osswald S, Swiss-AF Study Investigators. Relationships of Overt and Silent Brain Lesions With Cognitive Function in Patients With Atrial Fibrillation. J Am Coll Cardiol. 2019;73:989–999.
5. Brasier N, Raichle CJ, Dörr M, Becke A, Nohturfft V, Weber S, Bulacher F, Salomon L, Noah T, Birkemeyer R, Eckstein J. Detection of atrial fibrillation with a smartphone camera: first prospective, international, two-centre, clinical validation study (DETECT AF PRO). Europace. 2019;21:41–47.
6. Dörr M, Nohturfft V, Brasier N, Bosshard E, Djurdjevic A, Gross S, Raichle CJ, Rhinisperger M, Stöckli R, Eckstein J. The WATCH AF Trial: SmartWATCHes for Detection of Atrial Fibrillation. JACC Clin Electrophysiol. 2019;5:199–208.
7. Kirchhof P, Benussi S, Kotecha D, Ahlsson A, Atar D, Casadei B, Castella M, Diener H-C, Heidbuchel H, Hendriks J, Hindricks G, Manolis AS, Oldgren J, Popescu BA, Schotten U, Van Putte B, Vardas P, Agewall S, Camm J, Esquivias GB, Budts W, Carerj S, Casselman F, Coca A, De Caterina R, Deftereos S, Dobrev D, Ferro JM, Filippatos G, Fitzsimons D, Gorenek B, Guenoun M, Hohnloser SH, Kolh P, Lip GYH, Manolis A, McMurray J, Ponikowski P, Rosenhek R, Ruschitzka F, Savelieva I, Sharma S, Suwalski P, Tamargo JL, Taylor CJ, Van Gelder IC, Voors AA, Windecker S, Zamorano JL, Zeppenfeld K, Zamorano JL, Aboyans V, Achenbach S, Agewall S, Badimon L, Barón-Esquivias G, Baumgartner H, Bax JJ, Bueno H, Carerj S, Dean V, Erol Ç, Fitzsimons D, Gaemperli O, Kirchhof P, Kolh P, Lancellotti P, Lip GYH, Nihoyannopoulos P, Piepoli MF, Ponikowski P, Roffi M, Torbicki A, Vaz Carneiro A, Windecker S, Hayrapetyan HG, Roithinger FX, Aliyev F, Chasnoits A, Mairesse GH, Matičević DL, Shalganov T, Skorić B, Antoniades L, Taborsky M, Pehrson S, Khaled S, Kampus P, Hedman A, Poposka L, Le Heuzey J-Y, Estadashvili K, Bänsch D, Csanádi Z, Keane D, Beinart R, Romeo F, Koshumbayeva K, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J. 2016;37:2893–2962.
8. Healey JS, Alings M, Ha A, Leong-Sit P, Birnie DH, de Graaf JJ, Freericks M, Verma A, Wang J, Leong D, Dokainish H, Philippon F, Barake W, McIntyre WF, Simek K, Hill MD, Mehta SR, Carlson M, Smeele F, Pandey AS, Connolly SJ, ASSERT-II Investigators. Subclinical Atrial Fibrillation in Older Patients. Circulation. 2017;136:1276–1283.
9. Glotzer TV, Hellkamp AS, Zimmerman J, Sweeney MO, Yee R, Marinchak R, Cook J, Paraschos A, Love J, Radoslovich G, Lee KL, Lamas GA, MOST Investigators. Atrial high rate episodes detected by pacemaker diagnostics predict death and stroke: report of the Atrial Diagnostics Ancillary Study of the MOde Selection Trial (MOST). Circulation. 2003;107:1614–1619.
10. Glotzer TV, Daoud EG, Wyse DG, Singer DE, Ezekowitz MD, Hilker C, Miller C, Qi D, Ziegler PD. The relationship between daily atrial tachyarrhythmia burden from implantable device diagnostics and stroke risk: the TRENDS study. Circ Arrhythm Electrophysiol. 2009;2:474–480.
11. Tse HF, Lau CP. Prevalence and clinical implications of atrial fibrillation episodes detected by pacemaker in patients with sick sinus syndrome. Heart Br Card Soc. 2005;91:362–364.
12. Mittal S, Stein K, Gilliam FR, Kraus SM, Meyer TE, Christman SA. Frequency, duration, and predictors of newly-diagnosed atrial fibrillation following dual-chamber pacemaker implantation in patients without a previous history of atrial fibrillation. Am J Cardiol. 2008;102:450–453.
13. Benezet-Mazuecos J, Rubio JM, Cortés M, Iglesias JA, Calle S, de la Vieja JJ, Quiñones MA, Sanchez-Borque P, de la Cruz E, Espejo A, Farré J. Silent ischaemic brain lesions related to atrial high rate episodes in patients with cardiac implantable electronic devices. Europace. 2015;17:364–369.
14. Perez MV, Mahaffey KW, Hedlin H, Rumsfeld JS, Garcia A, Ferris T, Balasubramanian V, Russo AM, Rajmane A, Cheung L, Hung G, Lee J, Kowey P, Talati N, Nag D, Gummidipundi SE, Beatty A, Hills MT, Desai S, Granger CB, Desai M, Turakhia MP. Large-Scale Assessment of a Smartwatch to Identify Atrial Fibrillation. N Engl J Med. 2019;381:1909–1917.
15. Mahajan R, Perera T, Elliott A, Twomey D, Kumar S, Munwar D, Khokhar K, Thiyagarajah A, Middeldorp M, Nalliah C, Hendriks J, Kalman J, Lau D, Sanders P. Subclinical device-detected atrial fibrillation and stroke risk: a systematic review and meta-analysis. Eur Heart J. 2018;39:1407–1415.
16. Swiryn S, Orlov MV, Benditt DG, DiMarco JP, Lloyd-Jones DM, Karst E, Qu F, Slawsky MT, Turkel M, Waldo AL, RATE Registry Investigators. Clinical Implications of Brief Device-Detected Atrial Tachyarrhythmias in a Cardiac Rhythm Management Device Population: Results from the Registry of Atrial Tachycardia and Atrial Fibrillation Episodes. Circulation. 2016;134:1130–1140.
17. Van Gelder IC, Healey JS, Crijns HJGM, Wang J, Hohnloser SH, Gold MR, Capucci A, Lau C-P, Morillo CA, Hobbelt AH, Rienstra M, Connolly SJ. Duration of device-detected subclinical atrial fibrillation and occurrence of stroke in ASSERT. Eur Heart J. 2017;38:1339–1344.
18 Brambatti M, Connolly SJ, Gold MR, Morillo CA, Capucci A, Muto C, Lau CP, Van Gelder IC, Hohnloser SH, Carlson M, Fain E, Nakamya J, Mairesse GH, Halytska M, Deng WQ, Israel CW, Healey JS, ASSERT Investigators. Temporal relationship between subclinical atrial fibrillation and embolic events. Circulation. 2014;129:2094–2099.
19. Wong JA, Conen D, Van Gelder IC, McIntyre WF, Crijns HJ, Wang J, Gold MR, Hohnloser SH, Lau CP, Capucci A, Botto G, Grönefeld G, Israel CW, Connolly SJ, Healey JS. Progression of Device-Detected Subclinical Atrial Fibrillation and the Risk of Heart Failure. J Am Coll Cardiol. 2018;71:2603–2611.
20. Perino AC, Fan J, Askari M, Heidenreich PA, Keung E, Raitt MH, Piccini JP, Ziegler PD, Turakhia MP. Practice Variation in Anticoagulation Prescription and Outcomes After Device-Detected Atrial Fibrillation. Circulation. 2019;139:2502–2512.
info@herz+gefäss
- Vol. 10
- Ausgabe 2
- April 2020