- Erhöhte Harnsäure – wirklich nur Gicht oder mehr?
Hyperurikämie geht mit vermehrter koronarer Herzkrankheit, zerebrovaskulären Ereignissen und Gesamtmortalität sowie mit renalen Problemen einher. In diesem ersten Teil wird über Hyperurikämie und kardiovaskuläre Probleme berichtet, ein zweiter Teil wird sich den renalen Aspekten widmen.
L’ hyperuricémie est associée à une augmentation des maladies coronariennes, des événements cérébrovasculaires et de la mortalité toutes causes confondues, ainsi qu’à des problèmes rénaux. Dans cette première partie, l’hyperuricémie et les problèmes cardiovasculaires sont rapportés, une seconde partie traitera des aspects rénaux.
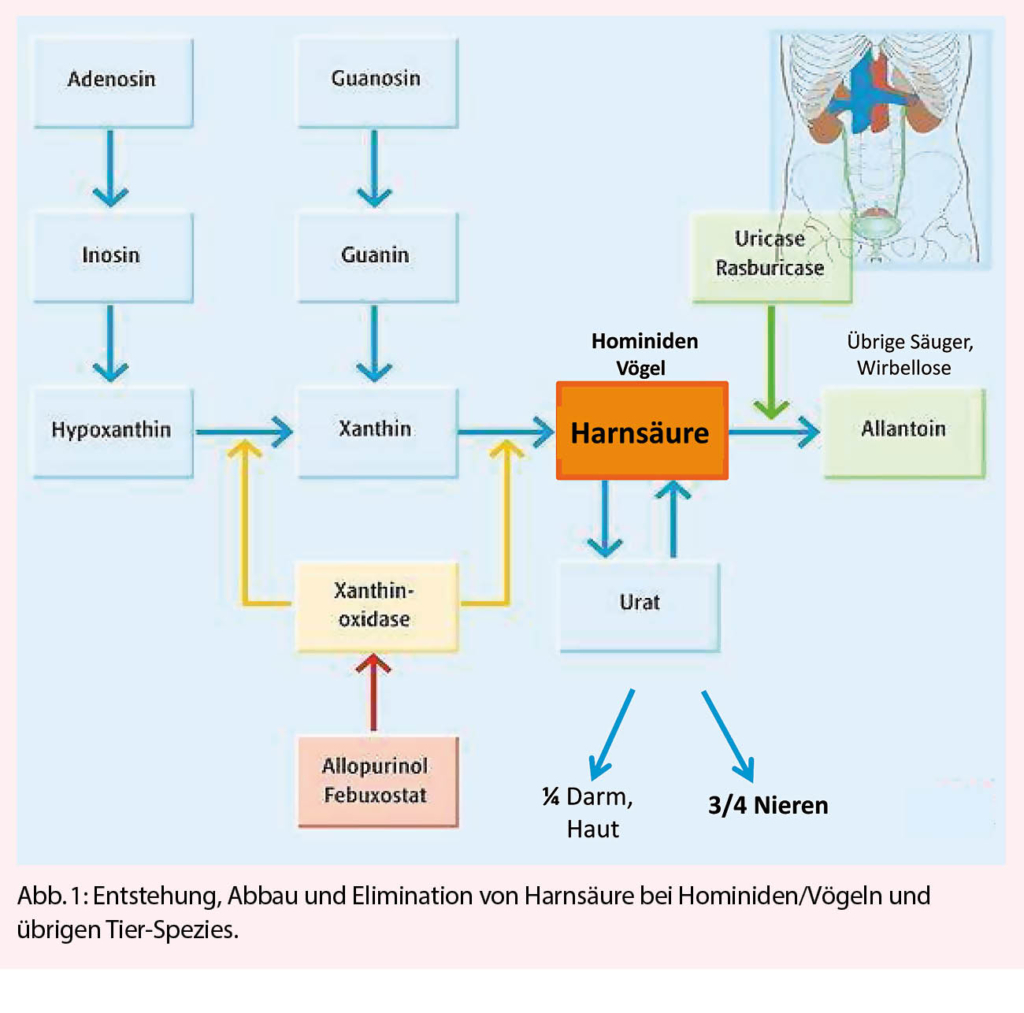
Die Serumharnsäure entsteht beim Abbau von Purinnukleotiden. Bei vielen Lebewesen baut Uricase (Uratoxidase) die Harnsäure zu Allantoin ab, wie in Abb. 1 gezeigt. Menschen, Menschenaffen und Vögel haben dieses Enzym nicht, und so hängt der Serumharnsäurespiegel allein von der Harnsäureproduktion und -ausscheidung ab (1). Die Hyperurikaemie, definiert als Serumharnsäure > 360 μmol/l bei Frauen und > 415 μmo/l bei Männern (2), wird im Praxisalltag im Zusammenhang mit Gicht («Zipperlein», Podagra) als Kristallarthropathie gesehen. Die Behandlung einer asymptomatischen Hyperurikaemie (ohne Gicht) wird in der Regel nicht empfohlen (3). Bei Patienten mit Gicht wird gemäss den EULAR-Guidelines von 2016 eine harnsäuresenkende Therapie auf einen Serumharnsäure-Zielwert unter 360 µmol/l angestrebt (4). Ein Wert unter 300 µmol/l wird bei Patienten mit Gichttophi, chronischer Gichtarthropathie und häufigen Gichtattacken empfohlen, um einen rascheren Abbau, d.h. eine Auflösung der Gichtkristalle zu erzielen (4).
Im Folgenden sollen die Effekte einer erhöhten Harnsäure und deren allfällige Behandlung auf das kardiovaskuläre System und die Nieren näher beleuchtet werden.
Pathophysiologie – das oxidativ-antioxidative Paradox
Ein Problem ist, dass Harnsäure sowohl prooxidativ als auch stark antioxidativ wirken kann, was als «oxidant-antioxidant paradox» bezeichnet wurde (2). Vermittelt wird die vor allem extrazellulär vorhandene antioxidative Wirkung durch Reaktion von Harnsäure mit Superoxid und Bildung von Allantoin (5). Hingegen entstehen offensichtlich mehrheitlich intrazellulär durch Bildung von Radikalen vermehrt schädigende oxidative Effekte (5-7). Folgende Mechanismen von harnsäurebedingten kardiorenalen oxidativen Schädigungen werden diskutiert (1, 2, 8, 9):
- oxidativer Stress mit Induktion einer endothelialen Dysfunktion und vermehrter Vasokonstriktion
- renal: direkte präglomeruläre Vasokonstriktion oder Induktion inflammatorischer tubulointerstitieller Schäden mit Aktivierung des Renin-Angiotensin-Systems
- intrazellulärer proinflammatorischer Effekt
- vermehrte Produktion freier Radikale mit Anstieg der Lipidperoxidation in Gefässwänden
In einem Frühstadium (bei jungen Patienten) können diese Schäden allenfalls durch Senkung der Harnsäurespiegel noch behoben werden, während sie nach längerer Zeit ohne Therapie (bei älteren Patienten) zu irreversiblem Verlust der Gefässcompliance und tubulointerstitiellen Nierenschäden führen (9).
Hyperurikaemie und kardiovaskuläre Krankheiten
Arterielle Hypertonie
Epidemiologie
Je nach Hypertonie-Schweregrad haben 25-75% der Erwachsenen mit unbehandeltem Bluthochdruck eine Hyperurikaemie (2). Eine systematische Meta-Analyse von 18 prospektiven Kohortenstudien mit 55 607 Probanden wies nach, dass ein Anstieg der Serumharnsäure um 60 μmol/l das Risiko für das Neuauftreten einer Hypertonie um 13% erhöht, wobei das Risiko bei Frauen und jungen Erwachsenen noch höher ist (10). Bei Kindern hatten 89% der essentiellen Hypertoniker eine Serumharnsäure > 330 μmol/l, bei jenen mit «Weisskittelhypertonie» 0% (11). Unter mehr als 6 000 Adoleszenten in den USA hatten 34% Serumharnsäurewerte > 330 μmol/l, was mit einem 2fach erhöhten Hypertonie-Risiko einherging (12).
Klinische Daten
Randomisierte Studien zur Harnsäuresenkung bei Hypertonikern sind rar. Die Verabreichung von Placebo, Allopurinol oder Probencid bei 60 adipösen Adoleszenten mit Grenzwerthypertonie und Serumharnsäure > 300 μmol/l führte unter beiden Harnsäuresenkenden Therapien zu einer systolischen Blutdruckreduktion um 10 mmHg, unter Placebo zu einem Anstieg um 2 mmHg (8). Bei 80 Erwachsenen > 65 Jahren nach Hirnschlag oder TIA führte die Behandlung mit 300 mg Allopurinol über 1 Jahr im Vergleich zu Placebo zu einer signifikanten systolischen Blutdruckreduktion um 6.6 mmHg und einer verlangsamten Progression der Karotis-Intima-Media-Dicke (13). Bei asymptomatischen Hyperurikaemikern (> 415 μmol/l) bewirkten 300 mg Allopurinol pro Tag im Vergleich zu Placebo eine Reduktion des systolischen Blutdrucks um 11 mmHg und eine verbesserte Endothelfunktion (14). In zwei weiteren Placebokontrollierten Studien an 149 normotensiven Probanden mit mässig erhöhter Serumharnsäure (360-480 mmol/l) hingegen waren diese Effekte nicht nachweisbar (15, 16).
Koronare Herzkrankheit
Es existieren keine prospektiv randomisierten Interventionsstudien zum Einfluss einer Hyperurikaemie auf die akute koronare Herzkrankheit. Basierend auf Daten der grossen Health Professional Study-Kohorte analysierten Choi und Curhan (17) bei 52 000 Männern prospektiv den Zusammenhang zwischen Gicht und dem Risiko für Tod, kardiovaskulären Tod oder Tod nach Herzinfarkt. Dabei war das Risiko für alle drei Endpunkte bei Männern mit Gicht im Vergleich zu jenen ohne Gicht um 28 bis 55% erhöht, und das Risiko für nicht-tödlichen Myokardinfarkt war 59% höher (17). Zwei grosse Meta-Analysen von Kohortenstudien bei 402 997 (18) resp. 341 389 (19) Erwachsenen fanden bei Hyperurikaemie nach multivariater Korrektur für diverse Einflussfaktoren ein leicht erhöhtes Risiko von 9% für Neuauftreten einer koronaren Herzkrankheit (18), von 14% (19) resp. 16% (18) für koronare Mortalität und von 20% für Gesamtmortalität (19). Bei einem Anstieg der Serumharnsäure um 60 μmol/l resultierte ein multivariat korrigierter Risikoanstieg von 20% für koronare Herzkrankheit (19) und von 12% für koronaren Tod (18).
Cerebrovaskulärer Insult
Auch hier existieren keine prospektiv randomisierten Interventionsstudien. Zwei grosse Meta-Analysen prospektiver Kohortenstudien mit 238 449 (20) resp. 1 042 358 Erwachsenen (21) wiesen bei Hyperurikaemie ein 47% (20) resp. 22% (21) erhöhtes Risiko für ein akutes cerebrovaskuläres Ereignis und eine 33% (20) resp. 26% höhere Hirnschlagmortalität (21) nach. Eine neuere Meta-Analyse von 21 Studien an 1 100 888 Erwachsenen (22) bestätigte diesen Zusammenhang. Hingegen war der Effekt der Serumharnsäure auf den funktionellen Outcome nach ischaemischem Hirnschlag nicht eindeutig: in Abhängigkeit der Serumkonzentration konnte Harnsäure protektive oder schädigende Effekte hervorrufen (22), und es wurde auch eine U-förmige non-lineare Beziehung zwischen Serumharnsäure und Outcome nach ischaemischem Insult beschrieben (23).
Kardiovaskuläre Mortalität
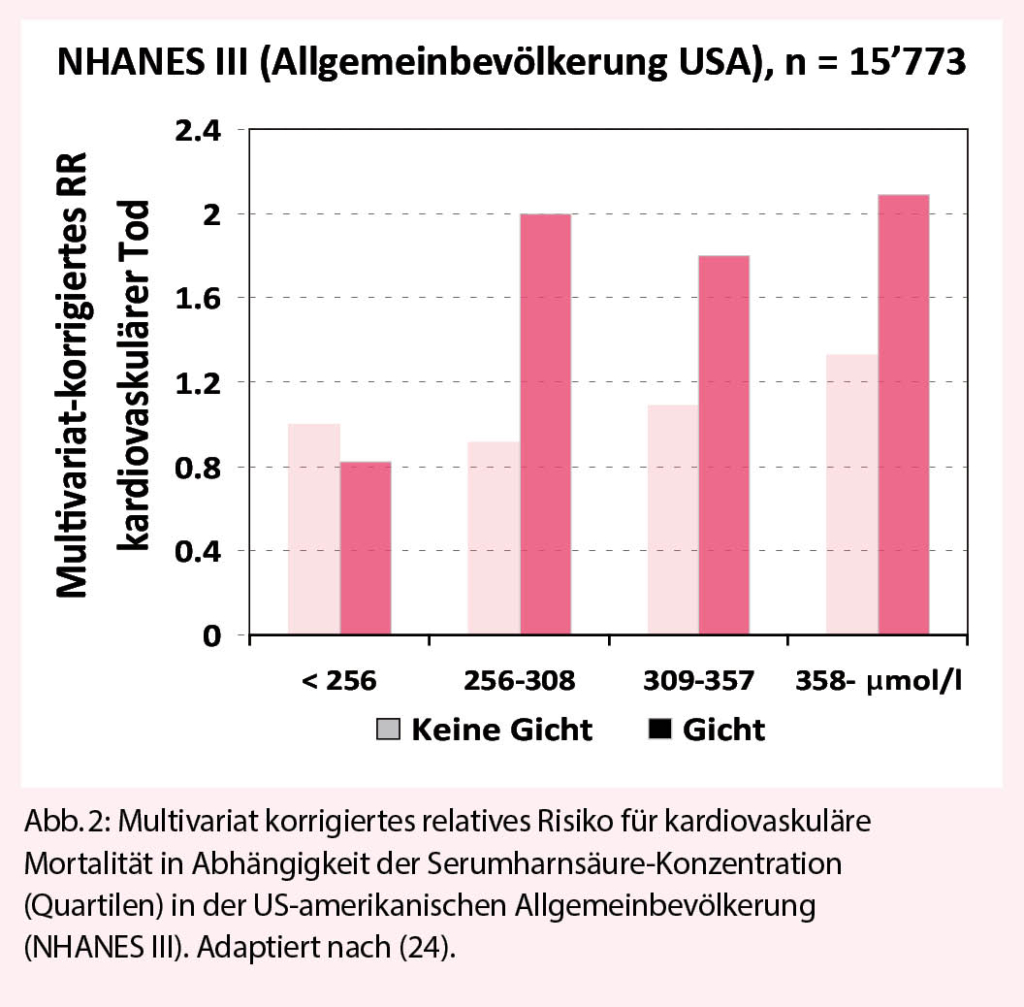
Prospektiv randomisierte Daten existieren nicht. Hingegen haben Stack et al. (24) anhand der Daten von 15 773 Teilnehmern des Third National Health and Nutrition Survey (NHANES III) in den USA gezeigt, dass die kardiovaskuläre und die Gesamtmortalität mit zunehmend höheren Harnsäurespiegeln (Quartilen) ansteigt, wobei der Effekt bei Patienten mit klinischer Gicht deutlich ausgeprägter ist als bei jenen ohne Gicht, wie in Abb. 2 für die kardiovaskuläre Mortalität abgebildet.
Kardiovaskuläre Risikofaktoren: Diabetes mellitus und Metabolisches Syndrom
Randomisierte Daten von Interventionsstudien am Menschen existieren nicht. Eine prospektive Studie bei jungen Erwachsenen zeigte aber, dass eine Serumharnsäure > 416 μmol/l das multivariat korrigierte Risiko für Insulinresistenz um 36%, für Prädiabetes um 25% und für Diabetes um 87% erhöht (25). Die Mechanismen der Harnsäure-induzierten Insulinresistenz und Entwicklung eines Diabetes mellitus sind tierexperimentell sehr gut untersucht und beinhalten u.a. oxidativen Stress in Hepatozyten und weissen Adipozyten sowie Hyalinose und Makrophageninfiltration in Pankreasinselzellen (26).
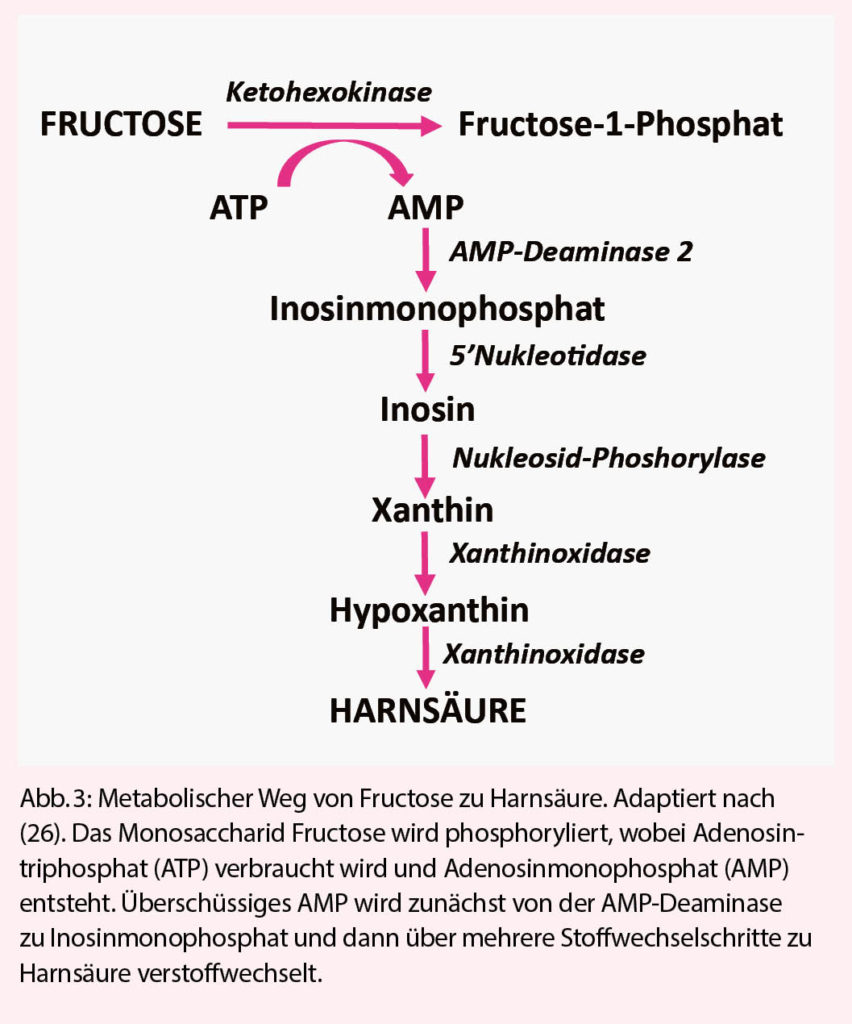
Eine wichtige Rolle in der Vermittlung des Harnsäureeffekts auf Insulinresistenz und metabolisches Syndrom kommt der vermehrt konsumierten (15% aller Kalorien bei Adoleszenten!) Fruktose zu (26). Der intrazelluläre Abbau von Fruktose in der Leber unterscheidet sich von jenem anderer Kohlenhydrate und führt durch Stimulation der Adenosin-Monophosphat-Deaminase 2 über verschiedene Stoffwechselschritte zur Harnsäure (Abb. 3). Tierexperimentelle Studien zeigen, dass der harnsäurebedingte oxidative Stress für metabolische Veränderungen wie Hyperglykaemie, Dyslipidaemie, nicht-alkoholische Fettleber und metabolisches Syndrom verantwortlich ist (9). In humanen klinischen Studien begünstigt denn auch ein hoher Fruktosekonsum den Anstieg der Serumharnsäure und induziert ein Metabolisches Syndrom (zitiert in 27).
Copyright bei Aerzteverlag medinfo AG
Innere Medizin & Nephrologie/Hypertonie
NierensteinZentrumZürich
Klinik Im Park
Bellariastrasse 38
8038 Zürich
bernhard.hess@hirslanden.ch
Der Autor hat deklariert, keine Interessenskonflikte in Zusammenhang mit diesem Artikel zu haben.
◆ Oxidativ-antioxidatives Paradox: Harnsäure wirkt je nach Höhe des Serumharnsäurespiegels und dem Wirkungsort (extra- vs. intrazellulär) sowohl oxidativ als auch antioxidativ.
◆ Die Behandlung einer Hyperurikaemie bei Hypertonikern zeigt in kleinen randomisierten Studien eine blutdrucksenkende Wirkung, was vor allem für Adoleszente und weniger für ältere Erwachsene gilt.
◆ In grossen Meta-Analysen ist die Hyperurikaemie mit vermehrter koronarer Herzkrankheit, cerebrovaskulären Ereignissen und kardiovaskulärer sowie Gesamtmortalität assoziiert. Kontrollierte Interventions-
studien existieren nicht
Messages à retenir
◆ Le paradoxe oxydatif-antioxydatif : l’ acide urique a des effets à la fois oxydatifs et antioxydatifs selon le niveau d’acide urique sérique et le site d’ action (extra- ou intracellulaire).
◆ Le traitement de l’ hyperuricémie chez les patients hypertendus montre des effets antihypertenseurs dans de petites études randomisées, surtout chez les adolescents et moins chez les adultes plus âgés.
◆ Dans de grandes méta-analyses, l’hyperuricémie est associée à une augmentation des maladies coronariennes, des événements cérébrovasculaires et de la mortalité cardiovasculaire et toutes causes confondues. Il n’ existe pas d’études d’intervention contrôlées.
1. Oluwo O, Scialla J (2021). Uric acid and CKD progression matures with lessons for CKD risk factor discovery. Clin J Am Soc Nephrol 16: 476-478.
2. Stewart DJ, Langlois V, Noone D (2019). Hyperuricemia and hypertension: links and risks. Integr Blood Press Control 12: 43-62.
3. Li Q, Li X, Wang J et al. (2019). Diagnosis and treatment for hyperuricemia and gout: a systematic review of clinical practice guidelines and consensus state-ments. BMJ Open 9: 9(8):e026677. doi: 10.1136/bmjopen-2018-026677.
4. Richette P, Doherty M, Pascual E et al. (2017). 2016 updated EULAR evidence-based recommendations for the management of gout. Ann Rheum Dis 76: 29-42.
5. Johnson RJ, Bakris GL, Borghi C et al. (2018). Hyperuricemia, acute and chronic kidney disease, hypertension, and cardiovascular disease: report of a scientific workshop organized by the National Kidney Foundation. Am J Kidyney Dis 71: 851-865.
6. Wang H, Zhang H, Sun L, Guo W (2018). Roles of hyperuricemia in metabolic syndrome and cardiac-kidney-vascular system diseases. Am J Transl Res 10: 2749-2763.
7. Battelli MG, Bortolotti M, Polito L, Bolognesi A (2018). The role of xanthine oxi-doredcutase and uric acid in metabolic syndrome. BBA – Molecular basis of dis-ease 1864: 2557-2565.
8. Soletsky B, Feig DI (2012). Uric acid reduction rectifies prehypertension in obese adolescents. Hypertension 60: 1148-1156.
9. Feig DI (2020). Urate-lowering therapy and chronic kidney disease progression (editorial). N Engl J Med 382: 2567-2568.
10. Grayson PC, Kim SY, LaValley M, Choi HK (2011). Hyperuricemia and incident hypertension: a systematic review and meta-analysis. Arthitis Care res 63: 102-110.
11. Feig DI, Johnson RJ. (2003): Hyperuricemia in childhood primary hypertension. Hypertension 42: 247-252.
12. Loeffler LF, Navas-Acien A, Brady TM, Miller ER, Fadrowski JJ (2012). Uric acid level and elevated blood pressure in US Adolescents: National Health and Nutri-tion Examination Survey, 1999-2006. Hypertension 59: 811-817.
13. Higgins P, Walter MR, Murray HM, McArthur K, McConnachie A, Lees KR, Daw-son J (2014). Allopurinol reduces brachial and central blood pressure, and carotid intima-media thickness progression after ischaemic stroke and transient ischaemic attack: a randomised controlled trial. Heart 100: 1085-1092.
14. Kanbay M, Huddam B, Azak A et al. (2011). A randomized study of allopurinol on endothelial function and estimated glomerular filtration rate in asymptomatic hyperuricemic subjects with normal renal function. Clin J Am Soc Nephrol 6: 1887-1894.
15. McMullan CJ, Borgi L, Fisher N, Curhan GC, Forman J (2017). Effect of uric acid lowering on renin-angiotensin-system activation and ambulatory BP: a randomi-zed controlled trial. Clin J Am Soc Nephrol 8: 807-816.
16. Borgi L, McMullan C, Wohlhueter A, Curhan GC, Fisher ND, Forman JP (2017) Effect of uric acid-lowering agents on endothelial function: a randomized, double-blind placebo-controlled trial. Hypertension 69: 243-248.
17. Choi HK, Curhan G. Independent impact of gout on mortality and risk for coronary heart disease. Circulation 116: 894-900, 2007.
18. Kim SY, Guevara JP, Kim KM, Choi HK, Heitjan DF, Albert DA (2010). Hyperuri-cemia and coronary heart disease: a systematic review and meta-analysis. Arthri-tis Care Res 62: 170-180.
19. Zuo T, Liu X, Jiang L, Mao S, Yin X, Guo L (2016). Hyperuricemia and coronary heart disease mortality: a meta-analysis of prospective cohort studies. BMC Car-diovasc. Disord. 16: 207 DOI 10.1186/s12872-016-0379-z
20. Kim SY, Guevara JP, Kim KM, Choi HK, Heitjan DF, Albert DA (2009). Hyperuri-cemia and risk of stroke: a systematic review and meta-analysis. Arthritis Rheum 61: 885-892.
21. Li M, Hou W, Zhang X, Hu L, Tang Z (2014). Hyperuricemia and risk of stroke: a systematic review and meta-analysis of prospective studies. Atherosclerosis 232: 265-279.
22. Tariq MA, Shamim S, Rana KF, Saeed A, Malik BH (2019). Serum uric acid – risk factor for stroke and poor outcomes. Cureus 11(10): e6007.doi: 10.7759/cureus. 6007
23. Yang Y, Zhang Y, Li Y, Ding L, Sheng L, Xie Z, Wen C (2018) U-shaped relation-ship between functional outcome and serum uric acid in ischemic stroke. Cell Physiol Biochem. 47: 2369–2379.
24. Stack AG, Hanley A, Casserly LF et al. (2013). Independent and conjoint associa-tions of gout and hyperuricemia with total and cardiovascular mortality. Q J Med 106: 647-658.
25. Krishnan E, Pandya BJ, Chung L, Hariri A, Dabbous O (2012). Hyperuricemia in young adults and risk of insulin resistance, prediabetes and diabetes: a 15-year follow-up study. Am J Epidemiol 176: 108-116.
26. Johnson RJ, Nakagawa T, Sanchez-Lozada LG et al. (2013). Sugar, uric acid, and the etiology of diabetes mellitus and obesity. Diabetes 62: 3307-3315.
27. Kanbay M, Jensen T, Solak Y et al. (2016). Uric acid in metabolic syndrome: from an innocent bystander to a central player. Eur J Intern Med 29: 3-8.
info@herz+gefäss
- Vol. 11
- Ausgabe 3
- Mai 2021