- Indikationen für offen chirurgische oder endovaskulär perkutane Therapie
Ein Bauchaortenaneurysma (Abdominales Aortenaneurysma, AAA) macht in der Regel keine Symptome und wird meist zu-fällig entdeckt. Die Gefahr geht von der Aneurysmaruptur aus, deren Wahrscheinlichkeit mit steigendem Aneurysmadurchmesser zunimmt. Zur Behandlung stehen der offen-chirurgische Graftersatz und die endovaskuläre Ausschaltung durch eine gestentete Endoprothese zur Verfügung. Viele verschiedene Faktoren wie das Alter, die Komorbiditäten, die Anatomie des Aneurysmas sowie der Leisten- und Beckenarterien des Patienten entscheiden, welches Verfahren geeignet ist.
Un anévrisme aortique abdominal ne provoque en règle générale aucun symptôme et est généralement découvert par hasard. Le danger est causé par une rupture d’ anévrisme dont la probabilité augmente avec le diamètre de l’ anévrisme. Les options de traitement comprennent le remplacement par greffe chirurgicale ouverte et l’ élimination endovasculaire au moyen d’ une endoprothèse sur stent. De nombreux facteurs différents tels que l’ âge, les comorbidités, l’ anatomie de l’ anévrisme et les artères inguinales et pelviennes du patient déterminent la procédure appropriée.
Definitionen
Eine Wandschwäche im Bereich des abdominellen Abschnitts der Aorta kann dazu führen, dass sich das Gefäss aufgrund des Innendrucks in diesem Bereich ausweitet. So kann ein Abdominales Aortenaneurysma (AAA) entstehen. Ein AAA besteht bei einem abdominellen Aortendurchmesser von 30 mm oder grösser, sonografisch gemessen in der anteroposterioren oder der transversalen Ebene. Computertomographisch erfasst man den maximalen Durchmesser korrekt anhand einer multiplanaren Rekonstruktion. Am häufigsten sind sog. wahre Aneurysmen mit Aussackung aller Wandschichten. Seltener sind Post-Dissektionsaneurysmen, die als Folge einer vorherigen Aortendissektion auftreten können. Ein AAA wird hinsichtlich seiner Lage in Relation zu den Nierenarterienabgängen eingeteilt, was entscheidend für die Komplexität der chirurgischen Versorgung ist (1). Ein infrarenales Aortenaneurysma ist definiert durch das Vorhandensein einer normalkalibrigen Aorta zwischen dem Abgang der Nierenarterien und dem Beginn des Aneurysmas. Von einem juxtarenalen AAA wird gesprochen, wenn sich das Aneurysma bis zu den Nierenarterienabgängen ausdehnt. Ein suprarenales Aortenaneursyma schliesst die Abgänge der Nierenarterien mit ein und dehnt sich oberhalb des Nierenarterienabgangs bis zur Basis der A. mesenterica superior aus.
Die Hauptgefahr eines AAA geht von der Ruptur aus, deren 30-Tage Mortalität bei über 70 % liegt, insbesondere, weil etwa ein Drittel der Patienten vor dem Eintreffen im Spital verstirbt (2). Die Wahrscheinlichkeit einer Ruptur steigt mit dem Diameter des AAA an. Liegt das jährliche Rupturrisiko eines Aortenaneurysmas < 5.0 cm Durchmesser bei 1%, beträgt es bei Aneurysmen von 5.5 – 6.0 cm 3.5%, bei 6.0 – 7.0 cm 4.1% und bei Aneurysmen mit einem Durchmesser über 7.0 cm deutlich über 10% (3).
Neben dem Durchmesser gelten als weitere wesentliche Risikofaktoren für eine Ruptur das weibliche Geschlecht sowie ein aktiver Nikotinkonsum. Ausserdem sind eine exspiratorische Einsekundenkapazität sowie ein hoher Blutdruck mit einer Aneurysmaruptur assoziiert (4).
Risikofaktoren
Auch für die Entwicklung eines AAA können gewisse Risikofaktoren ausgemacht werden: Insbesondere sind dies das Alter, das Rauchen sowie das männliche Geschlecht, wobei das Rauchen der mit Abstand stärkste beeinflussbare Risikofaktor ist (5). Ausserdem zeigen Zwillingsstudien, dass die Vererbung eine grosse Rolle spielt (Wahlgren 2010).
Operationsindikationen für Abdominale Aortenaneurysmen (AAA) (5)
- Fusiforme AAA mit Durchmesser ≥ 5.5 cm bei Männern
- Fusiforme AAA mit Durchmesser ≥ 5.0 cm bei Frauen
- Sakkuläre AAA ggfls. schon bei Durchmessern unter 5.0 cm
- Mykotische AAA
- Symptomatische AAA
- Rupturierte AAA
Allgemein
Aus diversen, auch randomisiert-kontrollierten Studien gilt in den Leitlinien ein AAA-Durchmesser von ≥ 5.5 cm oder ein schnelles Wachstum von > 10 mm/Jahr als Indikation für eine elektive operative Versorgung des AAA (5, 6). Bei Frauen mit akzeptablem perioperativem Risiko kann die Versorgung ab ≥ 5.0 cm erwogen werden.
Diese Grenzwerte gelten für das klassische, fusiforme Aneurysma. Exzentrische oder sakkuläre Aneurysmen, also lokalisierte, asymmetrische Ausweitungen der Aorta, können gegebenenfalls schon bei kleineren Diametern saniert werden, da von einer höheren Rupturgefahr ausgegangen wird (5). Bei polymorbiden Patienten mit deutlich erhöhtem perioperativen Risiko erscheint es nach Risiko-stratifizierung durchaus sinnvoll, das Aneurysma erst bei grösseren Durchmessern zu versorgen (5).
Mykotische AAA
Eine spezielle Gruppe bilden die mykotischen Aneurysmen, bei welchen es durch bakterielle Infektionen der Aortenwand zu Aneurysmabildungen kommt. Diese müssen unabhängig von der Grösse des Aneurysmas chirurgisch saniert werden. Je nach Allgemeinzustand des Patienten sowie der Erfahrung des Behandlungsteams können diese offen-chirurgisch oder auch endovaskulär behandelt werden. Bei der offenen Operation verwendet man bevorzugt einen biologischen Ersatz, etwa eine körpereigene Vene (z.B. V. femoralis), einen Homograft oder einen Graft aus Xenoperikard, um eine dauerhafte antibiotische Suppressionstherapie wie bei der endovaskulären Variante zu vermeiden.
Symptomatische AAA
Typisch sind Rücken- oder Leistenschmerzen. Bauchschmerzen mit einer druckdolenten Aorta bedeuten eine dringliche Operations-indikation, da diese als frühes Zeichen einer Ruptur zu werten sind. Gemäss den Leitlinien sollen diese Patienten zum nächstmöglichen elektiven Operationstermin (5,6) und bevorzugt endovaskulär behandelt werden, sofern die Anatomie dies erlaubt (6).
Weitere Indikationen
Patienten mit rupturiertem Aneurysma müssen notfallmässig in ein Gefässzentrum verlegt und notfallmässig – je nach Anatomie – offen oder endovaskulär versorgt werden.
Eine Therapieindikation besteht ebenfalls bei einem grössenprogredienten Aneurysmasack nach endovaskulärer Versorgung, da es weiterhin zu einer Ruptur kommen kann. Ursächlich hierfür sind Undichtigkeiten (Endoleaks), z. B. in den Überlappungszonen, durch rückblutende, aus dem Aneurysma abgehende Arterien oder Undichtigkeiten des Graftes. Je nach Ursache der Undichtigkeit können endovaskuläre Verfahren zur Anwendung kommen. Kann das Problem endovaskulär nicht gelöst werden, muss bei adäquatem Risikoprofil ein kompletter Graftausbau mit offenem Gefässersatz erfolgen.
Therapiemethoden
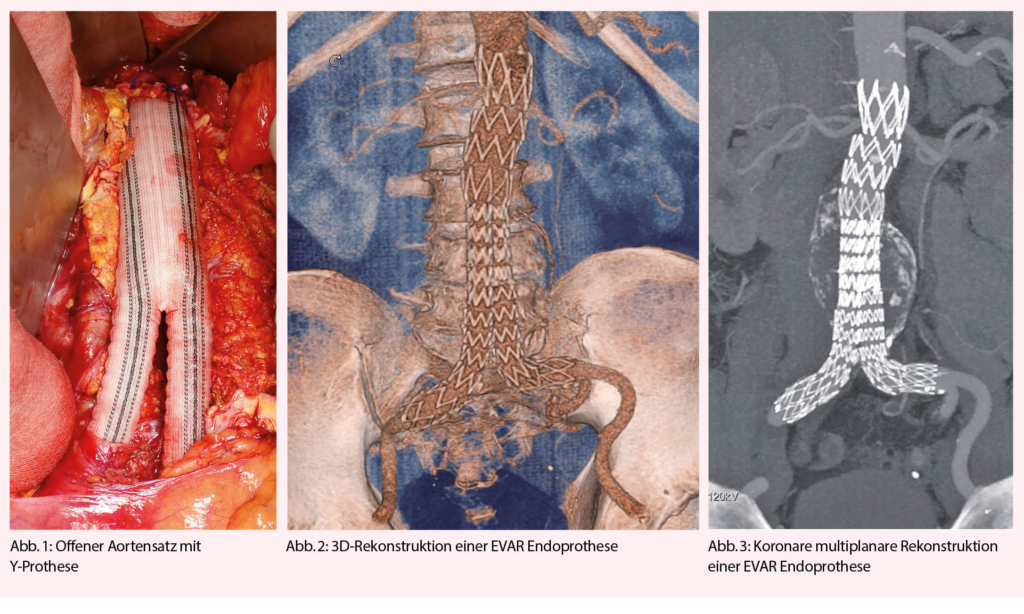
Im Prinzip gibt es zwei operative Methoden, ein Aortenaneurysma auszuschalten und damit den Patienten vor einer Ruptur zu bewahren: Einerseits die klassische offene Operation, bei der über eine Laparotomie (transperitoneal) oder eine Lumbotomie (retroperitoneal) eine Rohr- oder Y-Prothese (Abb. 1) eingenäht wird. Andererseits die minimal-invasive endovaskuläre Variante, bei der über eine Punktion beider Leistengefässe eine Endoprothese (Endo Vascular Aneurysm Repair, EVAR) eingebracht wird (Abb. 2, 3).
Offener Aortenersatz
Die offene Operation zieht einen Spitalaufenthalt von 7-10 Tagen nach sich. Nach dieser Zeit sind die Patienten in der Regel in ausreichend gutem Allgemeinzustand, um nach Hause auszutreten. Eine Rehabilitation ist meist nicht notwendig. Die Spitalmortalität des Eingriffs liegt in Referenzzentren um 1-2% (7). Die offene Sanierung führt zu signifikant weniger Re-Eingriffen an der Aorta gegenüber der endovaskulären Sanierung, gilt diesbezüglich also als beständigere Sanierung (8). Trotzdem kann es auch hier selten zu gefässbedingten Reoperationen, v.a. im Bereich der Anastomosen, kommen. Wegen des offenen Zugangs ist es möglich, dass spätere Narbenhernien oder Darmpassagestörungen wegen Verwachsungen revidiert werden müssen. Die offene Variante ist bei jeder Anatomie möglich, der Patient muss jedoch eine gewisse Grundfitness mitbringen, v.a. was die kardiopulmonalen Komorbiditäten anbelangt. Muss die Aorta oberhalb der Nierenarterien ausgeklemmt werden, steigt das Risiko einer Verschlechterung der Nierenfunktion. Bei Patienten mit genetisch determinierter Bindegewebsschwäche wird in den Leitlinien klar eine offene Aneurysmaausschaltung empfohlen. Wegen der Architekturstörung des aortalen Bindegewebes sind die Landezonen, d.h. die Verankerungszonen der Endoprothese geschwächt. In Folge dichten diese Prothesen im mittel- bis langfristigen Verlauf nicht mehr so gut ab.
Endovaskuläre Aortenreparatur (Endovascular aortic repair, EVAR)
Die endovaskuläre Methode weist eine signifikant geringere Krankenhausverweildauer, Krankenhausmortalität und -morbidität auf (8). Der Eingriff ist allerdings nicht bei allen Patienten geeignet, da gewisse anatomische Voraussetzungen erfüllt sein müssen. Zum einen müssen gute Zugangsgefässe vorhanden sein, da die Endoprothese über die Leisten- und Beckenarterien in die Aorta eingebracht wird. Andererseits muss genügend normalkalibrige Aorta oberhalb des Aneurysmas und unterhalb der Nierenarterien vorhanden sind (Aneurysmahals als proximale Landezone/Verankerungszone), damit die Endoprothese sicher verankert werden kann. In besonderen Fällen können sogenannte gefensterte oder mit Seitenarmen ausgestattete Endoprothesen implantiert werden, um die Landungszone weiter oberhalb der Abgänge von Nieren- und ggfls. Viszeralarterien zu verlängern. Damit nimmt man aber ein gewisses, wenn auch geringes Paraplegierisiko in Kauf. Da jeder Patient eine individuelle Anatomie bezüglich der Abgänge der reno-viszeralen Gefässe aufweist, sind in diesen Fällen massgeschneiderte Prothesen notwendig, um das Aneurysma suffizient auszuschalten. Falls gute Landungszonen unterhalb der Nierenarterien und gute Zugangsgefässe vorhanden sind, kann eine endovaskuläre Aneurysmaausschaltung in Lokalanästhesie über perkutane Zugänge durchgeführt werden. Dieses Vorgehen in Lokalanästhesie belastet den Patienten weniger als eine Vollnarkose. Der Patient kann nach 6 Stunden mobilisiert werden und das Spital nach 1-2 Tagen Überwachung verlassen. Bei der endovaskulären Methode sind im Verlauf jedoch deutlich häufiger Reinterventionen wegen nicht-kompletter Ausschaltung des Aneurysmas (sog. Endoleaks) notwendig. Hier bedarf es lebenslanger regelmässiger Nachkontrollen, worüber der Patient präoperativ aufgeklärt werden muss (8).
Therapiewahl
In den Langzeitresultaten von randomisiert kontrollierten Studien zeigen beide Methoden im Langzeitverlauf eine ähnliche Gesamtmortalität (8,9).
Wenn die endovaskuläre Versorgung anatomisch möglich ist und der Patient bezüglich der Komorbiditäten auch für einen offenen Eingriff geeignet ist, sollte der Patientenwunsch die Therapierichtung vorgeben. Während der eine Patient die Minimalinvasivität der endovaskulären Versorgung schätzt, bevorzugt der andere eine definitivere Sanierung mit weniger häufigen Nachkontrollen und weniger Reoperationen.
Häufiger ist es jedoch so, dass der behandelnde Arzt die eine oder andere Option aufgrund von Komorbiditäten, anatomischen Voraussetzungen oder dem Alter bevorzugt empfiehlt. Diese Entscheidungsfindung braucht gewisse Erfahrung. Patienten mit einem AAA sollten zeitnah einem erfahrenen gefässchirurgischen Zentrum vorgestellt werden, welches die offene wie die endovaskuläre Therapie routinemässig beherrscht. Dort sollte über beide möglichen Verfahren ausführlich aufgeklärt werden. Der Patientenwunsch ist sicherlich hoch zu gewichten, sollte jedoch nicht zu einer Therapie führen, welche für den Patienten mit zu vielen Kompromissen vergesellschaftet ist.
Weiter ist zu erwähnen, dass Patienten, die schwere andere Erkrankungen und eine stark limitierte Lebenserwartung haben, etwa Patienten mit einem metastasierenden Tumorleiden, nicht von einer Sanierung eines asymptomatischen Bauchaortenaneurysmas profitieren. Die Aneurysmaoperation kann bei diesen Patienten zu einem kürzeren Überleben und einer geringeren Lebensqualität führen.
Dr. med. Salome Weiss
Universitätsklinik für Herz- und Gefässchirurgie Inselspital, Universitätsspital Bern, Freiburgstrasse 18, 3010 Bern
Dr. med. Roman Bühlmann
Universitätsklinik für Herz- und Gefässchirurgie Inselspital, Universitätsspital Bern, Freiburgstrasse 18, 3010 Bern
Prof. Dr. med. Jürg Schmidli
Universitätsklinik für Herz- und Gefässchirurgie Inselspital, Universitätsspital Bern, Freiburgstrasse 18, 3010 Bern
PD Dr. med. Thomas R. Wyss
Klinik für Interventionelle Radiologie und Gefässchirurgie Kantonsspital Winterthur, Brauerstrasse 15, 8401 Winterthur
Copyright bei Aerzteverlag medinfo AG
Universitätsklinik für Herz- und Gefässchirurgie
Inselspital
Universitätsspital Bern
Freiburgstrasse 18
3010 Bern
silvan.jungi@insel.ch
Die Autoren haben in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
- Bei einem Bauchaortenaneurysma wird bei einem Durchmesser
von≥ 5.5 cm bei Männern sowie ≥ 5.0 cm bei Frauen eine elektive
Aneurysmaausschaltung empfohlen. - Die Therapie kann offen chirurgisch via Laparotomie / Lumbotomie oder endovaskulär perkutan über die Leisten mittels EVAR erfolgen.
- Beide Therapieoptionen müssen sorgfältig abgewogen werden, wobei die Fitness des Patienten, die Komorbiditäten, die anatomischen Gegebenheiten sowie der Patientenwunsch eine Rolle spielen.
Messages à retenir
- Dans le cas d’ un anévrisme aortique abdominal, l’ ablation élective de l’ anévrisme est recommandée pour un diamètre de ≥ 5,5 cm chez l’ homme et de ≥ 5,0 cm chez la femme.
- La thérapie peut être effectuée par voie chirurgicale ouverte via une laparotomie/lumbotomie ou par voie endovasculaire percutanée via l’ aine en utilisant la technique EVAR.
- Les deux options thérapeutiques doivent être soigneusement étudiées, en tenant compte de l’ aptitude du patient, des comorbidités, des conditions anatomiques et des souhaits du patient.
1. Johnston KW, Rutherford RB, Tilson MD, Shah DM, Hollier L, Stanley JC. Suggested standards for reporting on arterial aneurysms. Subcommittee on Reporting Standards for Arterial Aneurysms, Ad Hoc Committee on Reporting Standards, Society for Vascular Surgery and North American Chapter, International Society for Cardiovascular Surgery. J Vasc Surg [Internet]. 1991;13(3):452–8. Available from: http://www.ncbi.nlm.nih.gov/pubmed/1999868
2. Reimerink JJ, Van Der Laan MJ, Koelemay MJ, Balm R, Legemate DA. Systematic review and meta-analysis of population-based mortality from ruptured abdominal aortic aneurysm. Br J Surg. 2013;100(11):1405–13.
3. Parkinson F, Ferguson S, Lewis P, Williams IM, Twine CP. Rupture rates of untreated large abdominal aortic aneurysms in patients unfit for elective repair. J Vasc Surg. 2015;61(6):1606–12.
4. Brown LC, Powell JT. Risk factors for aneurysm rupture in patients kept under ultrasound surveillance. Ann Surg. 1999;230(3):289–97.
5. Wanhainen A, Verzini F, Van Herzeele I, Allaire E, Bown M, Cohnert T, et al. Editor’ s Choice – European Society for Vascular Surgery (ESVS) 2019 Clinical Practice Guidelines on the Management of Abdominal Aorto-iliac Artery Aneurysms. Eur J Vasc Endovasc Surg [Internet]. 2019;57(1):8–93. Available from: http://dx.doi.org/10.1016/j.ejvs.2018.09.020
6. Debus ES, Heidemann F, Gross-Fengels W, Mahlmann A, Muhl E, Pfister K, et al. S3-Leitlinie zu Screening , Diagnostik , Therapie und Nachsorge des Bauchaortenaneurysmas. AWMF online. 2018;
7. Lederle FA, Freischlag JA, Kyriakides TC, Matsumura JS, Padberg FT, Kohler TR, et al. Long-term comparison of endovascular and open repair of abdominal aortic aneurysm. N Engl J Med. 2012;367(21):1988–97.
8. Patel R, Sweeting MJ, Powell JT, Greenhalgh RM. Endovascular versus open repair of abdominal aortic aneurysm in 15-years’ follow-up of the UK endovascular aneurysm repair trial 1 (EVAR trial 1): a randomised controlled trial. Lancet. 2016;388(10058):2366–74.
9. Stather P, Sidloff D, Dattani N, Choke E, Bown M, Sayers R. Systematic review and meta-analysis of the early and late outcomes of open and endovascular repair of abdominal aortic aneurysm (Br J Surg 2013; 100: 863-872). Br J Surg. 2013;100(11):863–72.
info@herz+gefäss
- Vol. 10
- Ausgabe 3
- Juli 2020