- Kardioprotektion dank Nephroprotektion
Typ 2-Diabetes geht mit erheblichem Risiko für Gefässerkrankungen einher, und Typ 2-Diabetiker sterben zwei- bis viermal häufiger an kardiovaskulären Ereignissen (1). Kardiovaskuläre Erkrankungen sind für 70% der Todesfälle bei Typ 2-Diabetes verantwortlich (2). Die Niere ist in der Regel das erste Endorgan, das durch Diabetes geschädigt wird (3). Dabei spielen zwei in der Praxis einfach zu messende Parameter, welche früh im Krankheitsverlauf erfasst werden sollen, eine prognostisch entscheidende Rolle: Mikroalbumin und Serum-Kreatinin.
Le diabète de type 2 est associé à un risque important de maladie vasculaire et les diabétiques de type 2 meurent deux à quatre fois plus souvent d’événements cardiovasculaires (1). Les maladies cardiovasculaires représentent 70 % des décès dus au diabète de type 2 (2). Le rein est habituellement le premier organe terminal endommagé par le diabète (3). Deux paramètres, faciles à mesurer dans la pratique et qui doivent être enregistrés tôt dans l’évolution de la maladie, jouent un rôle déterminant dans le pronostic : la microalbumine et la créatinine sérique.
Die Mikroalbuminurie (MAU) ist bei Typ 2-Diabetikern primär ein Marker des ubiquitären Endothelschadens, so wie auch bei nicht-diabetischen kardiovaskulären Patienten (4). «Harte» kardiovaskuläre Endpunkte wie Gesamtmortaliät, kardiovaskuläre Mortalität, Myokardinfarkt und Hirnschlag nehmen bei progredient ansteigender MAU kontinuierlich zu (5). Bei Typ 2-Diabetes ist die MAU zudem eng mit den Komponenten des bei Typ 2-Diabetikern häufigen metabolischen Syndroms assoziiert (6).
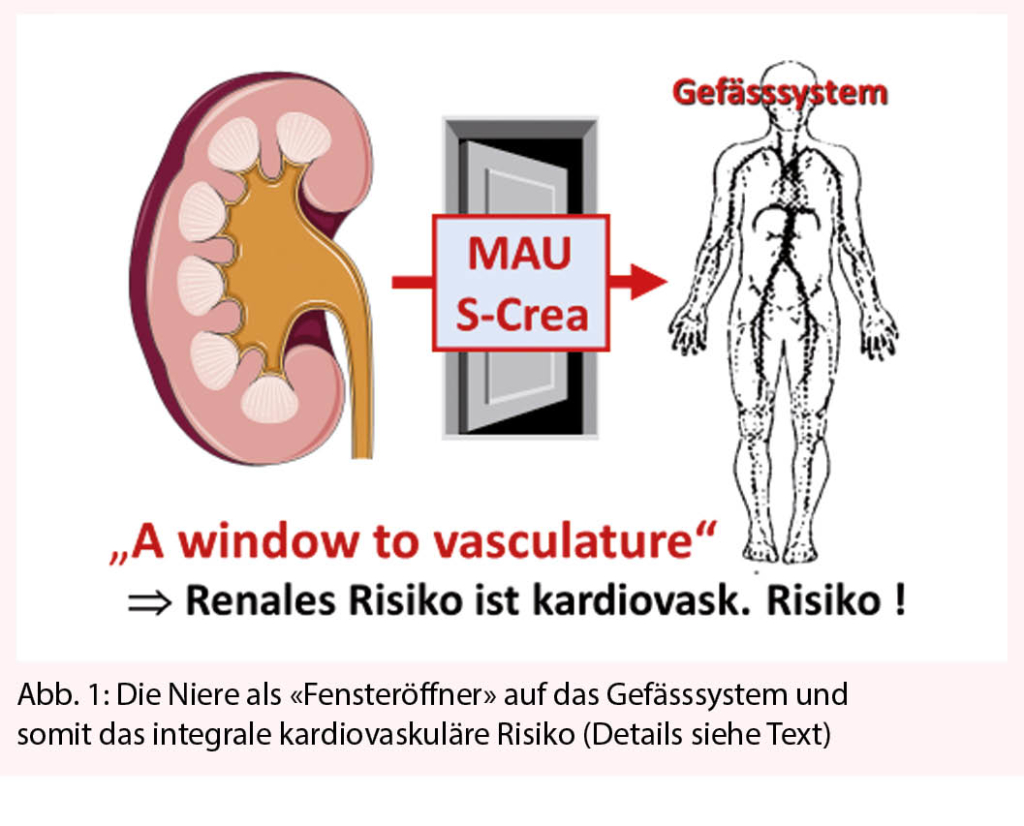
Eine hohe Albuminurie/Proteinurie ist zudem direkt nephrotoxisch (7). Eine renale Dysfunktion wirkt enorm atherogen und ist mit signifikant erhöhtem kardiovaskulärem Morbiditäts- und Mortalitätsrisiko assoziiert (zitiert in 7, 8). In einer Studie mit mehr als 1 Million Amerikanern stieg das Mortalitätsrisiko pro 100 Patientenjahre von 0.76 bei einer eGFR > 60 auf 4.76 bei eGFR 30-44 und erreichte 14.1 bei einer eGFR < 15 ml/min./1.73 m2 (9). Damit öffnet uns die Niere über die Parameter Serumkreatinin und MAU den Blick auf das integrale kardiovaskuläre Risiko (Abbildung 1).
In neuerer Zeit sind mit den SGLT2-Hemmern Medikamente zur Therapie des Typ 2-Diabetes verfügbar, welche überwiegend via Nephroprotektion kardioprotektiv wirken und entsprechende «harte» kardiale Endpunkte in randomisierten Studien signifikant vermindern. Die Wirkmechanismen und therapeutischen Effekte werden im Folgenden genauer dargestellt.
SGLT2-Hemmer
Pathophysiologie
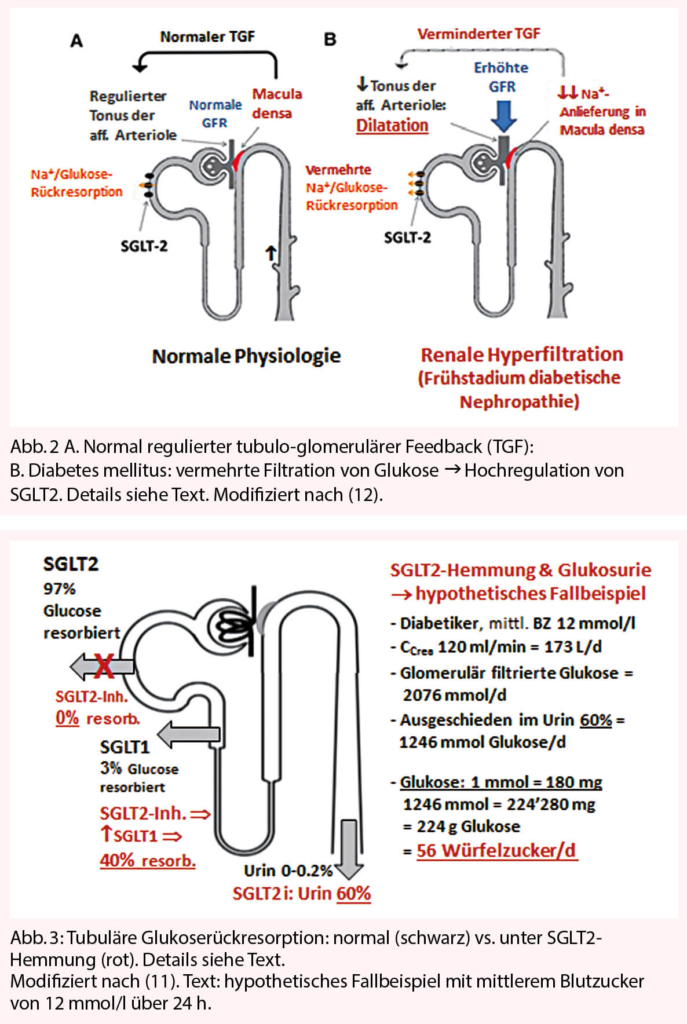
SGLT2 steht für Sodium-GLucose-Co-Transporter 2. Diese Transportproteine vermitteln in den proximalen Nierentubuluszellen die Rückresorption von glomerulär filtriertem Natrium und von Glukose (10). Eine entscheidende Wirkung dieser Co-Transporter ist die Beeinflussung der renalen Haemodynamik via tubulo-glomerulären Feedback (TGF). Wie in Abbildung 2A dargestellt, liegen die Zellen der Macula densa im frühen distalen Tubulus dem zuführenden Blutgefäss (afferente Arteriole) der Glomerula direkt an. Sie wirken als Chemorezeptoren, welche die Natrium- und Chloridkonzentration im frühen distalen Tubulus sensen und dementsprechend den Tonus der afferenten Arteriole regulieren. Bei Diabetes mellitus mit konstant vermehrter Filtration von Glukose wird im frühen Stadium SGLT2 hochreguliert, was zu einer gesteigerten Rückresorption sowohl von Glukose als auch Natrium führt (Abbildung 2B). Damit sinkt im frühen distalen Tubulus die Natriumkonzentration, was als «Natriumstau» gesenst wird. Zur Steigerung der Natriumausscheidung wird via TGF der Tonus der afferenten Arteriole gesenkt, so dass der intra-
glomeruläre Druck und die Filtration zunehmen – Hyperfiltration und intraglomeruläre Hypertonie (11, 12). Wie seit den Arbeiten von Brenner et al. (13) bekannt, führt dies langfristig zur Vernarbung/Schädigung der Glomerula mit Zunahme von Niereninsuffizienz und Proteinurie.
SGLT2-Hemmer sind die ersten Antidiabetika, die primär renal wirken. Durch Hemmung der proximal-tubulären Natriumrückresorption wird mehr Natrium nach distal angeliefert. Die Macula densa-Zellen nehmen dies als «Natriumverlust» wahr mit Folgen für den Kreislauf (Blutdruckabfall). Via TGF wird der Tonus der afferenten Arteriole hochreguliert, so dass der intraglomeruläre Druck abgesenkt und die schädigende Wirkung der Hyperfiltration reduziert wird (12).
Die Situation bezüglich Glukose ist in Abbildung 3 dargestellt: normalerweise werden 97% der Glukose proximal-tubulär durch SGLT2, die restlichen 3% weiter distal durch SGLT1 rückresorbiert (11). Unter SGLT2-Hemmung wird die Rückresorption proximal vollständig gehemmt, so dass mehr distal SGLT1 hochreguliert und ca. 40% der filtrierten Glukose rückresorbiert werden. Somit scheiden die Nieren jetzt 60% der filtrierten Glukose aus (11). Anhand eines hypothetischen Fallbeispiels zeigt Abbildung 3 auf, was dies konkret bedeutet und wie die in Studien beobachtete Gewichtsreduktion erklärt werden kann.
Halten randomisierte Studien den pathophysiologischen Erwartungen stand?
Bis März 2019 sind 3 grosse, prospektive, doppelblind-randomisierte Studien zur Therapie mit SGLT2-Hemmern bei Typ 2-Diabetes publiziert worden (14-16). Insgesamt wurden 34322 Typ 2-Diabetiker eingeschlossen, davon 35% Frauen; das Durchschnittsalter in allen Studien betrug 63.5 Jahre (17). Alle Patienten erhielten zusätzlich zur etablierten medikamentösen Therapie entweder Placebo oder einen SGLT2-Hemmer, die mittlere Beobachtungsdauer lag zwischen 2.4 und 4.2 Jahren (17). Der primäre Endpunkt in allen 3 Studien war MACE (major adverse cardiovascular events, d.h. Herzinfarkt, Hirnschlag, kardiovaskulärer Tod).
In der EMPA-REG-Studie (14) wurden 7020 Typ 2-Diabetiker entweder mit 10 oder 25 mg Empagliflozin pro Tag oder Placebo behandelt. Alle Patienten hatten bei Studieneinschluss etablierte kardiovaskuläre Krankheiten, womit eine sekundärpräventive Situation vorlag. Im CANVAS-Studienprogramm (15) wurden 10142 Typ 2-Diabetiker mit 100 oder 300 mg Canagliflozin pro Tag oder Placebo behandelt. Kardiovaskuläre Krankheiten lagen bei 66% vor, so dass die Intervention bei 34% primärpräventiv war (15). In der DECLARE-TIMI 58-Studie (16) wurden 17160 Typ 2-Diabetiker mit Placebo oder 10 mg Dapagliflozin pro Tag behandelt. Bei 41% lag bereits eine kardiovaskuläre Krankheit vor, womit 59% primär-präventiv behandelt wurden (16).
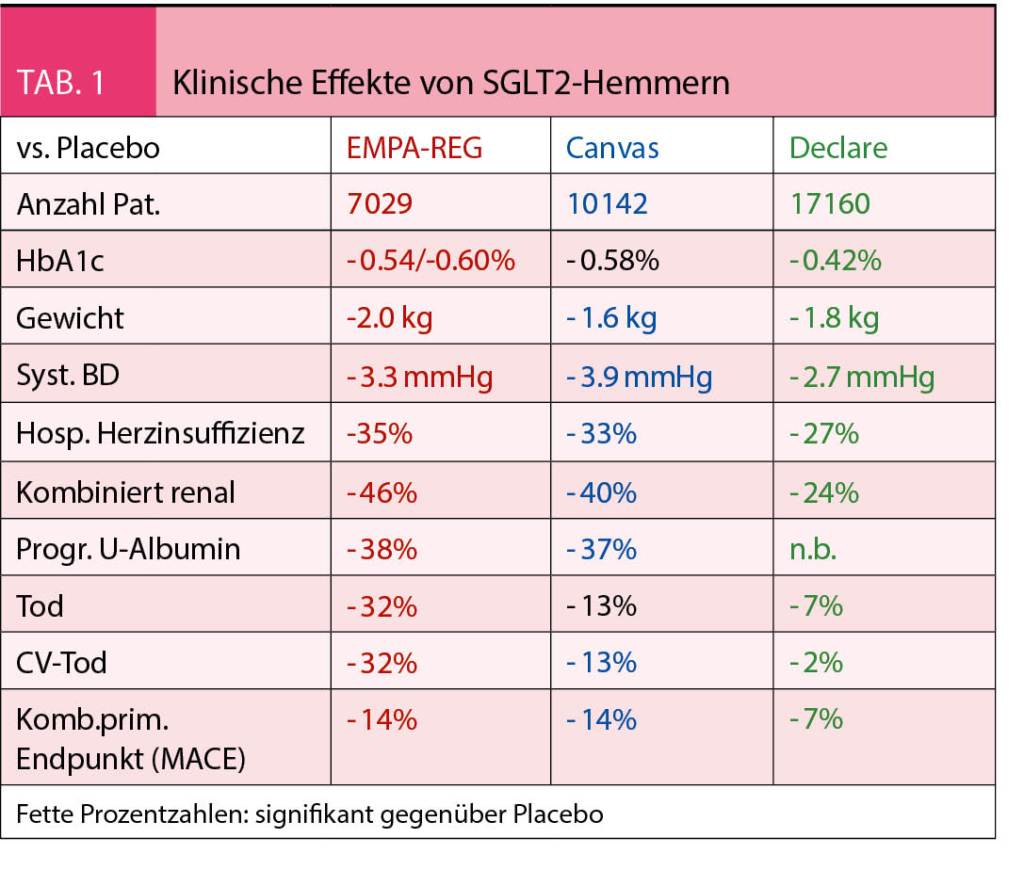
Die Tabelle 1 fasst die untersuchten Endpunkte für alle 3 Studien zusammen. Der primäre MACE-Endpunkt wurde in der DECLARE-TIMI 58 - Studie nur tendenziell vermindert. Eine Meta-Analyse aller 3 Studienprogramme wies nach (17), dass der MACE-Endpunkt nur bei sekundärpräventiv behandelten Typ 2-Diabetikern signifikant reduziert wurde, nicht aber in der primärpräventiven Situation. Der Einschluss von primärpräventiv behandelten Diabetikern erklärt auch, warum Gesamtmortalität und kardiovaskuläre Mortalität im CANVAS-Programm und in der DECLARE-TIMI 58-Studie im Gegensatz zu EMPA-REG nur tendenziell vermindert wurden.
In allen 3 Studien verminderten SGLT 2-Hemmer die Anzahl Hospitalisationen wegen Herzinsuffizienz, wobei diese Pathologie bei schon stärker fortgeschrittener Niereninsuffizienz (eGFR < 60 ml/min./ 1.73 m2) mit 40% am meisten reduziert wurde (17). Der kombinierte sekundäre renale Endpunkt (Verschlechterung der Nierenfunktion, terminale Niereninsuffizienz, renaler Tod) trat unter SGLT2-Hemmern signifikant weniger häufig auf, am ausgeprägtesten – Reduktion um 56% – bei frühzeitiger Intervention (eGFR > 90 ml/ml/1.73 m2) (17). Die neulich publizierte CREDENCE-Studie an 4401 Typ 2-Diabetikern mit manifest proteinurischer Nephropathie (eGFR 30-90 ml/min./1.73 m2) wies erstmals nach, dass der kombinierte primäre, spezifisch renale Endpunkt (terminale Niereninsuffizienz, Verdoppelung des Serumkreatinins, renaler Tod) durch Canagliflozin um 34% gesenkt werden kann (18). Eine jüngst publizierte, auf den Wirkmechanismus ausgerichtete Analyse von Blutproben eines früheren Trials wies nach, dass Canagliflozin im Vergleich zum Sulfonylharnstoff Glimepirid zu einer signfikanten Senkung proinflammatorischer (TNF1-Rezeptor, Interleukin-6) und fibrotischer (Matrix-Metalloproteinase 7, Fibronectin 1) Marker führt (19), so dass auch direkte molekulare Effekte zur Nephroprotektion beizutragen scheinen.
In EMPA-REG, CANVAS und DECLARE (14-16) waren als schwer beurteilte Nebenwirkungen unter SGLT2-Hemmern seltener als unter Placebo. Signifikant gehäuft gegenüber Placebo waren demgegenüber Genitalinfekte bei Männern und Frauen, nicht aber Harnwegsinfekte (14-16). Seltener als unter Placebo waren Episoden von akuter Niereninsuffizienz (14-16).
Fazit SGLT2-Hemmer
Die Effekte von SGLT2-Hemmern lassen sich wie folgt zusammenfassen:
• in grossen prospektiven, doppelblind-randomisierten Studien reduzieren SGLT2-Hemmer den primären Endpunkt (MACE) bei Typ 2-Diabetikern mit etablierten kardiovaskulären Krankheiten (Sekundärprävention), nicht aber ohne etablierte
kardiovaskuläre Krankheiten (primäre Prävention) (17).
• SGLT2-Hemmer sind im Vergleich zu andern oralen Antidiabetika besonders geeignet bei Typ 2-Diabetikern mit Herzinsuffizienz und bei bestehender Albuminurie/Nephropathie (20). Canagliflozin reduziert spezifisch bei vorbestehender proteinurischer Nephropathie das Risiko von terminaler Niereninsuffizienz und renalem Tod (18).
• Gemäss Verma et al. (19) sollten SGLT2-Hemmer sogar grossmehrheitlich bei Typ 2-Diabetikern nach Metformin als First-Line-Therapie eingesetzt werden, unabhängig vom Vorhandensein von Atherosklerose, chronischer Nephropathie oder Herzinsuffizienz.
Innere Medizin & Nephrologie/Hypertonie
NierensteinZentrumZürich
Klinik Im Park
Bellariastrasse 38
8038 Zürich
bernhard.hess@hirslanden.ch
Der Autor deklariert, Vortragshonorare von Mundipharma erhalten zu haben.
- Mikroalbuminurie und Nierenfunktion (eGFR) definieren das integrale kardio-renale Risiko bei Typ 2-Diabetes und müssen früh erfasst/jährlich kontrolliert werden.
- SGLT2-Hemmer bewirken als primär renal angreifende Antidiabetika eine stark vermehrte Glukosurie, was die Gewichtsreduktion fördert und den HbA1c-Wert senkt.
- SGLT2-Hemmer wirken natriuretisch, was 1) via tubulo-glomerulären Feedback den intraglomerulären Druck senkt und die Nierenfunktion länger erhält (Nephroprotektion) und 2) Hospitalisationen wegen Herzinsuffizienz bei Typ 2-Diabetikern vermindert.
- SGLT2-Hemmer reduzieren bei Typ 2-Diabetikern mit etablierten kardiovaskulären Krankheiten, nicht aber bei jenen mit lediglich kardio-renalen Risikofaktoren, den primären MACE-Endpunkt (Herzinfarkt, Hirnschlag, kardiovaskulärer Tod).
- Der prognostisch wichtige kombinierte renale Endpunkt (Verschlechterung der Nierenfunktion, terminale Niereninsuffizienz, renaler Tod) wird durch alle bisher untersuchten SGLT2-Hemmer signifikant reduziert.
Messages à retenir
- La microalbuminurie et la fonction rénale (eGFR) définissent le risque cardio-rénal intégral dans le diabète de type 2 et doivent être saisies tôt ou vérifiées annuellement.
- Les inhibiteurs de la SGLT2, en tant qu’antidiabétiques rénaux primaires, provoquent une forte augmentation de la glucosurie, ce qui favorise la réduction du poids et abaisse la valeur de l‘HbA1c.
- Les inhibiteurs de SGLT2 agissent de façon natriurétique, ce qui 1) par rétroaction tubulo-glomérulaire diminue la pression intra-glomérulaire et maintient la fonction rénale plus longtemps (néphroprotection) et 2) réduisent l’hospitalisation pour insuffisance cardiaque chez les diabétiques de type 2.
- Les inhibiteurs SGLT2 réduisent le paramètre MACE primaire (infarctus du myocarde, accident vasculaire cérébral, décès d’origine cardiovasculaire) chez les diabétiques de type 2 atteints de maladies cardiovasculaires établies, mais pas chez ceux qui présentent uniquement des facteurs de risque cardio-rénal.
- Tous les inhibiteurs de la SGLT2 étudiés jusqu’à présent réduisent de façon significative le critère d’évaluation combiné rénal (dégénérescence rénale, insuffisance rénale terminale, mort rénale), qui est important sur le plan pronostique.
1. Stamler J, Vaccaro O, Neaton JD, Wentworth D. Diabetes, other risk factors, and 12 year cardiovascular mortality for men screened in the multiple risk factor intervention trial. Diabetes Care 1993;16: 434–44.
2. Gerstein HC. Diabetes and the HOPE study: implications for macrovascular and microvascular disease. Int J Clin Pract Suppl. 2001; 117: 8–12.
3. Ritz E, Zeng XX, Rychlík I. Clinical manifestation and natural history of diabetic nephropathy. Contrib Nephrol 2011; 170: 19-27.
4. Parving H-H, Hommel E, Mathiesen E et al.. Prevalence of microalbuminuria, arterial hypertension, retinopathy and neuropathy in patients with insulin
dependent diabetes. Br Med J 1988; 296: 156-160.
5. Wachtell K, Ibsen H, Olsen MH et al. Albuminuria and cardiovascular risk in
hypertensive patients with left ventricular hypertrophy: the LIFE study.
Ann Int Med 2003; 139: 901-906.
6. Isomaa B, Almgren P, Tuomi T et al. (2001). Cardiovascular morbidity and
mortality associated with the metabolic syndrome. Diabetes Care 24: 683-689.
7. Remuzzi G, Ruggenenti P, Benigni A. Understanding the nature of renal disease progression. Kidney Int 1997; 51: 2-15.
8. Ritz E. Renal dysfunction as a novel risk factor: Microalbuminuria and
cardiovascular risk. Kidney Int 2005; 67, Suppl 93: S25-S28.
9. Go AS, Chertow GM, Fan D, McCulloch CE, Hsu C-Y. Chronic Kidney Disease and the Risks of Death, Cardiovascular Events, and Hospitalization. N Engl J Med. 2004; 351: 1296-1305.
10. Heerspink HJL, Kosiborod M, Inzucchi SE, Cherney DZI. Renoprotective effects of sodium-glucose cotransoprter-2 inhibitors. Kidney Int 2018; 94: 26-39.
11. Ito M, Tanaka T. The anticipated renoprotective effects of sodium-glucose
cotransporter 2 inhibitors. Intern Med. 2018; 57: 2105-2114.
12. Cherney DZ, Perkins BA, Soleymanlou N et al. Renal hemodynamic effect of sodium-glucose cotransporter 2 inhibition in patients with type 1 diabetes
mellitus. Circulation 2014; 129: 587-597.
13. Brenner BM, Lawler EV, Mackenzie HS. The hyperfiltration theory: a paradigm shift in nephrology. Kidney Int 1996; 49: 1774-1777.
14. Zinman B, Wanner C, Lachin JM et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N. Engl J Med 215: 373; 2217-2128.
15. Neal B, Perkovic V, Mahaffey KW et al. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med 2017; 377: 644-657.
16. Wiviott SD, Raz I, Bonaca MP et al. Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2019; 380: 347-357.
17. Zelniker TA, Wiviott SD, Raz I et al. SGLT2 inhibitors for primary and secon-
dary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systemic review and meta-analysis of cardiovascular outcome trials. Lancet 2019; 393: 31-39.
18. Perkovic V, Jardine MJ, Neal B et al. Canagliflozn and renal outcomes in type 2 diabetes and nephropathy. N Engl J Med. 2019 Apr 14. doi: 10.1056/ NEJMoa1811744.
19. Heerspink HJL, Perco P, Mulder S et al. Canagliflozin reduces inflammation and fibrosis biomarkers: a potential mechanism for beneficial effects of SGLT2 inhibitors in diabetic kidney disease. Diabetologia 2019 Apr 17. doi: 10.1007/s00125-019-4859-4.
20. Zheng SL, Roddick AJ, Aghar-Jaffar R et al. Association between use of sodium-glucose cotransporter 2 inhibitors, glucagon-like peptide 1 agonists, and dipeptidyl peptidase 4 inhibitors with all-cause mortality in patients with type 2 diabetes: a systematic review and meta-analysis. JAMA 2018; 319:1580-1591.
21. Verma S, Jüni P, Mazer CD. Pump, pipes, and filter: do SGLT2 inhibitors cover it all? Lancet 2019; 393: 3-5.
info@herz+gefäss
- Vol. 9
- Ausgabe 3
- Mai 2019