- Left Bundle Branch Area Pacing – die Zukunft der Herzschrittmacher-Therapie?
Die invasive Therapie der symptomatischen Bradykardie hat sich seit der ersten Herzschrittmacherimplantation im Jahr 1958 weiterentwickelt. Die klassische Form der kardialen Schrittmachertherapie ist die Stimulation des rechtsventrikulären Myokards, welche zu einer elektromechanischen interventrikulären Dyssynchronie mit konsekutivem Linksschenkelblock und Schrittmacher-induzierten Kardiomyopathie führen kann. Die seit dem Jahr 2000 aufkommende direkte Stimulation des kardialen Reizleitungssystems im Bereich des His-Bündels erreichte eine physiologischere elektromechanische myokardiale Aktivierung ohne interventrikuläre Dyssynchronie und mit sehr schmalen stimulierten QRS-Komplexen. Leider ist die Technik aber komplex in der Implantation wie auch in der Schrittmacher-Nachsorge und die Reizschwellen der His-Stimulation steigen nicht selten im Verlauf an, was einer breiten Adaptation im klinischen Alltag entgegenwirkte. Aktuell wird zunehmend die Stimulation des infrahissären elektrischen Reizleitungssystems, genauer gesagt des linken Tawara-Schenkels im interventrikulären Septum, als sogenanntes «left bundle branch area pacing» (LBBAP) durchgeführt. Dabei zeigt sich erfreulicherweise ein relativ schmaler stimulierter QRS-Komplex, hohe Erfolgsraten der Implantation, einheitliche und vergleichbar kurze Operationszeiten, sowie zu Beginn und auch im Verlauf stabile Messwerte der Elektroden. Auch ist es durch LBBAP möglich, einen bestehenden Linksschenkelblock zu korrigieren, weshalb LBBAP auch als Option in der kardialen Resynchronisationstherapie bei Patienten mit Herzinsuffizienz diskutiert wird. Jedoch ist dies insgesamt noch eine junge Technik, die Studienlage ist derzeit noch sehr begrenzt, und es fehlen Daten über den Langzeitverlauf.
Cardiac pacing has undergone significant innovation since the implantation of the first cardiac pacemaker in 1958. Pacing from the right ventricle has been the therapy of choice for many years, but it can lead to unphysiological depolarization of the ventricles with electromechanical dyssynchrony and pacing induced cardiomyopathy. Direct pacing of the conduction system in the region of the His-bundle has emerged since the year 2000, which leads to physiological ventricular depolarization with narrow QRS-complexes and without interventricular dyssynchrony. Implantation of a His-Electrode can however be technically challenging, elevated pacing thresholds are a potential downside and device follow-up is more complex compared to conventional devices. In the last few years, direct pacing of the infrahisian part of the conduction system, the left bundle branch in the interventricular septum, so called «left bundle branch area pacing» (LBBAP), has emerged as an alternative. Direct Pacing of the left bundle branch area results in relatively narrow QRS complexes, high implantation success rates, relatively short and reproducible procedural times as well as low and stable capture thresholds at implantation and during follow up. In some cases, correction of preexisting left bundle branch block is possible during LBBAP, which makes LBBAP interesting as a potential alternative to biventricular pacing in cardiac resynchronization therapy. While LBBAP is a young and promising technique, there is currently very limited scientific data and long-term follow-up results are lacking.
Key Words: pacing, cardiac pacing, LBBAP
Die invasive Therapie der symptomatischen Bradykardie mittels implantierbarer Herzschrittmacher (PM: Pacemaker, Herzschrittmacher) wurde 1958 gegründet, als in der Universitätsklinik Karolinska (Stockholm, Schweden) einem 43-jährigen Patienten erstmalig ein PM implantiert wurde. Der Patient hat bis zu seinem Tod mit 86 Jahren insgesamt 26 PM erhalten und überlebte sowohl den Ingenieur (Rune Elmqvist) als auch den Operateur (Ake Senning) des weltweit ersten implantierbaren PM. In den letzten 65 Jahren hat sich die Schrittmachertherapie deutlich weiterentwickelt. Während die ersten implantierbaren Schrittmachermodelle mit epikardialen Elektroden über eine laterale Thorakotomie abdominal implantiert wurden und die Batterie nur wenige Stunden hielt, werden die heutigen gängigen transvenösen Modelle subcutan oder submuskulär pectoral implantiert und haben eine Laufzeit von über einem Jahrzehnt. Ebenfalls wurde in den letzten Jahrzehnten eine «physiologischere» elektrische Stimulation des Herzens angestrebt, im Sinne einer Stimulation des Herzreizleitungssystems (und nicht des ventrikulären Myokards). Die Stimulation des linken Tawara-Schenkels im interventrikulären Septum (LBBAP: Left Bundle Branch Area Pacing) ist der nächste Schritt dieser Stimulation des kardialen Reizleitungssystems.
Left Bundle Branch Area Pacing
Die klassische Form der transvenösen Schrittmachertherapie ist die Stimulation des rechtsventrikulären Myokards (RVP: Right Ventricular Pacing), was naturgemäss zu einer elektromechanischen Dyssynchronie mit meist relativ breiter Linksschenkelblock-Konfiguration im EKG führt. Ein Teil der Patienten mit hohem RVP-Stimulationsanteil kann daher eine sogenannte Schrittmacher-induzierte Kardiomyopathie entwickeln mit negativem Remodelling des linken Ventrikels, Abnahme der linksventrikulären Ejektionsfraktion, erhöhter Inzidenz von Vorhofflimmern und erhöhter Mortalität (1-3). Die um das zweite Jahrtausend aufkommende Stimulation des His-Bündels (HBP: His-Bundle-Pacing), also des herzeigenen Reizleitungssystems unmittelbar unterhalb des AV-Knotens, zeigte eine physiologische elektromechanische Erregung der Ventrikel, schmale QRS-Komplexe und eine tiefere Inzidenz der Schrittmacher-induzierten Kardiomyopathie sowie damit assoziierten Hospitalisationen (4, 5). Leider hatte das HBP aber deutliche Limitationen, die eine breite Adaptation ausserhalb universitärer Zentren und Studien limitierten: Variierende Implantationszeiten machten eine strukturierte Patientenplanung schwierig, die Erfolgsraten waren sehr stark von der Erfahrung des Operateurs abhängig, Elektroden-Dislokationen mit benötigten operativen Revisionen waren (vor allem initial) nicht selten und zusätzlich zeigten sich nicht selten zu Beginn oder im Langzeitverlauf ansteigende Reizschwellen mit entsprechend schnellem Batterie-Verbrauch des PM. Aktuell wird deshalb vermehrt die Stimulation des infrahissären linken Tawara-Schenkels im interventrikulären Septum etwas weiter unterhalb des AV-Knotens und des His-Bündels (LBBAP: Left Bundle Branch Area Pacing) präferenziert (6). Dabei zeigte sich erfreulicherweise ein relativ schmaler stimulierter QRS-Komplex (schmaler als RVP, weniger schmal als HBP), hohe Erfolgsraten der Technik, einheitliche und vergleichbar kurze Operationszeiten, sowie zu Beginn und im Verlauf stabile Reizschwellen der Elektroden (6-8). Entsprechend wird heute zunehmend das LBBAP als optimaler Kompromiss zwischen idealer physiologischer elektrischer Stimulation des Herzens und kurz- sowie langfristiger technischer Machbarkeit angesehen.
Implantation und potenzielle Komplikationen
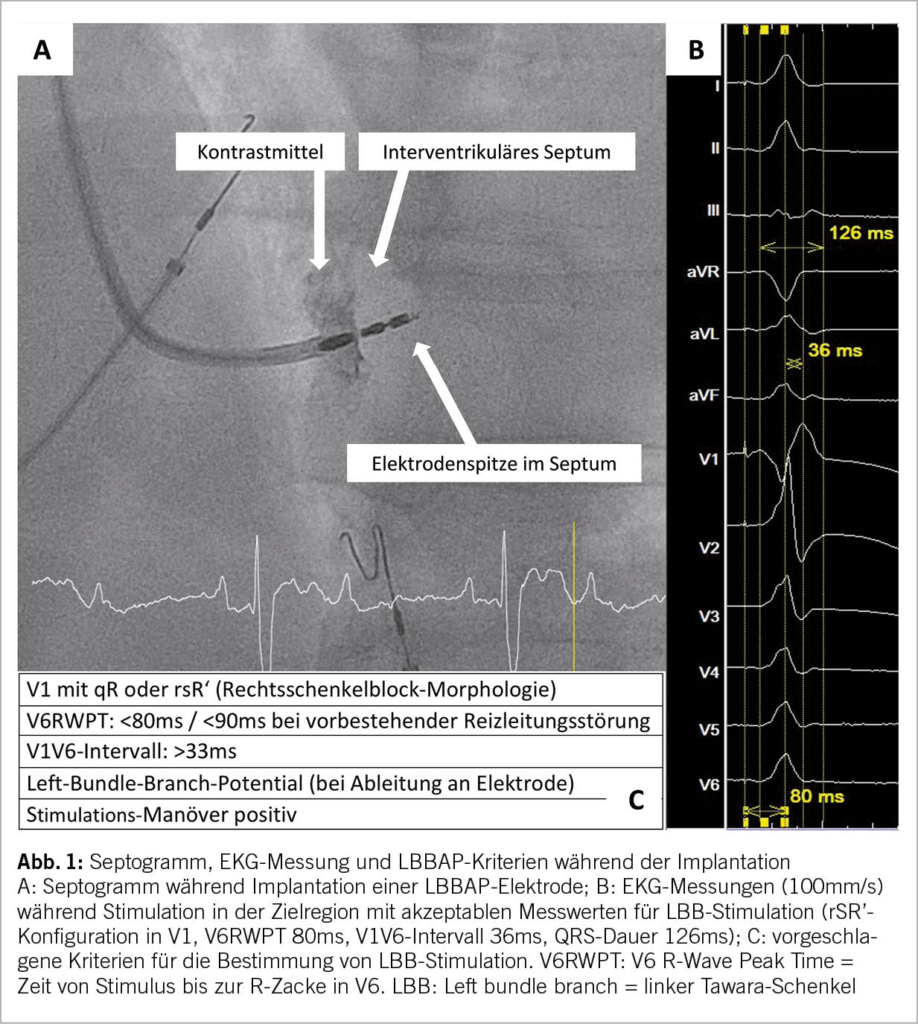
Die Patientenvorbereitung vor einer LBBAP-Implantation ist analog einer klassischen Schrittmacherimplantation. Neben einer standardmässigen Blutuntersuchung (Infektparameter, Elektrolyte, Nierenfunktion) wird eine präoperative Echokardiographie zur Evaluation der linksventrikulären systolischen Funktion, Septumdicke, Dimensionen der Herzhöhlen sowie möglicher Klappenpathologien empfohlen. Während der Implantation erfolgt zusätzlich die kontinuierliche Ableitung eines 12-Kanal-EKGs mit schneller Laufgeschwindigkeit (meist 100mm/s) zwecks Dokumentation der Stimulationsmorphologie während der LBBAP-Implantation. Falls die Implantation in einem Elektrophysiologie-Labor durchgeführt wird, kann ergänzend neben dem 12-Kanal-EKG fortlaufend das endokardiale Signal von der Spitze der Elektrode im Herzen dargestellt werden. Zur Implantation können verschiedene Elektroden mit oder ohne innere Lumen sowie dazugehörige lange Schleusen verwendet werden (9, 10). Die anschliessende LBBAP-Implantationstechnik hat sich seit der Erstbeschreibung 2017 nicht wesentlich verändert (6, 11). Nach der venösen Punktion erfolgt die Platzierung der Elektrode über eine lange Schleuse am basalen rechtsventrikulären interventrikulären Septum. Die Lokalisation der idealen Position erfolgt anhand anatomischer und elektrokardiographischer Kriterien mittels Pacemapping (11). Das anschliessende Einschrauben der Elektrode in das interventrikuläre Septum hinein erfolgt durch Drehen der gesamten Elektrode und unter Monitorisierung des Elektrogramms, der unipolaren Impedanz, der radiologischen Dokumentation sowie des Oberflächen-EKGs während der unipolaren Stimulation (11, 12). Die Drehbewegungen sollten gestoppt werden, wenn die typische LBBAP-Stimulationsmorphologie erreicht wurde (Abb. 1) oder ventrikuläre Extrasystolen mit LBBAP-Morphologie während dem Einschrauben provoziert werden (sogenannte «template beats» oder «fixation beats») (13-15). Ein plötzlicher Abfall der unipolaren Stimulationsimpedanz >200 Ohm, anhaltende unipolare Stimulationsimpedanzen < 400 Ohm, polymorphe VES mit Rechtsschenkelblock-Morphologie oder ein reduziertes Sensing sind Hinweise für eine mögliche Perforation in den linken Ventrikel.
Bezüglich der elektrophysiologischen Kriterien für eine erfolgreiche Stimulation des linksseitigen Tawara-Schenkels (LBB) herrscht derzeit kein wissenschaftlicher Konsens. Diese sind derzeit noch Gegenstand der aktuellen Forschung und wurden noch nicht in grossen prospektiven Studien validiert (16). Trotzdem haben sich in der aktuellen Literatur folgende Kriterien zunehmend konsolidiert: Bei Betrachtung des stimulierten Oberflächen-EKGs sollte bei Erreichen von LBBAP eine rechtsschenkelblockartige QRS-Morphologie (qR oder rsR‘ in V1) auftreten (Abb. 1). Die Zeit bis zur Aktivierung des linken Ventrikels (V6RWPT: Zeit bis zur R-Zacke in V6) sollte bei hohem und tiefem Output stabil kurz (<70-90ms) und idealerweise nicht länger als intrinsisch gemessen sein, als Zeichen der Stimulation des LBB (11, 15, 17). Das V6-V1-Interpeak-Intervall widerspiegelt die Zeit zwischen der Aktivierung des linken und des rechten Ventrikels und ist bei einem V6-V1 Intervall >33ms ein weiteres diagnostisches Kriterium für LBB-Stimulation (18). Manchmal lässt sich auf dem von der Elektrodenspitze abgeleiteten Elektrogramm ein scharfes hochfrequentes Linksschenkelpotential 20 – 35ms vor dem lokalen ventrikulären Elektrogramm nachweisen (19). Zuletzt existieren verschiedene aufwändigere Stimulations-Manöver (Nachweis von nicht-selektiver und selektiver LBB-Stimulation) (20). Wenn eine zufriedenstellende Position der Elektrode erreicht wurde, kann ergänzend ein Septogramm zur Darstellung der Tiefe der Elektrode im interventrikulären Septum erfolgen mittels Kontrastmittel-Applikation über die lange Schleuse (Abb. 1).
Neben den typischen Operationskomplikationen analog den konventionellen RVP-PM gibt es einige spezifische zu bedenkende Komplikationen bei LBBAP-PM Implantationen: Mikro-Dislokationen mit Verlust der LBB-Stimulation werden in 4-12% der Implantationen beschrieben, was sicher auch von der Erfahrung des Operateurs abhängig gemacht werden kann (21, 22). Makrodislokationen der Elektrode, entweder zurück in rechten Ventrikel oder eine späte Perforation des Septums mit Dislokation der Elektrode in den linken Ventrikel werden in 1-2% der Implantationen beschrieben. Akute septale Perforationen nach linksventrikulär während der Implantation werden in 3-14% der Implantation berichtet, diese scheinen aber keine relevante klinische Konsequenz für die Patienten zu haben bei intraoperativer Detektion und Replatzierung der Elektrode (23-26). Ebenfalls kann eine Verletzung des rechten Tawara-Schenkels mit konsekutivem Rechtsschenkelblock auftreten, entsprechend ist die vorübergehende Einlage einer Backup-Elektrode vor Implantation einer LBBAP-Elektrode bei vorbestehendem Linksschenkelblock empfehlenswert. Ergänzend treten während dem Eindrehen der Elektrode selten Verletzungen der septalen Koronararterien mit möglicher Myokardischämie, septale Hämatome oder Koronarfisteln auf.
Nachsorge
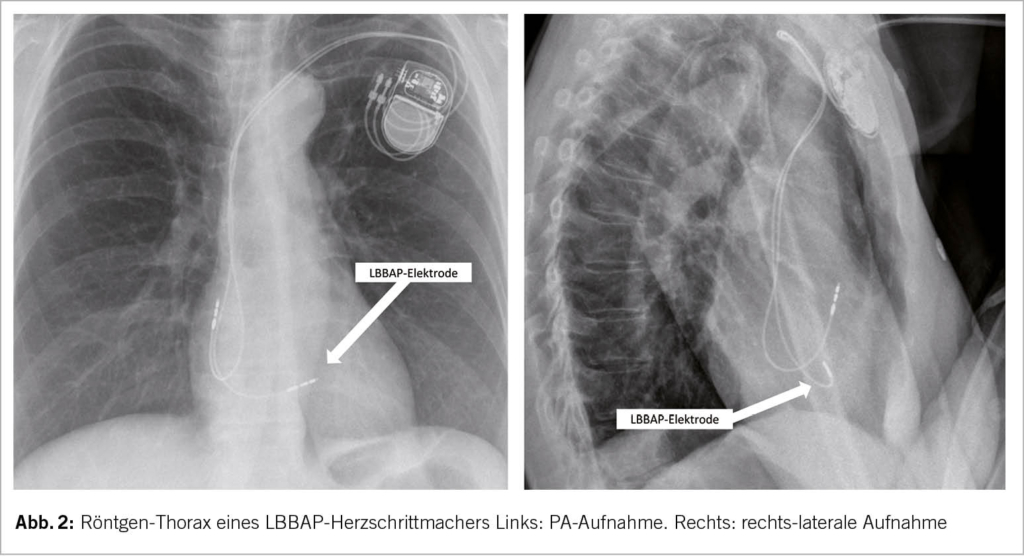
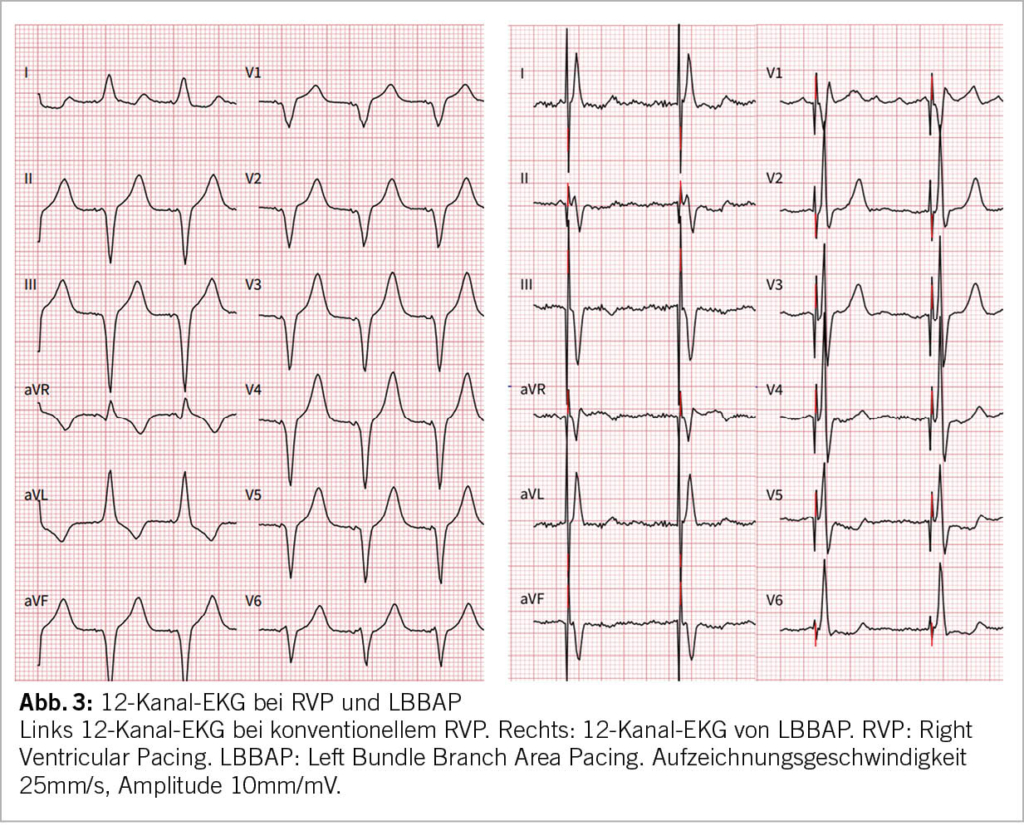
Im Gegensatz zu den HBP-PM zeichnen sich die LBBAP-PM durch stabile Messwerte (Sensing, Impedanzen, Reizschwellen) und weitgehend analoge Device-Programmierung sowie Nachsorge wie die konventionellen RVP-PM aus. Im Alltag fällt bei einer Nachkontrolle eines LBBAP-PM potenziell einzig eine manchmal auf unipolar programmierte Stimulation der LBBAP-Elektrode und auffällig schmale QRS-Komplexe auf, ansonsten unterscheidet sich eine Standardabfrage des LBBAP-PM meistens nicht von einem konventionellen RVP-PM. Auch in der Röntgenkontrolle fällt bis auf eine etwas proximalere Lage der LBBAP-Elektrode kein Unterschied zu einem RVP-PM auf (Abb. 2). Falls in der Nachsorge die LBB-Stimulation erneut geprüft werden möchte, ist diese detaillierte Nachsorge allerdings deutlich umfangreicher: Die LBBAP-Elektrode muss dann unter 12-Kanal-EKG-Ableitungen getestet werden in bipolarer sowie unipolarer Stimulation, sowie in hohem und tiefem Output mit Anwendung der bekannten Kriterien für LBB-Stimulation (Abb. 1, Abb. 3). Bei der LBBAP-Stimulation in bipolarer Konfiguration sollte darauf geachtet werden, ob es gegenüber der unipolaren Stimulation zu rein myokardialer Stimulation mit Verlust der LBB-Stimulation oder auch nur zu einem höheren Anteil an myokardialer Stimulation kommt. Die Wahl des Stimulationsmodus (uni- vs. bipolar) kann anschliessend neben den Reizschwellen auch vom Vorliegen und der Selektivität einer LBB-Stimulation abhängig gemacht werden. Schrittmachersysteme mit LBBAP-Elektroden sind MRI tauglich analog den konventionell implantierten RVP-Elektroden.
Wissenschaftliche Datenlage und Ausblick
Es existieren bisher leider nur eine sehr begrenzte Anzahl an nicht-randomisierten Studien und Registern für das LBBAP. Das grosse europäische multizentrische MELOS-Register mit >2500 Patienten demonstrierte eine Erfolgsrate einer LBBAP-Implantation von 92.4% mit stabilen Messwerten über >6 Monate, aber mit einer Komplikationsrate von 8% spezifisch für die LBBAP-Implantation (7). Die Mehrheit der kleineren prospektiven Studien zeigte ähnliche Ergebnisse mit einer Erfolgsrate um 90%, Operationsdauer vergleichbar mit einer RVP-Implantation und einer Komplikationsrate um 8-15% (24, 25). Allerdings ist die Definition einer «erfolgreichen» LBBAP-Implantation sehr heterogen, da bisher keine international akzeptierten Kriterien für LBBAP-Stimulation definiert wurden. Auch wenn die überwiegende Mehrheit dieser Komplikationen keine direkte langfristige Konsequenz für die Patienten beinhaltete (3.7% akute Perforation in den linken Ventrikel, 1.5% Elektrodendislokation, 1% Thoraxschmerzen, etc), sind es doch für die Implantationstechnik spezifische und somit potenziell verhinderbare Komplikationen. Langfristig unklar verbleibt aktuell zudem das «Überleben» von Elektroden in LBBAP-Position, beziehungsweise ob die Rate an Elektrodendefekten mit den aktuell verwendeten Elektroden höher sein könnte als in einer konventionellen RVP-Position. Etwas beunruhigend wurde diesbezüglich auch bereits ein früher Elektrodenbruch einer LBBAP-Elektrode berichtet (27). Auch stellt sich langfristig die Frage nach der Extrahierbarkeit von LBBAP-Elektroden angesichts der zu erwartenden Fibrose entlang der Elektrodenspitze im interventrikulären Septum. Hierzu existieren einzelne Fallberichte mit problemloser Extraktion durch leichten manuellen Zug ohne weitere Hilfsmittel und Komplikationen, allerdings waren die Elektroden auch alle <2 Jahren implantiert (28-30).
Dem erhöhten Komplikationsrisiko und Unklarheiten des Elektrodenverhaltens im langfristigen Verlauf gegenüber steht der potenzielle Benefit einer «physiologischeren» elektromechanischen ventrikulären Aktivierung, analog dem nachgewiesenen klinischen Vorteil des HBP gegenüber dem RVP bezüglich der Inzidenz einer «Schrittmacher-assoziierten-Kardiomyopathie» (1-3). Eine retrospektive Kohorten-Vergleichsstudie mit 703 Patienten (LBBAP 321, RVP 382 Patienten) zeigte schmalere QRS-Komplexe unter LBBAP im Vergleich zu RVP (121+-23ms vs 156 +- 27ms, p < 0.001) sowie eine signifikante Reduktion des primären Endpunkts (Mortalität, Hospitalisation wegen Herzinsuffizienz, Upgrade auf biventrikuläres Schrittmachersystem) bei einem Pacinganteil > 20% für LBBAP im Vergleich zu RVP (8). LBBAP zeigte gegenüber RVP auch eine Reduktion des Auftretens von Vorhofflimmern (31). Dementsprechend dürften Patienten mit einem hohen erwarteten Anteil an prozentualer ventrikulärer Stimulation potenziell am meisten von einer LBBAP-Implantation profitieren. Zunehmend attraktiv wird das LBBAP auch im Rahmen der kardialen Resynchronisationstherapie (CRT) für Patienten mit systolischer Herzinsuffizienz und Linksschenkelblock, entweder zusammen mit einer linksventrikulären Elektrode (dann als Alternative zur konventionellen RVP-Implantation) oder allein als Ersatz einer linksventrikulären Elektrode (dann als «Bail-out» bei ansonsten gescheiterter CRT-Implantation). Allerdings ist die Erfolgsrate einer LBBAP-Implantation bei Patienten mit Herzinsuffizienz als deutlich niedriger zu bewerten (MELOS-Register: 82%) (7). Andererseits war eine LBBAP-Implantation bei Pa-tienten mit Linksschenkelblock und Herzinsuffizienz mit einer deutlichen Abnahme der QRS-Dauer (152 +- 32ms zu 137 +- 22ms; p< 0.01) und Verbesserung der LVEF (33 +- 10% auf 44 +- 11%, p<0.01) assoziiert (32). Die Implantation einer LBBAP-Elektrode anstelle einer RVP-Elektrode im Rahmen einer CRT-Implantation wird Left-Bundle-Optimized-CRT (LOT-CRT) genannt und zeigte gegenüber konventioneller CRT eine deutlichere Abnahme der QRS-Dauer und eine deutliche Zunahme der linksventrikulären systolischen Funktion, sodass eine nochmals inkremental bessere elektromechanische Synchronisierung proklamiert wird, allerdings auch in diesem Kontext ohne bisherige kontrollierte randomisierte Studien (33, 34). Bezüglich der Bail-Out-LBBAP-Implantation anstelle einer LV-Elektrode für CRT-Implantationen gibt es ebenfalls noch keine randomisierten Studien, jedoch konnte in Beobachtungsstudien immerhin gezeigt werden, dass LBBAP gegenüber CRT für Patienten mit Herzinsuffizienz mit einer stärkeren Reduktion der QRS-Dauer, signifikant grösseren Verbesserung der LVEF und signifikant weniger Tod oder Hospitalisation assoziiert war (35).
Konklusion
Das LBBAP zeigt aus Beobachtungsstudien vielversprechende Resultate mit Blick auf eine neue Schrittmachertherapie der Bradykardie und potenziell auch Herzinsuffizienz. Die LBBAP-Implantationstechnik zeigt hohe Erfolgsraten, vertretbare Komplikationsraten und stabile Messwerte der Elektroden. Ob sich das LBBAP als Technik in der Zukunft durchsetzen kann und breite Anwendung findet, hängt massgeblich von den dringend benötigten Resultaten aus prospektiv kontrolliert-randomisierten Studien mit harten Endpunkten, Langzeitdaten über das Elektrodenverhalten und einem Konsens bezüglich der Kriterien für LBBAP ab. Solange diese nicht verfügbar sind, sollten Indikationsstellungen individualisiert und mit einer ausführlichen Aufklärung der Patienten erfolgen.
Abkürzungsverzeichnis
PM – Pacemaker, Herzschrittmacher
RVP – Right Ventricular Pacing
HBP – His Bundle Pacing
LBBAP – Left Bundle Branch Area Pacing
LBB – Left Bundle Branch, linker Tawara-Schenkel
V6RWPT – V6 R-Wave Peak Time, Zeit bis Peak der R-Zacke in V6
CRT – Cardiac Resynchronization Therapy
LOT-CRT – Left Bundle Optimized Cardiac Resynchronization Therapy
Prakt. med. Caroline Wiederkehr 1
Dr. med. Andreas Müller 1
PD Dr. med. Alexander Breitenstein 2
Dr. med. Daniel Hofer 1,2
1 Rhythmologie, Klinik für Kardiologie, Stadtspital Triemli
Birmensdorferstrasse 497, 8063 Zürich
2 Rhythmologie, Klinik für Kardiologie, Universitätsspital Zürich
Rämistrasse 100, 8091 Zürich
Rhythmologie, Klinik für Kardiologie, Stadtspital Triemli
Birmensdorferstrasse 497
8063 Zürich
– Rhythmologie, Klinik für Kardiologie, Stadtspital Triemli
Birmensdorferstrasse 497, 8063 Zürich
– Rhythmologie, Klinik für Kardiologie, Universitätsspital Zürich
Rämistrasse 100, 8091 Zürich
DH erhielt educational grants, consultant fees, speaker fees oder fellowship support von Abbott (SJM), Medtronic, Biotronik, Boston Scientific, Biosense Webster, Novartis, Bayer, Pfizer, Spectranetics/Philips. CW erhielt educational grants oder fellowship support von Abbott (SJM), Biotronik, Boston Scientific, Biosense Webster. AM erhielt fellowship und training support von Biotronik, Boston Scientific, Medtronic, Abbott/St. Jude Medical und Biosense Webster; Speaker honoraria von Biosense Webster, Medtronic, Abbott/St. Jude Medical, AstraZeneca, Daiichi Sankyo, Biotronik, MicroPort, Novartis und Consultant Fees von Biosense Webster, Medtronic, Abbott/St. Jude Medcal und Biotronik.
AB erhielt consultant oder speaker fees from Abbott, Bayer Healthcare, Biosense Webster, Biotronik, Boston Scientific, Bristol-Myers Squibb, Cook Medical, Daiichi Sankyo, Medtronic, Pfizer, und Spectranetics/Philips.
◆ Potenzielle Langzeitfolgen des chronischen RVP sind eine systolische Herzinsuffizienz, daraus bedingte Hospitalisationen und eine erhöhte Mortalität.
◆ LBBAP ist eine Stimulation des kardialen Reizleitungssystems mit dem Ziel diese negativen Langzeitfolgen zu verhindern.
◆ Erste Beobachtungsstudien suggerieren einen Vorteil von LBBAP gegenüber RVP bei allerdings erhöhten Komplikationsraten
◆ Um sichere Empfehlungen und Kriterien bezüglich LBBAP zu definieren, müssen kontrollierte randomisierte prospektive Studien mit harten klinischen Endpunkten abgewartet werden.
1. Slotwiner DJ, Raitt MH, Del-Carpio Munoz F, Mulpuru SK, Nasser N, Peterson PN. Impact of Physiologic Pacing Versus Right Ventricular Pacing Among Patients With Left Ventricular Ejection Fraction Greater Than 35%: A Systematic Review for the 2018 ACC/AHA/HRS Guideline on the Evaluation and Management of Patients With Bradycardia and Cardiac Conduction Delay: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol. 2019 Aug 20;74(7):988–1008.
2. Sweeney MO, Hellkamp AS, Ellenbogen KA, Greenspon AJ, Freedman RA, Lee KL, et al. Adverse effect of ventricular pacing on heart failure and atrial fibrillation among patients with normal baseline QRS duration in a clinical trial of pacemaker therapy for sinus node dysfunction. Circulation. 2003 Jun 17;107(23):2932–7.
3. Investigators* TDT. Dual-Chamber Pacing or Ventricular Backup Pacing in Patients With an Implantable DefibrillatorThe Dual Chamber and VVI Implantable Defibrillator (DAVID) Trial. JAMA [Internet]. 2002 Dec 25;288(24):3115–23. Available from: https://doi.org/10.1001/jama.288.24.3115
4. Deshmukh P, Casavant DA, Romanyshyn M, Anderson K. Permanent, Direct His-Bundle Pacing A Novel Approach to Cardiac Pacing in Patients With Normal His-Purkinje Activation [Internet]. Vol. 101, Circulation. 2000. Available from: http://www.circulationaha.org
5. Shimony A, Eisenberg MJ, Filion KB, Amit G. Beneficial effects of right ventricular non-apical vs. apical pacing: A systematic review and meta-analysis of randomized-controlled trials. Vol. 14, Europace. 2012. p. 81–91.
6. Huang W, Su L, Wu S, Xu L, Xiao F, Zhou X, et al. A Novel Pacing Strategy With Low and Stable Output: Pacing the Left Bundle Branch Immediately Beyond the Conduction Block. Canadian Journal of Cardiology. 2017 Dec 1;33(12):1736.e1-1736.e3.
7. Jastrzębski M, Kiełbasa G, Cano O, Curila K, Heckman L, De Pooter J, et al. Left bundle branch area pacing outcomes: the multicentre European MELOS study. Eur Heart J. 2022 Oct 21;43(40):4161–73.
8. Sharma PS, Patel NR, Ravi V, Zalavadia D V, Dommaraju S, Garg V, et al. Clinical outcomes of left bundle branch area pacing compared to right ventricular pacing: Results from the Geisinger-Rush Conduction System Pacing Registry. Heart Rhythm [Internet]. 2022 Jan 1;19(1):3–11. Available from: https://doi.org/10.1016/j.hrthm.2021.08.033
9. De Pooter J. My Preferred Approach to Left Bundle Branch Area Pacing: Stylet-Driven Leads. Heart Rhythm O2. 2022 Feb;
10. Ponnusamy SS, Vijayaraman P. My Preferred Approach to Left Bundle Branch Pacing: Lumenless Leads. Heart Rhythm O2. 2022 Feb;
11. Huang W, Chen X, Su L, Wu S, Xia X, Vijayaraman P. A beginner’s guide to permanent left bundle branch pacing. Heart Rhythm. 2019 Dec 1;16(12):1791–6.
12. de Pooter J, Wauters A, van Heuverswyn F, le polain de Waroux JB. A Guide to Left Bundle Branch Area Pacing Using Stylet-Driven Pacing Leads. Front Cardiovasc Med. 2022 Feb 21;9.
13. Ponnusamy SS, Ganesan V, Syed T, Balasubramanian S, Vijayaraman P. Template Beat: A Novel Marker for Left Bundle Branch Capture During Physiological Pacing. Circ Arrhythm Electrophysiol. 2021 Apr 1;14(4):E009677.
14. Ponnusamy SS, Vijayaraman P. Left bundle branch pacing guided by premature ventricular complexes during implant. HeartRhythm Case Rep. 2020 Nov 1;6(11):850–3.
15. Jastrzębski M, Kiełbasa G, Curila K, Moskal P, Bednarek A, Rajzer M, et al. Physiology-based electrocardiographic criteria for left bundle branch capture. Heart Rhythm [Internet]. 2021 Jun 1;18(6):935–43. Available from: https://doi.org/10.1016/j.hrthm.2021.02.021
16. Ponnusamy SS, Vijayaraman P. Evaluation of Criteria for Left Bundle Branch Capture. Card Electrophysiol Clin [Internet]. 2022;14(2):191–202. Available from: https://www.sciencedirect.com/science/article/pii/S1877918221001222
17. Wu S, Chen X, Wang S, Xu L, Xiao F, Huang Z, et al. Evaluation of the Criteria to Distinguish Left Bundle Branch Pacing From Left Ventricular Septal Pacing. JACC Clin Electrophysiol. 2021 Sep 1;7(9):1166–77.
18. Jastrzȩbski M, Burri H, Kiełbasa G, Curila K, Moskal P, Bednarek A, et al. The V6-V1 interpeak interval: A novel criterion for the diagnosis of left bundle branch capture. Europace. 2022 Jan 1;24(1):40–7.
19. Ponnusamy SS, Vijayaraman P. Concealed left bundle branch potential during physiological pacing. Journal of Interventional Cardiac Electrophysiology [Internet]. 2021;61(1):213–4. Available from: https://doi.org/10.1007/s10840-020-00899-4
20. Jastrzebski M. ECG and Pacing Criteria for Differentiating Conduction System Pacing from Myocardial Pacing. Arrhythm Electrophysiol Rev. 2021 Oct 1;10(3):172–80.
21. Ponnusamy SS, Ganesan V, Vijayaraman P. Loss of Capture During Long Term Follow-Up After Left-Bundle-Branch-Pacing. JACC Clin Electrophysiol [Internet]. 2022; Available from: https://www.sciencedirect.com/science/article/pii/S2405500X22008544
22. Tan ESJ, Lee JY, Boey E, Soh R, Seow SC, Teo LJT, et al. Predictors of loss of capture in left bundle branch pacing: A multicenter experience. Heart Rhythm [Internet]. 2022;19(10):1757–8. Available from: https://www.sciencedirect.com/science/article/pii/S1547527122020641
23. Su L, Wang S, Wu S, Xu L, Huang Z, Chen X, et al. Long-Term Safety and Feasibility of Left Bundle Branch Pacing in a Large Single-Center Study. Circ Arrhythm Electrophysiol. 2021 Feb 1;14(2):E009261.
24. Padala SK, Master VM, Terricabras M, Chiocchini A, Garg A, Kron J, et al. Initial Experience, Safety, and Feasibility of Left Bundle Branch Area Pacing: A Multicenter Prospective Study. JACC Clin Electrophysiol [Internet]. 2020;6(14):1773–82. Available from: https://www.sciencedirect.com/science/article/pii/S2405500X20306022
25. De Pooter J, Ozpak E, Calle S, Peytchev P, Heggermont W, Marchandise S, et al. Initial experience of left bundle branch area pacing using stylet-driven pacing leads: A multicenter study. J Cardiovasc Electrophysiol [Internet]. 2022 Jul 1;33(7):1540–9. Available from: https://doi.org/10.1111/jce.15558
26. Ponnusamy SS, Basil W, Vijayaraman P. Electrophysiological characteristics of septal perforation during left bundle branch pacing. Heart Rhythm [Internet]. 2022;19(5):728–34. Available from: https://www.sciencedirect.com/science/article/pii/S1547527122000339
27. Thaler R, Sinner MF, Joghetaei N, Fichtner S. Early sudden distal conductor fracture of a stylet-driven lead implanted for left bundle branch area pacing. HeartRhythm Case Rep. 2023 Jan 1;9(1):28–30.
28. Mahajan A, Pokharel P, Vijayaraman P. Lead-to-lead interaction leading to left bundle branch area pacing lead failure. HeartRhythm Case Rep. 2022 Feb 1;
29. Vijayaraman P. Extraction of Left Bundle Branch Pacing Lead. JACC Clin Electrophysiol. 2020 Jul 1;6(7):903–4.
30. Ponnusamy SS, Vijayaraman P. Late dislodgement of left bundle branch pacing lead and successful extraction. J Cardiovasc Electrophysiol [Internet]. 2021 Aug 1;32(8):2346–9. Available from: https://doi.org/10.1111/jce.15155
31. Zhu H, Li X, Wang Z, Liu Q, Chu B, Yao Y, et al. New-onset atrial fibrillation following left bundle branch area pacing vs. right ventricular pacing: a two-centre prospective cohort study. EP Europace. 2022 Feb 8;
32. Vijayaraman P, Ponnusamy SS, Cano Ó, Sharma PS, Naperkowski A, Subsposh FA, et al. Left Bundle Branch Area Pacing for Cardiac Resynchronization Therapy: Results From the International LBBAP Collaborative Study Group. JACC Clin Electrophysiol. 2021 Feb 1;7(2):135–47.
33. Feng XF, Yang LC, Zhao Y, Yu YC, Liu B, Li YG. Effects of adaptive left bundle branch–optimized cardiac resynchronization therapy: a single centre experience. BMC Cardiovasc Disord. 2022 Dec 1;22(1).
34. Jastrzębski M, Moskal P, Huybrechts W, Curila K, Sreekumar P, Rademakers LM, et al. Left bundle branch-optimized cardiac resynchronization therapy (LOT-CRT): Results from an international LBBAP collaborative study group. Heart Rhythm [Internet]. 2022 Jan 1;19(1):13–21. Available from: https://doi.org/10.1016/j.hrthm.2021.07.057
35. Vijayaraman P, Zalavadia D, Haseeb A, Dye C, Madan N, Skeete JR, et al. Clinical outcomes of conduction system pacing compared to biventricular pacing in patients requiring cardiac resynchronization therapy. Heart Rhythm [Internet]. 2022 Aug 1;19(8):1263–71. Available from: https://doi.org/10.1016/j.hrthm.2022.04.023
info@herz+gefäss
- Vol. 13
- Ausgabe 2
- April 2023