- Medikamentöse Adipositastherapie – endlich Licht, jedoch auch Schatten
Adipositas wird heute als chronische Erkrankung angesehen, welche das Leben betroffener Menschen sowohl gesundheitlich als auch seelisch erheblich beeinträchtigt. Leider zeigen klassische Therapieansätze, welche alleinig auf kognitive Strategien zur Optimierung des Lebensstils insbesondere des Ess- sowie des Bewegungsverhaltens fokussieren, nur unzureichend Wirkung im Hinblick auf die angestrebte Gewichtsreduktion. Bislang war daher die bariatrische Chirurgie die einzige effektive Methode, das Körpergewicht und die überschüssige Fettmasse von Menschen mit Adipositas nachhaltig zu reduzieren. Erfreulicherweise scheint nun ein Durchbruch in der medikamentösen Adipositasbehandlung gelungen zu sein; ein lang ersehnter Lichtblick in der Adipositastherapie. Doch wo Licht ist, gibt es auch Schatten. Wir möchten hier eine differenzierte Übersicht über praxisrelevante Aspekte der aktuellen und zukünftigen medikamentösen Adipositastherapie geben.
Today, obesity is regarded as a chronic disease that has a considerable impact on the lives of affected people, both in terms of health and mental health. Unfortunately, classical therapeutic approaches, which focus solely on cognitive strategies to optimize lifestyle, in particular eating and exercise behavior, are insufficiently effective in achieving the desired weight reduction. Until now, therefore, bariatric surgery has been the only effective method for sustainably reducing the body weight and excess fat mass of people with obesity. Fortunately, a breakthrough now seems to have been achieved in the pharmacological treatment of obesity; a long-awaited ray of hope in obesity therapy. But where there is light, there is also shadow. We would like to provide a differentiated overview of practical aspects of current and future drug-based obesity therapy.
Key Words: obesity, medical treatment for obesity, GLP-1 analogues
Nach langem Dunkel endlich Licht
Die Entwicklung von Medikamenten zur Gewichtsreduktion war über die letzten Jahrzehnte hinweg eine Geschichte mit Höhen und Tiefen (1, 2). Es wurde eine ganze Reihe an Medikamenten für die Behandlung von Adipositas zugelassen, welche jedoch im Verlauf wieder vom Markt verschwanden, da sie in der breiten Anwendung eine zu hohe Rate an unerwünschten Nebenwirkungen zeigten, welche das Risiko/Nutzen Verhältnis als nicht akzeptabel erscheinen liess. Umso erfreulicher ist es, dass nun Medikamente entwickelt wurden, welche einerseits deutlich effektiver sind, anderseits ein besseres Nutzen-Risiko-Verhältnis aufzuweisen scheinen. Es handelt sich dabei insbesondere um Substanzen, welche als Agonisten am «Glucagon-like peptide-1»/(GLP-1)-Rezeptor wirken. Diese Substanzgruppe kennen wir bereits seit bald 2 Jahrzehnten in der Therapie des Typ-2-Diabetes, wo sie nicht nur einen grossen Nutzen in Bezug auf die glykämische Kontrolle, sondern auch in Bezug auf die Prävention von kardiovaskulären Folgeerkrankungen zeigt. Obgleich bislang bei Menschen mit Adipositas, welche nicht zusätzlich unter einem Diabetes leiden, keine kardiovaskulären Endpunktstudien vorliegen, lassen die Erfahrungen aus dem Bereich der Diabetestherapie jedoch hoffen, dass bereits angelaufene Studien, welche diese Fragestellung untersuchen, ebenfalls positiv ausfallen werden.
Was sind GLP-1-Rezeptoragonisten?
GLP-1 ist ein körpereigenes Hormon, welches von spezialisierten Darmzellen insbesondere nach der Nahrungsaufnahme ausgeschüttet wird. Es handelt sich dabei um ein Peptidhormon, welches innerhalb weniger Minuten in der Blutbahn durch die Dipeptidylpeptidase (DDP) 4 aufgespalten und dadurch deaktiviert wird. GLP-1-Rezeptoragonisten (RA) stellen Analoga des ursprünglichen Hormons dar, welche derart modifiziert wurden, dass sie einerseits nicht durch DPP4 inaktiviert werden, andererseits, beispielsweise mittels Bindung an Albumin, lange in der Blutbahn zirkulieren. Die in der Adipositastherapie eingesetzten Medikamente werden dabei subkutan (s.c.) injiziert, da die Aufnahme von Peptiden über den Gastrointestinaltrakt prinzipiell möglich, jedoch nur mit hohem Aufwand zu erreichen ist.
Welche GLP-1-RA gibt es für die Adipositastherapie?
Für die Adipositastherapie sind in der Schweiz aktuell zwei Substanzen zugelassen. Unter dem Namen Saxenda® ist Liraglutid bereits seit einigen Jahren im Einsatz und wird aktuell unter Erfüllung der in der Spezialitätenliste definierten Limitatio von den Krankenkassen über maximal 3 Jahre finanziert (Tab. 1). Das Zweite von der Swissmedic für die Adipositastherapie zugelassene Medikament trägt den Namen Wegovy® und beinhaltet die Substanz Semaglutid, welche in der Diabetestherapie unter dem Namen Ozempic® gut bekannt ist. Obgleich zugelassen, ist Wegovy® aufgrund der grossen Nachfrage in den USA auf dem Europäischen sowie Schweizer Markt aktuell noch nicht verfügbar. Im Unterschied zu den in der Diabetestherapie eingesetzten Dosen werden für die Adipositastherapie deutlich höhere Dosen der entsprechenden Substanzen eingesetzt. Konkret beträgt die Höchstdosis von Saxenda® 3 mg s.c. pro Tag sowie bei Wegovy® 2.4 mg s.c. einmal pro Woche.
Eine dritte Substanz, welche bislang zwar nicht für die Adipositastherapie zugelassen ist, jedoch in einer grossen Phase-3-Studie bei Menschen mit Adipositas bereits getestet wurde, möchten wir hier ebenfalls vorstellen. Dieses designte Peptid namens Tirzepatid wirkt sowohl agonistisch am GLP-1-Rezeptor als auch am Rezeptor des glukoseabhängigen insulinotropen Polypeptids (GIP). Erwähnenswert ist, dass diese auch als Bi-Agonist bezeichnete Substanz von der Swissmedic bereits zur Therapie des Typ-2-Diabetes unter dem Namen Mounjaro® (3) zugelassen ist. Ebenfalls aufgrund einer hohen Nachfrage in den USA, welche offensichtlich die momentanen Produktionskapazitäten übersteigt, ist das Medikament auf dem Europäischen sowie Schweizer Markt bislang noch nicht verfügbar. Aktuell ist es für den Beginn von 2024 für den Einsatz in der Diabetesbehandlung angekündigt.
Wie wirken die Medikamente in der Adipositastherapie?
Haupteffekt der genannten Medikamente ist eine Verminderung des Appetits sowie eine frühzeitige Sättigung nach der Nahrungsaufnahme (4–7). Experimentelle Untersuchungen konnten zeigen, dass durch die Gabe von GLP-1-RA die Verarbeitung von Nahrungsreizen im Gehirn deutlich beeinflusst wird (8). Dies erleichtert es betroffenen Personen, Kontrolle über ihr Essverhalten auszuüben, um eine Energierestriktion zu erreichen. Leider gibt es jedoch auch Hinweise darauf, dass die Appetit-reduzierenden Effekte nach einer längeren Behandlungsdauer etwas nachlassen respektive von Gegenregulationsmechanismen teilweise überspielt werden (5), was zu einem Wiederanstieg des Körpergewichts führen könnte. In der Tat zeigte eine über 3 Jahre durchgeführte Studie bei Personen mit Prädiabetes, dass die nach etwa einem Jahr erreichte Gewichtsreduktion von 9.2% trotz fortgeführter Behandlung mit 3 mg Liraglutid nicht ganz erhalten werden konnte, sodass die Nettogewichtsreduktion nach
3 Jahren nur noch 7.1% betrug. Bezüglich 2.4 mg Semaglutid zeigte eine kürzlich veröffentlichte Studie, dass die nach 68 Wochen erreichte, maximale Gewichtsreduktion unter einer fortgeführten Behandlung im anschliessenden zweiten Jahr auf stabilem Niveau gehalten werden konnte (9) (Mittlerer Gewichtsverlust nach 2 Jahren 15.2%).
Dosis-Wirkung-Beziehung
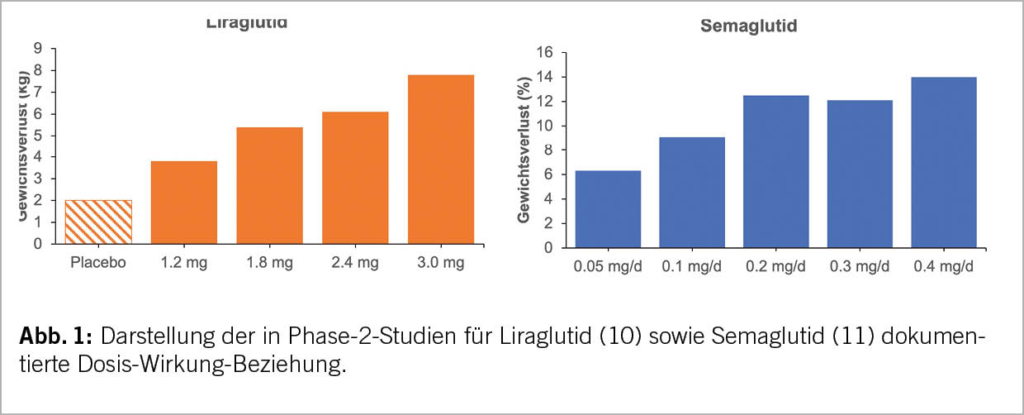
Weniger mit Adipositasmedizin vertraute Leserinnen und Leser wird es möglicherweise überraschen, dass bei Anti-Adipositas-Medikamenten ebenso wie in anderen pharmakologischen Bereichen der Medizin eine klare Dosis-Wirkung-Beziehung besteht. Abbildung 1 illustriert sowohl für Liraglutid als auch für Semaglutid diese Dosis-Wirkung-Beziehung aus Phase-2-Studien (10, 11). Für die klinische Praxis ist dies von grosser Bedeutung, da sich durch eine Dosisanpassung des verabreichten GLP-1-RA die Entwicklung des Körpergewichtes bei den meisten Patienten recht gut voraussehen und ggf. auch steuern lässt.
Effektivität der Anti-Adipositas-Medikamente
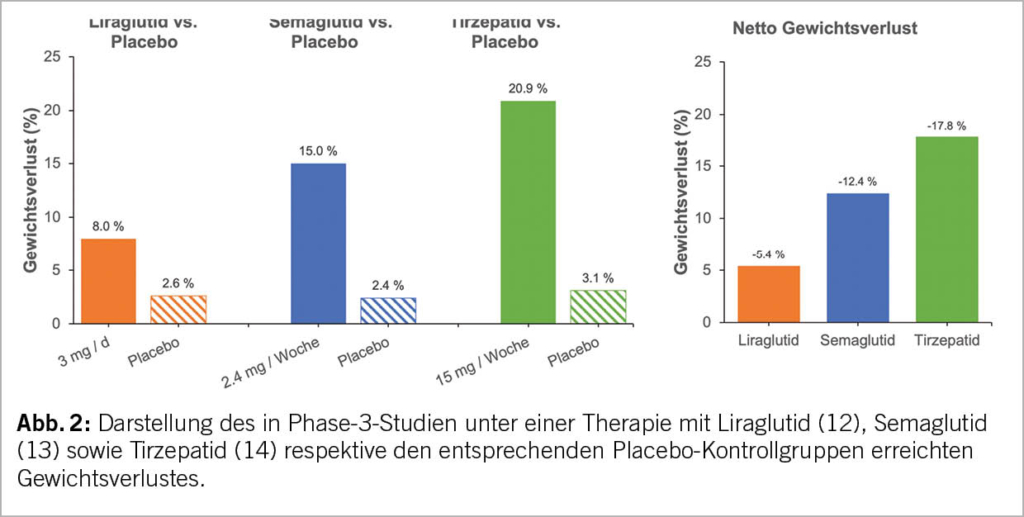
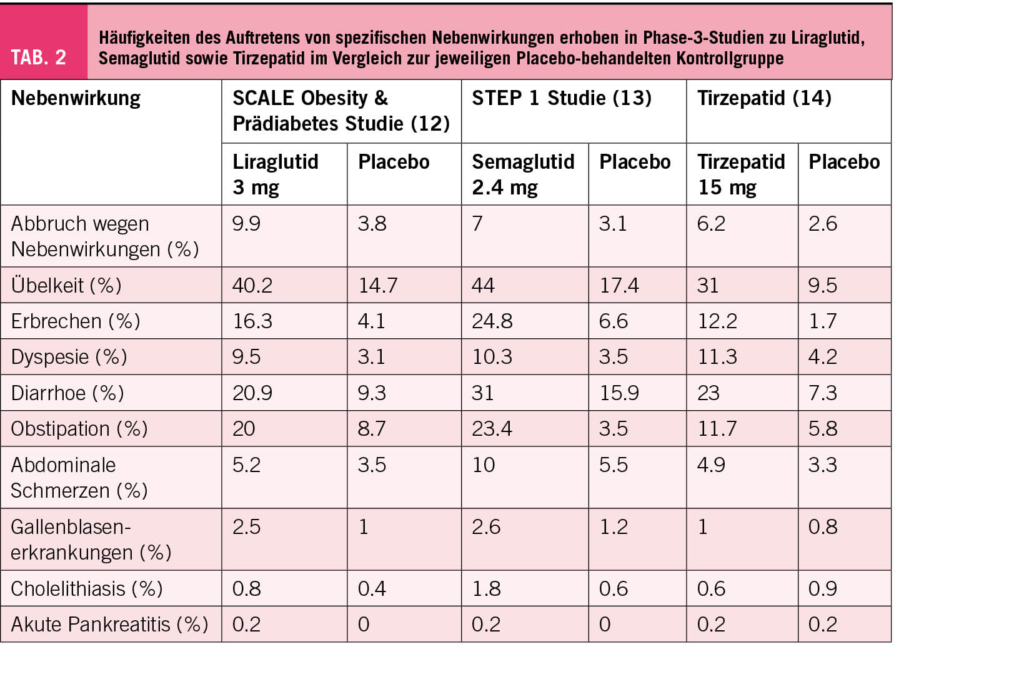
Um die Effektivität der erwähnten Substanzen darzustellen, haben wir die Daten von drei grossen Phase-3-Studien zusammengefasst (12–14). Aus streng wissenschaftlicher Sicht ist diese Gegenüberstellung nicht valide, da es sich nicht um ganz vergleichbare Untersuchungskollektive handelt. Auch die Basistherapie im Sinne einer Lifestyleintervention, welche sowohl die Verum- als auch die Placebo-Gruppen erhielten, war zwischen den Studien nicht identisch. Der Body-Mass-Index (BMI) zu Beginn der Behandlung war mit 38 kg/m2 in den unterschiedlichen Behandlungsgruppen sowie auch die Behandlungsdauer (Liraglutid und Tirzepatid 72 Wochen, Semaglutid 68 Wochen) jedoch gut vergleichbar. An dieser Stelle sei nochmals explizit erwähnt, dass Tirzepatid nicht zur Behandlung der Adipositas zugelassen ist und dass wir uns bei der Darstellung der Ergebnisse auf die höchste, der in der Studie eingesetzten Tirzepatid Dosen von 15 mg s.c. pro Woche beschränken.
Wie in Abbildung 2 gut erkennbar, ist 2.4 mg Semaglutid einmal pro Woche s.c. deutlich wirksamer bzgl. Gewichtsreduktion als die tägliche Applikation von 1 mg Liraglutid. Noch effektiver scheint jedoch die wöchentliche Gabe von 15 mg Tirzepatid zu sein. Da auch in den Placebogruppen, wohl aufgrund der gleichzeitigen Lebensstilintervention, das Gewicht etwas abnahm, ist immer der medikamentöse Nettoeffekt jeweils durch Subtraktion des in der Placebogruppe erzielten Gewichtsverlusts von dem der medikamentösen Behandlungsgruppe zu errechnen (Abb. 2).
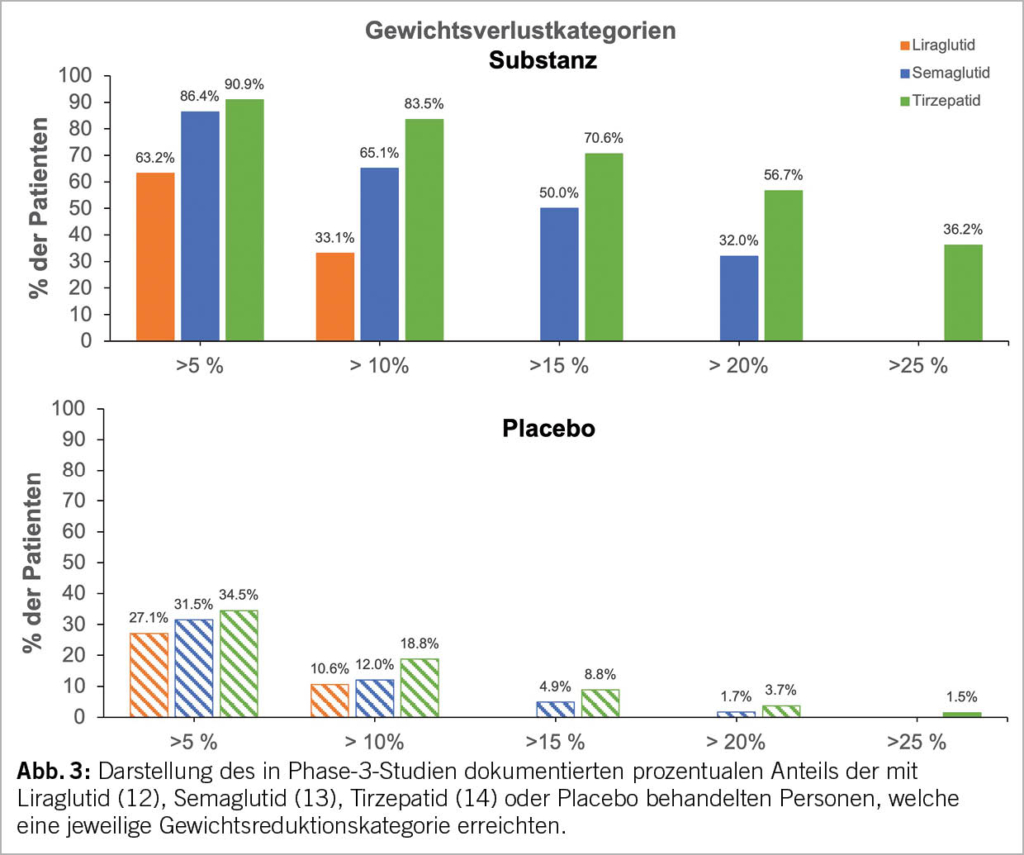
Eine klinisch relevante, in der klinischen Adipositasforschung übliche Darstellungsweise ist auch die Angabe des prozentualen Anteils der behandelten Personen in verschiedenen Gewichtsreduktionskategorien. Wie in Abbildung 3 ersichtlich, zeigten deutlich mehr Personen unter Semaglutid als unter Liraglutid eine erfolgreiche Gewichtsreduktion, wobei sich die Erfolgsquote unter Tirzepatid nochmals deutlich erhöht zeigte.
Insgesamt sind die gewichtsreduzierenden Effekte der beschriebenen Medikamente sehr beeindruckend und scheinen sich der Effektivität von bariatrischen Operationen wie dem Roux-en-Y-Magenbypass oder der Schlauchmagenresektion, welche einen langfristigen Gewichtsverlust von etwa 25 bis 30% generieren, anzunähern (15).
Die Medikamente wirken nur solange man sie einsetzt
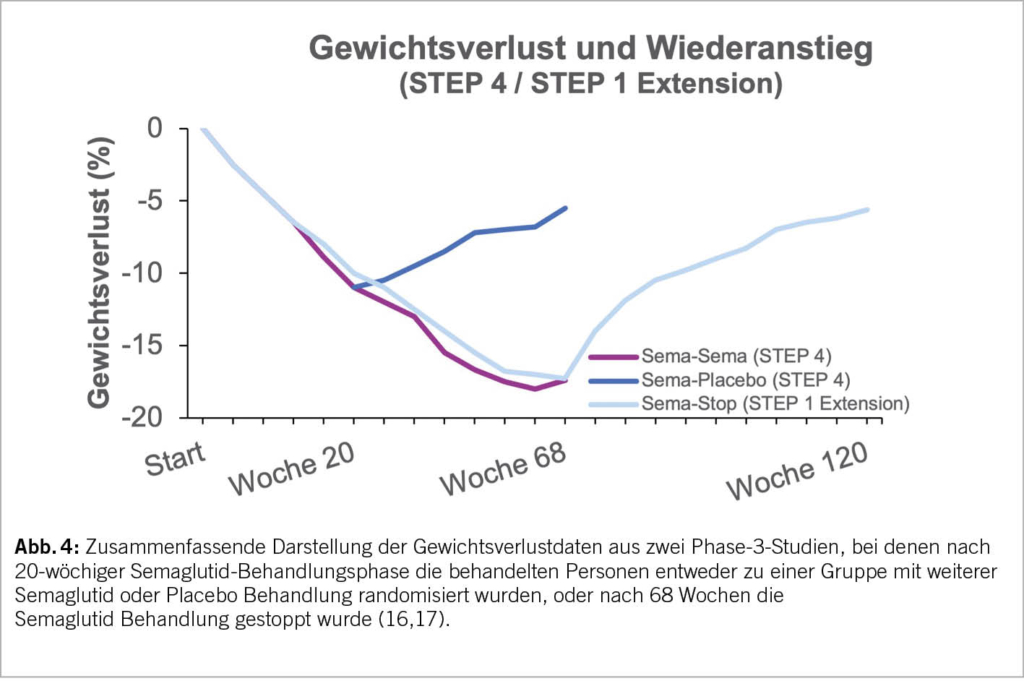
Adipositas ist eine chronische Erkrankung. Wir gehen heute davon aus, dass ein einmal erreichtes Körpergewicht im Sinne eines «Setpoints» über komplexe Regulationsmechanismen gegen Gewichtsreduktionsbemühungen sehr effektiv verteidigt wird. Wissenschaftliche Untersuchungen zeigen konsistent, dass es zu einem Wiederanstieg des Körpergewichtes kommt, sobald die Therapie, sei es eine Ernährungs- oder Bewegungs-Intervention, eine medikamentöse Therapie oder auch eine invasive Therapie, wie ein Magenballon oder Magenband, beendet wird. Dieses Grundprinzip der Adipositasmedizin wurde auch für die Behandlung mit Semaglutid einmal mehr eindrucksvoll dokumentiert. Abbildung 4 fasst zur Illustration die Daten der STEP 4 (16) sowie der STEP 1 trial extention Studie (17) zusammen. In der STEP 4 Studie wurden die eingeschlossenen Personen nach einer 20-wöchigen Semaglutid Behandlung, entweder zu je einer Gruppe mit weiteren Semaglutid- oder Placebo-Gaben randomisiert. In der STEP 1 trial extention Studie wurde Semaglutid nach 68 Wochen gestoppt. Es zeigte sich, dass es nach einem Wechsel auf Placebo oder nach Semaglutid-Stopp zu einem zügigen Wiederanstieg des Körpergewichts kam. Folglich sollte eine medikamentöse Adipositasbehandlung eine Dauertherapie darstellen, um langfristig erfolgreich zu sein.
Sowohl auf therapeutischer Seite als auch auf Patientenseite besteht jedoch oft noch die Vorstellung, dass man das Gewicht nur einfach reduzieren müsse und es dann ohne weitere pharmakologische oder chirurgische Massnahmen und ohne Ausübung einer dauerhaften, extrem ausgeprägten kognitiven Kontrolle auf dem reduzierten Niveau persistiere. Vor dem Hintergrund der wissenschaftlichen Evidenz ist diese Wunschvorstellung leider als veraltet und naiv zu bezeichnen. Vielmehr muss gerade vor diesem Hintergrund gefordert werden, dass vor Einleitung einer medikamentösen Adipositastherapie eine differenzierte Aufklärung über den zu erwartenden Wiederanstieg des Körpergewichts nach Beendigung der pharmakologischen Therapie erfolgen muss und für ein neues Krankheitsverständnis mit dauerhafter Behandlungsnotwendigkeit analog zur medikamentösen Therapie des Cholesterins oder des Blutdrucks geworben werden sollte.
Was sind die Schattenseiten?
Wie die meisten medikamentösen Therapien haben auch die beschriebenen Medikamente der Adipositastherapie Nebenwirkungen. Eine Übersicht der in den drei analysierten Studien vermehrt beobachteten Nebenwirkungen haben wir in Tabelle 2 zusammengefasst. Dabei stehen gastrointestinale Beschwerden klar im Vordergrund. Diese treten meist zu Beginn der Behandlung auf und lassen sich durch eine langsame Dosissteigerung oft limitieren. Im weiteren Verlauf verschwinden sie dann häufig oder reduzieren sich zumindest auf ein akzeptables Ausprägungsniveau. Es gibt jedoch auch Personen, welche die Medikamente schlichtweg nicht vertragen oder ein unzureichendes Ansprechen auf die Therapie zeigen. In dieser Situation sollte die Therapie frühzeitig beendet werden.
Als klinisch wohl relevanteste Nebenwirkungen ist die erhöhte Inzidenz von symptomatischen Gallensteinen zu erwähnen, welche auch zu einer erhöhten Rate an Cholecystektomien führt. Dabei ist die vermehrte Gallensteinbildung nicht als unmittelbare Folge der medikamentösen Therapie zu sehen, sondern als Folge der Gewichtsreduktion, da auch andere gewichtsreduzierende Behandlungen, wie die Durchführung einer sehr energierestriktiven Diät oder einer bariatrischen Operation, zu einer erhöhten Gallenstein-Inzidenz führen.
Sorge bereitet ein unkritischer Einsatz der Medikamente
Die oben beschriebenen Nebenwirkungen erachten wir insgesamt als unproblematisch und gehen davon aus, dass sie das Risiko-Nutzen-Verhältnis auch im Langzeitverlauf nicht wesentlich verschieben werden. Grössere Sorge macht uns der zunehmend unkritische Einsatz der Medikamente insbesondere im Selbstzahlerbereich, welcher keiner Regulation unterliegt. So können wir sowohl in unserem Umfeld als auch in den Massenmedien und auf Social-Media-Kanälen beobachten, dass es einen riesigen Hype um die beschriebenen Medikamente gibt. So werden sie offensichtlich nicht selten auch ohne eine medizinische Indikation unter der Motivation der subjektiven Selbstoptimierung des Körpergewichts eingesetzt. Während das Risiko-Nutzen-Verhältnis bei gegebener medizinischer Indikation aufgrund des übergewichts-bedingten, erhöhten gesundheitlichen Risikos zugunsten des Nutzens liegt, ist dies bei Personen mit nur geringem Übergewicht sowie damit fehlenden assoziierten Komorbiditäten oder gar bei Normalgewicht mit hoher Wahrscheinlichkeit nicht der Fall.
Potenziell problematisch ist auch der unreflektierte Einsatz der Medikamente bei Frauen im gebärfähigen Alter, welche keine konsequente Antikonzeption durchführen, und bei Frauen, die noch einen offenen Kinderwunsch hegen. Da bislang keine Daten hinsichtlich des Einsatzes der Medikamente während der Schwangerschaft vorliegen, muss die medikamentöse Therapie vor dem Eintritt einer Schwangerschaft, spätestens jedoch mit Feststellen einer Schwangerschaft abgesetzt werden. Der dann zu erwartende, rapide Wiederanstieg des Gewichtes könnte den Schwangerschaftsverlauf erheblich komplizieren sowie auch langfristig die metabolische Entwicklung des heranwachsenden Kindes über epigenetische Mechanismen der fetalen Programmierung ungünstig beeinflussen. Aus unserer Sicht besteht diesbezüglich ein dringender wissenschaftlicher Klärungsbedarf, damit therapiebedürftige Frauen adäquat aufgeklärt und beraten werden können (18). Im Hinblick auf diese Problematik und der Unwahrscheinlichkeit von durchführbaren Anwendungsstudien in dieser Fragestellung ist es um so wichtiger, Schwangerschaften unter GLP-1-RA zu sammeln und wissenschaftlich auszuwerten. Wir möchten daher Kollegen und Kolleginnen, die Patientinnen mit eingetretener Schwangerschaft unter aktiver Therapie betreuen, ermuntern diese zu melden (19).
Wo liegt die Grenze zwischen Lifestyle und medizinischer Indikation?
Wir wissen heute sehr gut, dass das allein quantitative Ausmass des Übergewichtes gemessen am BMI wenig über die gesundheitliche Gefährdung der betroffenen Person aussagt. Fettverteilungsmuster, Fettzellvolumen, Ausmass der subklinischen Inflammation sowie der Insulinresistenz, genetische und epigenetische Prägung und viele weitere Faktoren entscheiden, ob und wann Übergewicht respektive Adipositas zu gesundheitlichen Problemen führt. Nicht vergessen werden sollten jedoch auch die funktionellen Einschränkungen sowie psychosozialen und sozioökonomischen Folgen der Adipositas, welche das Leben von betroffenen Menschen deutlich erschweren. In der klinischen Praxis ist es daher unerlässlich, eine sorgfältige Evaluation durchzuführen, bevor eine Behandlungsempfehlung abgegeben und gegebenenfalls eine Behandlung eingeleitet werden kann.
Die Limitatio der Spezialitätenliste definiert als Kriterium für eine Kostenübernahme einer Behandlung mit Saxenda® einen BMI von >28 (bis 35) kg/m2 verbunden mit dem Bestehen mindestens einer Übergewichts-assoziierten Komorbidität wie Prädiabetes, Dyslipidämie oder arterieller Hypertonie (Tab. 3). Einerseits macht die Konzentration der Finanzierung der Therapie auf Personen mit entsprechenden Komorbiditäten aus unserer Sicht Sinn, andererseits kann jedoch die explizite Einschränkung auf einzelne Komorbiditäten problematisch sein. Neben dieser BAG-seitig willkürlich definierten Komorbiditäten könnte man ebenso als finanzierungsbegründende Komorbiditäten das Schlafapnoesyndrom oder die Steatosis hepatis respektive Steatohepatitis aufführen. Ebenso sollten funktionelle Einschränkungen wie beispielsweise eine Gonarthrose sowie auch psychosoziale Beeinträchtigungen durch das Übergewicht Berücksichtigung finden. Letztlich ist es wie immer Aufgabe der ärztlichen Tätigkeit, eine differenzierte Abwägung hinsichtlich einer potenziellen Behandlungsindikation vorzunehmen.
Strukturierte Begleitung immer notwendig
Generell sollte der Einsatz der beschriebenen Anti-Adipositas-Medikamente strukturiert begleitet werden, so wie dies auch in den Zulassungsstudien immer der Fall war. Durch die Medikation wird das Essverhalten der behandelten Person erheblich beeinflusst, so dass es insbesondere darum geht, dass nicht nur eine quantitative Veränderung der Ernährung, sondern auch eine qualitative Anpassung stattfindet. Eine begleitende, qualifizierte Ernährungsberatung sowie ggf. auch Trainingstherapie kann hierbei unterstützend sehr wirksam sein (20).
Fehlende Finanzierung der Dauerbehandlung
Aktuell ist die Finanzierung der medikamentösen Adipositastherapie zeitlich aktuell auf maximal 3 Jahre limitiert. Wir müssen leider davon ausgehen, dass sich dies zumindest kurzfristig auch nicht grundlegend ändern wird. Da es sich bei der Adipositas jedoch um eine chronische Erkrankung handelt und mit einem zügigen Wiederanstieg des Gewichts nach Absetzen der Medikation zu rechnen ist, macht eine zeitliche Begrenzung der Therapiefinanzierung medizinisch gesehen keinen Sinn. Eine Selbstfinanzierung der Therapie ist für viele betroffene Personen aufgrund ihrer sozioökonomischen Schlechterstellung nicht realistisch und aus unserer Sicht vor dem Hintergrund des Anspruchs auf soziale Gerechtigkeit auch nicht akzeptabel. Genau wie die bariatrisch-chirurgischen
Therapien sollte die Durchführbarkeit einer medikamentösen Therapie nicht von dem sozial-ökonomischen Status der betroffenen Person abhängig sein. Es kann nicht sein, dass es am Ende heisst: «Medikamente für Reiche, Operationen für Arme». Um eine solche Entwicklung zu verhindern, ist es dringend erforderlich, dass die Adipositas in der Gesellschaft, von Gesundheitsfachpersonen sowie insbesondere von regulatorischen Entscheidungsträgern endlich als chronische Erkrankung anerkannt wird.
Zweitabdruck aus «der informierte arzt» 03-2023
Copyright bei Aerzteverlag medinfo AG
Stoffwechselzentrum St. Gallen, friendlyDocs AG
Lerchentalstrasse 21
9016 St. Gallen
stoffwechselzentrum@friendlydocs.ch
Praxis für Endokrinologie, Diabetes & Adipositas
Baslerstrasse 30
4600 Olten
endokrinologie-olten@hin.ch
Prof. Dr. med. Bernd Schultes gibt an, Vortragstätigkeiten für die Firmen Novo Nordisk und Eli Lilly durchzuführen sowie an advisory boards dieser Firmen teilzunehmen. Diese Firmen produzieren und/oder Erforschen u.a. Arzneimittel zur Behandlung von Adipositas.
Zudem war er als Investigator an klinischen Studien der Firma Novo Nordisk beteiligt.
Dr. rer. hum. biol. Barbara Ernst gibt an, als Studienkoordinatorin an
klinischen Studien der Firma Novo Nordisk beteiligt gewesen zu sein.
Prof. Dr. med. Gottfried Rudofsky gibt an, Vortragstätigkeiten für die
Firmen Novo Nordisk und Eli Lilly durchzuführen sowie an advisory boards dieser Firmen teilzunehmen. Zudem war er als Investigator an klinischen Studien der Firma Novo Nordisk beteiligt.
◆ Die Entwicklung neuer Anti-Adipositas Medikamente stellt einen
enormen Fortschritt in der Adipositasmedizin dar und wird dabei
helfen, die Erkrankung effektiver zu behandeln.
◆ Eine medikamentöse Adipositastherapie sollte immer strukturiert begleitet werden.
◆ Vor Verordnung eines Medikaments ist darauf hinzuweisen, dass diese Therapie als dauerhafte Therapie zu verstehen ist und die Kosten der Medikation nach maximal 3 Jahren von den Betroffenen wahrscheinlich selbst zu tragen sind.
◆ Zu behandelnde Personen sind im Hinblick auf den zu erwartenden Wiederanstieg des Körpergewichts nach Absetzen der Therapie sowie über die unklare Situation bezüglich einer eventuell eintretenden Schwangerschaft explizit aufzuklären.
◆ Ein unkritischer Einsatz der Medikamente sollte auch im Selbstzahlerbereich unbedingt vermieden werden.
◆ Die Möglichkeit einer medikamentösen Behandlung der Adipositas sollte nicht vom sozioökonomischen Status der betroffenen Person abhängig sein. Es ist daher eine dauerhafte Finanzierung der Therapie bei gegebener Indikation anzustreben.
1. Schultes B. Pharmacological Interventions against Obesity: Current Status and Future Directions. Visc Med. 2016 Oct;32(5):347–51.
2. Schultes B. Medikamentöse Therapie der Adipositas – Aerzteverlag medinfo AG [Internet]. [cited 2023 Feb 6]. Available from: https://www.medinfo-verlag.ch/medikamentoese-therapie-der-adipositas/
3. Swissmedic 2019 © Copyright. Mounjaro®, Injektionslösung in einem Fertigpen (Tirzepatidum) [Internet]. [cited 2023 Feb 6]. Available from: https://www.swissmedic.ch/swissmedic/de/home/humanarzneimittel/authorisations/new-medicines/mounjaro_injektionsloesung_fertigpen_tirzepatidum.html
4. Blundell J, Finlayson G, Axelsen M, Flint A, Gibbons C, Kvist T, et al. Effects of once-weekly semaglutide on appetite, energy intake, control of eating, food preference and body weight in subjects with obesity. Diabetes Obes Metab. 2017 Sep;19(9):1242–51.
5. Tronieri JS, Wadden TA, Walsh O, Berkowitz RI, Alamuddin N, Gruber K, et al. Effects of liraglutide on appetite, food preoccupation, and food liking: results of a randomized controlled trial. Int J Obes (Lond). 2020 Feb;44(2):353–61.
6. Kadouh H, Chedid V, Halawi H, Burton DD, Clark MM, Khemani D, et al. GLP-1 Analog Modulates Appetite, Taste Preference, Gut Hormones, and Regional Body Fat Stores in Adults with Obesity. J Clin Endocrinol Metab. 2020 May 1;105(5):1552–63.
7. Friedrichsen M, Breitschaft A, Tadayon S, Wizert A, Skovgaard D. The effect of semaglutide 2.4 mg once weekly on energy intake, appetite, control of eating, and gastric emptying in adults with obesity. Diabetes Obes Metab. 2021 Mar;23(3):754–62.
8. Om F, M S, Ma T, F D, B T, A SE, et al. GLP-1 receptors exist in the parietal cortex, hypothalamus and medulla of human brains and the GLP-1 analogue liraglutide alters brain activity related to highly desirable food cues in individuals with diabetes: a crossover, randomised, placebo-controlled trial. Diabetologia [Internet]. 2016 May [cited 2023 Feb 6];59(5). Available from: https://pubmed.ncbi.nlm.nih.gov/26831302/
9. Garvey WT, Batterham RL, Bhatta M, Buscemi S, Christensen LN, Frias JP, et al. Two-year effects of semaglutide in adults with overweight or obesity: the STEP 5 trial. Nat Med. 2022 Oct;28(10):2083–91.
10. Astrup A, Carraro R, Finer N, Harper A, Kunesova M, Lean MEJ, et al. Safety, tolerability and sustained weight loss over 2 years with the once-daily human GLP-1 analog, liraglutide. Int J Obes (Lond). 2012 Jun;36(6):843–54.
11. O’Neil PM, Birkenfeld AL, McGowan B, Mosenzon O, Pedersen SD, Wharton S, et al. Efficacy and safety of semaglutide compared with liraglutide and placebo for weight loss in patients with obesity: a randomised, double-blind, placebo and active controlled, dose-ranging, phase 2 trial. Lancet. 2018 Aug 25;392(10148):637–49.
12. Pi-Sunyer X, Astrup A, Fujioka K, Greenway F, Halpern A, Krempf M, et al. A Randomized, Controlled Trial of 3.0 mg of Liraglutide in Weight Management. N Engl J Med. 2015 Jul 2;373(1):11–22.
13. Wilding JPH, Batterham RL, Calanna S, Davies M, Van Gaal LF, Lingvay I, et al. Once-Weekly Semaglutide in Adults with Overweight or Obesity. N Engl J Med. 2021 Mar 18;384(11):989–1002.
14. Jastreboff AM, Aronne LJ, Ahmad NN, Wharton S, Connery L, Alves B, et al. Tirzepatide Once Weekly for the Treatment of Obesity. N Engl J Med. 2022 Jul 21;387(3):205–16.
15. Peterli R, Wölnerhanssen BK, Peters T, Vetter D, Kröll D, Borbély Y, et al. Effect of Laparoscopic Sleeve Gastrectomy vs Laparoscopic Roux-en-Y Gastric Bypass on Weight Loss in Patients With Morbid Obesity: The SM-BOSS Randomized Clinical Trial. JAMA. 2018 Jan 16;319(3):255–65.
16. Rubino D, Abrahamsson N, Davies M, Hesse D, Greenway FL, Jensen C, et al. Effect of Continued Weekly Subcutaneous Semaglutide vs Placebo on Weight Loss Maintenance in Adults With Overweight or Obesity: The STEP 4 Randomized Clinical Trial. JAMA. 2021 Apr 13;325(14):1414–25.
17. Wilding JPH, Batterham RL, Davies M, Van Gaal LF, Kandler K, Konakli K, et al. Weight regain and cardiometabolic effects after withdrawal of semaglutide: The STEP 1 trial extension. Diabetes Obes Metab. 2022 Aug;24(8):1553–64.
18. Schultes B, Ernst B, Timper K, Puder J, Rudofsky G. Pharmacological interventions for weight loss before conception – putative effects on subsequent gestational weight gain should be considered. International Journal of Obesity. (in press).
19. Swissmedic 2019 © Copyright. Meldung von vermuteten unerwünschten Arzneimittelwirkungen durch Patientinnen und Patienten [Internet]. [cited 2023 Feb 7]. Available from: https://www.swissmedic.ch/swissmedic/de/home/humanarzneimittel/marktueberwachung/pharmacovigilance/patienten-innen.html
20. Lundgren JR, Janus C, Jensen SBK, Juhl CR, Olsen LM, Christensen RM, et al. Healthy Weight Loss Maintenance with Exercise, Liraglutide, or Both Combined. New England Journal of Medicine. 2021 May 6;384(18):1719–30.
21. Spezialitätenliste (SL) – Präparate [Internet]. [cited 2023 Feb 6]. Available from: https://www.xn--spezialittenliste-yqb.ch/ShowPreparations.aspx
22. ElSayed NA, Aleppo G, Aroda VR, Bannuru RR, Brown FM, Bruemmer D, et al. 2. Classification and Diagnosis of Diabetes: Standards of Care in Diabetes—2023. Diabetes Care. 2022 Dec 12;46(Supplement_1):S19–40.
23. Mach F, Baigent C, Catapano AL, Koskinas KC, Casula M, Badimon L, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020 Jan 1;41(1):111–88.
24. Unger T, Borghi C, Charchar F, Khan NA, Poulter NR, Prabhakaran D, et al. 2020 International Society of Hypertension Global Hypertension Practice Guidelines. Hypertension. 2020 Jun;75(6):1334–57
info@herz+gefäss
- Vol. 13
- Ausgabe 2
- April 2023