- Neueste Entwicklungen in der Behandlung der terminalen Herzinsuffizienz
In der Schweiz leben derzeit etwa 200’000 Menschen mit einer Herzinsuffizienz. Epidemiologischen Schätzungen zufolge haben 5% (10’000) davon eine Dyspnoe NYHA III bis IV, befinden sich also in einem fortgeschrittenen Stadium. Die steigende Prävalenz dieser Erkrankung ist auf die Reduktion der Sterblichkeit kardiovaskulärer Erkrankungen und die gesamthaft steigende Lebenserwartung der Bevölkerung zurückzuführen. Die Herzinsuffizienz als solche ist die Endstrecke verschiedenster Herzerkrankungen: Koronare Herzkrankheit, primäre Erkrankung des Myokards (dilatative Kardiomyopathie), Klappenvitien oder andere, seltenere Ursachen.
In Switzerland, about 200’000 people are currently living with heart failure. According to epidemiological estimates, 5% (10’000) of these have NYHA III to IV dyspnea, i.e. are in an advanced stage. The increasing prevalence of this condition is due to the reduction in mortality from cardiovascular disease and the overall increase in life expectancy of the population. Heart failure as such is the final stage of various cardiac diseases: Coronary artery disease, primary myocardial disease (dilated cardiomyopathy), valvular vitiation, or other less common causes.
Key Words: Heart failure, heart transplanttation, organ care system
Herzinsuffizienztherapie
Der unangefochtene Grundpfeiler einer effektiven Herzinsuffizienztherapie ist die Aufdosierung der «Fantastic Four». Dies sind bekanntermassen die Medikamente aus den Wirstoffklassen der ACE-Hemmer/AR(N)i, Beta-Blocker, MRA und SGLT2-Inhibitoren. Interventionell-kardiologische und chirurgische Therapien dienen der Behandlung struktureller Probleme, wie der Beseitigung von Koronarstenosen oder Klappenvitien. Auch die kardiale Resynchronisationstherapie bei erweitertem QRS-Komplex und die Implantation eines Kardioverter-Defibrillators insbesondere bei der ischämischen Kardiopathie stellen beide effektive Therapieoptionen dar. Die Anwendung dieser Therapieoptionen verläuft nach einem Stufenschema der Fachgesellschaften (1).
Goldstandard Herztransplantatation
Nach Ausschöpfung sämtlicher konservativer und interventioneller Optionen und Fortbestehen einer symptomatischen Herzinsuffizienz besteht die Indikation für ein Herzersatzverfahren.
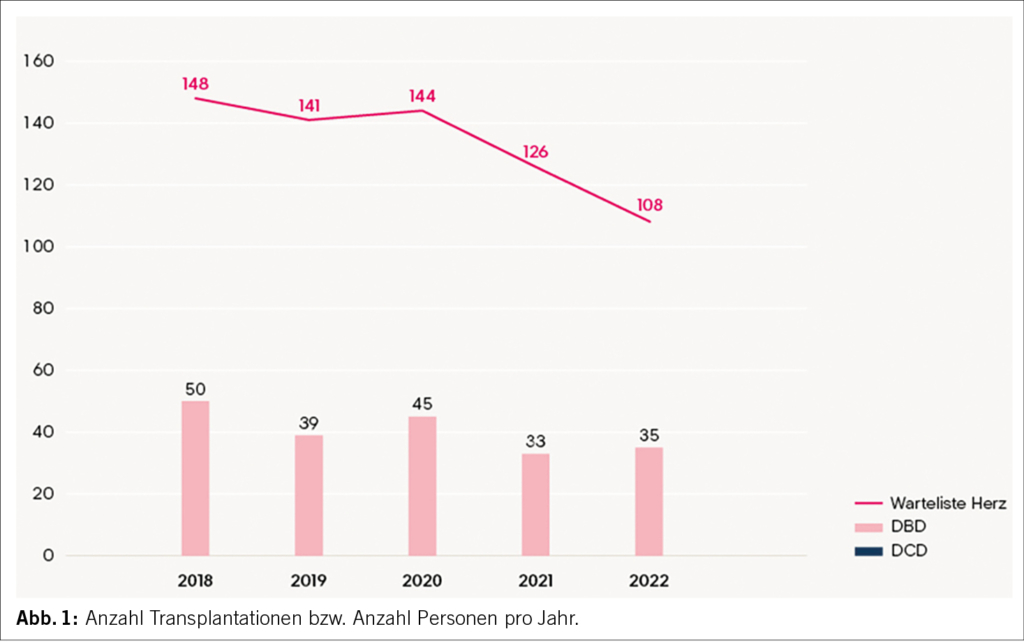
Die Herztransplantation ist der Goldstandard für die Behandlung der terminalen, therapierefraktären Herzinsuffizienz mit über 100’000 Transplantationen seit der Erstimplantation 1967 (2). Aufgrund deutlicher Fortschritte im Bereich der Immunsuppression, Organpräservation, Erkenntnissen der Histokompabilität und Operationstechniken, stellt die Herztransplantation eine effektive Behandlung der terminalen Herzinsuffizienz dar. Das mittlere Überleben nach Herztransplantation beträgt 10-15 Jahre. In der Schweiz wurden jährlich zuletzt 40 Herzen transplantiert. Eine Diskrepanz besteht zwischen Angebot und Nachfrage und viele Patienten versterben auf der Warteliste (Abb. 1). Zudem wird letztendlich nur ein Drittel aller potentiellen Spenderorgane vergeben (3).
Neuerungen zur Erhöhung der Organverfügbarkeit
Somit muss man zwei Kategorien unterscheiden, die letztendlich der Schlüssel zu einer erhöhten Organverfügbarkeit sind. Hier sind auf der einen Seite der potentielle Spender und die Gesetzgebung und auf der anderen Seite die Organqualität zu nennen.
Die erweiterte Widerspruchslösung
Im Bereich des Spenders und der zugehörigen Gesetzgebung hat sich zuletzt sehr viel getan.
So hat sich das Schweizer Stimmvolk am 15. Mai 2022 für die erweiterte Widerspruchslösung ausgesprochen. Bis zur Einführung dieser neuen Modalität der Willensäusserung (frühestens 2025 der Fall), gilt die erweiterte Zustimmungslösung. Ist kein Wille des Verstorbenen bekannt, entscheiden die Angehörigen in dessen Vertretung. Unsicherheiten bezüglich des mutmasslichen Wunsches des nächsten Angehörigen führen so mehrheitlich zur Ablehnung einer Spende.
Bei der zukünftigen erweiterten Widerspruchslösung muss eine Spende zu Lebzeiten aktiv abgelehnt werden. Sonst wird davon ausgegangen, dass ein Spendewille vorliegt. Die Angehörigen könnten dies ablehnen, falls sie Kenntnis davon hätten, dass die Person dies nicht gewollt hätte. Diese Willensäusserung ist fast europaweit Standard, entlastet die Angehörigen und gibt ihnen trotzdem ein Seit Anfang des Jahres wird jetzt auch im Rahmen der Herztransplantation Donation after Cardiocirculatory Death (DCD) praktiziert. Das Herz steht hierbei still, bevor die Organe entnommen werden. Schon vor 2008 in ausgewählten Zentren und schweizweit seit 2011 ist die Transplantation nach Kreislaufstillstand im Bereich der Leber, Nieren und Lungen etabliert und hat die Transplantationszahlen merklich gesteigert (5).
Organ care system
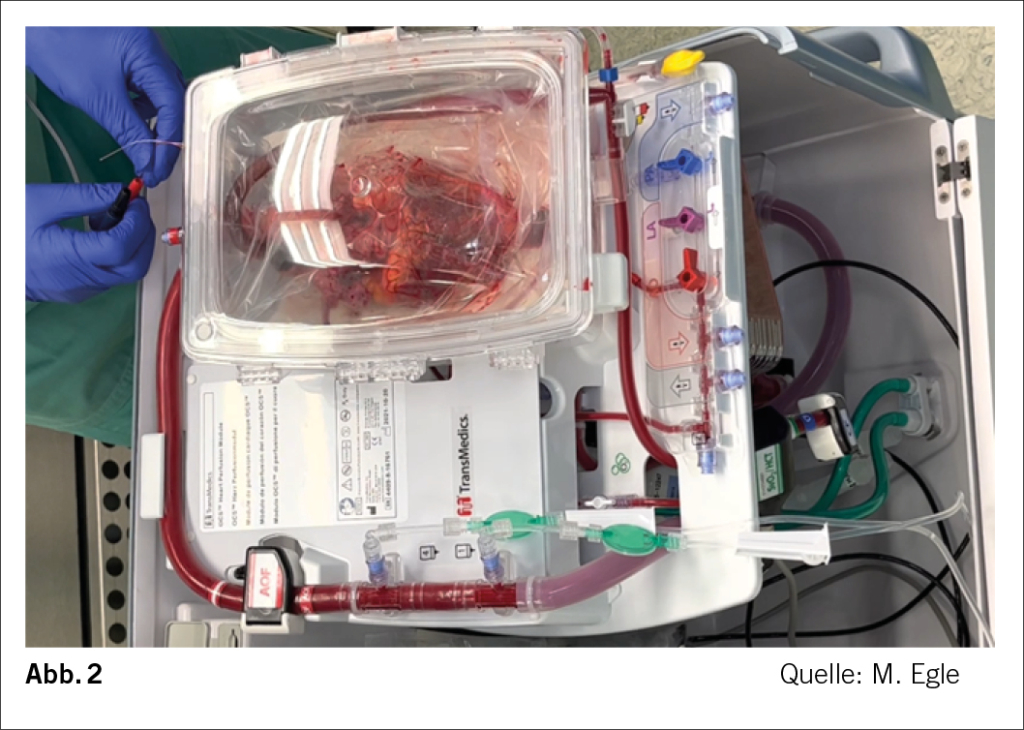
Die Herztransplantation nach dem DCD Prinzip ist jedoch nur mit dem sogenannten Organ Care System (OCS) möglich. Diese technische Neuerung wurde in Vorbereitung auf DCD langjährig geplant und im November letzten Jahres in der Schweiz eingeführt.
Während bei der konventionellen DBD Methode die Herzen nach der Entnahme direkt gekühlt werden und so 4 Stunden zwischen Entnahme und Implantation ohne nennenswerte Schäden verstreichen können, leiden DCD Herzen unter der sogenannten warmen Ischämie im Rahmen des unterschiedlich langen Sterbeprozesses.
Somit bedarf es einer Apparatur, die es uns erlaubt, das Herz nach unterschiedlich langer warmer Ischämie ausserhalb des Körpers zu revitalisieren und auf seine Funktionstüchtigkeit zu prüfen. Das OCS als ex-vivo Perfusions-Apparatur dient genau diesem Zweck (6).
Funktionsweise des Organ Care Systems
Statt des traditionellen Kühlschritts mit Lagerung auf Eis erfolgt beim Organ Care System der Firma TransMedics® eine maschinelle Perfusion. Dabei wird das Spenderorgan mit sauerstoffreichem Blut perfundiert. Diese aktive Perfusion versorgt die Zellen mit Nährstoffen und ermöglicht es dem Organ, weiterhin zu funktionieren und sich zu erholen.
Während des Transports wird das Organ kontinuierlich überwacht. Funktion und Vitalität des Organs entscheiden über die Eignung des Organs als Transplantat (Abb. 2.)
Erweiterte Spenderkriterien
Das OCS ermöglicht uns zudem die Anwendung der sogenannten erweiterten Spenderkriterien, um die Anzahl der Spenderherzen zu erhöhen.
Organe, die unter diese Kategorie fallen, wurden in den vergangenen Jahren aus Angst vor ungewisser Organqualität vermieden. Hierunter fallen Herzen mit reduzierter Pumpfunktion, Herzen älterer Spender (> 55 Jahre), reanimierte Herzen, koronare Herzkrankheit und Alkohol- oder Drogenabhängigkeit beim Spender. Ebenfalls in diese Kategorie gehören geographisch weit entfernte Organe und Verwachsungssituationen bei voroperierten Empfängern, beides Situationen, die zu extrem langen Ischämiezeiten für das Organ führen können.
Sobald eine Ischämiezeit mehr als 4 Stunden beträgt, steigt das Risiko für ein Spenderherzversagen, wobei das Spenderherzversagen der Hauptgrund für die 30 Tages Letalität darstellt (7).
DCD und OCS den traditionellen Verfahren ebenbürtig?
Letzte Daten haben gezeigt, dass die DCD Methode im mittelfristigen Verlauf der DBD Transplantation ebenbürtig ist und auch im OCS für gut befundene Organe aus dem Bereich der erweiterten Spenderkriterien den kalt präservierten Herzen in ihrer Funktion nicht unterlegen sind (8).
Mechanische Kreislaufunterstützung
Eignen sich Patienten aufgrund ihrer Dringlichkeit, ihres Alters oder Komorbiditäten nicht für eine Herztransplantation, stehen uns vielseitige, mechanische Herzunterstützungssysteme zur Verfügung, die je nach Perspektive kurz- oder langfristige Strategien verfolgen.
Kurzfristige mechanische Kreislaufunterstützung
Vor allem im kurzfristigen Unterstützungsbereich haben wir in den letzten Jahren von einem Erfahrungsgewinn profitiert, der es uns zunehmend erlaubt, Patienten zu einer Erholung oder Überbrückung zur Transplantation zu führen, ohne mit deutlich grösserem Aufwand an ein voll implantierbares Unterstützungssystem gehen zu müssen.
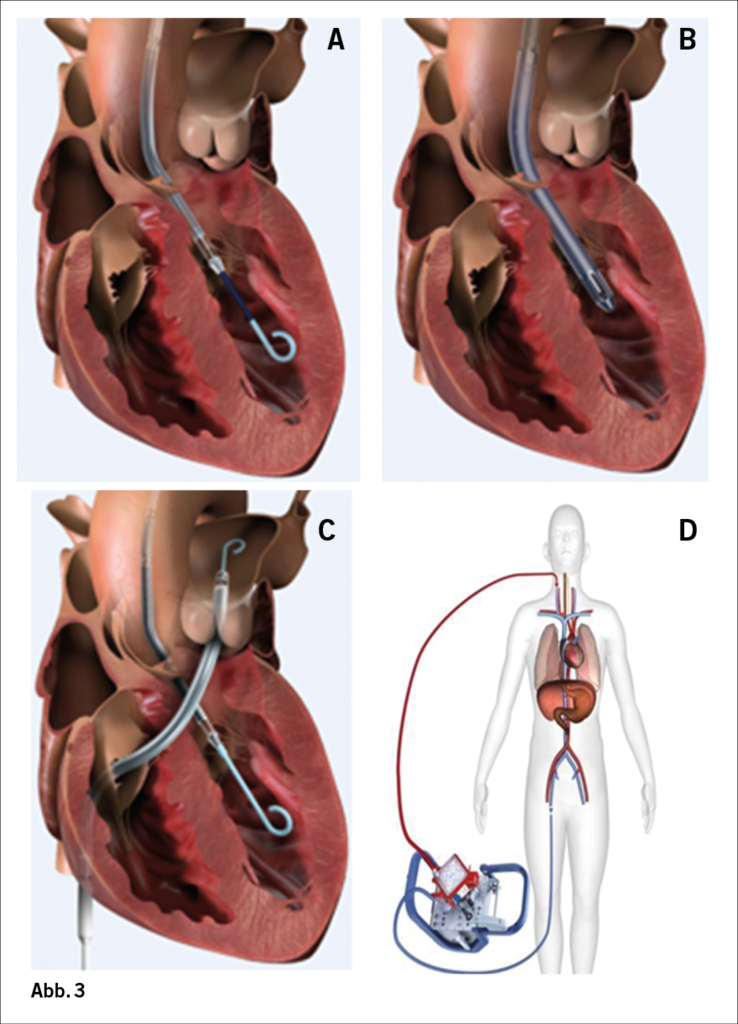
Mit der über die Leiste implantierbaren Impella CP® (Abb. 3A) und der leistungsfähigeren chirurgisch eingelegten Impella 5.5® (Abb. 3B) können wir den Patienten von einer kurzfristigen Unterstützung mit dem alleinigen Ziel der Wiederherstellung der adäquaten Kreislauffunktion in eine Phase der mittelfristigen Stabilisierung überführen, in der die weiteren Strategien mit dem Patienten und seiner Familie diskutiert werden können. Auch kann -neben der Strategie der Erholung und des langsamen Weanings- bei günstiger Blutgruppenkonstellation die hochdringliche Listung zur Transplantation in Erwägung gezogen werden.
Sollte ein zusätzliches Rechtsherzversagen oder Oxygenationsproblem vorliegen, kann die Impella mit einer ECMO (Abb. 3D) oder einem perkutanem Rechtherzunterstützungssystem (Impella RP® oder PROTEK DUO® Kanüle) (Abb. 3C) kombiniert werden.
Langfristige mechanische Kreislaufunterstützung
Für alle weiteren Fälle, in denen die Strategie der kurzfristigen Überbrückung nicht zielführend ist, bieten die langfristigen mechanischen Unterstützungsysteme ebenfalls eine vielversprechende Option zur Überbrückung (Bridge-to-Transplant) oder sogar als Alternative zur Transplantation (Destination), sollten Kontraindikationen gegen diese vorliegen (Alter, prohibitive Nebendiagnosen oder bestimmte psychosoziale Aspekte).
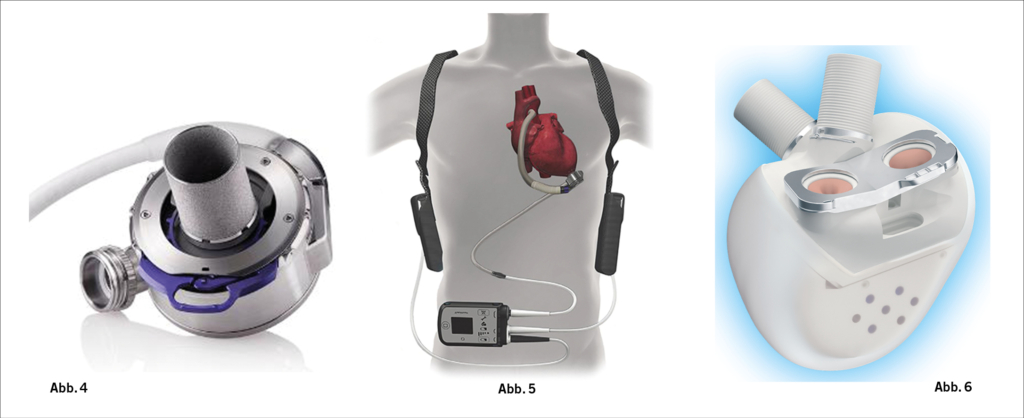
Mit dem HeartMate™ 3 steht uns mittlerweile nur noch ein einziges, dennoch sehr zuverlässiges System zur Verfügung. Hierbei handelt es sich um ein sogenanntes Ventricular assist device (VAD) (Abb. 4). Das native Herz verbleibt am Ort und die Pumpe arbeitet parallel zur verbleibenden Restfunktion des Herzens. Das System ist voll implantierbar. Ein durch die Bauchdecke herausgeleitetes Kabel verbindet das System mit einem am Körper getragen
Kontrollsystem und den Batterien (Abb. 5).
Zwei-Jahres Ergebnisse entsprechen denen der Herztransplantation mit einem Überleben von 80%.
Sollte eine reine Unterstützung des linken Herzens nicht ausreichen, kann neben temporären rechtsventrikulären Unterstützungspumpen auch ein kompletter Herzersatz (Total Artificial Heart) in Erwägung gezogen werden. Für diese Therapieform kann nun ein neues und zuverlässiges Kunstherz (Aeson® von Carmat, Abb. 6)) als Überbrückung bis zu einer Transplantation verwendet werden.
Dr. med. David Reineke 1,
Dr. med. Bruno Schnegg 2,
Dr. med. Monika Fürholz 2,
Dr. med. Michele Martinelli 2,
Prof. Dr. med. Lukas Hunziker 2,
Prof. Dr. med. Matthias Siepe 1
1 Abteilung für Herzchirurgie, Inselspital, Universität Bern, Bern, Schweiz
2 Abteilung für Kardiologie, Inselspital, Universität Bern, Bern, Schweiz
Copyright bei Aerzteverlag medinfo AG
Abteilung für Herzchirurgie
Inselspital, Universität Bern
Bern
Die Autoren haben keinen Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Nach Ausschöpfung sämtlicher “konventioneller” Therapieformen steht uns bei der Behandlung der terminalen Herzinsuffizienz die Herztransplantation und die mechanische Kreislaufunterstützung zur Verfügung. Aufgrund einer Diskrepanz zwischen Anzahl der Spender und Empfänger arbeiten wir über die Gesetzgebung und der Anwendung neuer Techniken daran, diese Kluft zunehmend zu schliessen. Steht uns der Goldstandard der Herztransplantation nicht zur Verfügung, helfen uns kurz- und langfristige Unterstützungssysteme, die Patienten zu stabilisieren, zur erneuten Erholung zu führen oder auch ohne eine Transplantation über viele Jahre eine gute Lebensqualität
zu bieten.
1. Authors/Task Force M, McDonagh TA, Metra M et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). With the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail 2022;24:4–131.
2. Messer S, Ardehali A, Tsui S. Normothermic donor heart perfusion: Current clinical experience and the future. Transpl. Int. 2015; 28:634–642.
3. Sáez D, Zych B, Sabashnikov A, Bowles C, De Robertis F, Mohite, P.N, Simon A. Evaluation of the organ care system in heart transplantation with an adverse donor/recipient profile. Ann. Thorac. Surg. 2014;98:2099–2105.
4. Quelle: www.swisstransplant.org
5. Iyer A, Gao L, Doyle A, Rao P, Cropper J, Soto C, Dinale A, Kumarasinghe G, Jabbour A, Hicks M et al. Normothermic ex vivo perfusion provides superior organ preservation and enables viability assessment of hearts from DCD donors. Am. J. Transplant. 2015;15:371–380.
6. Kothari, P. Ex-Vivo Preservation of Heart Allografts—An Overview of the Current State. J. Cardiovasc. Dev. Dis. 2023;10:105. doi: 10.3390/jcdd10030105.
7. Stehlik J., Edwards L, Kucheryavaya A, Benden C, Christie J, Dipchand A, Dobbels F, Kirk R, Rahmel A, Hertz M. The Registry of International Society of Heart and Lung Transplantation: 29th official adult heart transplant report. J. Heart Lung Transplant. 2012;31:1052-64.
8. Schroder JN, Patel CB, DeVore AD, Bryner BS, Casalinova S, Shah A et al., Transplantation Outcomes with Donor Hearts after Circulatory Death. N Engl J Med. 2023;388:2121-2131.
9. Mehra MR, Goldstein DJ, Cleveland JC, Cowger JA, Hall S, Salerno CT, Naka Y, Horstmanshof D, Chuang J, Wang A, Uriel N. Five-Year Outcomes in Patients With Fully Magnetically Levitated vs Axial-Flow Left Ventricular Assist Devices in the MOMENTUM 3 Randomized Trial. JAMA. 2022;328:1233-1242.
info@herz+gefäss
- Vol. 13
- Ausgabe 4
- September 2023