- Praktische Durchführung der Strain-Analyse und ihre Bedeutung bei verschiedenen Herzkrankheiten
Sowohl im Spital als auch in der kardiologischen Praxis ist die Strain-Analyse des linken Ventrikels (LV) eine fast ubiquitär verfügbare Technik der modernen Echokardiographie. Diese stellt ein äusserst hilfreiches Werkzeug dar, wenn sie technisch korrekt angewandt und die generierten Daten adäquat interpretiert werden. Diese kurze Übersichtsarbeit soll die praktische Anwendung und Beurteilung erläutern und als Hilfe im klinischen Alltag dienen.
Both in the hospital and in cardiology practice, left ventricular (LV) strain analysis is an almost ubiquitously available technique of modern echocardiography. It is an extremely useful tool when used correctly from a technical point of view and when the data generated are adequately interpreted. This brief review is intended to explain the practical application and evaluation and to serve as an aid in everyday clinical practice.
Key Words: Ventricular Function, Left; Strain; Heart Failure; Cardiomyopathy; Hypertrophic; Hypertension
Technische Grundlagen
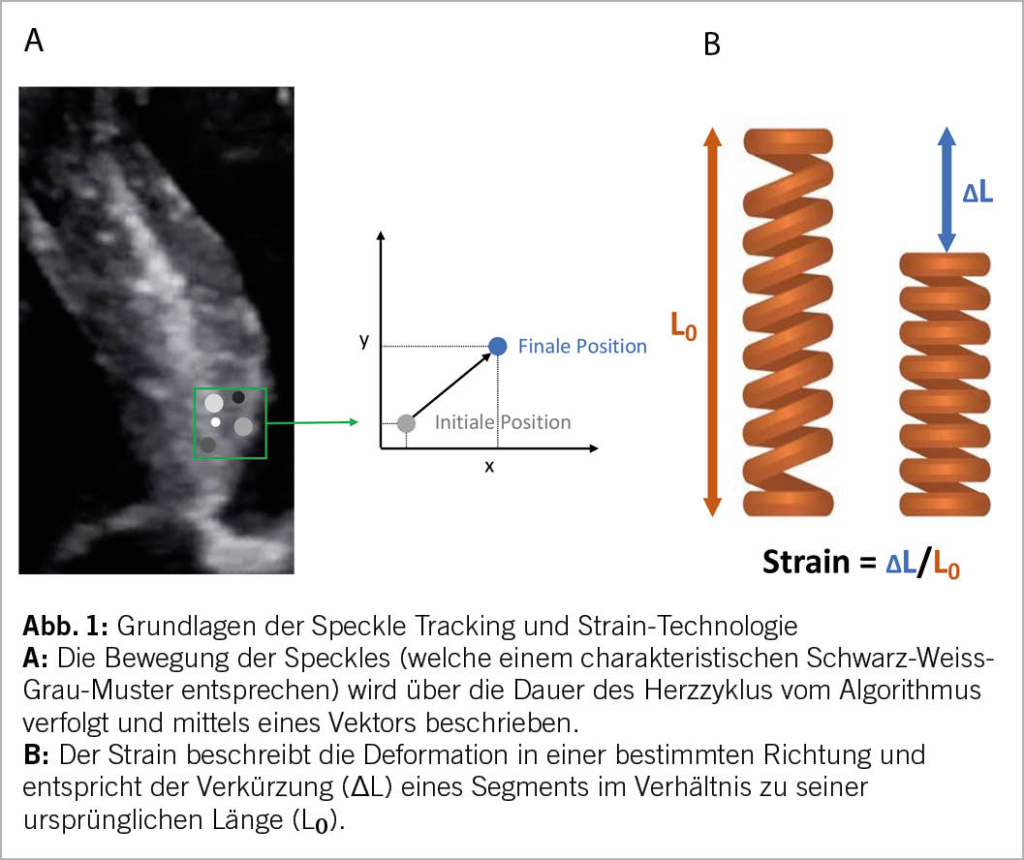
Die Strain-Analyse erfolgt auf der Basis des Konzepts des Speckle Trackings. Dies bedeutet, dass Software-Algorithmen in einem definierten Bildgebiet – der region of interest (ROI) – Schwarz-Weiss-Grau-Muster (Speckles) identifizieren und deren Bewegung über die Zeit (bzw. den Herzzyklus) verfolgen können, ohne dass eine Winkelabhängigkeit von der Position des Schallkopfs besteht (Abb. 1A). Die Speckles bewegen sich innerhalb der ROI relativ zueinander. Aus der festgestellten relativen Verschiebung berechnet der Algorithmus den Strain (entsprechend der Deformation) im jeweiligen myokardialen Segment gemäss der Formel ∆L/L₀ (Abb. 1B) (1).
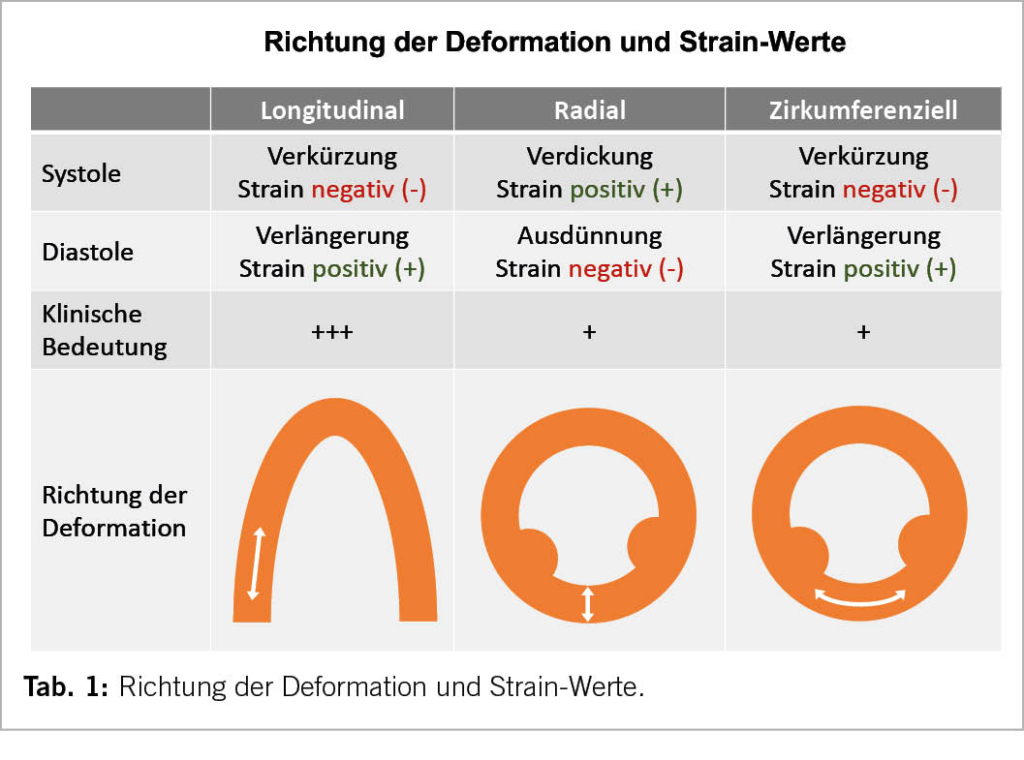
Diese systolische Deformation kann für unterschiedliche Richtungen bestimmt werden (Tab. 1): longitudinal (Verkürzung entlang der Ventrikellängsachse), zirkumferenziell (Verkleinerung des LV-Cavums in der kurzen Achse) und radial (Verdickung des Myokards in der kurzen Achse). Während die systolischen Strain-Werte in longitudinaler und zirkumferenzieller Richtung negativ sind (Verkürzung) ist der radiale systolische Strain positiv (Verdickung) – entsprechend der oben genannten Formel. Diese drei Richtungen bilden unterschiedliche Muskelschichten/-faserrichtungen ab und haben unterschiedliche klinische/prognostische Bedeutung. Am etabliertesten in der klinischen Anwendung ist der longitudinale Strain. Der Strain wird meist als systolischer Maximalwert (longitduinal peak strain) für ein bestimmtes Segment oder gemittelt über alle Segmente (global longitudinal peak strain, GLPS) angegeben. Die Änderung des Strains pro Zeiteinheit wird als Strain-Rate
(1/sec) bezeichnet (2).
Durchführung
Die Strain-Analyse erfolgt im Sinne eines post processings; es werden also erst die Aufnahmen akquiriert und danach die Strain-Analyse auf dem Echokardiographie-Gerät oder an einer Workstation durchgeführt. Die Vorgehensweise ist je nach Hersteller und Softwareversion etwas verschieden, folgt aber jeweils demselben Prinzip (3). Um einen longitudinalen Strain messen zu können, müssen möglichst hochwertige Loops von Vier-, Zwei- und Dreikammerblick aufgenommen werden. Hierbei ist insbesondere darauf zu achten, dass eine Verkürzung des linken Ventrikels vermieden wird und das Myokard möglichst frei von Artefakten in jedem Segment gut abgebildet wird. Translationale (atembedingte) Bewegungen sollten ebenfalls vermieden werden. Die Bildwiederholungsrate (frame rate) sollte dabei >60/sek sein (wobei heutige Programme oft auch tiefere Werte zulassen). Da der Algorithmus darauf angewiesen ist, die Phasen des Herzzyklus korrekt zu bestimmen, braucht es ein gutes EKG-Signal und je nach Software muss der Schluss der Aortenklappe zeitlich festgelegt werden (im Dreikammerblick).
Grundsätzlich ist eine Strain-Analyse auch bei Vorhofflimmern möglich, es muss jedoch auf ein möglichst einheitliches RR-Intervall in den Aufnahmen geachtet werden, damit der Algorithmus angewandt werden kann. Eine andere Möglichkeit ist, ein 3D-Volumen des linken Ventrikels aufzunehmen und die drei Schnittebenen daraus zu rekonstruieren. Die Herausforderung ist es jedoch, das 3D-Volumen mit der notwendigen Volumen-Rate
aufzunehmen.
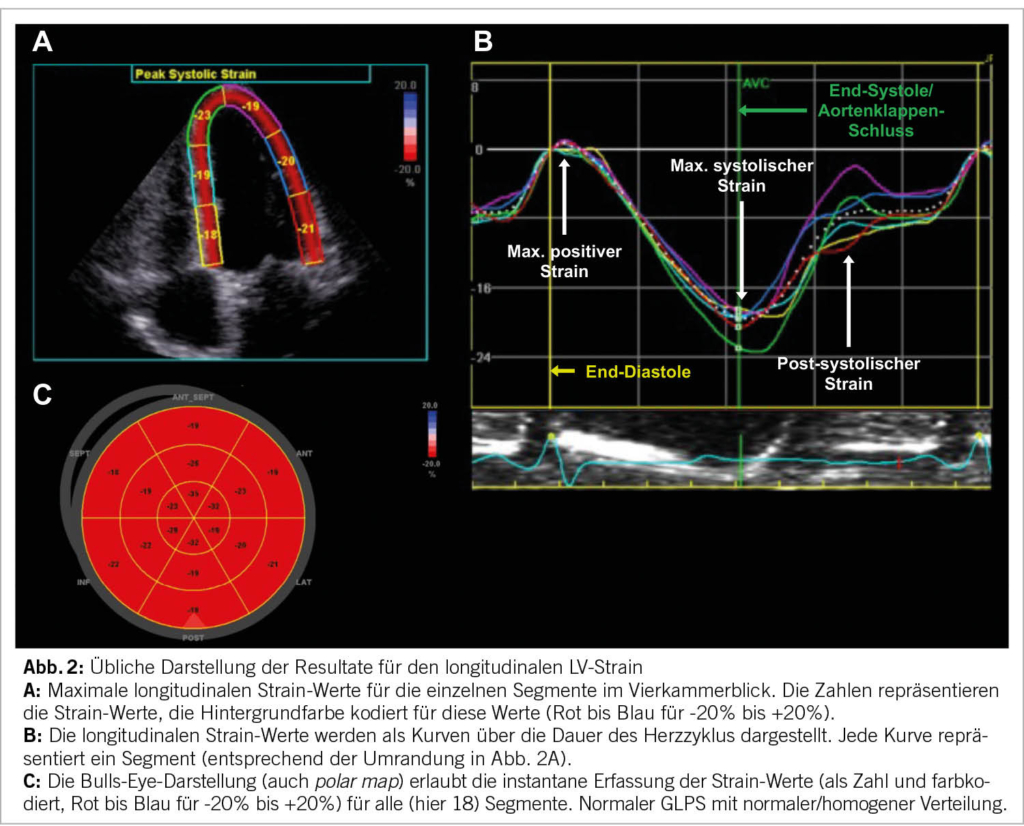
Nun wählt man die drei gewünschten Loops aus. Die neuesten Software-Versionen sind teilweise in der Lage, selbständig die korrekten Schnitte zu erkennen und die technisch geeignetsten auszuwählen. Nun wird die Software gestartet und der Algorithmus detektiert die Endokardgrenzen selbständig und legt die ROI auf das LV-Myokard. Anschliessend ist es wichtig, die korrekte Lage und auch Breite der ROI zu überprüfen und gegebenenfalls im Jojo-Modus (automatische, zeitliche Oszillation, welche die visuelle Erkennung des Endokards vereinfacht) anzupassen. Hier ist es wichtig, darauf zu achten, dass das Perikard nicht innerhalb der ROI liegt, da dieses naturgemäss keine Deformation zeigt und daher zu falsch tiefen Werten führen kann. Die Software teilt nun visuell und rechnerisch das Myokard in ein 17-Segement-Modell (teilweise auch 16 oder 18 Segmente) ein und liefert Werte für die einzelnen Segmente und Mittelwerte für das gesamte Myokard. Klinisch am etabliertesten ist dabei der GLPS, welcher den Mittelwert für die maximale, longitudinale, systolische Deformation in allen Segmenten beschreibt. Es ist möglich, einzelne Segmente von der Analyse auszuschliessen, falls die Bildqualität dort keine verlässliche Analyse zulässt. Üblicherweise werden die Ergebnisse visuell als Werte und farbcodiert in den einzelnen Segmenten der ROI angezeigt (Abb. 2A). Weitaus mehr Information liefert das Diagramm der Strain-Werte über die Dauer des Herzzyklus, dargestellt mittels einer Kurve für jeweils jedes einzelne Segment (Abbildung 2B). Zusätzlich und am anschaulichsten wird das Resultat in einer sogenannten Bulls-Eye-Darstellung (oder polar map) dargestellt, bei der alle einzelnen Segmente in einer einzigen Ansicht ersichtlich sind (Abb. 2C). Hierbei ist insbesondere die farbliche Darstellung der Maximalwerte hilfreich, die eine instantane qualitative Beurteilung zulassen (Rot für negative, Weiss für neutrale und Blau für positive Werte).
Eine dunkelrote Färbung signalisiert also eine starke systolische longitudinale Verkürzung (Kontraktion), eine blaue eine systolische Verlängerung des Segmentes (Dilatation, Dyskinesie). Anstelle der maximalen Strain-Werte können auch die Strain-Rate oder die Zeit bis zur maximalen Kontraktion angezeigt werden.
Interpretation
Für die meisten erhobenen Parameter sind Normwerte verfügbar. Als Faustregel kann ein GLPS-Wert von kleiner (negativer) als -18% als normal angenommen werden; da die Normwerte je nach Hersteller und Softwareversion jedoch variieren, muss der genaue Wert immer beim Herzsteller erfragt werden (4). Im Gegensatz zur am häufigsten angewandten Methode zur Quantifizierung der systolischen LV-Funktion – der Bestimmung der Auswurffraktion (LVEF) nach Simpson – zeigt die Bestimmung des GLPS eine niedrigere Inter- und Intraobserver-Variabilität und stellt daher einen sehr robusten Parameter dar. Ausserdem hat sich in vielen Studien gezeigt, dass der GLPS die systolische Funktion des LV zuverlässiger bestimmen und bereits subklinische Veränderungen, welche von der LVEF noch nicht erfasst werden, detektieren kann. Dies hat dazu geführt, dass sich die Bestimmung des GLPS bei PatientInnen mit kardiotoxischen Chemotherapeutika bereits als Standard etabliert hat (5).
Strain-Muster
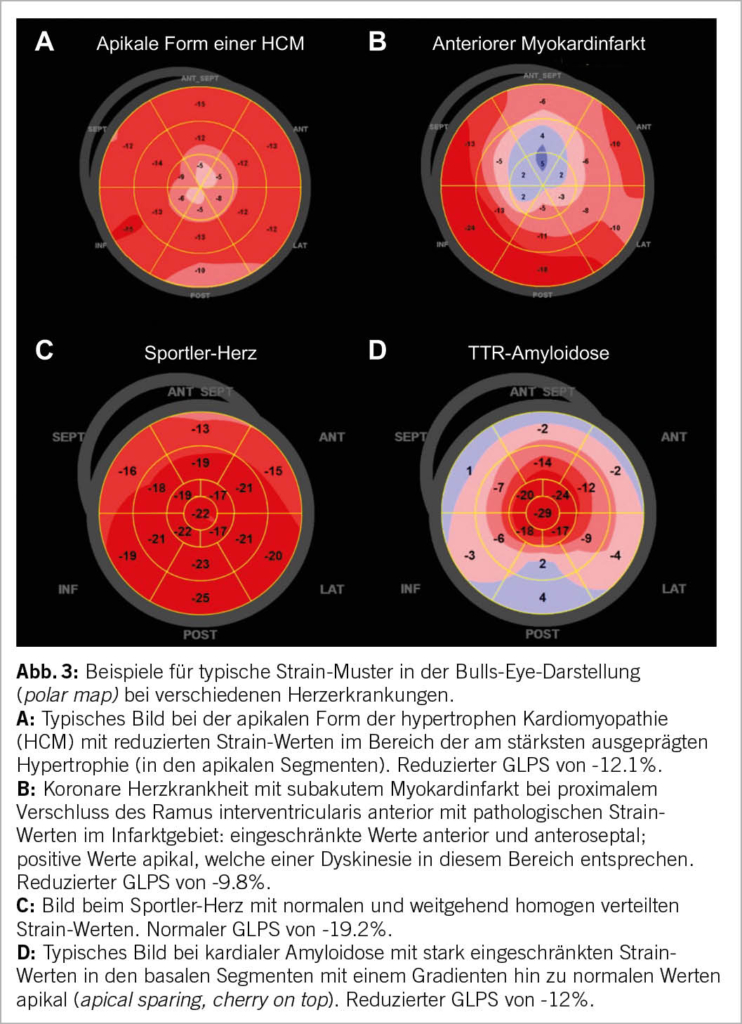
Die Bulls-Eye-Darstellung des maximalen longitudinalen Strains ermöglicht eine intuitive visuelle Erfassung der globalen und regionalen Deformation. Insbesondere bei PatientInnen mit LV-Hypertrophie (Abb. 3) können diese Strain-Muster in der Bulls-Eye-Darstellung von differentialdiagnostischer und prognostischer Bedeutung sein (6).
Bei der hypertensiven Herzerkrankung zeigt sich beispielsweise häufig eine Einschränkung des longitudinalen Strains im Bereich des basalen Septums (7). Ausserdem ist ein pathologischer GLPS-Wert (bei normaler LVEF) mit einer besonders lange bestehenden und/oder unkontrollierten arteriellen Hypertonie assoziiert (8).
Die hypertrophe Kardiomyopathie (HCM) zeigt interessanterweise meist am Ort der ausgeprägtesten Hypertrophie die am stärksten eingeschränkte longitudinale Deformation (9). Während die LVEF bei PatientInnen mit HCM und gesunden Kontrollpersonen vergleichbar ist, zeigt der GLPS eine signifikante Einschränkung, welche zudem bei der HCM mit dem Auftreten von ventrikulären Arrhythmien korreliert (10).
Bei der Speicherkrankheit Morbus Fabry findet typischerweise ein schleichender fibrotischer Umbau im basalen infero-lateralen LV-Myokard statt. Passend dazu finden sich häufig eingeschränkte longitudinale Strain-Werte im entsprechenden Segment bereits in sehr frühen Stadien der Erkrankung, wenn die visuelle Kontraktilität des entsprechenden Segments noch normal erscheint und die Fibrose kaum ausgeprägt ist (11).
Besonders auffällig ist das Strain-Muster bei der kardialen Amyloidose. Hier zeigt der Strain einen typischen und meist stark ausgeprägten baso-apikalen Gardienten mit stark pathologischen (bis hin zu positiven) longitudinalen Strain-Werten in den basalen Segmenten und einer graduellen Normalisierung zum Apex hin. Dieses Muster wird als apical sparing (oder auch cherry on top) bezeichnet. Der GLPS ist dabei pathologisch (12). Dieses Bild findet sich sowohl bei der Transthyretin (TTR)- als auch bei der AL-Amyloidose. Ein ähnliches aber trügerisches Bild kann entstehen, wenn bei einem Amyloidose-freien Herzen verkürzte Schnittbilder für die Analyse verwendet werden, da sich dann falsch hohe (negative) Strain-Werte apikal ergeben können; der GLPS ist in diesem Fall meist normal.
PatientInnen mit schwerer Aortenstenose und normaler LVEF haben tiefere (weniger negative) GLPS-Werte als gematchte Kontrollpersonen (13). Falls dabei ein apical-sparing-Muster auffällt, muss an eine zusätzliche TTR-Amyloidose gedacht werden, da mehrere Studien eine Koinzidenz der TTR-Amyloidose bei 10% oder mehr der PatientInnen mit schwerer Aortenstenose beobachtet haben (14).
Regionale Wandbewegungsstörungen im Rahmen einer koronaren Herzkrankheit können mithilfe der Strain-Analyse objektiviert werden. Dies ist insofern von grossem Wert, dass der Strain die aktive Kontraktion (Deformation) im einzelnen Myokardabschnitt erfasst und passive Bewegung durch Zug angrenzender, kontraktiler Segmente nicht einfliessen. Trotzdem müssen die Werte in einzelnen Segmenten mit Vorsicht interpretiert werden, da einerseits nicht alle Hersteller gleich verlässliche Werte liefern und insbesondere lokale Einschränkungen der Bildqualität (beispielsweise durch Artefakte) die segmentalen Strain-Werte zurzeit noch anfällig machen, sodass hier nicht dieselbe Reproduzierbarkeit besteht wie für die GLPS-Bestimmung (15).
Auch für die herausfordernde Diagnose des Sportler-Herzens kann die Strain-Analyse hilfreich sein. Hier zeigen sich üblicherweise trotz allenfalls eingeschränkter LVEF normale (oder höchstens leicht eingeschränkte) GLPS-Werte (16). Sind diese relevant vermindert muss zwingend eine andere Erkrankung gesucht werden.
Weiterführende Anwendungen
Auch die anderen Herzkammern können mithilfe der Strain-Analyse untersucht werden (17). Die Deformation der freien rechtsventrikulären Wand ist eine etablierte Methode zur Bestimmung der systolischen RV-Funktion und hat bei verschiedenen Erkrankungen eine prognostische Bedeutung gezeigt. Ebenso können die Vorhöfe mittels Strain-Analyse untersucht werden: hier werden der Reservoir-Strain als Parameter der Compliance (positive Werte) und der Kontraktions-Strain (negative Werte) unterschieden. Neben der 2D-Strain-Analyse, die in diesem Artikel behandelt wird, besteht auch die Möglichkeit, ein einem 3D-Datensatz die Bewegung der Speckles nicht in einer definierten Ebene, sondern im Raum zu verfolgen und zu quantifizieren. Die Verlässlichkeit dieser Analyse hängt naturgemäss davon ab, ob es gelingt einen 3D-Datensatz mit genügender Qualität in allen Segmenten und ausreichender Volumen-Rate zu akquirieren (18).
Zusammenfassung
Die Strain-Echokardiographie hat sich als nützliches und anwendbares Werkzeug im klinischen Alltag etabliert. Sie liefert wertvolle Informationen bezüglich der systolischen LV-Funktion, welche über die Aussagekraft der LVEF hinausgehen. Zusätzlich werden differentialdiagnostische Überlegungen durch das Erkennen typischer Strain-Muster unterstützt, welche dank der anzunehmenden technologischen Entwicklungen in Zukunft noch an Bedeutung gewinnen werden.
Copyright bei Aerzteverlag medinfo AG
Leitender Arzt Kardiologie
Leiter Ambulatorium und Echokardiographie
Herzzentrum Luzern
Luzerner Kantonsspital
simon.staempfli@luks.ch
Der Autor hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Pavlopoulos H, Nihoyannopoulos P. Strain and strain rate deformation parameters: from tissue Doppler to 2D speckle tracking. Int J Cardiovasc Imaging. 2008;24(5):479-91.
2. Blessberger H, Binder T. NON-invasive imaging: Two dimensional speckle
tracking echocardiography: basic principles. Heart. 2010;96(9):716-22.
3. Negishi K, Negishi T, Kurosawa K, Hristova K, Popescu BA, Vinereanu D, et al. Practical guidance in echocardiographic assessment of global longitudinal strain. JACC Cardiovasc Imaging. 2015;8(4):489-92.
4. Sugimoto T, Dulgheru R, Bernard A, Ilardi F, Contu L, Addetia K, et al. Echocardiographic reference ranges for normal left ventricular 2D strain: results from the EACVI NORRE study. Eur Heart J Cardiovasc Imaging. 2017;18(8):833-40.
5. Lyon AR, Lopez-Fernandez T, Couch LS, Asteggiano R, Aznar MC, Bergler-Klein J, et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). European heart journal. 2022;43(41):4229-361.
6. Tanaka H. Efficacy of echocardiography for differential diagnosis of left ventricular hypertrophy: special focus on speckle-tracking longitudinal strain. J Echocardiogr. 2021;19(2):71-9.
7. Galderisi M, Lomoriello VS, Santoro A, Esposito R, Olibet M, Raia R, et al. Differences of myocardial systolic deformation and correlates of diastolic function in competitive rowers and young hypertensives: a speckle-tracking echocardiography study. Journal of the American Society of Echocardiography : official publication of the American Society of Echocardiography. 2010;23(11):1190-8.
8. Soufi Taleb Bendiab N, Meziane-Tani A, Ouabdesselam S, Methia N, Latreche S, Henaoui L, et al. Factors associated with global longitudinal strain decline in hypertensive patients with normal left ventricular ejection fraction. Eur J Prev Cardiol. 2017;24(14):1463-72.
9. Urbano-Moral JA, Rowin EJ, Maron MS, Crean A, Pandian NG. Investigation of global and regional myocardial mechanics with 3-dimensional speckle tracking echocardiography and relations to hypertrophy and fibrosis in hypertrophic
cardiomyopathy. Circ Cardiovasc Imaging. 2014;7(1):11-9.
10. Haland TF, Almaas VM, Hasselberg NE, Saberniak J, Leren IS, Hopp E, et al. Strain echocardiography is related to fibrosis and ventricular arrhythmias in hypertrophic cardiomyopathy. Eur Heart J Cardiovasc Imaging. 2016;17(6):613-21.
11. Weidemann F, Breunig F, Beer M, Sandstede J, Stork S, Voelker W, et al. The variation of morphological and functional cardiac manifestation in Fabry disease: potential implications for the time course of the disease. European heart journal. 2005;26(12):1221-7.
12. Phelan D, Collier P, Thavendiranathan P, Popovic ZB, Hanna M, Plana JC, et al. Relative apical sparing of longitudinal strain using two-dimensional speckle-
tracking echocardiography is both sensitive and specific for the diagnosis of
cardiac amyloidosis. Heart. 2012;98(19):1442-8.
13. Lafitte S, Perlant M, Reant P, Serri K, Douard H, DeMaria A, et al. Impact of impaired myocardial deformations on exercise tolerance and prognosis in patients with asymptomatic aortic stenosis. European journal of echocardiography : the journal of the Working Group on Echocardiography of the European Society of Cardiology. 2009;10(3):414-9.
14. Castano A, Narotsky DL, Hamid N, Khalique OK, Morgenstern R, DeLuca A, et al. Unveiling transthyretin cardiac amyloidosis and its predictors among elderly patients with severe aortic stenosis undergoing transcatheter aortic valve replacement. European heart journal. 2017;38(38):2879-87.
15. Mirea O, Pagourelias ED, Duchenne J, Bogaert J, Thomas JD, Badano LP, et al. Variability and Reproducibility of Segmental Longitudinal Strain Measurement: A Report From the EACVI-ASE Strain Standardization Task Force. JACC Cardiovasc Imaging. 2018;11(1):15-24.
16. D’Andrea A, Cocchia R, Riegler L, Scarafile R, Salerno G, Gravino R, et al. Left ventricular myocardial velocities and deformation indexes in top-level athletes. Journal of the American Society of Echocardiography : official publication of the American Society of Echocardiography. 2010;23(12):1281-8.
17. Badano LP, Kolias TJ, Muraru D, Abraham TP, Aurigemma G, Edvardsen T, et al. Standardization of left atrial, right ventricular, and right atrial deformation imaging using two-dimensional speckle tracking echocardiography: a consensus document of the EACVI/ASE/Industry Task Force to standardize deformation imaging. Eur Heart J Cardiovasc Imaging. 2018;19(6):591-600.
18. Muraru D, Niero A, Rodriguez-Zanella H, Cherata D, Badano L. Three-dimensional speckle-tracking echocardiography: benefits and limitations of integrating myocardial mechanics with three-dimensional imaging. Cardiovasc Diagn Ther. 2018;8(1):101-17.
info@herz+gefäss
- Vol. 13
- Ausgabe 1
- Februar 2023