- Praktische Empfehlungen zur Nachbetreuung nach Myokarditis
Die Myokarditis ist eine heterogene inflammatorische Erkrankung des Myokards, welche ätiologisch, pathophysiologisch und nicht zuletzt in der klinischen Präsentation stark variiert. Diese drei Aspekte beeinflussen den Verlauf und die Prognose der Erkrankung. Am häufigsten ist die viral bedingte akute Myokarditis, die meist einen unkomplizierten Verlauf und eine gute Prognose aufweist. Therapieoptionen sind limitiert und spezifische Behandlungen beschränkt auf spezielle Formen der Erkrankung. Diese Zusammenfassung soll mit Blick auf klinisch relevante Hintergrundinformationen zum Krankheitsbild eine praktische Anleitung für das Management in der Nachsorge geben.
Practical recommendations for follow-up care after myocarditis Myocarditis is a heterogeneous inflammatory disease of the myocardium that varies greatly in terms of aetiology, pathophysiology and clinical presentation. These three aspects influence the course and prognosis of the disease. The most common is acute viral myocarditis, which usually has an uncomplicated course and a good prognosis. Therapeutic options are limited and specific treatments are restricted to specific forms of the disease. This summary is intended to provide practical guidance for the management of follow-up care with regard to clinically relevant background information on the clinical picture.
Key words: Acute myocarditis, heart failure, arrhythmia, sudden cardiac death, return to play
Akute Myokarditis: eine Uebersicht
Allgemein
Gemäss der Weltgesundheitsorganisation (WHO) Definition von 1995 (1) ist Myokarditis eine inflammatorische Erkrankung des Herzmuskels, die basierend auf etablierten histologischen, immunologischen (2,3) und immunhistochemischen (3) Kriterien diagnostiziert wird. Die europäische Gesellschaft für Kardiologie (ESC) hat diese Definition übernommen (2).
Perimyokarditis oder Myoperikarditis: Ausräumen von Gerüchten
Perikarditis beschreibt die Entzündung des Herzbeutels und Myokarditis die des Herzmuskels. Diese Begriffe sind nur theoretisch trennbar, denn die Inflammation kennt keine anatomischen Grenzen und eine exakte Differenzierung der betroffenen Gewebestrukturen ist kaum möglich. Ueber die Bezeichnung der Mischformen bestehen oft Unsicherheiten. Im Gegensatz zu Patient/-innen mit Myoperikarditis haben die mit Perimyokarditis eine Einschränkung der linksventrikuären Ejektionsfraktion (LVEF) von <50% (2) und die Behandlung erfolgt gleich wie bei einer isolierten Myokarditis.
Diagnostik
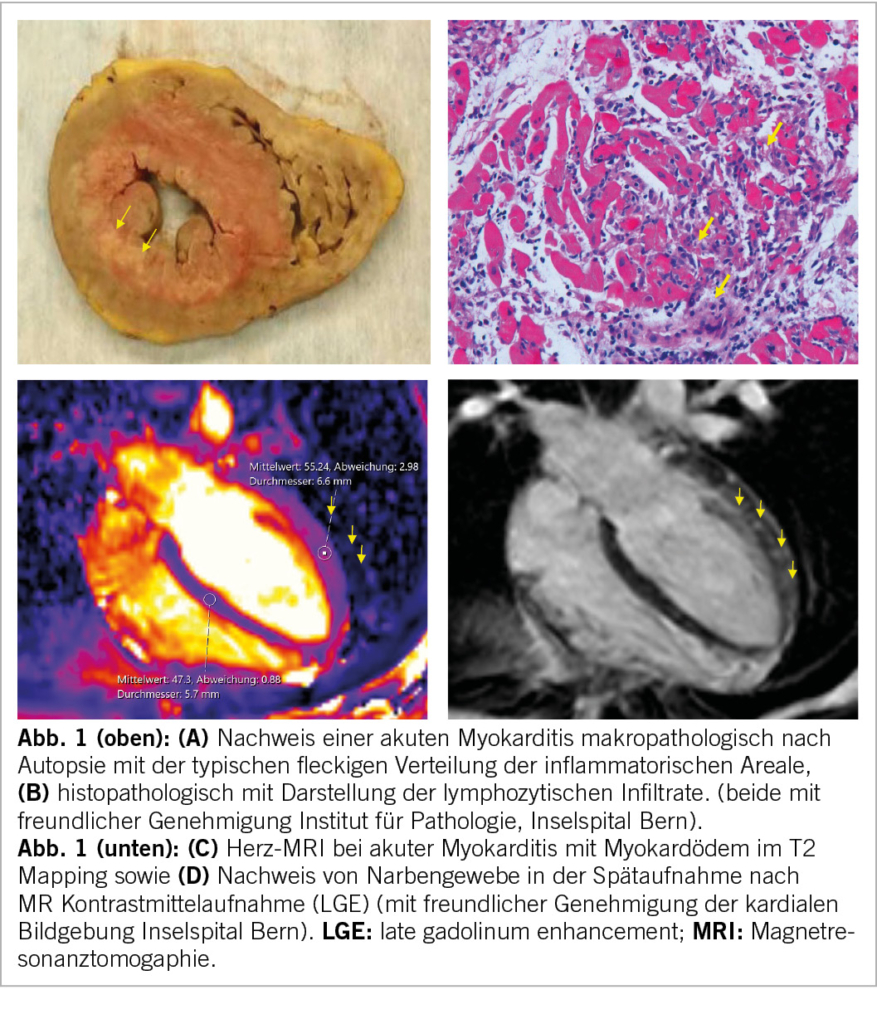
Seit Einführung der Dallas-Kriterien für den histopathologischen Nachweis der Myokarditis (3) gilt die Endomyokardbiopsie als Goldstandard in der Diagnosestellung (Abbildung 1A). Jedoch hat es in den letzten zwei Dekaden seit Einführung und Entwicklung neuer Mittel – allem voran das Herz-Magnestresonanztomogramm (MRI) (Abbildung 1B) und kardiale hochsensitive Troponin T (hs-Trop-T) – eine Anpassung der diagnostischen Aufarbeitung gegeben. Die Kombination von Symptomen, Untersuchungsbefunden, Laborresultaten und kardialer Bildgebung mit transthorakaler Echokardiographie (TTE) und Herz-MRI, selten Positronen-Emissions-Tomographie (PET)-CT, ist in der klinischen Routine meist ausreichend, um die Diagnose zu stellen. Wir sprechen je nach Konstellation der Befunde von einer möglichen, wahrscheinlichen oder definitiven Myokarditis (4). Die Endomyokardbiopsie (EMB) bleibt schwerwiegenden Fällen vorbehalten, bei denen nach der Untersuchung eine therapeutische Konsequenz zu erwarten ist. Das Risiko für Komplikationen ist generell – wenn in Zentren mit Erfahrung für den Eingriff durchgeführt– gering (<1%), aber prinzipiell höher bei inflammatorischen Kardiopathien und bei linksventrikulärer Biopsie. Die EMB aus dem linken Ventrikel (LV) ist häufig bei allein linksseitigem Befall der Myokarditis nötig. Aufgrund der häufig fleckigen Verteilung der Entzündung ist der Stichprobenfehler meist hoch.
Herz-MRI: Diagnose und Prognose
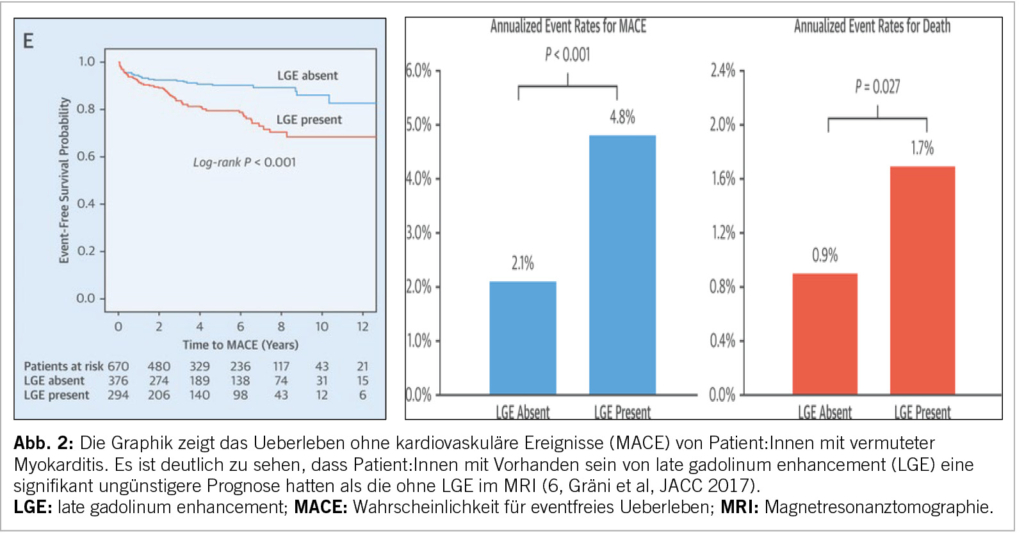
Das Herz-MRI ist das zentrale nicht-invasive Tool für die Diagnosestellung und mithilfe der aktualisierten «Lake Louis Kriterien» (5) erreicht es eine Sensitivität von 88% und Spezifität von 96%. Dabei ist eine klare Differenzierung der Inflammation nicht möglich, doch können durch die regionale Verteilung mögliche Schlüsse auf die Aetiologie in Korrelation mit der Klinik gezogen werden, zum Beispiel die Beteiligung des basalen Ventrikelseptums bei kardialer Sarkoidose. Nicht zuletzt hilft das kardiale MRI bei der Prognoseeinschätzung für Patient/-innen mit vermuteter Myokarditis (Abbildung 2). So zeigt das Fehlen von late gadolinum enhancement (LGE) eine gute Prognose (6), während das Vorliegen von LGE in einer neueren Studie mit einer Verdoppelung der kardiovaskulären Ereignisse einherging (7).
Epidemologie
Vor der Covid-10 Pandemie betrug die globale Inzidenz der Myokarditis 1 bis 10 Fälle pro 100.000 Personen pro Jahr (8) mit dem grössten Erkrankungsrisiko für junge Männer im Alter von 20 bis 40 Jahre. Eine Zunahme dieser Zahlen ist – mit Verbesserung der «nichtinvasiven» diagnostischen Möglichkeiten und vermehrten Durchführung des Herz-MRIs für unkomplizierte Fälle – zu erwarten.
Pathophysiologie: das Drei-Phasen-Modell
Nach Kontakt mit einem auslösenden Pathogen, infektiös oder nicht-infektiös, kommt es zur Destruktion von Myozyten, entweder direkt durch einen toxischen Effekt oder indirekt durch das Auslösen autoreaktiver immunologischer Prozesse (Phase 1). In den meisten Fällen führt die Elimination der auslösenden Substanzen zur Heilung der Myokarditis, in anderen Fällen jedoch zur Autoantikörper-vermittelten Persistenz der Inflammation, was mit und ohne viraler Perisistenz vonstattengehen kann (Phase 2). Auch in diesem Stadium ist noch ein Uebergang zur Heilung möglich. Selten kommt es in Folge zur chronisch-inflammatorischen Kardiomyopathie mit anhaltender Destruktion und Remodelling des Myokards (Phase 3) und im späten Stadium kann eine dilatierende Kardiomyopathie ohne Nachweis von Mikroorganismen vorliegen. Ein genetischer Hintergrund, der die Neigung des Einzelnen zur Erkrankung an einer Myokarditis und/ oder zur Entwicklung der genannten Spätstadien definiert, wird vielfach diskutiert wie auch die überlappenden Kriterien mit bestimmten genetischen Kardiopathien (9). Die Kenntnis der möglichen Verläufe der akuten Myokarditis sind wichtig für die Planung der Nachsorge dieser Personen.
Präsentation und Behandlung
Das klinische Bild der akuten Myokarditis kann sehr variabel sein. Die Hauptmanifestationen sind «infarktähnlich» mit Thoraxschmerzen (97%) und ST-Streckenhebungen (62%) im Elektrokardiogramm (EKG) mit meist unkompliziertem Verlauf, das heisst anhaltend normaler LVEF, ohne Arrhythmien und mit transplantatfreiem Ueberleben (10). In einer geringeren Anzahl Fälle kommt es zu zunehmender Herzinsuffizienz, kardiogenem Schock bei fulminanter Myokarditis, lebensbedrohlichen Arrhythmien wie atrioventrikulärer (AV) Block oder anhaltende ventrikuläre Arrhtyhmien bis hin zum plötzlichen Herztod (sudden cardiac death, SCD).
Die kardialen Nekrosebiomarker high sensitive-Troponin-T (hs-Troponin-T), Creatinkinase (CK)-MB sowie N-Terminal pro-Brain (NT-pro-BNP) sind sehr häufig erhöht. Trotzdem schliessen tiefe Enzyme oder das Fehlen eine Myokarditis nicht aus. Die Höhe der Werte korreliert zumeist nicht mit dem Schweregrad der Erkrankung.
Zusammengefasst erfolgt die Behandlung der Myokarditis vor allem symptomatisch für die auftretenden Symptome oder supportiv entsprechend den jeweiligen Leitlinien für z.B. Herzinsuffizienz, Arrhythmien, Verhinderung von plötzlichem Herztod mit internem Defibrillator/ Kardioverter (ICD), falls nötig. In der Regel wird mit einer ICD Implantation oder auch Radiofrequenzkatheterablation von Kammertachykardien bis zur Ausheilung der Inflammation gewartet, allenfalls kann diese Zeit mit einer Life Vest überbrückt werden. Ausnahmen für eine frühe ICD Implantation bilden die kardiale Sarkoidose und die Riesenzellmyokarditis. Auch eine immunsuppressive Therapie ist diesen spezifischen Formen der Myokarditis sowie der eosinophilen und der Immuncheckpointinhibitor (ICI)-Myokarditis vorbehalten, nachdem behandelbare Ursachen wie parasitäre Erkrankungen bei der Eosinophilie ausgeschlossen bzw. die auslösenden Noxen entfernt wurden. Nur wenige Studien haben eine günstige Wirkung auf die Entwicklung der LVEF bei chronischer Myokarditis gezeigt und die Behandlung kann wegen fehlender Evidenz nicht empfohlen werden (11-13). In einem aktuellen Expertenkonsensusdokument der American Heart Association (AHA) wird zu der Gabe von 1g Solumedrol bei fulminanter Myokarditis mit hohem Verdacht auf eine immunmediierte Form noch vor weiterführender Diagnostik wie EMB zum Virenausschluss aufgerufen (20).
Im Klinikalltag wird häufig bereits ab einer LVEF < 50% oder auch normaler Pumpfunktion eine RASS Blockade in protektiver Absicht eingeleitet und ein Betablocker für alle Patient/-innen eingesetzt. Der Nutzen der Therapie für die Betroffenen hinsichtlich Remodelling, Fibrosebildung respektive Arrhythmien ist unklar. Eine Therapieempfehlung kann daher nicht ausgesprochen werden. Die Indikation für eine medikamentöse Herzinsuffizienztherapie sollte gemäss den Leitlinien der ESC gestellt und weitergeführt werden (14).
Jede Myokarditis sollte für mindestens 48 Stunden hospitalisiert werden, um die Dynamik der Erkrankung zu beobachten.
Nachsorge
Die Nachbetreuung der Patient/-innen mit Myokarditis umfasst die Beobachtung des Rückgangs der Beschwerden und des Verlaufs der Inflammation, um sekundär auftretende Komplikationen zu erfassen, die eine Aenderung der Behandlungsstrategie erfordern würden. Die Einschätzung des Risikos für Arrhythmien und der Entscheid bezüglich Rückkehr zu sportlicher Aktivität ist eine andere wichtige Aufgabe der Nachsorge dieser Patient/-innen. Die Nachsorgeplanung beginnt bereits im Spital mit der Risikoklassifizierung.
Risikoklassifizierung
Für das primäre Management und die Nachsorgeplanung hat sich eine Risikoeinteilung als hilfreich erwiesen, welche insbesondere die initiale Präsentation der Erkrankung berücksichtigt (4, 8). Bei fulminantem Verlauf oder Auftreten von Komplikationen müssen die Nachsorgetermine engmaschiger geplant werden. Limitierend sind vor allem relevante Herzrhythmusstörungen wie AV-Block, anhaltende Kammertachykardien, Kammerflimmern und Herzkreislaufstillstand im Spital oder auswärts. Gerade bei Sportler/-innen ist der plötzliche Herztod eine gefürchtete Manifestation der akuten Myokarditis und kann in jeder Phase der akuten Erkrankung auftreten (7).
Als Hochrisikofaktoren gelten Symptome der akuten Herzinsuffizienz inklusive kardiogener Schock, die Einschränkung der LVEF auf weniger als 40% und das Auftreten relevanter Arrhythmien wie ventrikuläre Tachykardien, Kammerflimmern oder AV-Block.Diese Menschen sollten an einem spezialisierten Zentrum behandelt werden, weil das Risiko für eine akute Verschlechterung der kardiorespiratorischen Situation des Patient/-innen hoch ist und allenfalls eine provisorische Schrittmacherstimulation oder eine mechanische Kreislaufunterstützung (MCS) erfordert. Bei der mechanischen Kreislaufunterstützung kommen Geräte wie der «extracorporale life support» (ECLS/ECMO) und/ oder eine temporäre linksventrikuläre axiale Kreislaufpumpe zum Einsatz.
Plötzlicher Herztod
Das Risiko für einen plötzlichen Herztod bei akuter Myokarditis korreliert nicht immer mit dem Schweregrad der myokardialen Inflammation und/ oder der Troponinkonzentration im Serum. Zwar wird die linksventrikuläre Dysfunktion als wichtigster Prognosemarker für «adverse events» gesehen, doch kann ein plötzlicher Herztod auch bei normaler LVEF auftreten und ist am häufigsten mit Tachyarrhythmien assoziiert. Die pathophysiologische Entstehung der Arrhythmien bei akuter Myokarditis ist vielfältig. Ein möglicher Erklärungsansatz ist die adrenerge Stimulation des inflammatorischen Myokards mit verändertem Milieu und Membranpotenial (19). Die Rückkehr zu sportlicher Aktivität bzw. körperlicher Anstrengung sollte erst nach vollständigem Abklingen der Entzündung erfolgen. In der klinischen Praxis gilt es, diesbezüglich auch die täglichen beruflichen Herausforderungen der Patient/-innen zu berücksichtigen; eine büroangstellte Person darf beispielsweise früher mit vollem Pensum zurück zur Arbeit als ein Logistikmitarbeiter, der schwere Lasten heben muss.
Sportkarenz
Patient/-innen mit akuter Myokarditis wird die Empfehlung zur Sportkarenz für mindestens 3 bis 6 Monate in Anlehnung an die Vorgaben der europäischen Gesellschaft für Kardiologie (2) und Empfehlung der amerikanischen Gesellschaft für Kardiologie (4) ausgesprochen. Diese Empfehlung ist vor allem für Sportler/-innen, die an kompetitiven Wettkämpfen teilnehmen, gültig, unabhängig von Alter, Geschlecht und LVEF. Wegen fehlender Leitlinien für andere Patientengruppen – ausser Athleten – werden dieselben Richtlinien auch auf die Allgemeinbevölkerung angewandt.
Ein Modell (Abbildung 3)
Eine erste Kontrolle nach 1-4 Wochen dient in erster Linie der klinischen Verlaufsbeobachtung der Inflammation, denn häufig würde sich eine sekundäre Verschlechterung nach der Erstbeurteilung in diesem Zeitraum zeigen und ein Richtungswechsel des Managements könnte jetzt eingeleitet werden. Neben der anamnestischen Erhebung des Beschwerdeverlaufs erfolgt die Bestimmung der kardialen Biomarker und die Durchführung eines 12-Kanal-EKGs. Das in der Zwischenzeit durchgeführte Herz-MRI kann mit dem/der Patient/-in besprochen und eine bessere Einschätzung der Prognose als nach der ersten Risikobeurteilung erhoben werden. Nicht zuletzt ist diese Konsultation für die Patient/-innen wichtig, die bis anhin zumeist (herz)gesund waren, manche noch nie im Spital und nicht selten durch das Ereignis verunsichert sind. Es gilt, ihnen Sicherheit zu vermitteln und – insbesondere bei den am häufigsten unkomplizierten Verläufen – zu bestätigen, dass sie nach Abklingen der akuten Phase nicht beeinträchtigt sein werden. Der psychologische Aspekt und eine gute Aufklärung sind nicht unerheblich, insbesondere wenn die Patient/-innen Rezidive entwickeln.
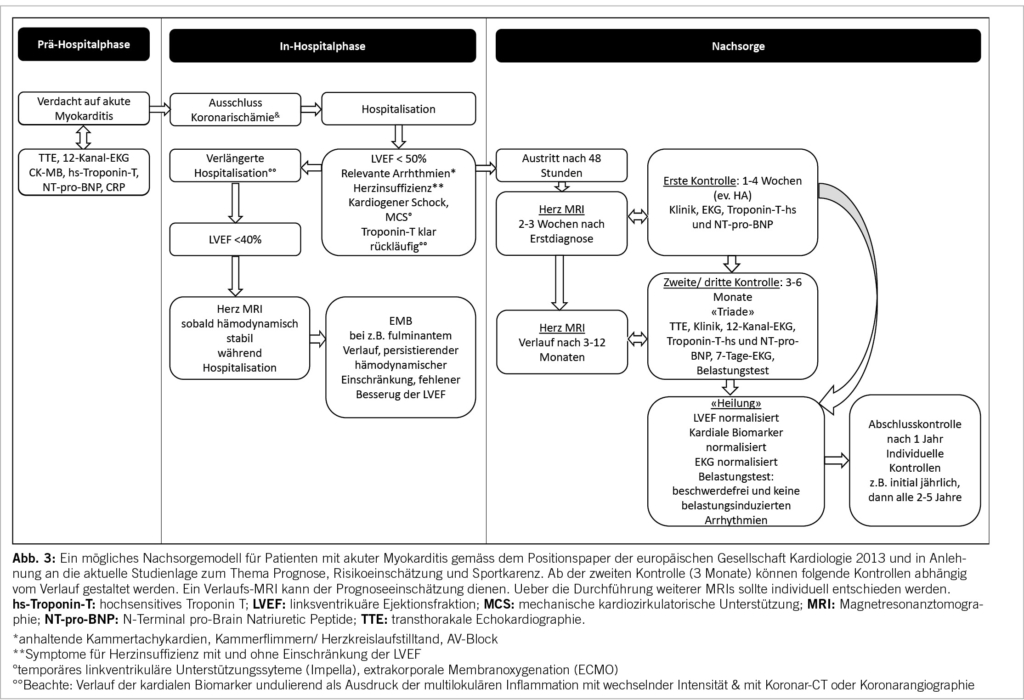
Die Zweite Kontrolle erfolgt in der Regel nach 3 Monaten mit einem sogenannten «Triade Test», der 3 Untersuchungsmodalitäten umfasst: 12-Kanal-EKG, TTE, Troponinbestimmung. Die Rückkehr zur sportlichen Aktivität gilt als sicher, wenn zusätzlich keine relevanten Arrhythmien (anhaltende Kammertachykardien, AV-Block) in der 24 Stunden Rhythmusüberwachung und im kardialen Belastungstest vorkommen (15-17). Sofern ein Kriterium des Triade Tests pathologisch ausfällt oder Arrhythmien in einer Untersuchung nachgewiesen werden, gilt die Myokarditis als persistierend und weitere Verlaufskontrollen müssen folgen, z.B. nach weiteren 3 Monaten. Eine Erweiterung der diagnostischen und Aenderung der therapeutischen Strategie ist dann notwendig. In der Regel ist ein erneutes kardiales MRI und die Evaluation einer EMB zu empfehlen. Ein Sonderfall stellt die isolierte Erhöhung des Troponin-T dar. Differentialdiagnostisch muss an das Vorliegen heterophiler Antikörper, die mit dem Labor-Essay interferieren gedacht werden und die Bestimmung des ausschliesslich kardial exprimierten Troponin-I kann klären, ob es sich um einen laboranalytischen Fehler oder eine persistierende Inflammation handelt. Auch chronische Pathologien der Skelettmuskulatur führen zu einer Erhöhung des Troponin-T und müssen insbesondere in Hinblick auf systemische inflammatorische Erkrankungen mit myokardialer Beteiligung an dieser Stelle differenziert werden.
Nach Heilung der Myokarditis und Rückkehr des/der Patient/-in zu normaler körperlicher Aktivität muss die Entscheidung für die weiteren Nachkontrollen individuell, abhängig von der initialen Präsentation, dem klinischen Verlauf und zusätzlichen Befunden der kardialen Bildgebung wie Ausmass des Late Gadolinum Enhancements (LGE) und des Extrazellulärvolumens (ECV) im Herz-MRI getroffen werden. Bei unkompliziertem Verlauf sind zunächst jährliche Kontrollen mit Echokardiographie sinnvoll, später können die Abstände erweitert werden.
Fortsetzung der medikamentösen Therapie
Die Indikation für eine medikamentöse Herzinsuffizienztherapie sollte gemäss den Leitlinien der europäischen Gesellschaft für Kardiologie (ESC) 2023 (14) erfolgen und – insbesondere wenn anfangs nicht erfüllt – im Laufe der Nachsorgebehandlung in regelmässigen Abständen evaluiert werden. Nach Normalisierung der LVEF kann die Therapie formal sistiert werden. Eine partielle Fortsetzung, die sich nach den Komorbiditäten richtet, wie ACE-Hemmer bei Bluthochdruck oder Betablocker bei Vorhofflimmern, ist von dieser Empfehlung natürlich ausgenommen. Die häufig gestellte Frage nach der Dauer einer «empirisch» begonnen medikamentösen Herzinsuffizienztherapie bei einer LVEF >40% bleibt an dieser Stelle unbeantwortet.
Rehabilitation
In der akuten Phase der Myokarditis ist ein kardiales Rehabilitationsprogramm selbstverständlich obsolet, da den Patient/-innen schon moderate körperliche Aktivität untersagt ist. Doch kann es während der Phase der Sportkarenz rasch zu einer Dekonditionierung kommen und die Symptome der Herzinsuffizienz bei kardialer Inflammation gehen in Leistungsminderung über.
Das Wiedererlangen, der Erhalt und der Aufbau der muskulären Kondition sind unerlässlich für die Rekonvaleszenz. Bleibt dies aus, können im Verlauf Symptome der Dekonditionierung häufig nicht von kardialen unterschieden werden. Ein multimodales Trainingsmodell zur kardialen Rehabilitation hilft, dass die Patient/-innen das Selbstvertrauen in ihr Körpergefühl, die körperliche Fitness zurückerhalten. Die Integration einer kardiopsychologischen Unterstützung in diese Programme fördert die Rückkehr zur Aktivität dieser Personen.
Schlussfolgerung
Daten zum Thema Nachsorge für Patienten und Patientinnen mit akuter Myokarditis sind begrenzt. Wir halten uns generell an die Richtlinien der ESC von 2013 (2) und der amerikanischen Gesellschaft für Kardiologie (ACC) (4), die wir mit Hilfe von aktuellen Studien für unsere klinische Praxis adaptieren können.
Mit der Weiterentwicklung der kardialen Bildgebung, insbesondere dem Herz-MRI, sind mehr vielversprechende Untersuchungen zu erwarten, so dass eine weitere evidenzbasierte Verbesserung der Nachsorge von Patient/-innen mit Myokarditis wird folgen können.
Abkürzungen
AHA American Heart Association
AV-Block atrioventrikulärer Block
CT Computertomographie
ECLS/ECMO extracorporale life support
ECV extrazelluläres Volumen
EKG Elektrokardiogramm
EMB Endomyokardbiopsie
ESC europäische Gesellschaft für Kardiologie
hs-Troponin-T high-sensitive Troponin T
LGE Late Gadolinum Enhancement
LV linker Ventrikel
LVEF linksventrikuläre Ejektionsfraktion
MCS mechanische Kreislaufunterstützung
MRI Magnetresonanztomographie
NT-pro-BNP N-Terminal pro-Brain Natriuretic Peptide
PET Positronen Emissions Tomographie
SCD Sudden Cardiac Death
Copyright Aerzteverlag medinfo AG
Inselspital, Universitätsspital Bern
Universitätsklinik für Kardiologie
Herz Gefäss Zentrum
Freiburgstrasse 20
3010 Bern
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Die akute Myokarditis ist ein heterogenes Krankheitsbild; die häufigste Manifestation ist der akute Thoraxschmerz mit normaler LVEF und ohne Arrythmien mit meist folgenloser Ausheilung
◆ Die Behandlung erfolgt primär supportiv, eine Herzinsuffizienztherapie sowie Betablockerbehandlung, akut oder im späteren Verlauf, hat erst ab einer LVEF <40% nachweislichen Nutzen.
◆ Eine Risikoeinteilung für das Management initial und in der Nachsorge ist schon früh sinnvoll
◆ Hauptpfeiler der Nachsorgebehandlung sind regelmässige Verlaufskontrollen für die Beobachtung der Inflammation und die Bestimmung der Sportkarenzdauer
◆ Nach einem unauffälligen Triade Test mit EKG, Troponin-T, TTE sowie Belastungstest ohne auslösbare Herzrrhythmusstörungen ist eine Rückkehr zu sportlicher Aktivität nach frühestens 3 Monaten erlaubt.
◆ Bei Erkennen einer sekundären Verschlechterung (z.B. Abnahme der LVEF, Auftreten von Rhythmusstörungen, persistierend erhöhte oder steigende kardiale Biomarker) ist eine erweiterte Diagnostik mit erneutem Herz MRI, EMB und Abklärung von Erkrankungen aus dem rheumatologischen Formenkreis indiziert.
1. Report of the 1995 World Health Organization/ International Society and Federation of Cardiology Task Force on the Definition and Classification of Cardiomyopathies. Circulation 1996;93:841-842.
2. Caforio A. et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J 2013 Sep;34(33):2636-48, 2648a-2648d.
3. Aretz HT. Myocarditis: the Dallas criteria. Hum Pathol 1987;18:619-624.
4. Ammirati et al. Management of acute and chronic inflammatory cardiomyopathy: an expert consensus document. Circ Heart Fail 2020;13(11).
5. Luetkens JA et al. Comparison of original and 2018 Lake Louise criteria for diagnosis of acute myocarditis: results of a validation cohort. Radiol Cardiothorac Imaging 2019;1(3): e190010.
6. Gräni et al. Prognostic Value of Cardiac Magnetic Resonance Tissue Charakterization in Risk Stratifying Patients With Suspected Myocarditis. J Am Coll Cardiol 2017.70(16):1964-1976.
7. Eichorn et al. Myocarditis in Athletes Is a Challenge: Diagnosis, Risk Stratification, and Uncertainties. JACC 2020.13(2):497-507.
8. Basso C. Myocarditis. N Engl J Med 2022; 387:1488-1500.
9. Lota AS et al. Genetic Architecture of Acute Myocardits and the Overlap With Inherited Cardiomyopathy. Circulation 2022.146(15):1123-1134.
10. Ammirati E et al. Clinical presentation and outcome in a contemporary cohort of patients with acute myocarditis: multicenter Lombardy registry. Circulation 2018;138:1088-1099.
11. Frustaci A et al. Randomized Study on the efficiacy of immunosuppressive therapy in patients with virus-negative inflammatory cardiomyopathy: the TIMIC study. Eur Heart J 2009;30:1995-2002.
12. Merken J et al. Immunosuppressive Therapy Improves Both Short- and Long-Term Prognosis in Patients With Virus-Negative Nonfulminant Inflammatory Cardiomyopathy. Circ Heart Fail 2018. 11(2).
13. Escher et al. Long-term outcome of patients with virus-negative chronic myocarditis or inflammatory cardiomyopathy after immunosuppressive therapy. Clin Res Cardiol. 2016 Dec;105(12):1011-1020.
14. Theresa A McDognagh et al. Focused Update of the 2021 ESC Guidelines for the Diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2023.44(37):3627-3639.
15. Bryde et al. Exercise After Acute Myocarditis : When and How to Return to Sports. Cardiol Clin 2013.41(1):107-115.
16. Pelliccia et al. 2020 ESC Guidelines on sports cardiology and exercise in patients with cardiovascular disease. (The Task Force on sports cardiology and exercise in patients with cardiovascular disease of the European Society of Cardiology (ESC)). Eur Heart J 2020 00, 1-80.
17. Pelliccia et al. Recommendations for participation in competitive and leisure time sport in athletes with cardiomyopathies, myocarditis, and pericarditis: position statement of the Sport Cardiology Section of the European Association of Preventive Cardiology (EAPC). Eur Heart J 2019.40(1):19-33.
18. Peretto et al. Arrhythmias in myocarditis: state of the art. Heart Rhythm 2019; 16(5):793-801.
19. Kociol RD et al. Recognition and initial management of fulminant myocarditis: a scientific statement from the American Heart Association. Circulation 2020;141(6).
info@herz+gefäss
- Vol. 14
- Ausgabe 5
- November 2024